Перейти к:
Теплоотдача испарением определяет знак влияния назального феназепама на тепловой стресс у крыс
https://doi.org/10.47183/mes.2024-245
Аннотация
Введение. Тепловой стресс — рост температуры тела вследствие преобладания теплоты, поступившей извне и освободившейся при метаболизме, над теплоотдачей. Коррекция теплопродукции возможна с использованием бензодиазепинов в дозах, недостижимых при однократном внутримышечном введении их официнальных препаратов. Это ограничение преодолено с помощью прототипа препарата «Феназепам спрей назальный» (ФСН), содержащего 170 мг феназепама в 1 мл неводного раствора.
Цель. Экспериментальная оценка влияния ФСН на уровень метаболизма и тепловой баланс при тепловом стрессе.
Материалы и методы. Изучено влияние однократной интраназальной инстилляции ФСН в объеме 10 мкл на интенсивность внешнего дыхания, потребление кислорода, а также повторных интраназальных введений ФСН 170 мг/мл в объеме по 10 мкл с интервалом 0,5 ч на динамику ректальной температуры, массы тела и летальность крыс при температуре воздуха 40 °С.
Результаты. Инстилляция ФСН снижала потребление кислорода на величину, достаточную для уменьшения на 0,3 °С температуры тела за 0,5 ч. Введение ФСН замедляло повышение температуры тела у крыс, размещенных в рестрейнерах при температуре воздуха 40 °С, но ускоряло рост температуры и способствовало повышению летальности при размещении крыс в вольерах. Под влиянием ФСН потеря влаги крысами, находившимися в вольерах, судя по динамике массы тела, уменьшалась.
Выводы. Результаты работы указывают на перспективность ФСН в качестве средства фармакотерапии теплового удара при высокой относительной влажности, пребывании в изолирующих средствах защиты кожи или при иммерсионной гипертермии. Требует проверки возможность усугубляющего влияния ФСН на тепловой стресс у человека при отсутствии физических препятствий для теплоотдачи испарением.
Ключевые слова
Для цитирования:
Ивницкий Ю.Ю., Вакуненкова О.А., Краснов К.А., Гафт С.С., Лапина Н.В. Теплоотдача испарением определяет знак влияния назального феназепама на тепловой стресс у крыс. Медицина экстремальных ситуаций. 2025;27(1):37-42. https://doi.org/10.47183/mes.2024-245
For citation:
Ivnitsky J.J., Vakunenkova O.A., Krasnov K.A., Gaft S.S., Lapina N.V. Heat transfer by evaporation determines the effect of nasal phenazepam on thermal stress in rats. Extreme Medicine. 2025;27(1):37-42. https://doi.org/10.47183/mes.2024-245
ВВЕДЕНИЕ
Тепловой стресс — рост температуры «ядра» тела вследствие превышения алгебраической суммы значений тепловой энергии, поступившей извне и освободившейся в процессах метаболизма, суммы значений тепловой энергии, потерянной испарением, излучением, конвекцией и теплопроведением. Совокупность наиболее тяжелых клинических проявлений теплового стресса, обозначаемая термином «тепловой удар» [1], является критическим состоянием организма с летальностью 27% [2]. Актуальность проблемы определяется тем, что повышенному риску теплового удара подвержены не только дети и пожилые люди, но и экономически активная часть населения, чья деятельность связана с физическим напряжением или работой в условиях, препятствующих теплоотдаче: военнослужащие, сотрудники полиции, пожарные, работники горячих цехов, спортсмены.
Ведущий принцип первой и медицинской помощи при тепловом ударе — скорейшее снижение температуры тела. В соответствии с действующим стандартом скорой медицинской помощи1 для этого применяют физиотерапевтические средства увеличения теплоотдачи: охлаждающие жидкости и аппликации. Из медикаментов предусмотрено применение солевых растворов, нестероидных противовоспалительных средств и диазепама. Судя по суточной или курсовой дозе последнего (10 мг), подразумевается его назначение в разовой дозе 5 мг в качестве седативного средства. В литературе отсутствуют данные о влиянии диазепама, применяемого в таком режиме, на тепловое состояние организма. Однако при парентеральном введении бензодиазепинов в дозах более 20 мг, аналогичных применяемым для купирования судорожного синдрома химической этиологии [3], такое влияние представляется вероятным.
Внутримышечное введение бензодиазепинов на догоспитальном этапе, осуществляемое, как правило, с целью купирования судорожного синдрома, — вынужденная альтернатива их внутривенному введению, проблематичному на фоне судорог. Ввиду низкой водорастворимости фармацевтических субстанций бензодиазепиновой группы их концентрация в официнальных инъекционных препаратах (сибазон, мидазолам) не превышает 5 мг/мл. Поэтому одномоментная доставка в организм человека бензодиазепинов в дозах более 20 мг требует внутримышечного введения таких препаратов в объемах более 4 мл, что не всегда возможно. Ранее мы предложили подход к преодолению этого ограничения, основанный на использовании неводного раствора бензодиазепина [4] и его назальной лекарственной формы [5]. Создан прототип препарата «Феназепам спрей назальный» (ФСН), содержавший 170 мг феназепама в 1 мл. При двукратном впрыске по 140 мкл ФСН в каждый носовой ход доза феназепама превышала высшие разовые дозы диазепама или мидазолама, вводимых в виде официальных инъекционных препаратов, в 4,8 и в 6,4 раза соответственно. Необходимость таких доз определялась изначальным требованием к ФСН как к средству купирования судорожного синдрома химической этиологии. Однако увеличение дозы открывает возможность проявления у феназепама и других фармакологических свойств, некоторые из которых, предположительно, полезны в условиях теплового стресса. В этой связи заслуживает внимания факт снижения бензодиазепинами потребления кислорода как головным мозгом [6], так и организмом в целом [7]. Сопряженное с этим уменьшение теплопродукции могло бы замедлить рост температуры тела в условиях, способствующих перегреванию организма, а значит, и повысить переносимость тепловой нагрузки. Однако имеется предпосылка и к противоположному эффекту: нарушение поведенческих паттернов, направленных на увеличение теплоотдачи. У крыс, кожа которых, исключая подошвенную поверхность конечностей, лишена потовых желез, к таковым гипотетически относится груминг с нанесением на шерстный покров слюны и ее последующим испарением — терморегуляторная реакция, аналогичная потоотделению у человека [8].
Цель исследования — экспериментальная оценка влияния ФСН на уровень метаболизма и тепловой баланс при тепловом стрессе.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено с использованием беспородных крыс-самцов альбиносов (191–210 г), приобретенных в Филиале НИЦ «Курчатовский институт» — ПИЯФ — ПЛЖ «Рапполово». Животные получали стандартный корм для крыс и питьевую воду ad libitum. Проведено две серии экспериментов.
В первой серии экспериментов использовали 16 животных по 8 особей в каждой группе (контроль, опыт). Изучали динамику интенсивности функции внешнего дыхания и потребления кислорода организмом после однократной интраназальной инстилляции изотонического 0,9% и раствора хлорида натрия контрольным животным и ФСН 170 мг/мл в объеме 10 мкл (по 5 мкл в каждый носовой ход) животным из опытной группы, что соответствует средней дозе фармацевтической субстанции феназепама® 8,5 мг/кг и биоэквивалентно дозе 100 мг (четыре впрыскивания по 140 мкл ФСН) для человека. Для введения растворов использовали дозаторы переменного объема. Острая токсичность ФСН в указанной дозе характеризовалась данными доклинического исследования его опытного промышленного образца, в котором интраназальное введение крысам ФСН в 20 раз бóльшей дозе (пятикратно по 40 мкл с интервалом 10 мин) не вызывало гибели животных. Потребление кислорода организмом определяли в аппарате Миропольского с респирометрической камерой емкостью 2 л, к которой животных приучали в течение 2 мин до начала каждого измерения. Интенсивность потребления кислорода организмом QО2, мл/(кг×мин) находили из уравнения:
QО2 = V×F/(m×∆t), (1)
где V — объем манометрической жидкости, поступившей в бюретку, мл;
F — коэффициент для приведения объема кислорода к нормальным условиям;
m — масса тела, кг;
∆t — время пребывания крысы в герметизированной камере, мин.
Продолжительность измерения составляла 3 мин, его абсолютная погрешность — 0,1 мл (≤2% величины V). Животных не фиксировали, они свободно располагались в респирометрической камере. В это время у них подсчитывали частоту дыхательных движений (мин-1). Измерения проводили с интервалом 10 мин.
Во второй серии экспериментов изучали влияние ФСН на динамику ректальной температуры, массы тела и летальность крыс, размещенных в термокамере в условиях, допускавших (размещение в вольерах) или исключавших (размещение в рестрейнерах) груминг. Формировали четыре рандомизированные группы: две контрольные и две опытные по 12–14 особей.
1-я группа (n = 14) — интраназальное введение 0,9% р-ра хлорида натрия в объеме 10 мкл; содержание животных в вольере;
2-я группа (n = 14) — интраназальное введение ФСН 170 мг/мл в объеме 10 мкл; содержание животных в вольере;
3-я группа (n = 12) — интраназальное введение 0,9% р-ра хлорида натрия в объеме 10 мкл; содержание животных в рестрейнерах;
4-я группа (n = 12) — интраназальное введение 0,9% р-ра ФСН 170 мг/мл в объеме 10 мкл; содержание животных в рестрейнерах.
Препараты вводили по 5 мкл в каждый носовой ход до помещения животных в термокамеру и далее каждые полчаса. Число инстилляций зависело от продолжительности жизни животных и варьировало от двух до семи; суммарная доза феназепама составляла при этом от 17 до 59,5 мг/кг.
Сразу после введения препаратов животных (одномоментно по 3 особи из каждой группы) помещали в термокамеру. Размер рестрейнеров не препятствовал дыхательным движениям, но исключал груминг. Климатические условия, способствовавшие перегреванию организма, моделировали в термокамере BMT Stericell SC 111 ECO (Чехия) емкостью 111 л с вытяжной вентиляцией 5 м3/ч. Температуру воздуха 40 ± 1 °С, относительную влажность 46% поддерживали автоматически. Тепловой баланс организма оценивали по динамике ректальной температуры, которую измеряли с интервалом 30 мин электрическим термометром с датчиком для крыс RET-2 (WPI, КНР), наконечник термометра вводили в rectum на глубину 3 см. Потерю организмом влаги оценивали по изменению массы тела, измеряемой с получасовым интервалом.
Результаты представляли в виде среднего значения и его ошибки (M ± m). Для проверки нормальности распределения использовали критерий Шапиро — Уилка. Для оценки влияния тепловых условий и вводимых веществ на регистрируемые количественные показатели проводили многомерный дисперсионный анализ. При наличии значимого влияния какого-либо фактора выполняли одномерный дисперсионный анализ. В случаях экспериментальных планов с повторными измерениями использовали модели со смешанными эффектами. Межгрупповое сравнение средних величин выполняли методом линейных контрастов, выбранных априорно, либо с помощью апостериорных критериев Тьюки. Для выявления межгрупповых различий функций дожития использовали критерий Гехана — Вилкоксона, частоты встречаемости альтернативных признаков — точный метод Фишера. Критический уровень значимости a приняли равным 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В первой серии экспериментов через 2–3 мин после однократной интраназальной инстилляции ФСН 170 мг/мл 10 мкл двигательная активность крыс снижалась, животные выглядели заторможенными. Результаты изучения влияния ФСН на потребление кислорода и внешнее дыхание представлены на рисунке 1.
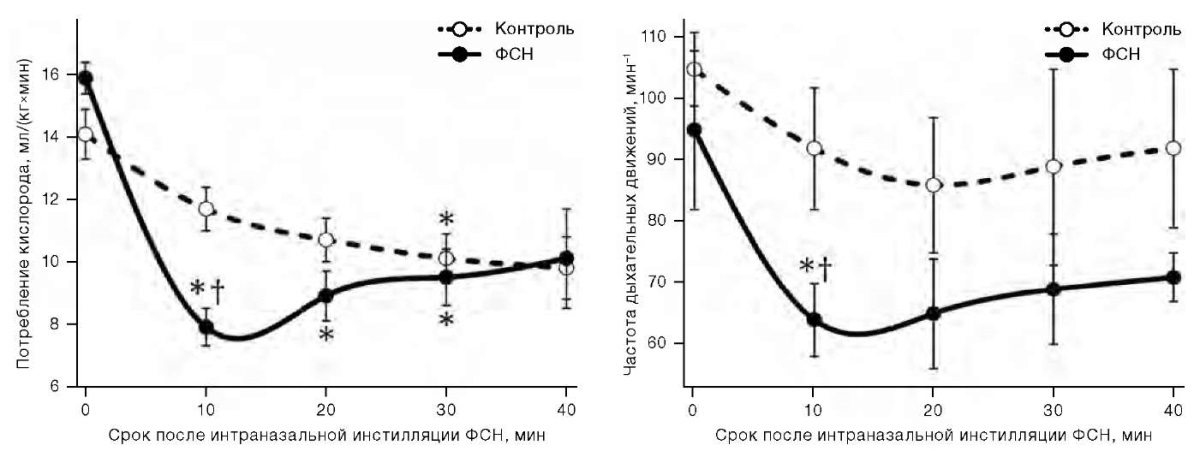
Рисунок подготовлен авторами по собственным данным
Рис. 1. Динамика потребления кислорода (слева) и частоты дыхательных движений (справа) у крыс самцов после однократной интраназальной инстилляции ФСН
Примечание: данные представлены в виде среднего значения и стандартной ошибки среднего (M ± m); * — статистически значимое отличие от исходного уровня; † — статистически значимое отличие от группы контроля.
Как видно из данных, представленных на рисунке 1, через 10 мин после применения ФСН потребление кислорода животными опытной группы снижалось на 33%, а частота дыхательных движений — на 32% по сравнению со значениями в группе контроля. Газообменная эффективность внешнего дыхания, оцениваемая по потреблению кислорода в расчете на дыхательный цикл, существенно не изменялась. В последующие 20 мин потребление кислорода у крыс, интраназально однократно получавших ФНС, оставалось на 9–20% более низким, чем в контроле, хотя и имело тенденцию к частичной нормализации. Таким образом, продолжительность гипометаболического действия однократной инстилляции ФСН составляла не менее получаса.
Во второй серии экспериментов при изучении влияния ФСН 170 мг/мл в объеме 10 мкл на состояние теплового обмена у крыс отмечено, что пребывание животных в термокамере приводило к статистически значимому повышению ректальной температуры. У животных, помещенных в рестрейнеры, в течение часа она возрастала на 5,5 ± 0,3 °С против 3,3 ± 0,3 °С у животных, свободно располагавшихся в вольерах. В эти же сроки применение ФСН на 15% ускоряло прирост температуры тела у крыс, располагавшихся в вольерах, но на 11% замедляло его у находившихся в рестрейнерах (рис. 2а). При размещении в вольерах у получивших солевой раствор животных наблюдался активный груминг, чего не было у получивших ФСН. Через 120 мин после помещения в вольеры оцениваемая по убыли массы тела потеря организмом влаги на фоне применения ФСН была на 1% от исходной массы тела меньшей, чем в контроле (рис. 2б). Продолжительность жизни крыс в вольерах была большей, чем в рестрейнерах. При расположении в вольерах применение ФСН снижало продолжительность жизни, а при размещении в рестрейнерах имелась тенденция к ее продлению (рис. 2в).
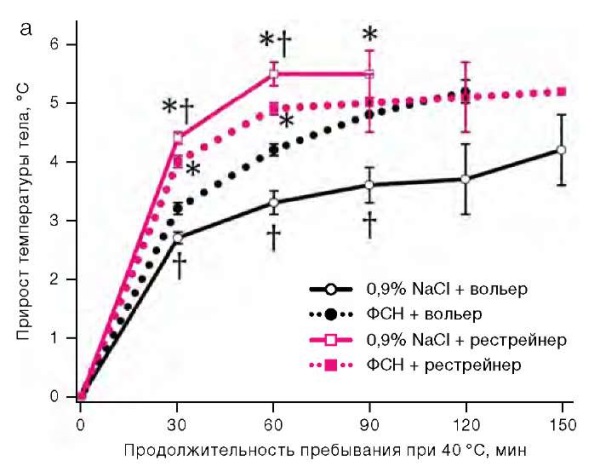
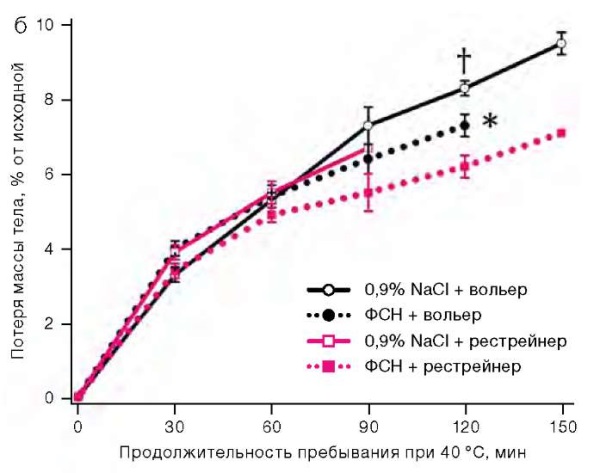
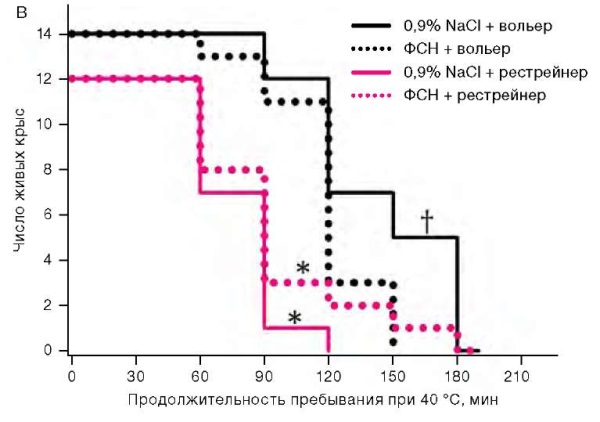
Рисунок подготовлен авторами по собственным данным
Рис. 2. Динамика ректальной температуры, потери массы тела и выживаемость у крыс при температуре воздуха 40 °С
Примечание: прирост ректальной температуры и потеря массы тела представлены как среднее значение и стандартная ошибка среднего (M ± m); * — статистически значимое отличие от группы крыс, размещенных в вольере; † — статистически значимое отличие от группы крыс, получавших ФСН, при аналогичных условиях размещения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При однократной инстилляции 10 мкл ФСН доза феназепама для крыс составляла 8,5 мг/кг м.т., что биоэквивалентно 100 мг для взрослого человека. Это пятикратно превышало высшую разовую дозу диазепама 20 мг, которая при внутривенном введении снижала потребление кислорода человеком на 8% [9]. Поэтому наблюдавшийся в настоящем исследовании вчетверо больший гипометаболический эффект ФСН был обусловлен дозой бензодиазепина, при экстраполяции на человека пятикратно превышавшей высшую разовую дозу. Продолжительность этого эффекта была близка к получасу, что указывает на необходимость повторных назначений ФСН для достижения более длительного гипометаболического действия.
Как следовало из роста температуры тела, пребывание в термокамере вызывало у крыс тепловой стресс. В силу невозможности груминга у крыс, помещенных в рестрейнеры, затруднялось распределение влаги (предположительно слюны) по шерстному покрову, а следовательно, и потеря тепла ее испарением. Это делало сопоставимыми условия теплоотдачи для помещенных в рестрейнеры животных, получавших интраназальные инстилляции ФСН или раствора хлорида натрия. Поэтому вероятной причиной уменьшения теплового стресса крыс, располагавшихся в рестрейнерах, на фоне применения ФСН было не повышение теплоотдачи, а снижение теплопродукции.
Оценка снижения теплопродукции у животных, перед помещением в термокамеру получивших ФСН, возможна с использованием калорического эквивалента кислорода, который при рационе с преобладанием углеводов близок к 21 Дж/мл [10]. В течение ближайших 30 мин после инстилляции ФСН потребление кислорода животными было в среднем на 2,06 мл/(кг×мин) меньшим, чем в контроле, что отвечает на 1294 Дж/кг меньшей теплопродукции. При близости значений удельной теплоемкости биотканей и воды 4187 кал/(кг×°С) это могло вести к уменьшению на 0,3 °С прироста температуры тела за ближайшие 30 мин после помещения крыс в термокамеру, что и наблюдалось в настоящей работе. Таким образом, при повышенной температуре воздуха и невозможности испарения влаги с большей части поверхности тела введение ФСН замедляло формирование теплового стресса у крыс, снижая теплопродукцию. Для экстраполяции этих данных на человека представляет интерес изучить влияние ФСН на температуру тела в условиях, препятствующих теплоотдаче испарением: при высокой относительной влажности [11], пребывании в изолирующих средствах защиты кожи [12] или при иммерсионной гипертермии [13]. Способность диазепама, вводимого внутривенно в дозах 10 или 20 мг, снижать температуру тела человека [14] позволяет ожидать ее снижения и на фоне применения ФСН.
Оптимальная относительная влажность и достаточная скорость воздухообмена в термокамере благоприятствовали потере тепла путем испарения влаги крысами, имевшими возможность наносить ее на поверхность тела. Поэтому при их расположении в вольерах температура тела повышалась медленнее, чем в рестрейнерах. Однако введение ФСН сглаживало это различие: препарат ускорял повышение температуры тела. Через 120 мин после помещения в вольеры потеря массы тела, в основном обусловленная испарением воды, на фоне применения ФСН была на 10 г/кг меньшей, чем при введении солевого раствора. При удельной теплоте парообразования воды 2260 Дж/г это соответствовало накоплению в теле животных на 22 600 Дж/кг большего количества теплоты, чем в контроле. При удельной теплоемкости биотканей, близкой к 4187 Дж/(кг×°С), этой энергии было достаточно для повышения температуры тела на 5,4 °С; в действительности же у получивших ФСН крыс она была лишь на 2 °С выше, чем в контроле. Это говорит о влиянии на температуру тела получивших ФСН крыс противоположно направленных факторов, в том числе уменьшения теплоотдачи и показанного выше снижения теплопродукции. Как видно, у животных, не имевших физических препятствий к увлажнению поверхности тела, влияние ФСН на теплоотдачу преобладало над его влиянием на теплопродукцию.
Определенную роль в снижении выживаемости крыс, перед свободным расположением в термокамере получивших ФСН, могли играть неблагоприятные фармакологические эффекты бензодиазепинов: разобщающее действие на окислительное фосфорилирование [15], снижение артериального давления, частоты сердечных сокращений и коронарного кровотока [16]. Однако основным механизмом вызванного ФСН снижения выживаемости в условиях свободного расположения в термокамере было усугубление теплового стресса. На это указывает тот факт, что через 90 мин после помещения в термокамеру температура тела 43 °С, соответствующая порогу необратимого повреждения биотканей [17], достигалась у 21 и 71% животных, получавших солевой раствор и ФСН соответственно (p < 0,05). Экстраполяция этих данных на человека затруднена наличием у него потовых желез на всей поверхности кожного покрова, что обеспечивает теплоотдачу испарением даже на фоне гиподинамии. Вместе с тем нарушение теплоотдачи не исключено и у человека ввиду сообщений об антагонизме бензодиазепинов к мускариновым рецепторам [18], что требует учета климатических условий при разработке рекомендаций по применению ФСН.
Полученные результаты указывают на возможность смягчения применением ФСН теплового стресса при высокой относительной влажности, пребывании в изолирующих средствах защиты кожи или при иммерсионной гипертермии. Особую ценность такая возможность обретает при продолжающемся тепловом воздействии или недоступности физических средств охлаждения тела на догоспитальном этапе помощи пострадавшим.
ВЫВОДЫ
- Однократная интраназальная инстилляция крысам феназепама в дозе 8,5 мг/кг м.т., что биоэквивалентно 100 мг для взрослого человека, снижала потребление кислорода организмом на величину, достаточную для уменьшения на 0,3 °С прироста температуры тела за 30 мин пребывания при температуре воздуха 40 °С. Продолжительность гипометаболического действия однократной инстилляции назального препарата феназепама (ФСН) составляла не менее получаса, что обеспечивало этот эффект у животных, получавших препарат с получасовым интервалом.
- При температуре воздуха 40 °С и отсутствии условий для испарения влаги с поверхности тела введение крысам ФСН уменьшало тепловой стресс, снижая теплопродукцию и прирост ректальной температуры на 0,3 °С за 30 мин.
- Открытое расположение крыс при температуре воздуха 40 °С в вольерах, не создававшее препятствий теплоотдаче путем испарения слюны, наносимой на шерстный покров, сопровождалось более медленным повышением температуры тела и меньшей летальностью, чем при расположении животных в рестрейнерах.
- Введение ФСН способствовало повышению температуры тела и летальности у крыс, располагавшихся в вольерах при температуре воздуха 40 °С. Основным механизмом этих эффектов было снижение теплоотдачи испарением вследствие подавления ФСН видоспецифического терморегуляторного рефлекса: нанесения слюны на шерстный покров.
- ФСН перспективен в качестве средства фармакотерапии теплового удара при высокой относительной влажности, пребывании в изолирующих средствах защиты кожи или при иммерсионной гипертермии. Требует проверки возможность усугубляющего влияния ФСН на тепловой стресс у человека в условиях жаркого климата при беспрепятственной теплоотдаче испарением.
1. Приказ Министерства здравоохранения Российской Федерации № 1115н. Стандарт скорой медицинской помощи при тепловом и солнечном ударе; 20.12.2012.
Список литературы
1. Cramer MN, Gagnon D, Laitano O, Crandall C. Human temperature regulation under heat stress in health, disease, and injury. Physiol. Rev. 2022;102(4):1907–89.https://doi.org/10.1152/physrev.00047.2021
2. Garcia CK, Renteria LI, Leite-Santos G, Leon LR, Laitano O. Exertional heat stroke: pathophysiology and risk factors. BMJ Ved. 2022;1(1):e000239. https://doi.org/10.1136/bmjmed-2022-000239
3. Крюков ЕВ, ред. Военно-полевая терапия. СПб.: ООО «ГЭОТАР-Медиа 2023.
4. Краснов КА, Ивницкий ЮЮ, Вакуненкова ОА, Рейнюк ВЛ. Фармацевтическая композиция для устранения судорожного синдрома на основе никетамида и препаратов бензодиазепиновой группы. Патент Российской Федерации № 2801050;2023.
5. Ивницкий ЮЮ, Рейнюк ВЛ, Краснов КА, Краснова АА, Шутаева КВ. Требования к медикаментозным средствам первой помощи при судорожном синдроме химической этиологии (обзор литературы). Воен. мед. журн. 2022;343(3):18–23. https://doi.org/10.52424/00269050_2022_343_3_18
6. Fleiscer JE, Milde JH, Moyer TP, Michenfelder JD. Cerebral effects of high-dose midazolam and subsequent reversal with Ro 14-1788 in dogs. Anesthesiol. 1988;68(2):234–42. https://doi.org/10.1097/00000542-198802000-00010
7. Hostler D, Northington WE, Callaway CW. High-dose diazepam facilitates core cooling during cold saline infusion in healthy volunteers. Appl. Physiol. Nutr. Metab.2009;4(4):582–6. https://doi.org/10.1139/H09-011
8. Attah AT, Negrón-Moreno PN, Amigo-Duran M, Zhang L, Kenngott M, Brecht M. et al. Sensory cues, behavior and fur-based drying in the rat wetness response. Sci Rep. 2024;14(1):24550. https://doi.org/10.1038/s41598-024-74900-9
9. Griffe O, Griffe H, du Cailar J. Effects of diazepam on oxygen consumption. Ann. Aneshesiol. Fr. 1979;20(1):37–40.
10. Симбирцев ГС. Регулирующее влияние углекислого газа на потребление кислорода у спортсменов, развивающих выносливость, в свете математического анализа продукции энергии аэробного окисления. Спортивная медицина: наука и практика. 2019;9(3):12–24. https://doi.org/10.17238/ISSN2223-2524.2019.3.12
11. Wolf ST, Bernard TE, Kenney WL. Heat exposure limits for young unacclimatized males and females at low and high humidity. J. Occup. Environ. Hyg. 2022;19(7):415–24. https://doi.org/10.1080/15459624.2022.2076859
12. Zhao Y, Su M, Meng X, Liu J, Wang F. Thermophysiological and perceptual responses of amateur healthcare workers: impacts of ambient condition, inner-garment insulation and personal cooling strategy. Int. J. Environ. Res. Public Health. 2022;20(1):612. https://doi.org/10.3390/ijerph20010612
13. Ким АЕ, Шустов ЕБ, Зайцева ИП, Лемещенко АВ. Патофизиологические механизмы неблагоприятного взаимодействия гипоксии и температурных факторов в отношении физической работоспособности. Пат. Физиол. Эксперим. Терап. 2022;66(4):94–106. https://doi.org/0.25557/0031-2991.2022.04.94-106
14. Hostler D, Northington WE, Callaway CW. High-dose diazepam facilitates core cooling during cold saline infusion in healthy volunteers. Appl. Physiol.Nutr. Metab. 2009.34(4):582–86. https://doi.org/10.1139/H09-011
15. Jeso F, Truscello A, Martinotti G, di Jeso B, Magnani B, Martinotti A. Effect of diazepam on mitochondrial respiration. C. R. Seances. Soc. Biol. Fil. 1990;184(1):37–40.
16. Shintani R, Ichinomiya T, Tashiro K, Miyazaki Y, Tanaka T, Kaneko S, et al. Comparison of hemodynamic effects of remimazolam and midazolam during anesthesia induction in patiemts undergoing cardiovascular surgery: a single-center retrospective and exploratory study. Cureus. 2024;16(10):e72032. https://doi.org/10.7759/cureus.72032
17. Yarmolenko PS, Moon EJ, London C, Manzoor A, Hochman DW, Viglianti L, Dewhirst MW. Thresholds for thermal damage to normal tissues: an update. Int. J. Hyperthermia. 2011;27(4):320–43. https://doi.org/10.3109/02656736.2010.534527
18. Hiroshi K, Naoko T, Mitsuru K, Mostofa J, Asuka I, Nagata K, et al. An autopsy case of heatstroke under the influence of psychotropic drugs. Soud. Lek. 2020;65(4):76–8.
Об авторах
Ю. Ю. ИвницкийРоссия
Ивницкий Юрий Юрьевич - д-р мед. наук, профессор.
Санкт-Петербург
О. А. Вакуненкова
Россия
Вакуненкова Ольга Александровна
Санкт-Петербург
К. А. Краснов
Россия
Краснов Константин Андреевич - д-р хим. наук
Санкт-Петербург
С. С. Гафт
Россия
Гафт Семен Самуилович - канд. хим. наук
Санкт-Петербург
Н. В. Лапина
Россия
Лапина Наталья Вадимовна - канд. мед. наук
Санкт-Петербург
Дополнительные файлы
Рецензия
Для цитирования:
Ивницкий Ю.Ю., Вакуненкова О.А., Краснов К.А., Гафт С.С., Лапина Н.В. Теплоотдача испарением определяет знак влияния назального феназепама на тепловой стресс у крыс. Медицина экстремальных ситуаций. 2025;27(1):37-42. https://doi.org/10.47183/mes.2024-245
For citation:
Ivnitsky J.J., Vakunenkova O.A., Krasnov K.A., Gaft S.S., Lapina N.V. Heat transfer by evaporation determines the effect of nasal phenazepam on thermal stress in rats. Extreme Medicine. 2025;27(1):37-42. https://doi.org/10.47183/mes.2024-245

















