Перейти к:
Анализ факторов, влияющих на процессы апоптоза в периоде отдаленных последствий тяжелых острых отравлений нейротропными токсикантами
https://doi.org/10.47183/mes.2024-247
Аннотация
Введение. Поражение нервной системы при действии нейротоксикантов характеризуется различными морфологическими изменениями, проявляющимися в основном дистрофическими и некротическими процессами. Ключевыми механизмами патогенеза постинтоксикационной астении, определяющимися спецификой токсиканта, являются активация апоптоза, нарушение трофики, активация перекисного окисления липидов (ПОЛ), недостаточность нейропептидного звена регуляции, нарушения ликвородинамики.
Цель. Количественная оценка вклада процессов апоптоза, оксидативного стресса и нейротрофиновой регуляции в формировании отдаленных последствий тяжелых острых отравлений нейротропными токсикантами.
Материалы и методы. Экспериментальное исследование выполнено на крысах-самцах. В качестве токсикантов использовались: фенилкарбамат (1,6 мг/кг м.т.), метанол (11,5 г/кг м.т.), ацетат свинца (300 мг/кг м.т.). Период формирования отдаленных последствий составил 30 суток. Уровень апоптоза нейронов височной коры головного мозга определяли методом TUNEL. Определение нейроспецифических белков в плазме крови осуществлялось ИФА-методом. Определение показателей ПОЛ и антиоксидантной системы проводили стандартными биохимическими методами.
Результаты. Воздействие веществ вызывало признаки токсического действия у крыс на 1–2-е сутки, причем у фенилкарбамата с максимальной выраженностью в первые, а у метанола и ацетата свинца — на вторые. К 5–7-м суткам у выживших животных (независимо от токсиканта) состояние нормализовалось. На 30-е сутки были выявлены нарушения, совокупность которых позволила разделить выживших животных на подгруппы по уровню сформированности функциональных признаков отдаленных последствий острых отравлений.
Выводы. Показано, что формирование отдаленных последствий тяжелых острых отравлений для исследуемых нейротоксикантов связано с повышением количества TUNEL-позитивных нейронов и снижением концентрации белка S100 в сыворотке. Процессы ПОЛ в тканях мозга в указанные сроки не играли существенной роли в активации апоптоза.
Ключевые слова
Для цитирования:
Шустов Е.Б., Мельникова М.В., Мастерова К.В., Остров В.Ф., Золотоверхая Е.А., Кубарская Л.Г., Танаянц К.О., Козлов А.А., Соколова Ю.О., Потапов П.К. Анализ факторов, влияющих на процессы апоптоза в периоде отдаленных последствий тяжелых острых отравлений нейротропными токсикантами. Медицина экстремальных ситуаций. 2025;27(1):5-14. https://doi.org/10.47183/mes.2024-247
For citation:
Shustov E.B., Melnikova M.V., Masterova K.V., Ostrov V.F., Zolotoverkhaja E.A., Kubarskaya L.G., Tanayants K.O., Kozlov A.A., Sokolova Yu.O., Potapov P.K. Analysis of factors influencing apoptotic processes during formation of long-term health effects of severe acute poisoning with neurotropic toxicants. Extreme Medicine. 2025;27(1):5-14. https://doi.org/10.47183/mes.2024-247
ВВЕДЕНИЕ
Отдаленный период после тяжелых острых отравлений нейротропными токсикантами характеризуется развитием преимущественно неспецифических проявлений психоорганического синдрома, постинтоксикационной и цереброгенной астенией, токсическими полинейропатиями. Токсическое поражение нервной системы, как и других тканей организма, имеет различные морфологические изменения на клеточном и тканевом уровнях и проявляется в основном дистрофическими и некротическими процессами [1][2]. Применение световой микроскопии позволяет установить наличие апоптоза нейронов, которое является следствием большинства токсических поражений нервной системы [3]. Для токсического повреждения ткани головного мозга наиболее характерны мелкие очаги некроза, часто элективного, при котором повреждаются только отдельные элементы ткани (часть из них сохраняется); такие очаги проявляются разрежением нейропиля и глиопенией. Морфологической основой психоорганического синдрома при нейроинтоксикациях является гибель нейронов и глиальных клеток, связанная как с прямым токсическим действием ксенобиотиков, так и с индукцией процессов апоптоза [4]. Ключевыми механизмами патогенеза постинтоксикационной астении, определяющимися спецификой токсиканта, являются активация апоптоза, нарушение трофики, активация перекисного окисления липидов (ПОЛ), недостаточность нейропептидного звена регуляции, нарушения ликвородинамики. Токсические нейропатии проявляются сегментарной демиелинизацией (токсической миелинопатией) и аксональной дегенерацией (токсической дистальной аксонопатией).
К неспецифическим механизмам токсического действия, характерным для всех нейротропных ксенобиотиков, могут быть отнесены: угнетение активности ферментов за счет блокады сульфгидрильных, карбоксильных, амино- и других функционально активных структурных групп в составе пептидов и белков; формирование оксидативного стресса с последующей активацией процессов ПОЛ1; угнетение митохондрий; нарушение гомеостаза кальция; эксайтотоксичность; экспрессия провоспалительных цитокинов, индукция воспалительных процессов в нервной ткани; гаптеновая модификация белков с приобретением ими антигенных свойств с индукцией аутоиммунных механизмов повреждения; угнетение высвобождения нейротрофинов, нейроногенеза и глиогенеза в сочетании с подавлением пролиферации и дифференциации новых нейронов и глиоцитов; усиление проницаемости гематоэнцефалического барьера; усиление процессов апоптоза клеток центральной и периферической нервной системы2 [5–8].
В настоящее время актуальным и приоритетным является более углубленное исследование отдаленных последствий тяжелых острых отравлений нейротропными токсикантами.
Цель исследования — количественная оценка вклада процессов апоптоза, оксидативного стресса и нейротрофиновой регуляции в формировании отдаленных последствий тяжелых острых отравлений нейротропными токсикантами.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальное исследование выполнено на 53 крысах-самцах аутбредной линии с массой тела на начало исследования 180–220 г, поступивших из НИЦ «Курчатовский институт» — питомник «Рапполово», Ленинградская область.
Моделирование отдаленных последствий проводили путем однократного введения нейротропных токсикантов лабораторным животным в дозе ЛД50. Период формирования отдаленных последствий составлял 30 суток. В качестве токсикантов были использованы:
- фенилкарбамат — обратимый ингибитор ацетилхолинэстеразы, синтезированный в лаборатории синтеза лекарственных препаратов Научно-клинического центра токсикологии имени академика С.Н. Голикова [9];
- метанол (АО «Вектон», Россия) — органический растворитель, реализующий свое токсическое действие за счет повреждения клеточных мембран;
- ацетат свинца (ООО АО «Реахим», Россия) — органическая соль тяжелого металла, подавляющая активность различных ферментов.
Лабораторные животные были распределены на 4 группы:
группа 1 — «Контроль» К (n = 8), проведено внутрижелудочное введение 0,5 мл физиологического раствора;
группа 2 — «Фенилкарбамат» (ФК) (n = 15), проведено внутрибрюшинное введение в виде 0,1% водного раствора в дозе 1,6 мг/кг м.т.;
группа 3 — «Метанол» (М) (n = 15), проведено внутрижелудочное введение в виде 75% водного раствора в дозе 11,5 г/кг м.т.;
группа 4 — «Ацетат свинца» (АС) (n = 15), проведено внутрибрюшинное введение в виде 5% водного раствора в дозе 300 мг/кг м.т.
Выявленные в результате наблюдения признаки токсического действия оценивали в баллах в соответствии со шкалой признаков интоксикации [10]. Еженедельно определяли динамику массы тела животных, потребление ими корма и воды.
Для оценки формирования фазы отдаленных последствий токсического действия на 7, 15, 21 и 28-е сутки проводили нейрофизиологическое тестирование животных в тестах «Открытое поле» («VideoMot 2», TSE, Германия), «Вращающийся стержень» («Rota-Rod Treadmills for rats 7700-7750», Ugo Basile, Италия), «Сила хвата» («Gripstrengthmeter 303500 series, TSE, Германия), «Исследование сенсорных реакций» («Startle Response System», TSE, Германия), «Оценка условного рефлекса пассивного избегания (УРПИ)» (PACS-30, Columbus Instruments, США).
На 28-й день исследования у выживших животных (n = 32) осуществляли забор образцов крови и тканей головного мозга для последующего исследования.
Определение нейроспецифических белков (нейроспецифическая енолаза NSE, нейротрофический фактор мозга BDNF, основной белок миелина MBP и кальций-связывающий белок S100) в плазме крови животных осуществляли методом иммуноферментного анализа с использованием коммерческих наборов (Cloud-Clone Corp, США) согласно инструкции производителя. Показатели перекисного окисления липидов (диеновые конъюгаты (ДК), малоновый диальдегид (МДА)); антиоксидантной системы (АОС) (восстановленный глутатион (ВГ), активность глутатионтрансферазы (ГТ), глутатионпероксидазы (ГП), супероксиддисмутазы (СОД)), а также маркера энергетического обмена (активность глюкозо-6-фосфатдегидрогеназы (Г6ФДГ)) определяли в гомогенате ткани мозга, как описано ранее [11].
Оценку активности процессов апоптоза осуществляли путем определения количества TUNEL-позитивных (Terminal deoxynucleotidyl transferase dUTP nick end labeling) клеток в височной коре крыс. Выбор этого участка коры был обусловлен особенностями ее цитоархитектоники (высокая плотность нейронов, радиальное расхождение корковых колонок, наличие интернейронов 8 типов и проекций от слухового, статокинетического, вкусового и обонятельного анализаторов, таламуса, высокая их чувствительность к гипоксии, частые дисплазии и способность к эпилептогенезу). Подсчет апоптотических TUNEL-клеток проводился на 4–5 срезах исследуемой области головного мозга. Был использован коммерческий набор Elabscience® E-CK-A320 «Набор для изучения апоптоза TUNEL In Situ (Green, FITC), One-step TUNEL In Situ Apoptosis Kit». Изображения срезов головного мозга были получены с помощью микроскопа Nikon Eclipse 80i с цветной камерой Nikon DS-Fi1c при увеличении ×100 для анализа и ×200 для фотоматериалов в разрешении 1280×960 пикселей программой NIS-Elements AR 4.20.00. Подсчет апоптотических TUNEL-клеток проводился на 4–5 срезах исследуемой области головного мозга каждого животного.
Статистическая обработка полученных экспериментальных данных осуществлялась в процессоре электронных таблиц MS EXCEL с использованием пакета прикладных программ «Анализ данных» и специализированной программы статистического анализа Statistica v.10. Применялись методы частотного, дисперсионного, факторного и корреляционного анализов. Достоверность различий между группами оценивали с использованием рангового критерия Уайта, критерия метода точной вероятности Фишера для частотного анализа; F-критерия дисперсионного анализа ANOVA.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Наблюдение за животными в острый интоксикационный период показало, что признаки токсического действия (по сумме баллов, характеризующих особенности внешнего вида, мышечного тонуса, двигательной активности и реакции на взятие на руки) выявлены на 1–2-е сутки с быстрой нормализацией состояния к 5–7-м суткам у выживших животных (рис. 1).
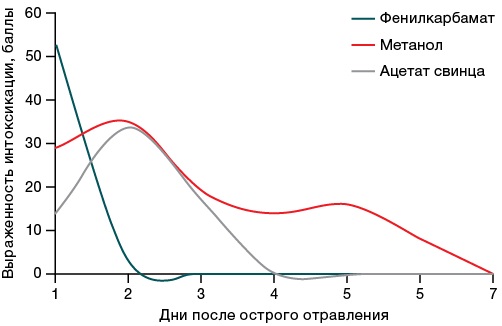
Рисунок подготовлен авторами по собственным данным
Рис. 1. Динамика тяжести интоксикации после введения LD50 токсикантов
В клинической картине острой интоксикации фенилкарбаматом преобладали признаки судорог и атаксии, при отравлении метанолом — снижение мышечного тонуса и двигательной активности, нарушения координации движений и позы, снижение чувствительности и рефлексов, при интоксикации ацетатом свинца — энтеропатогенный симптомокомплекс, раздражение брюшины, нарушения двигательной активности и дыхания. При этом для разных токсикантов была характерна разная скорость нарастания и снижения симптомов интоксикации (максимально быстрое и более выраженное проявление интоксикации, интенсивное снижение — для фенилкарбамата, более медленное снижение — для метанола). Для ацетата свинца было характерно более медленное нарастание симптомов отравления, что связано с особенностями его всасывания в организме.
В ходе динамического наблюдения у животных не были выявлены статистически значимые различия между контрольной группой и группами выживших после острой интоксикации животных по таким показателям, как масса тела, потребление корма, сила хвата лап, время удержания на вращающемся стержне, а также по отдельным показателям использованных нейрофизиологических методик (локомоторная активность, эмоциональная лабильность, агрессивность, груминг в тесте открытого поля; локомоторная активность и пребывание в освещенном секторе при проведении теста УРПИ; показатели рефлекторного ответа на резкий звук и характеристики латентностей в тесте Startle Response System), в связи с чем они не были отражены в последующих таблицах и рисунках.
На 30 сут исследования были выявлены признаки нарушений водно-пищевого поведения, воспроизведения УРПИ, координации движений, торможения в полисинаптических рефлекторных цепях, истощения активационных влияний (табл. 1), совокупность которых позволила разделить выживших после отравления животных на подгруппы по уровню сформированности функциональных признаков отдаленных последствий острых отравлений.
Таблица 1. Динамика нейрофизиологических показателей в постинтоксикационный период
Показатель, тест | Группа | Дни после интоксикации | |||
7 | 15 | 21 | 28 | ||
Потребление воды, мл/сутки1 | Контроль | 26,9 | 25,6 | 27,5 | 28,1 |
Фенилкарбамат | 32,8* | 32,2 | 33,3* | 36,8* | |
Метанол | 32,0* | 35,5* | 21,1 | 20,0* | |
Ацетат свинца | 24,0 | 23,0 | 21,1 | 20,0* | |
Поисково-исследовательская активность, ед. | Контроль | 9,2 ± 1,7 | 8,9 ± 1,6 | 6,0 ± 1,5 | 4,9 ± 1,0 |
Фенилкарбамат | 11,4 ± 1,1 | 10,2 ± 1,2 | 6,2 ± 1,3 | 5,6 ± 1,3 | |
Метанол | 2,8 ± 0,7* | 3,1 ± 0,8* | 4,5 ± 0,4 | 4,9 ± 1,0 | |
Ацетат свинца | 14,6 ± 0,9 | 12,4 ± 2,0 | 8,2 ± 2,0 | 9,2 ± 1,2* | |
Длительность пребывания в темной камере, с | Контроль | 29 ± 15 | – | – | 4 ± 3 |
Фенилкарбамат | 75 ± 11* | – | – | 33 ± 13* | |
Метанол | 35 ± 14 | – | – | 24 ± 13 | |
Ацетат свинца | 35 ± 23 | – | – | 40 ± 2,5* | |
Тредбан, доля выполнивших тест, % | Контроль | 100 | 100 | 100 | 100 |
Фенилкарбамат | 89 | 100 | 78 | 33 | |
Метанол | 100 | 0♦ | 44 | 44 | |
Ацетат свинца | 100 | 30 | 70 | 0♦ | |
Реакция на звук, амплитуда, ед. | Контроль | 76 ± 34 | 123 ± 63 | – | 247 ± 113 |
Фенилкарбамат | 153 ± 72 | 271 ± 135 | – | 303 ± 134 | |
Метанол | 61 ± 39 | 248 ± 33 | – | 159 ± 59 | |
Ацетат свинца | 76 ± 31 | 112 ± 58 | – | 79 ± 25 | |
Реакция на свет, длительность, мс | Контроль | 13 ± 3 | 9 ± 2 | – | 15 ± 2 |
Фенилкарбамат | 14 ± 2 | 9 ± 4 | – | 16 ± 2 | |
Метанол | 7 ± 1* | 9 ± 1 | – | 21 ± 2* | |
Ацетат свинца | 20 ± 5 | 9 ± 4 | – | 31 ± 2● | |
Реакция на электрический стимул, амплитуда, ед. | Контроль | 224 ± 46 | 293 ± 111 | – | 618 ± 80 |
Фенилкарбамат | 283 ± 67 | 358 ± 78 | – | 537 ± 145 | |
Метанол | 46 ± 15♦ | 337 ± 60 | – | 315 ± 63♦ | |
Ацетат свинца | 202 ± 70 | 360 ± 140 | – | 221 ± 74♦ | |
Таблица подготовлена авторами по собственным данным
Примечание: данные представлены в формате среднего значения и стандартной ошибки среднего (М ± m); показатель «потребление воды» представлен в виде среднегруппового значения; «–» — не исследовались; статистически значимые различия с группой контрольных животных: * p < 0,05; ♦ p < 0,01; ● p < 0,001.
Данные таблицы 1 свидетельствуют, что в ранние сроки после острой интоксикации (7 сут) отмечали статистически значимое повышение объема потребления воды у животных, получивших фенилкарбамат и метанол, что необходимо для снижения концентрации токсиканта и ускорения его выведения из организма.
Вместе с тем отмечено снижение поисково-исследовательской активности у крыс-самцов в группе воздействия метанола, 2,8 ± 0,7 ед. против 9,2 ± 1,7 ед. у контрольных животных, что является проявлением прямого токсического действия вещества.
Также было зарегистрировано нарушение воспроизведения выработанных условных рефлексов в тесте УРПИ, постстрессорный эффект у животных из группы фенилкарбамата, 33 ± 13 с против 4 ± 3 с в группе контроля; укорочение длительности реакции на вспышку света, 7 ± 1 мс против 13 ± 3 мс в группе контроля. В ходе работы в группе животных, получавших метанол, отмечали снижение амплитуды реакции в ответ на электрический стимул, 46 ± 15 ед., по сравнению с животными из контрольной группы, 224 ± 46 ед. Указанные признаки соответствуют пролонгированному периоду картины острой интоксикации.
В последующие сроки выраженность подобных изменений в основном нивелировалась. В конечной точке исследований (28-е сутки) у животных из группы ФК сохранялись повышенное потребление воды и нарушения воспроизведения условного рефлекса, отмечавшиеся на ранних сроках после интоксикации.
У животных после воздействия метанола к 21-м суткам после первоначального увеличения потребления воды произошло снижение данного показателя. Наряду с этим отмеченное на ранних сроках увеличение длительности реакции на вспышку света и снижение амплитуды ответа на электрический стимул нивелировалось к концу эксперимента.
В группе животных, выживших после отравления ацетатом свинца, снижение потребления воды отмечали весь период наблюдения с нарастанием показателя к 28-м суткам, также зафиксированы нарушения воспроизведения условных рефлексов, реакций на свет (31 ± 2 мс против 15 ± 2 мс в контроле) и звук, причем более существенные, чем выявленные у крыс при воздействии метанолом. Кроме того, для этих животных оказалось невозможным выполнение теста бега на тредбане, а в тесте открытого поля у животных отмечалась некоторая суетливость, сопровождающаяся повышением поисково-исследовательской активности.
Анализ обнаруженной динамики признаков токсического действия и нейрофизиологических показателей позволил выявить признаки, чувствительные к формированию отдаленных последствий острых отравлений. К ним относятся следующие: нарушение водно-пищевого поведения и его эндокринной регуляции (снижение потребления воды), нарушение воспроизведения условных рефлексов, повышенная чувствительность к стрессу (время пребывания в темной камере в тесте УРПИ), невозможность выполнения теста бега на тредбане на высокой скорости движения ленты, торможение в полисинаптических путях (высокая длительность реакции на свет в тесте TSE Startle Response System) и недостаточность (истощение) активационных влияний (низкая амплитуда реакции на электрический стимул в тесте TSE Startle Response System). В совокупности эти признаки позволили на основе балльной системы оценки получить интегральную количественную величину уровня сформированности отдаленных последствий.
Отмечены отдельные сдвиги в исследуемых показателях метаболизма головного мозга, соответствующие данные представлены в таблице 2.
Таблица 2. Показатели метаболизма головного мозга выживших животных на 28-е сутки после острого отравления нейротоксикантами
Показатель, ед. измерения | Контрольная (n = 8) | Фенилкарбамат (n = 9) | Метанол (n = 10) | Ацетат свинца (n = 5) |
NSE, пг/мл | 0,71 ± 0,11 | 0,65 ± 0,07 | 0,99 ± 0,17 | 1,38 ± 0,39* |
BDNF, нг/мл | 1,22 ± 0,12 | 1,15 ± 0,04 | 1,30 ± 0,09 | 1,73 ± 0,11* |
MBP, нг/мл | 0,06 ± 0,01 | 0,06 ± 0,01 | 0,06 ± 0,01 | 0,05 ± 0,01 |
S100, нг/мл | 0,120 ± 0,011 | 0,084 ± 0,007* | 0,087 ± 0,012 | 0,064 ± 0,006* |
ВГ, ммоль/л | 2,00 ± 0,05 | 1,95 ± 0,04 | 1,91 ± 0,04 | 1,94 ± 0,05 |
МДА, ммоль/л | 19,1 ± 1,7 | 19,2 ± 0,9 | 22,8 ± 2,3 | 18,9 ± 1,0 |
ДК, ммоль/л | 65,3 ± 1,6 | 98,7 ± 36,0 | 126,7 ± 52,9 | 197,2 ± 80,6 |
ГТ, Ед/г белка | 62,7 ± 1,2 | 57,8 ± 3,5 | 75,2 ± 6,0 | 56,2 ± 1,2 |
ГП, Ед/г белка | 1,45 ± 0,03 | 1,42 ± 0,08 | 1,76 ± 0,16 | 1,40 ± 0,04 |
Г-6-ФДГ, Ед/г белка | 35,8 ± 2,3 | 38,2 ± 3,2 | 49,2 ± 5,0* | 42,4 ± 2,3 |
СОД, Ед/г белка | 21,5 ± 5,3 | 24,2 ± 5,7 | 50,0 ± 5,4* | 20,5 ± 5,4 |
Таблица подготовлена авторами по собственным данным
Примечание: данные представлены в формате среднего значения и стандартной ошибки среднего (М ± m); статистически значимые различия с группой интактных животных: * р ≤ 0,05.
Анализ данных, представленных в таблице 2, показывает, что на 28-е сутки после отравления (период формирования отдаленных последствий острых отравлений) под влиянием острой интоксикации фенилкарбаматом у выживших животных отмечается умеренное снижение белка S100 на 30% (р ≤ 0,05).
В группе животных с отравлением метанолом отмечено статистически достоверное повышение активности СОД на 90% и Г-6-ФДГ на 37%, а также статистическая тенденция к снижению активности на 27% белка S100 при повышении активности ферментов антиоксидантной защиты (глутатионтрансферазы и глутатионпероксидазы на 20–21%), что может отражать компенсаторные процессы в ткани мозга в постинтоксикационном периоде.
После острой интоксикации ацетатом свинца у выживших животных на 28-е сутки наблюдалась статистическая тенденция к повышению маркера нейронального повреждения NSE на 94% и увеличение в 3 раза концентрации конечных продуктов ПОЛ диеновых конъюгатов при снижении активности глутатионтрансферазы на 10%, что отражает проявления нейротоксичности этого соединения. В то же время отмечается и более выраженное, по сравнению с другими токсикантами, статистически достоверное снижение активности на 46% белка S100 и основного белка миелина на 23%, повышение активности нейротрофического фактора мозга BDNF на 42%, а также умеренное повышение активности Г-6-ФДГ на 18%, что отражает высокую активность компенсаторно-приспособительных биохимических механизмов в этом периоде.
Необходимо отметить, что нейроспецифические белки, определяемые в сыворотке крови через 30 суток после острого отравления, оказались малоинформативными для выявления и оценки выраженности отдаленных последствий интоксикаций. Только для ацетата свинца были обнаружены метаболические признаки повреждения нейронов и, вероятно, повышения проницаемости гематоэнцефалического барьера. Важным является тот факт, что для ацетата свинца типичным является и активация процессов ПОЛ на фоне снижения активности ферментативного звена антиоксидантной системы. Вероятно, эти данные могут быть соотнесены с известной для тяжелых металлов способностью угнетать ферментативную активность широкого круга ферментов за счет связывания с тиоловыми группами в активном центре.
Микрофотографии срезов височной коры головного мозга крыс для оценки влияния токсикантов на процессы апоптоза нейронов представлены на рисунке 2.
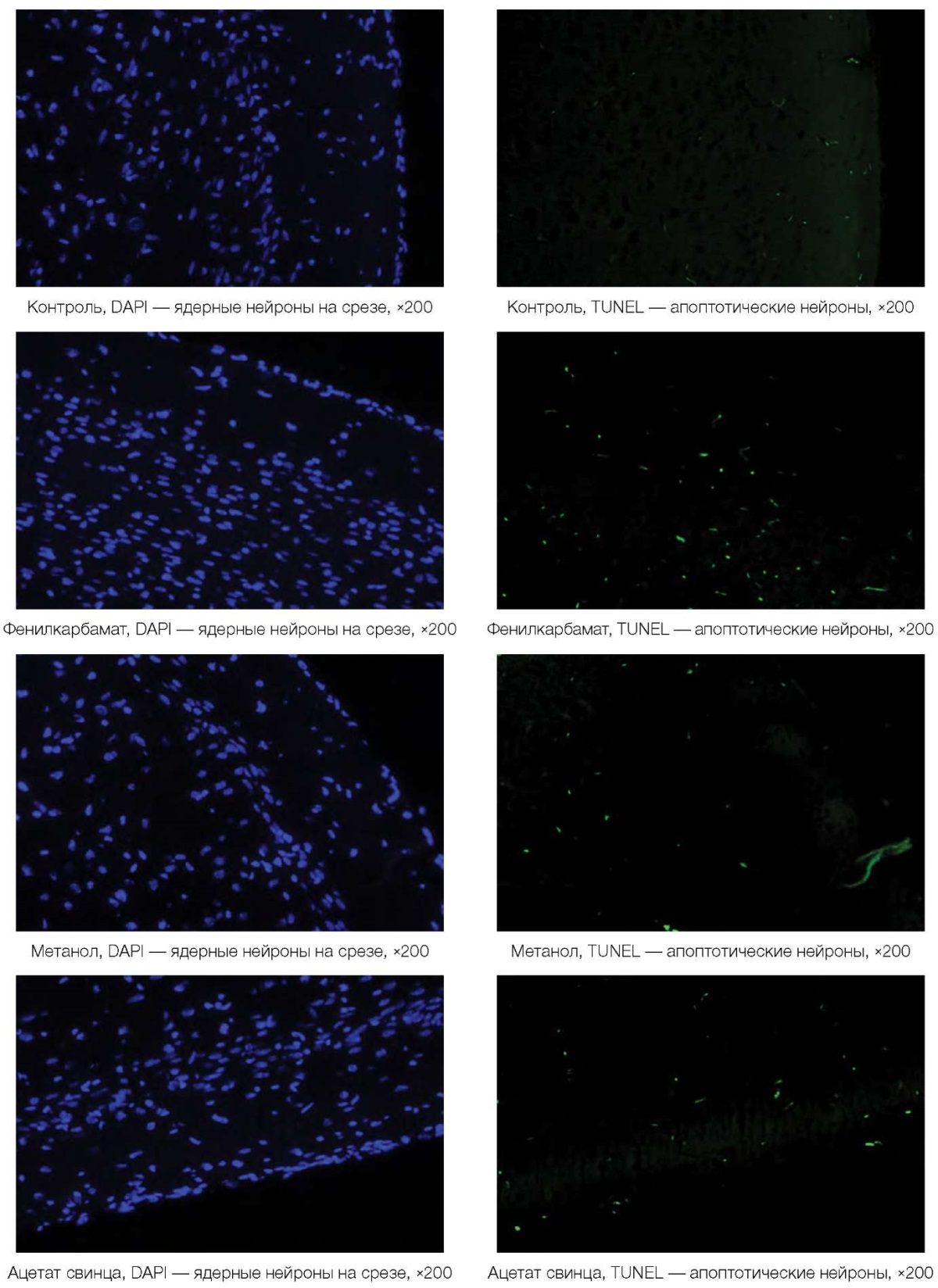
Рисунок подготовлен авторами по собственным данным
Рис. 2. Микрофотографии срезов височной коры головного мозга крыс
При практически одинаковом количестве окрашенных синим ядерных нейронов на срезе коры головного мозга (фотографии слева) под влиянием токсикантов у выживших животных существенно повышается количество апоптотических TUNEL-позитивных нервных клеток — зеленое свечение, правый ряд фотографий (рис. 2).
Результаты оценки активности процессов апоптоза представлены на рисунке 3.
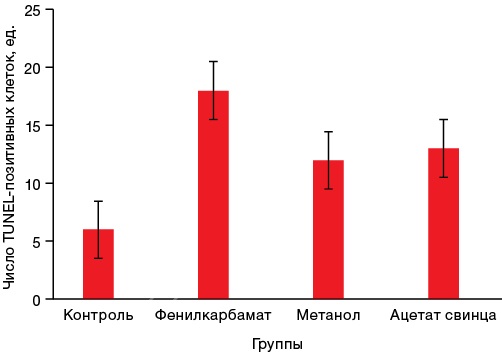
Рисунок подготовлен авторами по собственным данным
Рис. 3. Активность процессов апоптоза в клетках височной коры головного мозга крыс на 28-е сутки после острого отравления нейротоксикантами
Примечание: * p ≤ 0,05 — статистически значимые различия от группы контроля.
Представленные на рисунке 3 данные показывают, что все изученные токсиканты, вне зависимости от механизмов их токсического действия, в 3–4 раза повышают количество нейронов в состоянии апоптоза, т.е. являются индукторами этого патологического процесса.
Дисперсионный факторный анализ показал, что выраженность апоптоза нейронов коры мозга крыс тесно связана с процессами формирования отдаленных последствий тяжелых острых отравлений нейротропными токсикантами: с ним связано более 20% всей вариативности оценки их сформированности (R2 = 0,47, р = 0,034) у выживших животных. В связи с этим дальнейший анализ был сфокусирован на оценке значимости влияния исследуемых метаболических факторов на уровень активности процессов апоптоза нейронов.
Как следует из рисунка 3, на 28-е сутки в клетках головного мозга у выживших животных отмечается выраженная резкая активация процессов апоптоза, в большей степени характерная для фенилкарбамата. Дисперсионный факторный анализ показал, что контролируемый фактор «факт интоксикации» определяет 64% общей вариативности (р = 5×10–8) показателя апоптоза. Вид нейротоксиканта имеет еще большее значение в активации апоптоза (72% общей вариативности признака, р = 2×10–6), при этом для фенилкарбамата коэффициент детерминации D = 0,97 (p = 5×10–13), для метанола D = 0,86 (p = 4×10–8), для ацетата свинца D = 0,80 (p = 4×10–5).
Для оценки уровня активации апоптоза в период формирования отдаленных последствий острых отравлений методом частотного анализа и S-образного шкалирования были определены точки перегибов на кривых статистического распределения количества TUNEL-позитивных клеток на срезах (рис. 4), которые и являются границами уровней активации апоптоза. Если исследуемый показатель может быть охарактеризован как близкий к нормальному статистическому распределению, такими критериальными точками на кумулятивной кривой будут 16% (граница низкого и среднего уровня), 66% (граница среднего и повышенного уровня) и 84% (граница повышенного и высокого уровня). Обращает на себя внимание, что более выраженная (в 4 раза) индукция апоптоза зафиксирована при воздействии фенилкарбамата, в то время как апоптоз-индуцирующая активность метанола и ацетата свинца проявлялась слабее (примерно на 30%).
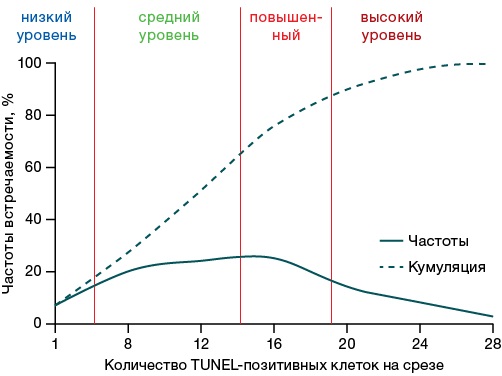
Рисунок подготовлен авторами по собственным данным
Рис. 4. Частотные кривые распределения количества TUNEL-позитивных клеток на срезах височной коры головного мозга крыс
Границами диапазонов (рис. 4) являются: низкого уровня — 6 и менее TUNEL-позитивных клеток на срезе, среднего уровня — 7–10 клеток, повышенного — 14–18 клеток, высокого уровня — 19 и более клеток на срезе.
В анализируемых экспериментальных группах была выявлена следующая структура уровней активации апоптоза (табл. 3).
Таблица 3. Распределение животных по уровням активации процессов апоптоза при влиянии нейротоксикантов
Группа | Уровень активации апоптоза | |||
низкий | умеренный | повышенный | высокий | |
Контрольная | 88 | 12 | – | – |
Фенилкарбамат (1,6 мг/кг м.т.) | – | – | 33 | 67 |
Метанол (11,5 г/кг м.т.) | – | 100 | – | – |
Ацетат свинца (300 мг/кг м.т. ) | – | 80 | – | 20 |
Таблица составлена авторами по собственным данным
Примечание: данные представлены в виде % встречаемости в группе.
Данные, представленные в таблице 3, показывают, что фенилкарбамат является сильным индуктором апоптоза, вызывая преимущественно высокий уровень его активации, в то время как метанол и ацетат свинца вызывают умеренную по степени выраженности активацию программированной клеточной гибели нейронов.
После анализа роли отдельных компонентов метаболических систем мозга в активации процессов апоптоза под действием нейротоксикантов установлено, что исследованные в работе показатели метаболизма не играют существенной роли в процессе апоптоза клеток головного мозга на этапе формирования отдаленных последствий тяжелых острых отравлений нейротропными токсикантами, их коэффициенты детерминации находились в диапазоне от 0,02 до 0,11 и не были статистически значимыми. Для нейроспецифических белков, вероятно, это может быть связано как с особенностями токсического повреждения мозга на тканевом уровне, так и со сроками, прошедшими после острой интоксикации, запустившей активацию апоптоза. Так, известно, что NSE достигает максимума в ликворе через сутки после ишемического или геморрагического инсульта, снижается к 4–5 сут и более специфична фокальным повреждениям мозга, чем диффузным [12–15]. Для белка S100 также существуют типичные сроки повышения его концентрации — 2–7 сут. MBP является маркером аксональных повреждений и демиелинизации, которые к сроку 30 сут от момента острой интоксикации могут еще не сформироваться. BDNF в большей степени гиперэкспрессируется при недостатке нейрональной пластичности, клинически более значимой является слабая реакция этого нейротрофина на повреждение мозговой ткани [17][18].
В группе интактных животных уровень апоптоза не имел значимых корреляционных связей ни с нейроспецифическими белками, ни с показателями ПОЛ и антиоксидантной системы (АОС) и представлял собой спонтанно протекающий процесс. В группе животных, перенесших интоксикацию фенилкарбаматом, на уровень апоптоза оказывал умеренное влияние низкий уровень восстановленного глутатиона (r = –0,53). После интоксикации метанолом выявлена слабая корреляционная связь апоптоза и содержания основного белка миелина (r = +0,47), вероятнее всего, отражающая наличие общего для них индуцирующего фактора. После интоксикации ацетатом свинца активность процессов апоптоза нейронов была связана с низкой активностью глутатионтрансферазы (r = –0,66) и СОД (r = –0,47). Следовательно, применение активаторов этих ферментов может быть полезно в комплексе средств профилактики отдаленных последствий отравлений органическими производными свинца.
NSE в группе интактных животных демонстрировала умеренные отрицательные связи с активностью глутатион-зависимых ферментов АОС: ГТ (r = –0,63) и ГП (r = –0,57), т.е. повышение содержания этого маркерного белка может отражать слабость ферментативного звена АОС. В то же время была выявлена положительная корреляционная связь с уровнем восстановленного глутатиона (r = +0,75). В совокупности эти связи могут означать, что повреждение тел нейронов может быть обусловлено нарушением способности утилизировать восстановленный глутатион в реакциях антиоксидантной защиты, так как при этом происходит одновременное повышение его уровня и снижение активности ферментов утилизации. Эта закономерность прослеживается и при отравлении фенилкарбаматом, однако при этом дополнительно отмечается снижение активности глюкозо-6-фосфатдегидрогеназы (r = –0,67) и положительная корреляционная связь с белком S100 (r = +0,70). После интоксикации метанолом также отмечается накопление неутилизированного восстановленного глутатиона (r = +0,55), но при этом оно сочетается с более низкими значениями BDNF (r = –0,50).
Своеобразная картина взаимосвязей NSE отмечается после интоксикации ацетатом свинца. Выявлена альтернативная активация экспрессии или NSE, или белка S100 (коэффициент корреляции между ними r = –0,81). Причем низкая активность АОС смещает систему в сторону повышения уровня белка S100. При интоксикации свинцом обнаружена выраженная положительная корреляционная связь (практически линейная) между уровнем NSE и активностью СОД (r = +0,94), что подразумевает единую ответную реакцию на отравление свинцом. После отравления фенилкарбаматом этот маркер отрицательно коррелирует с активностью глутатион-зависимых ферментов АОС. При отравлении метанолом повышение количества этого белка в тканях мозга связано с накоплением МДА (r = +0,61) и компенсаторным субстратным повышением активности СОД (r = +0,57). Аналогичная корреляционная связь МВР с СОД была выявлена и после отравления ацетатом свинца (r = +0,53).
При отравлении фенилкарбаматом уровень BDNF коррелировал с диеновыми конъюгатами (r = +0,61), а после отравления метанолом — с дефицитом восстановленного глутатиона (r = –0,60). После отравления свинцом фиксируются нейропротекторные эффекты BDNF: снижение аксональных повреждений по маркеру белка S100 (r = –0,66) и улучшение показателей антиоксидантной защиты (снижение диеновых конъюгатов (r = –0,62), повышение активности глутатионтрансферазы (r = +0,68), глутатионпероксидазы (r = +0,61) и СОД (r = +0,49)).
Белок S100 в группе интактных животных и при отравлении метанолом имеет умеренную корреляционную связь с СОД (r = +0,62). После отравления фенилкарбаматом он коррелирует с уровнем NSE (r = +0,70), что может отражать процесс параллельного повреждения как тел нейронов, так и аксонов. После отравления ацетатом свинца уровень белка S100 повышается при недостаточности антиоксидантной системы — низком уровне восстановленного глутатиона (r = –0,51), ГТ (r = –0,61) и особенно ГП (r = –0,84) и СОД (r = –0,75).
В блоке показателей ПОЛ и АОС в тканях мозга интактных животных выделяется плотный кластер из положительно коррелирующих друг с другом показателей активности глутатион-зависимых ферментов (ГТ и ГП) и глюкозо-6-фосфат дегидрогеназы (коэффициенты корреляции в диапазоне от +0,70 до +0,98). При отравлении фенилкарбаматом и метанолом к этому кластеру присоединяется СОД, плотность корреляционных связей снижается незначительно. В то же время после отравления ацетатом свинца этот кластер распадается, ключевым антиоксидантным ферментом становится глутатионпероксидаза, а СОД оказывается соединен умеренной корреляционной связью с глюкозо-6-фосфат дегидрогеназой.
ЗАКЛЮЧЕНИЕ
Проведенное исследование показало, что общим для анализируемых токсикантов было повышение количества нейронов, гибнущих путем апоптоза (наиболее выражено при интоксикации фенилкарбаматом), и снижение концентрации белка S100 в сыворотке крови (наиболее выражено при отравлении ацетатом свинца). Специфичной для отдаленных последствий отравления метанолом была умеренная активация ферментов антиоксидантной защиты; возможно, как компенсаторная реакция на активацию процессов ПОЛ. Специфичными для отдаленных последствий отравления ацетатом свинца у выживших животных были повышение концентрации в сыворотке крови NSE и BDNF, снижение белка S100 и МВР, повышение уровня диеновых конъюгатов при снижении активности ГТ, умеренная активация глюкозо-6-фосфатдегидрогеназы — ключевого фермента пентозофосфатного пути образования в тканях мозга восстановленных форм коферментов окисления субстратов энергетического обмена.
Установлено, что фенилкарбамат проявляет свойства сильного индуктора апоптоза клеток коры головного мозга, метанол и ацетат свинца являются индукторами с умеренной активностью.
Необходимо отметить, что рассчитанные коэффициенты детерминации имеют низкие или умеренные (для глутатионтрансферазы и глутатионпероксидазы) значения. Это позволяет утверждать, что нейроспецифические белки, процессы перекисного окисления липидов и антиоксидантной защиты не оказывают существенного влияния на процессы апоптоза нейронов у выживших животных на этапе формирования отдаленных последствий тяжелых острых отравлений. В связи с этим целесообразно будет продолжить изучение влияния метаболических процессов в ткани головного мозга животных на активность процессов апоптоза и формирование отдаленных последствий на более ранних сроках после острой интоксикации нейротропными токсикантами.
1. МР ФМБА России. 12.08-2021. Клиника, диагностика и лечение хронических отравлений (воздействий) веществами нейротоксического действия. 2021.
2. Бадалян А.В., Белова М.В., Брусин К.М. и др. Медицинская токсикология: национальное руководство. М.: ГЭОТАР-Медиа, 2014.
Список литературы
1. Краснов ВН. Психоорганический синдром как предмет нейропсихиатрии. Доктор.Ру. 2011;(4):34–42. EDN: OYYBSX
2. Brendan L. McNeish, Noah Kolb. Toxic Neuropathies. Continuum (Minneap Minn). 2023;29(5):1444–68. https://doi.org/10.1212/CON.0000000000001343
3. Гайкова ОН, Козлов, АА, Катрецкая, ГГ, Мельникова, МВ, Мелехова, АС, Бондаренко АА. Морфологические характеристики токсического поражения головного мозга. Медицина экстремальных ситуаций. 2024;26(2):13–9. https://doi.org/10.47183/mes.2024.025
4. Деев РВ, Билялов АИ, Жампеисов ТМ. Современные представления о клеточной гибели. Гены и Клетки. 2018;13(1):6–19. https://doi.org/10.23868/201805001
5. Кашуро ВА. Динамика содержания нейротрофических факторов головного мозга при экспериментальной коме у крыс. Казанский медицинский журнал. 2013;(94): 695–9. EDN: RSHIDV
6. Кострова ТА. Экспериментальная оценка изменений нейротрофических и апоптотических факторов в реализации отдаленных последствий острого тяжелого отравления тиопенталом натрия. Токсикологический вестник. 2019;(5):49–53. https://doi.org/10.36946/0869-7922-2019-5-49-53
7. Лужников ЕА. Особенности формирования и течения токсикогипоксической энцефалопатии при острых отравлениях веществами нейротоксического действия. Анестезиология и реаниматология. 2005;6:4–8. EDN: HVKWSV
8. Петров АН, Войцехович КО, Мелехова АС, Лисицкий ДС, Бельская АВ, Михайлова МВ, Гайкова ОН. Проблемы диагностики нейротоксических нарушений — последствий отравлений веществами судорожного действия. Вестник Российской военно-медицинской академии. 2017;3(59):211–7. EDN: ZOWOBD
9. Беспалов АЯ, Прокопенко ЛИ, Горчакова ТЛ, Козлов ВК, Петров АН, Зайцева МА и др. Гидрохлориды замещенных 2-[(диметиламино)метил] арилдиметилкарбаматов, обладающие антихолинэстеразной активностью. Патент Российской Федерации № 2754133;2021.
10. Капанадзе ГД, Ревякин АО, Шустов ЕБ. Методика оценки системы детоксикации ксенобиотиков у лабораторных животных. Биомедицина. 2017;3:71–81. EDN: ZHYWKB
11. Кострова ТА, Батоцыренова ЕГ, Кашуро ВА, Долго-Сабуров ВБ, Степанов СВ, Золотоверхая ЕА. Оценка биохимических показателей в тканях головного мозга у крыс в отдаленный период после тяжелого отравления тиопенталом натрия. Медицина экстремальных ситуаций. 2019;21(3):429–35. EDN: GGIEFQ
12. Максимова МЮ, Ионова ВГ, Сыскина АА, Шабалина АА, Костырева МА, Сенектутова ОА. Нейроспецифические белки в оценке состояния ткани мозга при атеротромботическом инсульте (клинико-биохимическое исследование). Анналы клинической и экспериментальной неврологии. 2011;5(3):4–10. EDN: OOKEFR
13. Wunderlich MT, Lins H, Skalej M, Wallesch C-W, Goertler M. Neuron-specific enolase and tau protein as neurobiochemical markers of neuronal damage are related to early clinical course and long-term outcome in acute ischemic stroke. Clin Neurol Neurosurg.2006; 108(6):558–63. https://doi.org/10.1016/j.clineuro.2005.12.006
14. Berger RP, Beers SR, Richichi R, Wiesman D, Adelson PD. Serum biomarker concentrations and outcome after pediatric traumatic brain injury. Journal of Neurotrauma. 2007;(24):1793–1801. https://doi.org/10.1089/neu.2007.0316
15. Vlasakova K, Tsuchiya T, Garfinkel IN, et al. Performance of biomarkers NF-L, NSE, Tau and GFAP in blood and cerebrospinal fluid in rat for the detection of nervous system injury. Front Neurosci. 2024;(17):1285359. https://doi.org/10.3389/fnins.2023.1285359
16. Клименко АЛ, Деев АИ, Баскаков ИС, Богданова МН, Забирова АХ, Мазикина АН. Класс нейроспецифических белков S100 и металлолигандный гомеостаз в этиопатогенезе ишемического инсульта. Микроэлементы в медицине. 2019;20(1):3–13. https://doi.org/10.19112/2413-6174-2019-20-4-3-13
17. Левчук ЛА, Бохан НА, Иванова СА. Нейроспецифические белки как трансдиагностические маркеры аффективных расстройств. Нейрохимия. 2023;40(1):30–4. https://doi.org/10.31857/S1027813323010119
18. Lima Giacobbo B, Doorduin J, Klein HC, Dierckx RAJO, Bromberg E, de Vries EFJ. Brain-Derived Neurotrophic Factor in Brain Disorders: Focus on Neuroinflammation. Mol Neurobiol. 2019;56(5):3295–3312. https://doi.org/10.1007/s12035-018-1283-6
Об авторах
Е. Б. ШустовРоссия
Шустов Евгений Борисович - д-р мед. наук
Санкт-Петербург
М. В. Мельникова
Россия
Мельникова Маргарита Викторовна
Санкт-Петербург
К. В. Мастерова
Россия
Мастерова Кристина Вячеславовна
Санкт-Петербург
В. Ф. Остров
Россия
Остров Владимир Федорович - канд. биол. наук.
Санкт-Петербург
Е. А. Золотоверхая
Россия
Золотоверхая Екатерина Андреевна - канд. биол. наук.
Санкт-Петербург
Л. Г. Кубарская
Россия
Кубарская Лариса Георгиевна - канд. биол. наук.
Санкт-Петербург
К. О. Танаянц
Россия
Танаянц Ксения Олеговна
Санкт-Петербург
А. А. Козлов
Россия
Козлов Александр Александрович
Санкт-Петербург
Ю. О. Соколова
Россия
Соколова Юлия Олеговна - канд. биол. наук.
Санкт-Петербург
П. К. Потапов
Россия
Потапов Петр Кириллович - канд. мед. наук.
Санкт-Петербург
Дополнительные файлы
Рецензия
Для цитирования:
Шустов Е.Б., Мельникова М.В., Мастерова К.В., Остров В.Ф., Золотоверхая Е.А., Кубарская Л.Г., Танаянц К.О., Козлов А.А., Соколова Ю.О., Потапов П.К. Анализ факторов, влияющих на процессы апоптоза в периоде отдаленных последствий тяжелых острых отравлений нейротропными токсикантами. Медицина экстремальных ситуаций. 2025;27(1):5-14. https://doi.org/10.47183/mes.2024-247
For citation:
Shustov E.B., Melnikova M.V., Masterova K.V., Ostrov V.F., Zolotoverkhaja E.A., Kubarskaya L.G., Tanayants K.O., Kozlov A.A., Sokolova Yu.O., Potapov P.K. Analysis of factors influencing apoptotic processes during formation of long-term health effects of severe acute poisoning with neurotropic toxicants. Extreme Medicine. 2025;27(1):5-14. https://doi.org/10.47183/mes.2024-247

















