Перейти к:
Люминесцентная иммунохроматография на основе комплексных соединений Eu³⁺ для выявления патогенных микроорганизмов и бактериальных токсинов
https://doi.org/10.47183/mes.2025-257
Аннотация
Введение. Повышение чувствительности иммунохроматографического анализа как одного из экспресс-методов индикации и диагностики патогенных микроорганизмов и токсинов актуально для пищевой безопасности и здравоохранения в целом.
Цель. Разработка экспериментального образца видеоцифрового регистратора люминесцентных иммунохроматограмм РЛИ-Eu³⁺ и адаптированных к прибору люминесцентных иммунохроматографических тестов (ЛИХТ) на основе микросфер с соединениями европия, сравнение чувствительности ЛИХТ с ИХА-тестами на основе наночастиц коллоидного золота (НКЗ) для увеличения чувствительности метода и выявления патогенных микроорганизмов и их токсинов.
Материалы и методы. В качестве люминесцентной метки для иммунохроматографии использовали субмикронные полимерные микросферы, меченные органическими комплексами трехвалентного европия (Eu³⁺), ЛИХТ регистрировали с помощью разработанного прибора-регистратора РЛИ-Eu³⁺.
Результаты. Показано, что порог обнаружения люминесцирующего комплекса Eu³⁺ на иммунохроматографической мембране равен 2 пг/мм², линейность показаний наблюдается в диапазоне 2–200 пг/мм². Коэффициенты вариации показаний прибора в диапазоне концентраций люминесцирующего комплекса 20–200 пг/мм² составляют < 5%, в диапазоне 2–20 пг/мм² — менее 10%. С использованием ЛИХТ и прибора РЛИ-Eu³⁺ определены следующие пороги обнаружения: холерного токсина — 10 нг/мл, стафилококкового энтеротоксина типа В — 0,5 нг/мл, клеток возбудителя чумы — 1×10³ м.к./мл, спор возбудителя сибирской язвы — 5×10³ спор/мл, антигенов вируса Конго-Крымской геморрагической лихорадки (ККГЛ) — в разведении 1:640 000.
Выводы. Разработанный видеоцифровой регистратор РЛИ-Eu³⁺ и ЛИХТ на основе комплексов европия позволили снизить в 20–128 раз порог обнаружения патогенных микроорганизмов и бактериальных токсинов по сравнению с иммунохроматографическими тестами на основе НКЗ для тех же патогенов.
Ключевые слова
Для цитирования:
Ярков С.П., Третьяков С.И., Шиленко И.В., Шаулина Е.К., Мандажи А., Зенков Д.А., Ишков Ю.Н., Стяжкин К.К. Люминесцентная иммунохроматография на основе комплексных соединений Eu³⁺ для выявления патогенных микроорганизмов и бактериальных токсинов. Медицина экстремальных ситуаций. 2025;27(1):107-114. https://doi.org/10.47183/mes.2025-257
For citation:
Yarkov S.P., Tretyakov S.I., Shilenko I.V., Shaulina E.K., Mandaji A., Zenkov D.A., Ishkov Yu.N., Styazhkin K.K. Luminescent immunochromatography based on Eu³⁺ coordination compounds for detection of pathogenic microorganisms and bacterial toxins. Extreme Medicine. 2025;27(1):107-114. https://doi.org/10.47183/mes.2025-257
ВВЕДЕНИЕ
Иммунохроматографический анализ в различных его вариантах широко распространен для проведения экспресс-анализов в клинической лабораторной диагностике при контроле пищевых продуктов, мониторинге объектов окружающей среды для выявления патогенных микроорганизмов и токсинов.
Люминесцентный иммунохроматографический анализ (ЛИХА) является распространенным методом экспресс-диагностики (например, специфических антител к вирусу ящура в сыворотке крови [1]), в котором люминесцентные частицы используются для маркировки антител. Концентрация кардиомаркеров в крови методом люминесцентного иммунохроматографического анализа количественно определяется путем анализа интенсивности люминесценции тест-полоски [2][3]. Преимуществами этого метода являются высокая воспроизводимость результатов, чувствительность, помехозащищенность со стороны естественной флуоресценции исследуемой пробы. ЛИХА широко используется в области безопасности пищевых продуктов [4][5] и мониторинга окружающей среды [6].
Прирост чувствительности, достигнутый в ЛИХА, по сравнению с традиционными метками иммунохроматографии — наночастицами коллоидного золота (НКЗ) — составляет один-два порядка [7][8]. Сравнение флуоресцентных маркеров с метками на основе НКЗ и магнитных наночастиц в ИХА резюмируется в обзоре [9]. Среди люминесцентных маркеров, применяемых в ЛИХА, своими свойствами выделяются полимерные микросферы диаметром 0,1–0,3 мкм, поверхность которых содержит карбоксильные группы, что позволяет осуществлять ковалентную связь с рецепторными белками, например иммуноглобулинами различных классов. При получении микросфер в процессе полимеризации в состав реакционной массы вводят органические комплексы трехвалентного европия, например Eu(DBM)3Phen, (1,10-фенантролин)-три-(дибензоилметанат) европия; Eu(TTA)3Phen, (2,9-диметил-4,7-дифенил-1,10-фенантролин-три-теноилтрифторацетонат) европия в количестве не более 10% по массе [10]. Препараты таких микросфер поглощают свет в ближней ультрафиолетовой области при λmax = 365 нм и флуоресцируют в красной области спектра при λmax = 615 нм, обладая при этом узким эмиссионным пиком флуоресценции. Для регистрации люминесценции аналитической и контрольной зон иммунохроматограмм (АЗ, КЗ) используют полупроводниковые диоды, фотоэлектронные умножители, видеокамеры. Видеоцифровой метод регистрации (ВЦР) результатов ИХА с различными метками имеет ряд преимуществ по сравнению с другими конструктивными решениями. ВЦР тестов на основе НКЗ, например, позволяет получить количественные данные о содержании токсинов в молочных продуктах [11].
Цель исследования — разработка экспериментального образца видеоцифрового регистратора люминесцентных иммунохроматограмм РЛИ-Eu3+ и адаптированных к прибору люминесцентных иммунохроматографических тестов (ЛИХТ) на основе микросфер с соединениями европия, сравнение чувствительности ЛИХТ с ИХА-тестами на основе НКЗ для увеличения чувствительности метода и выявления патогенных микроорганизмов и их токсинов.
МАТЕРИАЛЫ И МЕТОДЫ
Для получения конъюгатов использовали: моноклональные антитела (МКА) к В-субъединице холерного токсина (ХТ), клон 3D11 (ООО «Хайтест», Россия); МКА к капсульному F1 антигену возбудителя чумы; МКА к спорам возбудителя сибирской язвы, клон SA26; МКА к SEB, клон S222 (ОАО «ВНЦМДЛ», Россия); мышиные поликлональные иммуноглобулины к ККГЛ (ФГБУ «ФНИЦЭМ им. Н.Ф. Гамалеи» Минздрава России). Для создания ЛИХТ и тестов на основе НКЗ использовали одни и те же партии и лоты препаратов антител.
В качестве анализируемых антигенов применяли паспортизованные препараты ХТ и SEB, инактивированные микробные клетки Y. рestis, штамм EV, инактивированные клетки B. anthracis, штамм 942 (ФБУН «ГНЦ ПМБ» Роспотребнадзора), паспортизованные cахарозо-ацетоновые антигены вируса ККГЛ, штамм 741, генотип Европа 1 (ФГБУ «ФНИЦЭМ им. Н.Ф. Гамалеи» Минздрава России).
Синтез конъюгатов антител с люминесцирующими микросферами осуществляли путем ковалентного связывания [12]. К 5 мкл суспензии люминесцирующих микросфер (1%, вес/объем) диспергировали в 1,0 мл MES-буфера (0,05 М, pH 6,0) и дополняли 10 мкл растворами EDC и NHS (0,5 мг/мл) для активации карбоксильных групп, содержащихся на их поверхности. Перемешивали и встряхивали на лабораторном вихревом встряхивателе Vortex-3000 (производитель Viggens, КНР) в течение 20 мин при комнатной температуре в темноте, затем центрифугировали на центрифуге Thermo Scientific SL 4R Plus (производитель Thermo Fisher Scientific, США) при ×9600 g в течение 15 мин, супернатант отбрасывали. Осадок ресуспендировали в 1,0 мл фосфатного буфера (0,01 М, рН 7,4). Затем добавляли 100 мкл раствора антител в концентрации 0,2 мг/мл. Полученную смесь антител и активированных люминесцирующих микросфер постоянно перемешивали в течение 2 ч при комнатной температуре в темноте. Затем добавляли 100 мкл блокирующего раствора (20% БСА), чтобы заблокировать сайты неспецифического связывания на поверхности люминесцирующих микросфер, и выдерживали 1 ч при комнатной температуре. Полученную суспензию центрифугировали при 8000 g в течение 15 мин, супернатант отбрасывали, а к осадку добавляли 200 мкл диспергирующего раствора, препятствующего агглютинации конъюгатов люминесцирующих микросфер с антителами между собой (0,02 М, TRIS-HCl), содержащего 0,5% (вес/объем) трегалозы, 10% (вес/объем) сахарозы, 0,5% поливинилпирролидона, 0,1% Tetronic 1307 (S9), 0,05% ProClinTM 300, 1% БСА и 0,1% Tween-20), и хранили при 4 °С до применения.
В качестве антител для формирования аналитической зоны ЛИХТ использовали: кроличьи поликлональные антитела к В-субъединице холерного токсина; МКА к капсульному F1 антигену возбудителя чумы, клон F41F8C9; МКА к спорам сибирской язвы, клон 278H4A7 (филиал ФГБУ «48 ЦНИИ» Минобороны России, г. Киров); мышиные иммуноглобулины к антигенам ККГЛ (ФГБУ «ФНИЦЭМ им. Н.Ф. Гамалеи» Минздрава России); МКА к SEB S643 (производство ОАО «ВНЦМДЛ») в концентрации 2,0 мг/мл. Антителами контрольной зоны ЛИХТ служили козьи антитела к иммуноглобулинам мыши и козьи антитела к иммуноглобулинам кролика (ООО «Хайтест») в концентрации 0,1 мг/мл.
Для изготовления мультимембранного композита ЛИХТ использовали стекловолоконную мембрану GFCP001000 и целлюлозные мембраны CFSP203000 и CFSP173000 (Millipore), карточки с нитроцеллюлозной мембраной TYPE-CNPF-SN12-L2-P25, 10 µ Mdi (Индия). Готовые тест-полоски помещали в пластиковые оправы TYPE-Device-1 Mdi (Индия), верхнюю крышку которых покрывали матовой черной краской. Перед нанесением на стекловолоконную мембрану конъюгат микросфер с антителами обрабатывали ультразвуком на диспергаторе Labsonic 2000 (производство B. Braun, Германия) в течение 10 с, перемешивали, добавляли буфер хранения до концентрации 0,01%. Полученный конъюгат вручную наносили на стекловолоконную мембрану GFCP001000 Millipore и сушили при комнатной температуре.
Видеоцифровой люминесцентный иммунохроматографический анализ проводили с помощью прибора РЛИ-Eu3+ при комнатной температуре в течение 25 мин с момента внесения анализируемой пробы. Объем пробы, вносимой в ЛИХТ, составлял 140 мкл.
Рабочие контрольные образцы (РКО), предназначенные для изучения аналитических характеристик регистрирующего прибора, изготавливали в двух вариантах, отличающихся диапазоном концентраций люминесцирующих микросфер в аналитической зоне. РКО представляли собой иммунохроматографические мембраны, на которые с помощью диспенсера IsoFlowTM (изготовитель Imagene Technology Inc, США) наносили в виде полосок суспензию люминесцирующих микросфер с европием с линейной плотностью 0,08 мкл/мм. Мембраны высушивали при комнатной температуре, нарезали с помощью программируемой гильотины Matrix 2360 (изготовитель Kinematic Automation Inc, США) на полоски шириной 4 мм и помещали в оправы для мультианалитных иммунохроматографических элементов. Для формирования КЗ использовали суспензию микросфер в концентрации 0,01%. Для формирования АЗ использовали концентрации микросфер от 0,00005 до 0,01%. Площадь зон на мембране с люминесцирующими микросферами составляла 4 мм2 каждая. Таким образом получали имитацию ЛИХТ с различной интенсивностью люминесценции АЗ.
РКО хранили в светонепроницаемых пакетах при 4 °С. В исследовании использовались следующие реактивы. 1% (вес/объем) суспензия карбоксилированных полистирольных микросфер с комплексом европия в деионизованной воде с добавлением 0,05% NaN3 (производство Bang Laboratories, США). Средний диаметр микросфер 190 нм (2-(N-морфино)-этансульфоновая кислота) моногидрат (МЕS), трис-(гидроксиметиламинометан) солянокислая соль (TRIS-HCl), Тween-20, бычий сывороточный альбумин (БСА) свободный от протеаз, (N-(3-диметиламинопропил)-N-этилкарбодиимид гидрохлорид) (EDC), N-гидроксисукцинимид (NHS), гидроксид натрия, ProClinTM-300, глицин, поливинилпирролидон ММ 40.000, натрия хлорид — все производство Sigma-Aldrich. Трегалоза-D (+) — дигидрат для биохимии, соляная кислота (ч) (Диа-М (Россия)), Tetronic 1307(S9), Braveds (КНР).
Для изготовления иммунохроматографических тестов на основе НКЗ в качестве метки конъюгата использовали частицы со средним диаметром 30 нм [11]. Иммунные компоненты таких тестов были идентичны тем, которые применяли при изготовлении ЛИХТ. Мультимембранные композиты и приемы изготовления тестов аналогичны приемам изготовления ЛИХТ. Для ВЦР иммунохроматограмм с НКЗ использовали анализатор видеоцифровой иммунохроматографический Рефлеком (регистрационное удостоверение на медицинское изделие от 26 апреля 2016 года № ФСР 2011/11281/, TУ9443-001-43312649-2014, изготовитель ООО «Синтэко-комплекс» (Россия)).
Обработка результатов проводилась с помощью программы Microsoft Excel 2003, опция «Описательная статистика».
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Разработанный регистратор люминесцентных иммунохроматограмм РЛИ-Eu3+ состоит из измерительного блока и ЭВМ (ноутбука) с предустановленной программой управления и обсчета полученных результатов анализа. Внешний вид прибора представлен на рисунке 1.
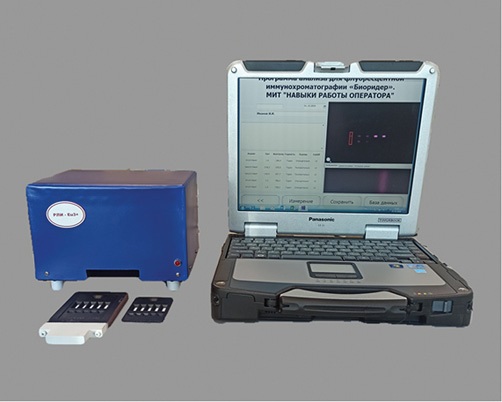
Рисунок подготовлен авторами по собственным данным
Рис. 1. Внешний вид регистратора люминесцентных иммунохроматограмм РЛИ-Eu3+
В измерительном блоке находится люминесцентный источник света, состоящий из двух ртутных газоразрядных ламп мощностью по 4 Вт каждая. Колбы ламп изготовлены из стекла Вуда, создающего поле равномерного ультрафиолетового облучения иммунохроматограмм с максимумом длины волны при 365 нм, а также источник питания ламп. В корпусе измерительного блока также расположена твердотельная видеокамера с разрешением 1200×1600 пикселей и скоростью съемки видео 15 кадров/с. Перед объективом камеры установлен стеклянный светофильтр эмиссии люминесценции СВ580, обеспечивающий 90% пропускания излучения в диапазоне длин волн от 600 до 900 нм. Видеокамера соединена с компьютером через разъем USB 2.0. Пластиковые оправы, содержащие мембраны ЛИХТ, помещаются внутрь прибора с помощью держателя. Прибор позволяет проводить одновременную регистрацию до 5 иммунохроматограмм, однако предусмотрена возможность измерения и единичных тестов.
Полученные с помощью видеокамеры прибора изображения обрабатывались программой анализа флуоресцентных иммунохроматограмм, работающей в среде Windows 7, 10.
Прибор обеспечивает вычисление интегральной интенсивности аналитической и контрольной зон ЛИХТ с автоматической коррекцией базовой линии. Критерием положительного результата анализа при ВЦР являлось превышение величины интенсивности люминесценции аналитической зоны теста над средним значением фона в «холостом» опыте с учетом ошибки измерения при 95% доверительной вероятности:
[Хср. – ts × SE]сигнала ≥ [Хср. + ts × SE]фона, (1)
где:
Xср. — среднее из n измерений;
ts — коэффициент распределения Стьюдента для n измерений;
SE — стандартная ошибка среднего значения при 95% доверительной вероятности.
Технические характеристики регистратора люминесценции РЛИ-Eu3+: масса 1,64 кг, габариты 150×200×170 мм, электропитание 220–240 В, 0,15 А, 50 Гц. Управление от внешнего компьютера с ОС Windows 7, 10 специализированной программой. Максимум длины волны возбуждающего света λex = 365 нм, максимум длины волны эмиссии λem = 615 нм. Предел обнаружения люминесцирующего вещества на иммунохроматографической мембране 2,0 пг/мм2. Количество иммунохроматограмм в оправе теста может варьироваться от 1 до 5. Коэффициент вариации показаний интенсивности люминесценции аналитической зоны теста в диапазоне концентраций люминесцирующего комплекса 2–20 пг/мм2 < 10%, в диапазоне 20–200 пг/мм2 < 5%. Линейность показаний в диапазоне 2–200 нг/мм2. Рабочий диапазон температур от 5 до 35 °С.
В таблице 1 приведены результаты измерений РКО с помощью прибора РЛИ-Eu3+ в различных диапазонах концентраций люминесцирующего комплекса европия в аналитической зоне РКО.
Таблица 1. Результаты измерения интенсивности люминесценции аналитической зоны РКО в зависимости от концентрации люминесцирующего комплекса европия на мембране
Концентрация суспензии микросфер при формировании аналитической зоны, % | 1×10-2 | 5×10-3 | 2,5×10-3 | 1×10-3 | 5×10-4 | 2,5×10-4 | 1×10-4 | 5×10-5 | 0 |
Концентрация люминесцирующего комплекса европия на мембране, пг/мм2 | 200 | 100 | 50 | 20 | 10 | 5 | 2 | 1 | 0 |
Средняя величина интенсивности люминесценции, усл. ед. | 552,3 | 314 | 144,3 | 45,5 | 44,3 | 24,4 | 12,1 | 3,5 | 1,06 |
Стандартное отклонение (SD) | 13,0 | 12,1 | 5,9 | 2,3 | 3,9 | 2,0 | 1,2 | 1,7 | 0,62 |
Коэффициент вариации (CV), % | 2,35 | 3,9 | 4,09 | 5,05 | 8,80 | 8,20 | 9,92 | 48,57 | 58,49 |
Стандартная ошибка среднего значения (SE) | 4,1 | 4,0 | 1,9 | 0,7 | 1,2 | 0,6 | 0,4 | 0,5 | 0,20 |
Уровень надежности (95,0%) | 9,3 | 9,3 | 4,2 | 1,7 | 2,8 | 1,4 | 0,9 | 1,2 | 0,44 |
Таблица подготовлена авторами по собственным данным
Данные, представленные в таблице 1, демонстрируют удовлетворительные значения коэффициента вариации измерений (CV) в диапазоне концентраций микросфер от 20 до 200 пг/мм2, что говорит о высокой воспроизводимости результатов измерений с помощью прибора РЛИ-Eu3+. Более высокие значения коэффициента вариации наблюдаются при измерении концентраций < 5 пг/мм2. Чувствительность обнаружения люминесцирующих микросфер на поверхности мембраны достигает 1 пг/мм2, что в 3,5 раза превышает средние значения люминесценции в «холостом» опыте.
Линейность показаний прибора при измерении РКО представлена на рисунке 2.
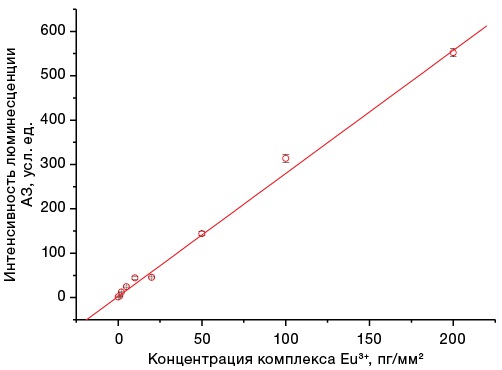
Рисунок подготовлен авторами по собственным данным
Рис. 2. График зависимости интенсивности люминесценции аналитической зоны РКО от поверхностной концентрации комплекса европия на аналитической мембране
Линейная регрессия зависимости интенсивности люминесценции микросфер на мембране от концентрации микросфер построена методом наименьших квадратов с помощью программы Origine 6.1 (OriginLab Corp). Коэффициент корреляции линейной зависимости R = 0,99.
Люминесцентные тесты для иммунохроматографического выявления патогенных микроорганизмов и токсинов были разработаны в «сэндвич»-формате. Подробное описание иммунохроматографических тестов на основе НКЗ в «сэндвич»-варианте и процедуры анализа для выявления бактериальных токсинов и споровых форм микроорганизмов даны в работах [13][14].
В ходе исследования жидкую пробу, потенциально содержащую патогенные микроорганизмы или токсины, вносили на подложку для нанесения образца. Под действием капиллярных сил происходит перемещение жидкости по мультимембранному композиту. Сначала солюбилизируется конъюгат микросфер с иммобилизованными на поверхности специфическими иммуноглобулинами. Конъюгат микросфер люминесцировал в красной области спектра. При этом в случае наличия определяемого антигена в пробе образовывался антигенный иммунный комплекс, который с током жидкости перемещался по аналитической мембране вместе с избытком конъюгата. Далее иммунный комплекс захватывался на аналитической мембране специфическими антителами в АЗ, образуя «сэндвич», а несвязанные антитела конъюгата — антителами, расположенными в КЗ тест-полоски, что приводило к образованию двух люминесцирующих линий. В случае отсутствия антигена в пробе антигенный иммунный комплекс не образуется, поэтому единственная видимая при ультрафиолетовом освещении линия формируется за счет связывания антител конъюгата и антител КЗ (антивидовых по отношению к антителам конъюгата) только в КЗ. Внешний вид тестов для обнаружения клеток вакцинного штамма возбудителя чумы на основе НКЗ и на основе люминесцентных микросфер при ультрафиолетовом облучении с длиной волны 365 нм представлен на рисунке 3.
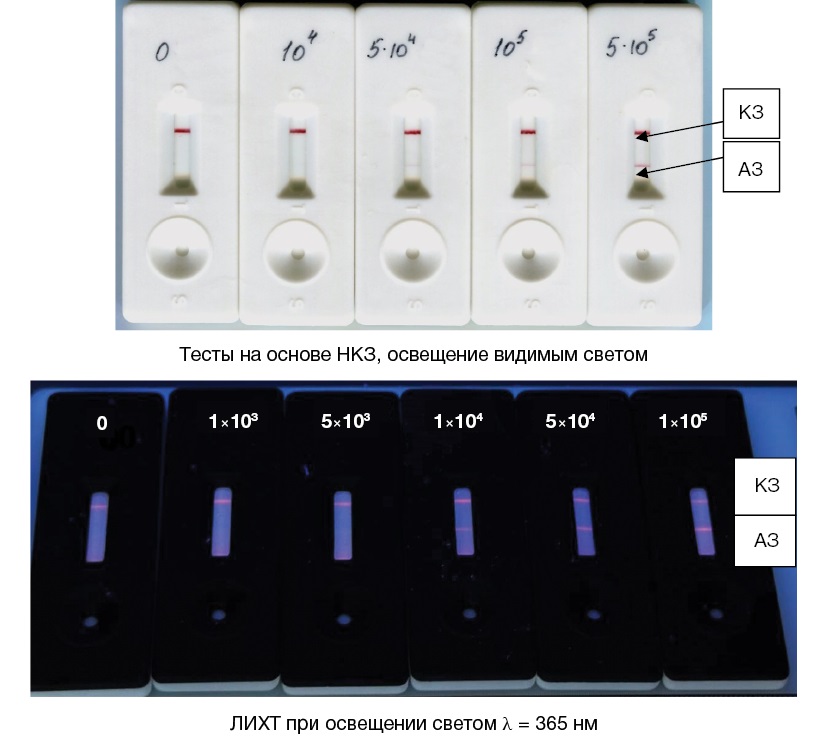
Рисунок подготовлен авторами по собственным данным
Рис. 3. Внешний вид иммунохроматограмм клеток Y. pestis EV
Примечание: стрелками и буквами обозначены аналитическая (АЗ) и контрольная (КЗ) зоны тестов; концентрации указаны в м.к./мл.
В таблице 2 приведены пороги обнаружения для различных патогенных микроорганизмов и бактериальных токсинов, достигнутые с помощью ЛИХТ и иммунохроматографии с применением НКЗ.
Таблица 2. Сравнительные характеристики ЛИХТ и иммунохроматографических тестов на основе НКЗ при выявлении бактериальных токсинов и патогенных микроорганизмов
Аналит | Отношение минимально выявляемых концентраций аналита для различных меток конъюгатов иммунохроматографических тестов | ||
ЛИХТ на основе микросфер с комплексом Eu3+, ВЦР люминесценции | ИХТ на основе НКЗ, ВЦР отраженного света | Отношение чувствительности ЛИХТ к чувствительности ИХТ | |
Стафилококковый энтеротоксин типа В, нг/мл | 0,5 | 30 | 60 |
Холерный токсин, нг/мл | 10 | 500 | 50 |
Микробные клетки Y. pestis, штамм EV, м.к./мл | 1×103 | 5×104 | 50 |
Споры B. anthracis, спор/мл | 5×103 | 1×105 | 20 |
Возбудитель ККГЛ (разведение исходного препарата вирусных антигенов) | 1:640 000 | 1:5000 | 128 |
Таблица составлена авторами по собственным данным
Данные, приведенные в таблице 2, показывают на примере микроорганизмов различных таксономических групп (вегетативные и споровые формы бактерий, вирусы, а также бактериальные токсины), что применение иммунохроматографии с конъюгатами на основе микросфер с люминесцентной меткой соединений европия обеспечивает намного большую чувствительность, чем использование тестов с конъюгатами НКЗ. Корректность сравнения обеспечивается использованием тех же партий антител для изготовления тестов на основе люминесцентных антител и тестов на основе НКЗ. При сравнении чувствительности применяли идентичные антигенные препараты.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Применение видеоцифровой регистрации иммунохроматограмм в сочетании с микросферами, содержащими комплексы европия, дает значительный выигрыш чувствительности в ИХА. Это обусловлено значительным объемом микросфер, содержащих большое количество комплексов европия на частицу, и фотофизическими свойствами самих комплексов европия. Эти соединения возбуждаются УФ-светом ближнего диапазона 365–370 нм, а излучают люминесценцию в красной области.
Значительный стоксов сдвиг обусловлен процессами возбуждения хелатного лиганда комплекса и дальнейшим переносом энергии на 5D0 энергетический уровень иона Eu3+ c последующими переходами между уровнем 5D0→7F2 и эмиссией света в диапазоне λ = 610–660 нм с высоким квантовым выходом. С практической точки зрения это позволяет применять в конструкции прибора недорогие стеклянные светофильтры для выделения возбуждающего света и света эмиссии, что обеспечивает хороший контраст линий иммунохроматограмм с фоном. Другим преимуществом таких меток является малая ширина (<10 нм) линий эмиссии и длительное время жизни люминесценции микросфер с европием τ = 0,43–0,55 мс. Изолированный в матрице полистирола люминесцентный комплекс европия стабилен, т.к. защищен от воздействия кислорода воздуха и тушащих люминесценцию веществ, потенциально присутствующих в анализируемом образце и буферных растворах, применяемых в ИХА. Однако данные соединения не лишены недостатков, поскольку уменьшают квантовый выход люминесценции при повышении температуры. Так, заполимеризованные в пленках комплексы европия имеют стабильную люминесценцию в диапазоне от –60 до +25 °С, а при нагревании пленки до температуры выше +25 °С наблюдается уменьшение интенсивности и времени затухания люминесценции, соответствующей переходу 5D0→7F2 [15]. Эффект обратим: при охлаждении интенсивность люминесценции восстанавливается. Это явление может снижать чувствительность ЛИХТ при использовании в полевых условиях при повышенных температурах.
Согласно паспортным данным препарата поверхность одной микросферы содержит до 353 тыс. карбоксильных групп при среднем диаметре микросфер 190 нм. Это позволяет проводить эффективную конъюгацию люминесцирующих микросфер с белками антител за счет образования ковалентных связей между аминогруппами антител и карбоксильными группами микросфер. Конъюгат микросфер с иммуноглобулинами обладает значительным количеством валентностей антител, что способствует эффективному образованию иммунных комплексов с антигенами бактерий, токсинов, вирусов [16].
Применение видеокамер в качестве приемника излучения также является значительным достоинством ВЦР [17], поскольку последние имеют высокую чувствительность и возможность изменять яркость, контраст, гамму изображения. Эти свойства видеокамер позволяют улучшать изображение иммунохроматограмм в широком диапазоне интенсивности люминесценции. Кроме того, ВЦР не требует механических приводов (актуаторов) для перемещения иммунохроматограмм под лучом возбуждающего света.
Нами получены данные относительно существенных различий в чувствительности ЛИХТ и иммунохроматографических тестов на основе НКЗ при выявлении токсинов и патогенных микроорганизмов. Повышение чувствительности обнаружения микроорганизмов и токсинов при применении люминесцентных меток по сравнению с тестами на основе НКЗ объясняется в первую очередь более высокой чувствительностью обнаружения люминесцентных меток по сравнению с чувствительностью обнаружения колориметрических меток (НКЗ). Важным фактором повышения чувствительности является большее количество захватывающих антител в иммунохроматографических конъюгатах люминесцентных микросфер сравнительно с аналогичными конъюгатами НКЗ. Это обусловлено геометрическими размерами микрочастиц: средний диаметр НКЗ составляет 30 нм, а средний диаметр люминесцентных микросфер 190 нм. Указанные факторы приводят к более эффективному процессу иммунохроматографии и детекции результатов анализа. При этом следует отметить, что подготовка проб к анализу, процедура ИХА и время его проведения не изменяются. Технологически изготовление ЛИХТ и тестов ИХА на основе НКЗ также сходны, за исключением стадии синтеза конъюгата, и не требуют изменения технологической линейки производственного оборудования.
Высокая чувствительность ЛИХТ имеет значение для санитарно-гигиенического аспекта применения иммунохроматографии в целом, т.к. дает возможность обнаруживать меньшие концентрации патогенных микроорганизмов и токсинов в объектах окружающей среды, пищевых продуктах, биологических жидкостях организма. ЛИХТ могут быть полезны для иммунохимической верификации посевов микроорганизмов традиционным микробиологическим методом за счет сокращения времени культивирования, позволяя идентифицировать клетки и бактериальные токсины за более короткое время.
ВЫВОДЫ
- Разработан экспериментальный образец видеоцифрового регистратора люминесцентных иммунохроматограмм РЛИ-Eu3+, где в качестве метки для иммунохроматографии используются субмикронные микросферы, в состав которых входят комплексные соединения трехвалентного европия, конъюгированные со специфическими антителами.
- РЛИ-Eu3+ имеет порог чувствительности по люминесцирующему комплексу европия 2 пг вещества на 1 мм2 иммунохроматографической мембраны и линейность в диапазоне 2–200 пг/мм2.
- Коэффициент вариации измерений не превышает 5% в диапазоне концентраций 20–200 пг/мм2 и 10% в диапазоне 2–20 пг/мм2.
- Разработаны ЛИХТ для выявления холерного токсина, стафилококкового энтеротоксина типа В, клеток возбудителя чумы (вакцинный вариант EV), спор возбудителя сибирской язвы, а также антигенов вируса возбудителя Конго-Крымской геморрагической лихорадки. Последующие исследования предполагают расширение номенклатуры ЛИХТ для обнаружения патогенов.
- Чувствительность ЛИХТ на основе микросфер, содержащих комплексы европия, при приборной регистрации в 20–128 раз превышает чувствительность иммунохроматографических тестов на основе НКЗ, сконструированных на основе одних и тех же специфических иммуноглобулинов и аналитических мембран.
Список литературы
1. Hou FP, Bai MY, Zhang Y, Liu HY, Sun SQ, Guo HC. Fluorescent immunochromatographic assay for quantitative detection of the foot-and-mouth disease virus serotype O antibody. Microchem. J. 2020;155:104690. https://doi.org/10.1016/j.microc.2020.104690
2. Kim TK, Oh S, Hong SC, Mok YJ, Choi EY. Point-of-Care Fluorescence Immunoassay for Cardiac Panel Biomarkers. J. Clin. Lab. Anal. 2014;28:419–27. https://doi.org/10.1002/jcla.21704
3. Gao YM, Wei JC, Mak PU, Vai MI, Du M, Pun SH. Development of a Calibration Strip for Immunochromatographic Assay Detection Systems. Sensors. 2016;16:1007. https://doi.org/10.3390/s16071007
4. Raeisossadati MJ, Danesh NM, Borna F, Gholamzad M, Ramezani M, Abnous K, Taghdisi SM. Lateral flow-based immunobiosensors for detection of food contaminants. Biosens.Bioelectron. 2016;86:235–46. https://doi.org/10.1016/j.bios.2016.06.061
5. Wu Y, Sun J, Huang X, Lai W, & Xiong Y. Ensuring food safety using fluorescent nanoparticles-based immunochromatographic test strips. Trends in Food Science & Technology. 2021; 118:658–78. https://doi.org/10.1016/j.tifs.2021.10.025
6. Sanchis A, Salvador JP, Marco MP. Multiplexed immunochemical techniques for the detection of pollutants in aquatic environments. TrAC Trends Anal. Chem. 2018;106:1–10. https://doi.org/10.1016/j.trac.2018.06.015
7. Berlina AN, Taranova NA, Zherdev AV, Vengerov YY, Dzantiev BB. Quantum dotbased lateral flow immunoassay for detection of chloramphenicol in milk. Analytical and Bioanalytical Chemistry. 2013;405(14):4997–5000. https://doi.org/10.1007/s00216-013-6876-3
8. Taranova NA, Berlina AN, Zherdev AV, Dzantiev BB. “Traffic light” immunochromatographic test based on multicolor quantum dots for the simultaneous detection of several antibiotics in milk. Biosensors and Bioelectronics. 2015;63:255–61. https://doi.org/10.1016/j.bios.2014.07.049
9. Yang J.C., Wang K., Xu H., Yan W.Q., Jin Q.H., Cui D.X. Detection platforms for point-of-care testing based on colorimetric, luminescent and magnetic assays: A review. Talanta. 2019;202:96–110. https://doi.org/10.1016/j.talanta.2019.04.054
10. Баюшева ВВ, Белозерова ОА, Чередниченко АГ. Синтез и люминесцентные свойства комплексов редкоземельных металлов (РЗМ) с замещенным 1,10-фенантролином и β-дикетонами. Успехи в химии и химической технологии. 2014;28(6):16–8. EDN: STFWMN
11. Ярков СП, Третьяков СИ, Шиленко ИВ, Ишков ЮН, Стяжкин КК. Выявление стафилококкового энтеротоксина типа B в молочной продукции иммунохроматографией с визуальной и видеоцифровой детекцией. Медицина экстремальных ситуаций. 2023;3:86–91. https://doi.org/10.47183/mes.2023.039
12. Jiao X, Peng T, Liang Z, Hu Y, Meng B, Zhao Y, et al. Lateral Flow Immunoassay Based on Time-Resolved Fluorescence Microspheres for Rapid and Quantitative Screening CA199 in Human Serum. Int. J. Mol. Sci. 2022;23:9991–9. https://doi.org/10.3390/ijms23179991
13. Еремкин АВ, Ипатов СС, Куклина ГВ, Печенкин ДВ, Кытманов АА, Тихвинская ОВ и др. Разработка иммуноферментных тест-систем и иммунохроматографических наборов реагентов, предназначенных для выявления стафилококковых энтеротоксинов типов А и В. Проблемы особо опасных инфекций. 2021;2:94–9. https://doi.org/10.21055/0370-1069-2021-2-94-99
14. Ярков СП, Третьяков СИ, Шаулина ЕК, Бровкина АН, Храмов ЕН. Повышение чувствительности иммунохроматографических тестов для выявления возбудителя сибирской язвы и стафилококкового энтеротоксина типа В на основе усиления серебром и инструментальной регистрации. Медицина экстремальных ситуаций. 2019;21(3):122–31. EDN: KSFFST
15. Лапаев ДВ, Зиятдинова РМ, Князев АА, Галяметдинов ЮГ, Никифоров ВГ, Лобков ВС. Механизм температурного тушения люминесценции в застеклованной пленке β-дикетонатного комплекса европия (III). Вестник технологического университета. 2018;21(4):13–18. EDN: XPSTYL
16. Xie QY, Wu YH, Xiong QR, Xu HY, Xiong YH, Liu K, et al. Advantages of fluorescent microspheres compared with colloidal gold as a label in immunochromatographic lateral flow assays. Biosens. Bioelectron. 2014;54:262–5. https://doi.org/10.1016/j.bios.2013.11.002
17. Gupta, R., Gupta, P., Wang, S. et al. Ultrasensitive lateral-flow assays via plasmonically active antibody-conjugated fluorescent nanoparticles. Nat. Biomed. Eng. 2023;7:1556–70. https://doi.org/10.1038/s41551-022-01001-1
Об авторах
С. П. ЯрковРоссия
Ярков Сергей Петрович - д-р. биол. наук
Москва
С. И. Третьяков
Россия
Третьяков Сергей Иванович - канд. технич. наук
Москва
И. В. Шиленко
Россия
Шиленко Инесса Владимировна - канд. технич. наук
Москва
Е. К. Шаулина
Россия
Шаулина Екатерина Константиновна
Москва
А. Мандажи
Россия
Мандажи Ангелина
Москва
Д. А. Зенков
Россия
Зенков Денис Алекcандрович
Москва
Ю. Н. Ишков
Россия
Ишков Юрий Николаевич - канд. хим. наук
Москва
К. К. Стяжкин
Россия
Стяжкин Константин Кириллович - д-р биол. наук, профессор
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Ярков С.П., Третьяков С.И., Шиленко И.В., Шаулина Е.К., Мандажи А., Зенков Д.А., Ишков Ю.Н., Стяжкин К.К. Люминесцентная иммунохроматография на основе комплексных соединений Eu³⁺ для выявления патогенных микроорганизмов и бактериальных токсинов. Медицина экстремальных ситуаций. 2025;27(1):107-114. https://doi.org/10.47183/mes.2025-257
For citation:
Yarkov S.P., Tretyakov S.I., Shilenko I.V., Shaulina E.K., Mandaji A., Zenkov D.A., Ishkov Yu.N., Styazhkin K.K. Luminescent immunochromatography based on Eu³⁺ coordination compounds for detection of pathogenic microorganisms and bacterial toxins. Extreme Medicine. 2025;27(1):107-114. https://doi.org/10.47183/mes.2025-257

















