Перейти к:
Определение состава протеогликанов, синтезируемых in vitro хондроцитами различного генеза
https://doi.org/10.47183/mes.2025-27-1-97-106
Аннотация
Введение. Применение клеточных конструкций на основе плюрипотентных стволовых клеток человека (чПСК) связано с рядом трудностей, одной из них является необходимость стандартизации методов культивирования хондроцитоподобных производных чПСК для получения хрящевой ткани, схожей с естественным гиалиновым хрящом. Гликозаминогликаны (ГАГ) – основа внеклеточного матрикса (ВКМ) хрящевой ткани, поэтому анализ качественного и количественного состава ГАГ хрящеподобных тканеинженерных конструкций является важным звеном для итоговой оценки их потенциальной терапевтической эффективности.
Цель. Определить состав ГАГ, синтезируемых in vitro хондроцитами различного генеза, с использованием иммуноферментного анализа (ИФА) и жидкостной хроматографии с тандемной масс-спектрометрией (ЖХ-МС/МС), а также оценить влияние 2D- и 3D-культивирования на их синтез.
Материалы и методы. В исследовании анализировали уровни ГАГ в 2D- и 3D-тканеинженерных конструкциях, полученных из хрящевой ткани 5 доноров, хондроцитоподобных клеток, дифференцированных из 2-х линий чПСК. Клеточные сфероиды получали методом агрегации в микролуночных планшетах и культивировали в мини-биореакторах. Анализ содержания ГАГ в образцах клеточных культур и сфероидов проведен с помощью ИФА и ЖХ-МС/МС. Для оценки статистической значимости различий между образцами использовали тест Крускала-Уоллиса и тест Данна.
Результаты. В исследовании с помощью ИФА выявлены статистически значимые различия (p<0,0021), подтверждающие более высокий уровень синтеза ГАГ в 3D-культурах нативных хондроцитов по сравнению с 2D-культурами (108,67 нг/мл и 1099,87 нг/мл соответственно). Среднее число спектров белка хондроитинсульфат-протеогликана 4, определенное с помощью ЖХ-МС/МС, также было выше в 3D-культурах, составив 41,75 спектров по сравнению с 2,24 спектров в образцах 2D-культур. Уровни аггрекана, бигликана и декорина между культурами не различались. 3D-культуры хондроцитоподобных клеток из чПСК не показали достоверных отличий в содержании ГАГ по сравнению с 2D, что указывает на необходимость оптимизации условий их дифференцировки.
Выводы. В нашем исследовании был определен состав ГАГ, синтезируемых in vitro хондроцитами различного генеза, с использованием ИФА и ЖХ-МС/МС, а также оценено влияние 2D- и 3D-культивирования на их синтез. Результаты показали, что 3D-среда культивирования создает условия, способствующие более полноценному формированию хондроцитарного ВКМ в образцах нативных хондроцитов. Однако, несмотря на это, полученные сфероиды хондроцитоподобных производных чПСК не достигают функциональной идентичности с естественной хрящевой тканью, даже после завершения протоколов дифференцировки, и не представляют собой идеальные тканеинженерные конструкции для коррекции дефектов хряща.
Ключевые слова
Для цитирования:
Голубинская П.А., Ручко Е.С., Пикина А.С., Смирнов И.П., Владимирова Т.В., Гордеева В.Д., Арапиди Г.П., Еремеев А.В. Определение состава протеогликанов, синтезируемых in vitro хондроцитами различного генеза. Медицина экстремальных ситуаций. 2025;27(1):97-106. https://doi.org/10.47183/mes.2025-27-1-97-106
For citation:
Golubinskaya P.A., Ruchko E.S., Pikina A.S., Smirnov I.P., Vladimirova T.V., Gordeeva V.D., Arapidi G.P., Eremeev A.V. Composition analysis of proteoglycans synthesized in vitro by chondrocytes of various origins. Extreme Medicine. 2025;27(1):97-106. https://doi.org/10.47183/mes.2025-27-1-97-106
ВВЕДЕНИЕ
Хронические заболевания суставов по-прежнему представляют собой серьезную проблему для мирового здравоохранения. Эти заболевания несут значительное экономическое бремя вследствие распространенности и тяжести поражения опорно-двигательного аппарата. Расходы на лечение и связанная с ними инвалидность ложатся тяжелым бременем как на пациентов, так и на системы здравоохранения. В 2019 году было зафиксировано около 528 млн человек в мире с остеоартритом, что на 113% больше, чем в 1990 году [1]. Клинический потенциал хондроцитов, полученных из хрящевой ткани пациентов, давно признан. Наиболее распространенным методом лечения дефицита хрящевой ткани и коррекции дефектов хряща является индуцированная матрицей имплантация аутологичных хондроцитов (MACI). Данный метод терапии был одобрен Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA) в 2016 году [2]. В этой методике используются аутологичные хондроциты, выделенные из биоптата хрящевой ткани пациентов, культивирование которых происходит на трехмерной матрице из коллагеновой мембраны [3]. Однако в некоторых случаях, например при длительном приеме кортикостероидов, нестероидных противовоспалительных препаратов или химиотерапии, получение достаточного количества клеточного материала для проведения MACI оказывается невозможным, что является основным ограничением данной методики. Плюрипотентные стволовые клетки человека, являясь неограниченным источником клеточного материала и исключая необходимость болезненного хирургического вмешательства, представляют собой следующий шаг в развитии клеточных технологий [4]. Однако нерешенными остаются такие проблемы, связанные с применением чПСК, как высокая стоимость их культивирования и дифференцировки в хондроцитарном направлении, потенциальные риски иммунной реакции на хондроциты, полученные из чПСК, и риски туморогенности и онкогенности полученных из чПСК клеточных конструкций. Прогресс в решении данных проблем неразрывно связан с разработкой новых протоколов дифференцировки, генетического редактирования и культивирования как хондроцитов, полученных из чПСК, так и самих чПСК [4].
Основу хрящевой ткани составляют внеклеточный матрикс и небольшое количество специализированных клеток — хондроцитов, включенных в ВКМ. Состав и организация ВКМ определяют его биомеханические свойства. Функциональные свойства ВКМ близки к вязкоупругому гелю, состоящему из двух основных фаз: твердой фазы, включающей коллагеновые волокна, протеогликаны и неколлагеновые белки, и жидкой фазы, состоящей на 80% из воды и электролитов (Ca2+, K+, Na+, Cl-); основным протеогликаном в хряще является аггрекан.
Хондроциты механочувствительные клетки, и на их функциональную активность значительную роль оказывает микроокружение [5]. Хондроциты располагаются в небольших полостях, называемых лакунами, окруженных ВКМ. Эти структуры, известные как хондроны [6], образуют основные структурные, функциональные, метаболические единицы суставного хряща [7] и различаются по составу коллагеновых фибрилл и ГАГ. Зона хондронов имеет толщину 2–4 мкм и состоит в основном из протеогликанов и ГАГ (перлекан, декорин, бигликан, аггрекан и гиалуроновая кислота), а также коллагена VI типа [8].
Основным протеогликаном хрящевой ткани является аггрекан, который взаимодействует с гиалуроновой кислотой и образует большие агрегаты, придающие хрящу амортизирующие свойства. Снижение содержания аггрекана и других протеогликанов в хряще связано с развитием остеоартрита, что приводит к ухудшению механических свойств хряща и прогрессированию заболевания [9]. В то же время бигликан и декорин являются малыми лейцин-обогащенными протеогликанами (SLRP), играющими ключевую роль в поддержании структуры и функции хрящевой ткани. Они участвуют в регуляции фибриллогенеза коллагена, взаимодействуя с его волокнами и влияя на организацию внеклеточного матрикса. Декорин, в частности, связывается с коллагеном II типа, регулируя размер и форму коллагеновых фибрилл, что способствует поддержанию структурной целостности хряща. Бигликан также взаимодействует с коллагеном, но его функции более разнообразны: участие в минерализации кости и регуляции роста клеток [10]. Хондроитинсульфат-протеогликан 4 — мембранный протеогликан, участвующий в адгезии, миграции и межклеточной сигнализации. Его роль в хрящевой ткани недостаточно изучена, но предполагается, что он влияет на взаимодействие хондроцитов с внеклеточным матриксом, поддерживая структуру и функциональность хряща. Также хондроитинсульфат-протеогликан 4 может регулировать рост и дифференцировку клеток, что делает его перспективной мишенью для терапии остеоартрита и регенерации хрящевой ткани [11].
Ферментативно выделенные хондроциты могут продуцировать новый ВКМ в течение нескольких часов после культивирования in vitro, хотя дальнейшего образования ВКМ вокруг клетки не происходит [12]. Считается, что полное созревание ВКМ занимает 2–3 недели. При этом исследования показали, что для полного созревания ВКМ и формирования хондронов необходимы определенные условия: микроокружение и физические факторы, такие как гравитационные и гидродинамические эффекты [13], поддержание которых возможно в 3D-структурах [14]. Сфероидные клеточные культуры, в частности, способствуют лучшей выживаемости и функциональной активности клеток по сравнению с традиционными 2D-культурами хондроцитов. Эти преимущества объясняются способностью 3D-структур к лучшей имитации естественной микросреды, а также влиянием химических и физических факторов [15]. Напротив, в условиях 2D-культуры хондроциты теряют свой фенотип, демонстрируют повышенное производство коллагена I типа (ассоциированного с волокнистым хрящом) и пониженный уровень коллагена II типа (ассоциированного с гиалиновым хрящом), а также снижают уровень ГАГ. Следует отметить, что данный феномен дифференцировки еще не был полностью изучен в хондроцитах, полученных из чПСК.
Состав и уровень содержания ГАГ являются критическими характеристиками, описывающими сформированный хондрон. Поэтому при разработке хрящеподобных тканеинженерных конструкций для регенеративной медицины определение уровня содержания и состава ГАГ необходимо для оценки эффективности и функциональной активности полученного хрящевого имплантата [16]. Кроме того, на содержание, свойства и состав ВКМ влияет состояние хондроцитов и их микроокружение. Хондроциты, полученные из поврежденных тканей, таких как пораженный остеоартрозом хрящ, синтезируют гепарансульфат с повышенной сульфатацией, что связано с повышенной активностью катаболических ферментов, таких как матриксные металлопептидазы (MMP3, MMP13), и снижением экспрессии ключевых хондроцитарных генов, таких как коллаген II типа альфа 1 цепи (COL2A1), аггрекан (ACAN) и SRY-box транскрипционный фактор 9 (SOX9) [8].
В исследовании G. Lee, R. Loeser [12] было показано, что хондроциты из поверхностной и средней/глубокой зон хряща, выделенные методом зональной абразии, и при культивировании в течение четырех недель демонстрировали значительные различия в содержании ГАГ. Авторами J. Hu, K. Athanasiou установлено, что хондроциты из средней/глубокой зоны вырабатывали на 250% больше ГАГ и коллагена в пересчете на сухой вес по сравнению с хондроцитами из поверхностной зоны [17]. Кроме того, хондроциты средней/глубокой зоны способны образовывать агрегаты и хрящеподобные структуры, что благоприятно для создания тканеинженерных конструкций. В другом исследовании J. Bekkers et al. [18] было обнаружено расхождение в синтетической активности хондроцитов, выделенных из нагруженных и ненагруженных зон хряща, хотя эти различия уменьшались при прохождении клетками нескольких процедур пассирования.
Существующие подходы получения хрящеподобных клеточных конструкций из чПСК являются несовершенными, так как часто характеризуются низкой воспроизводимостью, вариабельностью эффективности дифференцировки клеток, недостаточной механической прочностью образованных тканей и сложностью масштабирования. ГАГ являются одним из главных компонентов ВКМ хрящевой ткани, поэтому анализ качественного и количественного состава ГАГ — один из основных этапов оценки потенциальной терапевтической эффективности хрящеподобных клеточных конструкций [19]. В то же время условия культивирования, непосредственно влияющие на уровень содержания ГАГ, представляют собой ключевой аспект существующих методик создания подобных клеточных конструкций, который можно модифицировать для получения образцов тканей, наиболее близких по характеристикам к гиалиновому хрящу.
Цель исследования — определить состав ГАГ, синтезируемых in vitro хондроцитами различного генеза, с использованием иммуноферментного анализа (ИФА) и жидкостной хроматографии с тандемной масс-спектрометрией (ЖХ-МС/МС), а также оценить влияние 2D- и 3D-культивирования на их синтез.
МАТЕРИАЛЫ И МЕТОДЫ
Распределение образцов по экспериментальным группам
Образцы исследуемых клеточных культур были распределены на группы (табл. 1) по критерию происхождения клеток и типа их культивирования:
1) группа 2D-культур нативных хондроцитов включала образцы, полученные от пациентов с гонартрозом и невралгией мениска;
2) группа 3D-культур нативных хондроцитов также была представлена образцами от пациентов с аналогичными диагнозами, но выращенными в трехмерных условиях культивирования;
3) группа 2D-культур хондроцитов, дифференцированных из чПСК, включала образцы, полученные из клеточных линий чПСК IPSRG4SAb2m c55/1 и IPSRG4S;
4) группа 3D-культур хондроцитов, дифференцированных из чПСК, аналогично содержала образцы, полученные из тех же клеточных линий, но в условиях трехмерного культивирования;
5) контрольная группа чПСК состояла из клеточных линий IPSRG4S и IPSRG4SAb2m c55/1, не подвергавшихся дифференцировке в хондроциты.
Таблица 1. Распределение образцов по группам для анализа содержания гликозаминогликанов с помощью ИФА и анализа протеогликанов с помощью ЖХ-МС/МС
ИФА | ЖХ-МС/МС | ||||
Группа образцов | Число образцов | Характеристика клеточных культур | Группа образцов | Число образцов | Характеристика клеточных культур |
2D-культуры нативных хондроцитов | 5 | Гонартроз — 4 Невралгия мениска — 1 | 2D-культуры нативных хондроцитов | 5 | Гонартроз — 4 Невралгия мениска — 1 |
3D-культуры нативных хондроцитов | 2 | Гонартроз — 1 Невралгия мениска –1 | 3D-культуры нативных хондроцитов | 5 | Гонартроз — 4 Невралгия мениска — 1 |
2D-культуры хондроцитов, дифференцированных из чПСК | 2 | Клеточная линия чПСК IPSRG4SΔb2m cl55/1 Клеточная линия чПСК IPSRG4S | 2D-культуры хондроцитов, дифференцированных из чПСК | 2 | Клеточная линия чПСК 4SΔb2m cl55/1 Клеточная линия чПСК IPSRG4S |
3D-культуры хондроцитов, дифференцированных из чПСК | 2 | Клеточная линия чПСК IPSRG4SΔb2m cl55/1 Клеточная линия чПСК IPSRG4S | 3D-культуры хондроцитов, дифференцированных из чПСК | 2 | Клеточная линия чПСК IPSRG4SΔb2m cl55/1 Клеточная линия чПСК IPSRG4S |
Контрольная группа чПСК | 2 | Клеточная линия чПСК IPSRG4S Клеточная линия чПСК IPSRG4SΔb2m cl55/1 | Контрольная группа чПСК | 1 | Клеточная линия чПСК IPSRG4S |
Таблица составлена авторами по собственным данным
Подобный подход к разделению образцов позволил провести сравнительный анализ влияния различных условий культивирования и происхождения клеток на их характеристики.
Получение первичной культуры хондроцитов из донорского материала и культивирование хондроцитов
Хондроциты выделяли из биоптатов хрящевой ткани пациентов, давших информированное согласие. Перед измельчением хрящ переносили в пробирку объемом 15 мл с помощью серологической пипетки и однократно промывали модифицированной средой «Игла Дульбекко» (DMEM) (Thermo Fisher Scientific, США), дополненной двойным количеством пенициллина/стрептомицина (200 Ед/мл, «ПанЭко», Россия). Затем хрящ помещали в стерильную 60 мм чашку Петри и измельчали стерильными ножницами и скальпелем в присутствии 4 мл среды DMEM, в которую также добавляли двойное количество антибиотика. Измельченный хрящ промывали в 15 мл той же среды. Затем кусочки хряща инкубировали в течение 40 мин в пробирке объемом 15 мл на лабораторном орбитальном шейкере (качалке) (Infors HS Celltron, Швейцария) при 37 °C с 5% CO2, используя 10 мл среды DMEM, дополненной двойным количеством антибиотика, а также 10 мг коллагеназы типа IV (Worthington Biochemical, США) и 10 мг коллагеназы типа I (Worthington Biochemical, США). После инкубации кусочки хряща центрифугировали в течение 5 мин при 200 g на центрифуге (Eppendorf Сentrifuge 5804R, Германия). Надосадочную жидкость аккуратно удаляли, а кусочки хряща ресуспендировали в среде DMEM и повторяли промывку еще 2 раза. После этого к хрящу добавляли 10 мл среды Игла в модификации Дульбекко с добавлением питательной смеси F-12 в соотношении 1:1 (DMEM/F12) (Thermo Fisher Scientific, США), дополненной 20% фетальной бычьей сывороткой (FBS) (HyMedia, Индия), 2 мМ Glutamax (Thermo Fisher Scientific, США) и 100 Ед/мл пенициллина/стрептомицина («ПанЭко», Россия). Затем кусочки переносили в культуральный флакон T-25 см2, предварительно обработанный 0,01% раствором желатина типа B («ПанЭко», Россия). Кусочки хряща культивировали при 37 °C с 5% CO2. Культуру пассировали до достижения монослоя клеток 70% конфлюэнтной плотности; замену культуральной среды производили каждые пять дней.
Культивирование человеческих плюрипотентных стволовых клеток
Линия индуцированных плюрипотентных стволовых клеток человека IPSRG4S была получена в ходе выполнения совместной работы лаборатории клеточной биологии ФНКЦ ФХМ им. Ю.М. Лопухина и лаборатории стволовых клеток группы молекулярных исследований мозга Института А.И. Виртанена, Университет Восточной Финляндии, Куопио, Финляндия [20]. В дальнейшем в лаборатории клеточной биологии ФНКЦ ФХМ им. Ю.М. Лопухина на основе линии чПСК IPSRG4S была получена линия клеток чПСК IPSRG4SΔb2m cl55/1, в которой с помощью геномного редактирования CRISPR/Cas9 был инактивирован ген бета-2-микроглобулина. чПСК культивировали в шестилуночных планшетах, предварительно покрытых матригелем (BD, CША), на питательной среде, состоящей из mTeSR-1 (STEMCELL Technology, Канада) и Hybris 8 («Панэко», Россия) в соотношении 1:3.
Дифференцировка человеческих чПСК в хондроцитарном направлении
Чтобы вызвать дифференцировку, чПСК культивировали в среде DMEM/F12 (Thermo Fisher Scientific, США), дополненной 10% FBS (HyMedia, Индия), 2 мМ Glutamax (Thermo Fisher Scientific, США), 100 Ед/мл пенициллина/стрептомицина («ПанЭко», Россия), 10 мкМ ингибитора гликогенсинтазы киназы-3 CHIR99021 (Miltenyi Biotec, Германия) и 10 нМ ретиноевой кислоты (Miltenyi Biotec, Германия). Клетки инкубировали в течение двух дней в CO2-инкубаторе при 37 °C с 5% CO2. После этого среда была заменена на среду DMEM/F12 (Thermo Fisher Scientific, США), дополненную 10% FBS (HyMedia, Индия), 2 мМ Glutamax (Thermo Fisher Scientific, США), 100 Ед/мл пенициллина/стрептомицина («ПанЭко», Россия), 10 нг/мл трансформирующего фактора роста β (TGF-β) (Miltenyi Biotec, Германия), 10 нг/мл костного морфогенетического белка-2 (BMP-2) (Miltenyi Biotec, Германия), 2% B27 (Thermo Fisher Scientific, США), 10 мкМ аскорбиновой кислоты (Sigma-Aldrich, США) и 1% раствора инсулин-трансферрин-селенита («ПанЭко», Россия). Клетки культивировали в течение двух недель в тех же условиях CO2-инкубатора. После дифференцировки хондроцитоподобные производные культивировали в среде DMEM/F12 (Thermo Fisher Scientific, США), дополненной 10% FBS (HyMedia, Индия), 2 мМ Glutamax (Thermo Fisher Scientific, США), 100 Ед/мл пенициллина/стрептомицина («ПанЭко», Россия), 10 нг/мл TGF-β (Miltenyi Biotec, Германия) и 10 нг/мл BMP-2 (Miltenyi Biotec, Германия).
Приготовление культуры сфероидов
Для формирования сфероидов брали хондроциты, которые были на 2-м пассаже после выделения клеточной культуры из хрящевой ткани, а хондроцитоподобные производные чПСК сворачивали в сфероиды на 2-м пассаже после начала протокола дифференцировки чПСК. К началу хондроцитарной дифференцировки чПСК клеточная линия IPSRG4S находилась на 34-м пассаже, а клетки линии IPSRG4SΔb2m — на 41-м пассаже. Хондроцитоподобные производные снимали с шестилуночных планшетов с помощью 0,05% раствора трипсина (Thermo Fisher Scientific, США), а хондроциты снимали с культуральных флаконов T-75 см2 с помощью 0,25% раствора трипсина (Thermo Fisher Scientific, США). Клетки отмывали от трипсина с помощью среды DMEM (Thermo Fisher Scientific, США), дополненной 10% FBS (HyMedia, Индия), и центрифугировали в течение 5 мин при 200 g. Затем клетки переносили в планшет AggreWell800™ (STEMCELL Technology, Канада) в плотности от 900 000 до 3 млн клеток на лунку и культивировали в среде DMEM/F12 (Thermo Fisher Scientific, США), дополненной 10% FBS (HyMedia, Индия) и 10 мкМ ингибитором Rho киназы Y27632 (Miltenyi Biotec, Германия), внося 2 мл полной среды на лунку.
Клетки культивировали на планшете AggreWell800™ от 12 до 24 ч. После периода инкубации сфероиды собирали из лунок с помощью серологической пипетки объемом 5 мл и переносили в пробирку объемом 15 мл. Давали им осесть на дно пробирки в течение 2–3 мин, после чего надосадочную жидкость отбрасывали. Затем сфероиды помещали в свежеразмороженный неразбавленный матригель (BD, США). Через 30 мин сфероиды отмывали путем пассивного отстаивания в пробирке объемом 15 мл или осторожного центрифугирования в течение одной мин при 300 об/мин. После этого сфероиды переносили в самодельные мини-биореакторы, которые являлись низкоадгезионными чашками Петри с каплей клея в центре. Подробный протокол создания мини-биореакторов описан в предыдущем исследовании [21]. Мини-биореакторы помещали на орбитальный шейкер в CO2-инкубатор. Скорость вращения была установлена на 70–75 об/мин. Через 24 ч среду заменяли. После этого среду меняли еженедельно. После переноса в биореакторы сфероиды культивировали в течение 2 недель.
Количественная полимеразная цепная реакция (кПЦР)
Для оценки экспрессии хондроцитарных маркеров проводили количественную полимеразную цепную реакцию с обратной транскрипцией по описанному ранее протоколу [22].
Для лизиса клеток в монослойных культурах и сфероидах использовали RLT-буфер (QIAGEN, Германия), дополненный 10 мкл/мл β-меркаптоэтанола. Сфероиды (по 3–5 штук, в зависимости от размера) и монослойные клеточные культуры пипетировали в 600 мкл RLT для лизирования. Для выделения РНК использовали набор RNeasy Plus Mini Kit (QIAGEN, Германия), а для очистки от геномной ДНК — раствор ДНКзы («СибЭнзим», Россия). Синтез первой нити кДНК проводили с использованием набора MMLV RT kit (Evrogen, Россия) по протоколу производителя. Для проведения кПЦР готовили реакционную смесь: 5 мкл 5× qPCRmix-HS SYBR (Evrogen, Россия), 0,8 мкл 10 мкМ смеси праймеров, 18,2 мкл воды, затем добавляли 1 мкл матрицы кДНК в лунки 96-луночного планшета (SSIbio, США). Амплификацию осуществляли на термоциклере CFX96 (Bio-Rad, США) при 39 циклах. В качестве отрицательного контроля использовали кДНК образцов ИПСК для оценки специфичности реакции. Анализ результатов проводили в программе Microsoft Excel с использованием метода ΔΔCt.
Измерение содержания гликозаминогликанов с помощью ИФА
Содержание ГАГ в образцах 2D- и 3D-культуры хондроцитов определяли с помощью набора Human GAG ELISA Kit (FineTest, Китай). Во время культивирования хондроцитов для анализа отбирали аликвоты среды. Образцы хранили при температуре –80 °C. Каждый анализ биологического образца состоял из двух технических повторов. Оптическая плотность измерялась при длине волны 450 нм с помощью ридера Tecan Infinity 200Pro. Стандартная кривая была сформирована в программе Curve Expert Basic путем построения графика зависимости оптической плотности при λ = 450 нм каждого стандартного раствора от его соответствующей концентрации. Целевая концентрация образцов интерполировалась из этой стандартной кривой.
Для проведения ИФА образцов 2D-культуры клеток брали от 200 000 до 500 000 клеток хондроцитов, хондроцитоподобных производных чПСК и 1,5 млн клеток чПСК. Для проведения ИФА образцов 3D-культур клеток брали 700 000 клеток сфероидов хондроцитов, от 375 000 до 1 млн клеток сфероидов хондроцитоподобных производных чПСК и 1 млн клеток сфероидов чПСК. Для обработки данных значения, полученные для каждого образца, были нормализованы в зависимости от объема среды, в которой культивировались хондроциты, и количества клеток.
Сбор образцов для ЖХ-МС/МС
Хондроциты и хондроцитоподобные производные из чПСК использовали для создания хондроцитарных мультислоев (2D-хрящеподобных структур) и 3D-сфероидов с помощью микролуночных планшетов AggreWell 800™ (STEMCELL Technology, Канада). Кроме того, 2D- и 3D-хрящеподобные структуры были получены из первичных культур хондроцитов, выделенных из донорских биологических материалов пациентов. Образцы клеточных культур и 3D-структур подвергали трипсинолизу, проводили жидкостную хроматографию с использованием системы Dionex Ultimate 3000 (Thermo Fisher Scientific, США), а затем масс-спектрометрический анализ с использованием системы Orbitrap Q Exactive HF-X (Thermo Fisher Scientific, США).
Для проведения ЖХ-МС/МС брали по 1 млн клеток для анализа 2D-культур и по 10 сфероидов при анализе 3D-клеточных культур. Перед анализом монослойные культуры предварительно трижды промывали фосфатным буфером для удаления культуральной среды, затем отделяли от культуральной посуды с помощью раствора Версена. После промывки центрифугированием надосадочную жидкость удаляли, а клетки замораживали при –70 °C до анализа. 3D-структуры аналогичным образом промывали фосфатным буфером три раза путем пассивной седиментации. Затем осадок подвергался последней процедуре промывки перед замораживанием. После седиментации осадок переносили для анализа белкового состава методом ЖХ-МС/МС.
Анализ состава ГАГ с помощью ЖХ-МС/МС
Для разрушения клеточных структур и выделения белков в образцы добавляли 10% раствор дезоксихолата натрия, доводя его до финальной концентрации 1%. Затем вносили смесь нуклеаз для деградации нуклеиновых кислот и инкубировали при 4 °C в течение 30 мин. Далее для восстановления и алкилирования дисульфидных связей к раствору добавляли трис(2-карбоксиэтил)фосфин (5 мМ) и хлорацетамид (30 мМ), после чего инкубировали при 80 °C на протяжении 10 мин. Белки осаждали метанол-хлороформом, полученные осадки ресуспендировали в 100 мкл буфера Tris-HCl (50 мМ, pH 8,5), после этого определяли концентрацию белков с помощью BCA Assay Kit (Thermo Fisher Scientific, США). Ферментативное расщепление белков проводили трипсином (Trypsin Gold, Mass Spectrometry Grade, Promega, США) в соотношении трипсин:белок 1:50 (% w/w), выдерживая образцы при 37 °C в течение 16 ч. Прекращение протеолиза осуществляли добавлением трифторуксусной кислоты до концентрации 1%. Затем пептиды высушивали с помощью вакуумного концентрирования (SpeedVac, Thermo Fisher Scientific, США) и растворяли в 20 мкл раствора, содержащего 3% ацетонитрила и 0,1% трифторуксусной кислоты в воде сверхвысокой очистки (mQ). Вслед за этим определяли концентрацию пептидов, используя колоритмический метод определения концентрации белка с помощью бицинхониновой кислоты (BCA-анализ).
Для жидкостной хроматографии использовали систему нано-ЖХ Dionex Ultimate 3000 (Thermo Fisher Scientific, Waltham, США) с колонкой PicoTips C-18 (длина 10 см, внутренний диаметр 75 мкм, New Objective, США), заполненную сорбентом Kinetex C18 (2,4 мкм, Phenomenex, Torrence, США). Поток устанавливали на уровне 300 нл/мин при 60 °C. Буфер А состоял из 0,1% муравьиной кислоты в воде класса LC/MS, а буфер В — из 80% ацетонитрила, 0,1% муравьиной кислоты в воде класса LC/MS. Разделение проводили в градиентном режиме, увеличивая концентрацию буфера B от 3 до 40% в течение 120 мин. Масс-спектрометрический анализ производили на приборе Orbitrap Q Exactive HF-X (Thermo Fisher Scientific, США) с нанораспылительным источником (напряжение +2,2 кВ, температура капилляра 300 °C). Сканирование MS1 осуществляли в диапазоне 350–1500 m/z (разрешение 60 000, AGC 3e6, время инжекции 45 мс). Для фрагментации использовали HCD с энергией 30 эВ. Сканирование MS2 выполняли в диапазоне 200–2000 m/z (разрешение 30 000, AGC 2e5, время инжекции 50 мс). Применяли стратегию dd-MS2 с выбором 12 наиболее интенсивных ионов (Top12).
Анализ данных ЖХ-МС/МС
Необработанные данные ЖХ-МС/МС, полученные на масс-спектрометре Orbitrap, были преобразованы в данные формата mgf с помощью программы MSConvert со следующими параметрами командной строки: «--mgf --filterpeakPicking true». Для комплексной идентификации белков полученные результаты обрабатывали с помощью MASCOT и X! Tandem. Показатели тандемной масс-спектрометрии анализировали по базе данных белковых последовательностей UniProt Knowledgebase (таксон человека) с использованием алгоритма ALANINE с допустимой ошибкой 20 ppm для определения массы предшественника и 50 ppm для определения массы фрагмента. Параметры поиска были заданы следующим образом: гидролиз белка трипсином с одним возможным пропущенным сайтом расщепления, постоянная карбамидометилирующая модификация (C) и переменная окислительная модификация (M). Для сравнения результатов идентификации, полученных с помощью MASCOT и X! Tandem, и составления окончательного списка идентифицированных белков результаты обоих алгоритмов идентификации были проанализированы в программе Scaffold 5. Этот алгоритм оценивал локальную частоту ложноположительных идентификаций с использованием стандартной группировки белков в рамках всего эксперимента. Для оценки погрешности идентификации пептидов и белков был выбран пороговый уровень ложной идентификации менее 5%. Дифференциальную экспрессию генов идентифицировали с помощью пакета языка программирования R limma.
Статистический анализ
Статистический анализ данных кПЦР, ИФА, ЖХ-МС/МС выполняли с помощью программы Biorender. Для оценки различий между группами использовали непараметрический тест Краскела — Уоллиса, который применяется для независимых выборок, данные в которых не имели нормального распределения. В случае выявления статистически значимого различия (p < 0,05) дополнительно проводили тест множественных сравнений Данна для парных сравнений между группами, что позволило скорректировать вероятность ложноположительных результатов. Статистически достоверными считали различия при p < 0,05, при этом для обозначения уровней значимости использовали следующие символы: * (p < 0,05), △ (p < 0,01), ○ (p < 0,001). Для анализа данных кПЦР использовали t-тест Уэлча, учитывающий различия в стандартных отклонениях между двумя группами независимых выборок. Различия считали достоверными при уровне статистической значимости p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ экспрессии хондроцитарных генов
Метод кПЦР был использован для подтверждения идентичности клеточных культур хондроцитов и хондроцитов, полученных из чПСК, путем анализа экспрессии ключевых молекулярных маркеров, характерных для зрелых клеток хрящевой ткани.
Результаты кПЦР подтвердили, что клеточные культуры нативных хондроцитов проявляют высокую экспрессию специфических маркеров, таких как аггрекан (ACAN), коллаген II типа (COL2A1) и транскрипционный фактор SOX9, который является ключевым регулятором хондрогенеза (рис. 1). На графике представлены значения относительной экспрессии ключевых хондроцитарных генов в клеточных культурах нативных хондроцитов и хондроцитов, полученных из чПСК. Для нормализации уровней экспрессии использован референсный ген YWHAZ. Столбцы на графике отражают средние значения относительной нормализованной экспрессии генов (ΔΔCt) с указанием стандартного отклонения (SD). Достоверных различий, проанализированных с помощью t-теста Уэлча, между образцами нативных хондроцитов и хондроцитоподобных производных чПСК обнаружено не было. Высокий уровень экспрессии хондроцитарных генов указывает на функциональную зрелость клеточных культур нативных хондроцитов. Хондроциты, полученные из чПСК, также показали выраженную экспрессию данных маркеров, что свидетельствует о высокой степени их дифференцировки в хрящевые клетки, аналогичные нативным хондроцитам.
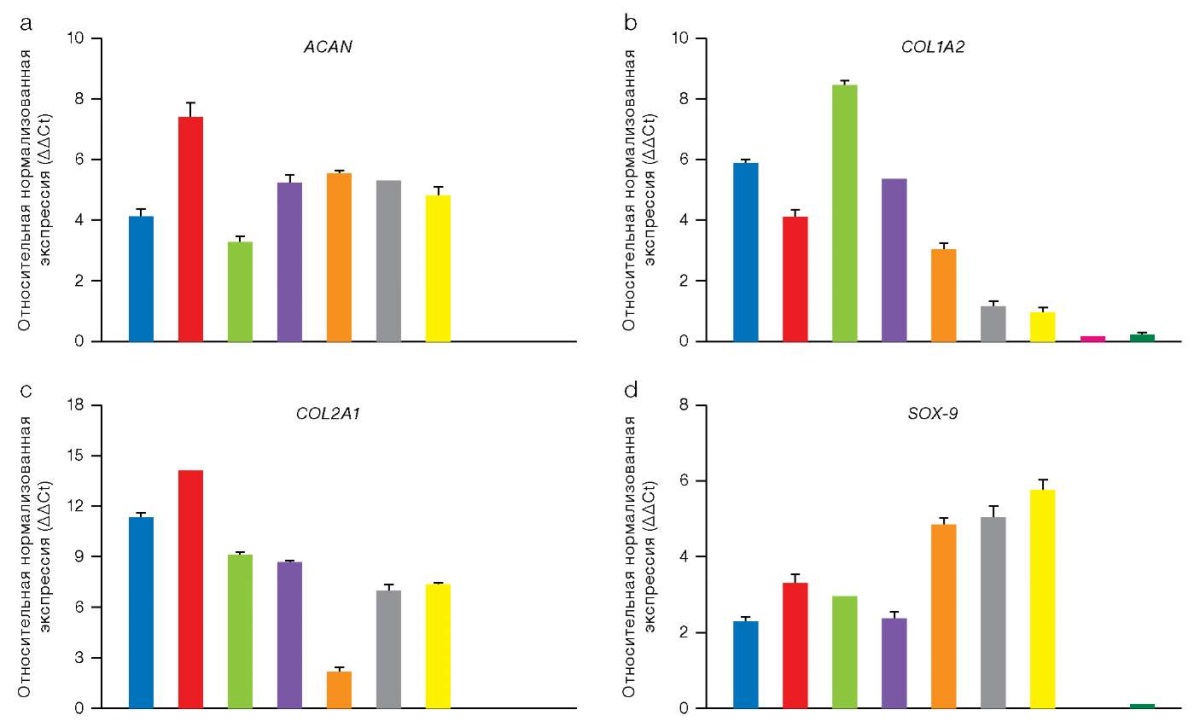
Рисунок подготовлен авторами по собственным данным
Рис. 1. Относительная экспрессия хондроцитарных генов (ΔΔCt), нормированная на ген YWHAZ, в 2D-образцах культур хондроцитов различного происхождения, измеренная методом кПЦР
Примечание: a. Аггрекан (ACAN); b. Альфа-2 цепь коллагена I типа (COL1A2); c. Альфа-1 цепь коллагена II типа (COL2A1); d. Транскрипционный фактор SOX-9; соответствие цветов на схеме исследуемым образцам: синий –хондроциты пациента 76; красный — хондроциты пациента 75; зеленый — хондроциты пациента 47; фиолетовый — хондроциты пациента 44; коричневый — хондроциты пациента 12; серый — хондроцитоподобные клетки, дифференцированные из чПСК IPSRG4SΔb2m cl55/1; желтый — хондроцитоподобные клетки, дифференцированные из чПСК IPSRG4S; пурпурный — чПСК IPSRG4SΔb2m cl55/1; темно-зеленый — чПСК IPSRG4S.
Количественное определение ГАГ в хондроцитах различного происхождения с помощью ИФА
Количественный анализ ГАГ с помощью ИФА выявил, что содержание данных биополимеров значительно выше в 3D-культурах хондроцитов по сравнению с 2D-культурами. В частности, концентрация ГАГ в 3D-культурах нативных хондроцитов достигала 1099,87 нг/мл, что значительно превышало уровень, зафиксированный в 2D-культурах (108,67 нг/мл). Аналогичная тенденция наблюдалась и в культурах хондроцитов, полученных из чПСК, однако содержание ГАГ оставалось ниже по сравнению с нативными хондроцитами, что может свидетельствовать о необходимости дополнительной оптимизации условий дифференцировки и удлинения срока культивирования; соответствующие данные представлены на рисунке 2.
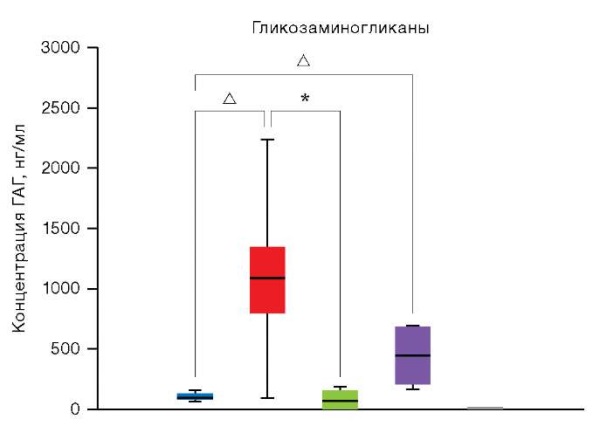
Рисунок подготовлен авторами по собственным данным
Рис. 2. Результаты количественного определения ГАГ методом ИФА в культурах хондроцитов при 2D- и 3D-условиях
Примечание: соответствие цветов на схеме исследуемым образцам: cиний — 2D-культуры хондроцитов пациентов (n = 5); красный — 3D-культуры хондроцитов пациентов (n = 2); зеленый — 2D-культуры хондроцитов пациентов, дифференцированных из чПСК (n = 2); фиолетовый — 2D-культуры хондроцитов пациентов, дифференцированных из чПСК (n = 2); серый — контрольная группа чПСК (n = 2); уровень экспрессии ГАГ в культурах чПСК равен нулю; уровни статистической значимости по сравнению с группой контроля: * — p < 0,0332; △ — p < 0,0021.
Феномен дедифференцировки хондроцитов в двумерных условиях хорошо документирован [23][24]. Было показано, что культивирование сфероидов хондроцитов в трехмерных средах усиливает процесс хондрогенной дифференцировки, позволяя получать хондрогенные клеточные конструкции без необходимости в использовании скаффолда или многократного пассирования клеток [25][26]. Однако количественная оценка ГАГ в данном контексте не приводилась.
Анализ состава ГАГов в культурах клеток хондроцитов различного генеза
ЖХ-МС/МС-анализ позволил детально исследовать состав внеклеточного матрикса. Основным компонентом гликозаминогликанов (ГАГ) оказался хондроитинсульфат-протеогликан 4, уровень которого был значительно выше в 3D-культурах нативных хондроцитов, что свидетельствует о благоприятных условиях для продукции ключевых компонентов хрящевого матрикса. В то же время содержание других протеогликанов, таких как аггрекан, бигликан и декорин, оставалось без значительных изменений.
Рисунок 3 представляет результаты анализа состава ГАГ, синтезируемых в культурах хондроцитов различного генеза, с использованием метода ЖХ-МС/МС. График отображает количественное содержание различных типов ГАГ, включая хондроитинсульфат-протеогликан 4, аггрекан, бигликан и декорин, в 2D- и 3D-культурах нативных хондроцитов и хондроцитов, полученных из чПСК. Данные представлены в виде средних значений с указанием стандартного отклонения (SD). Значимые различия между группами оценены с помощью статистических критериев.
Состав ГАГ, определенный с помощью ЖХ-МС/МС, показал повышенный уровень их содержания в 3D-культурах нативных хондроцитов по сравнению с 2D-культурами (рис. 3). Сфероиды хондроцитов, полученные из биоптатов тканей пациентов, демонстрировали значительно более высокую концентрацию хондроитинсульфат-протеогликана 4, в то время как трехмерные культуры хондроцитоподобных производных чПСК имели низкий уровень всех исследованных ГАГ, что указывает на их незрелость даже после дифференцировки. Это ограничение можно потенциально устранить путем продления периода культивирования и дополнения среды факторами, стимулирующими метаболические пути синтеза ГАГ, такими как TGF-β, SOX9, костные морфогенетические белки и сигнальные пути ретиноевой кислоты.
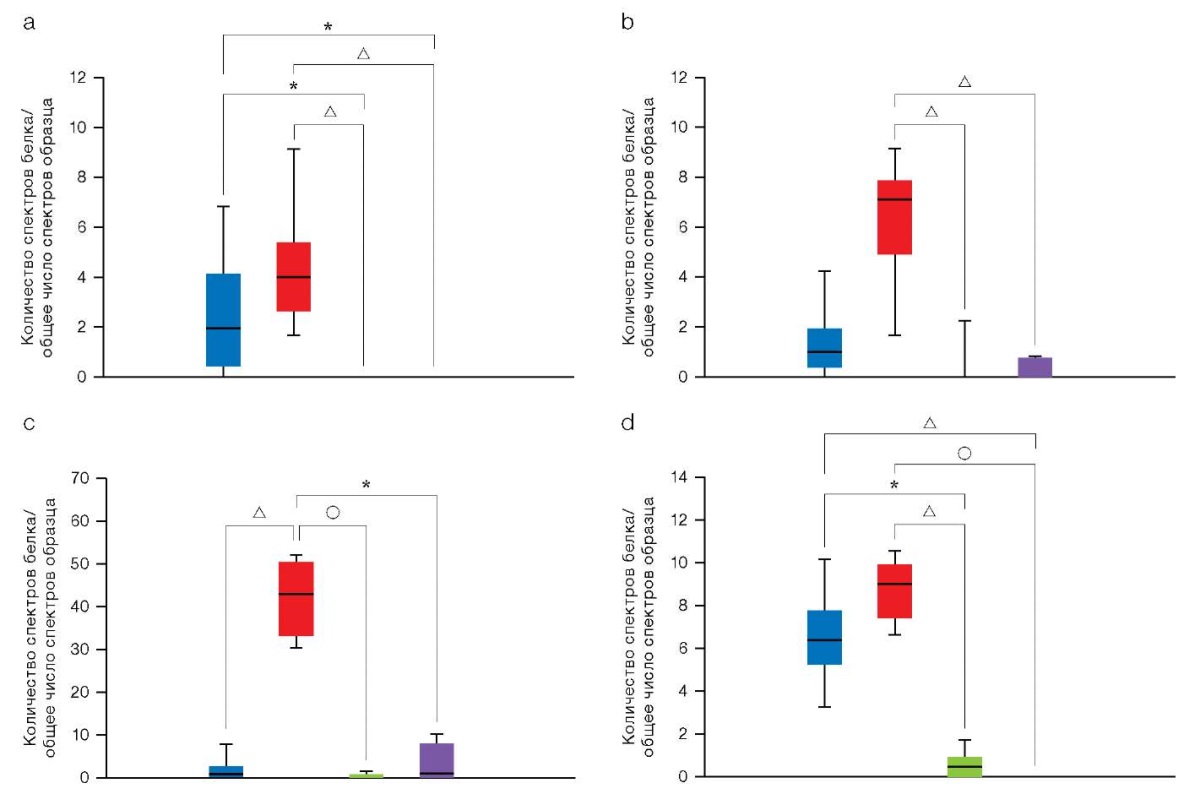
Рисунок подготовлен авторами по собственным данным
Рис. 3. Результаты анализа состава ГАГ методом ЖХ-МС/МС
Примечание: a. Аггрекан; b. Бигликан; c. Хондроитинсульфат-протеогликан 4; d. Декорин; соответствие цветов на схеме исследуемым образцам: синий — 2D-культуры хондроцитов пациентов (n = 5); красный — 3D-культуры хондроцитов пациентов (n = 5); зеленый — 2D-культуры хондроцитов пациентов, дифференцированных из чПСК (n = 2); фиолетовый — 2D-культуры хондроцитов пациентов, дифференцированных из чПСК (n = 2); серый — контрольная группа чПСК (n = 1); уровень экспрессии протеогликанов в культурах чПСК равен нулю; уровни статистической значимости по сравнению с контрольной группой чПСК:* — p < 0,0332; △ — p < 0,0021; ○ — p < 0,0001.
ЗАКЛЮЧЕНИЕ
В нашем исследовании был определен состав ГАГ, синтезируемых in vitro хондроцитами различного генеза, с использованием ИФА и ЖХ-МС/МС, а также оценено влияние 2D- и 3D-культивирования на их синтез. Результаты показали, что 3D-среда культивирования создает условия, способствующие более полноценному формированию хондроцитарного ВКМ в образцах нативных хондроцитов. Однако, несмотря на это, полученные сфероиды хондроцитоподобных производных чПСК не достигают функциональной идентичности с естественной хрящевой тканью даже после завершения протоколов дифференцировки и не представляют собой идеальные тканеинженерные конструкции для коррекции дефектов хряща. Возможно, для более полноценного созревания ВКМ и повышения их потенциальной эффективности в роли конструкций для тканевой инженерии требуется более длительное культивирование в 3D-условиях.
Список литературы
1. GBD 2019 Diseases and Injuries Collaborators. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2020;396(10258):1204–22. https://doi.org/10.1016/S0140-6736(20)30925-9
2. Carey JL, Remmers AE, Flanigan DC. Use of MACI (autologous cultured chondrocytes on porcine collagen membrane) in the United States: preliminary experience. Orthopaedic Journal of Sports Medicine. 2020;8(8):e2325967120941816. https://doi.org/10.1177/2325967120941816
3. Dekker TJ, Aman ZS, DePhillipo NN, Dickens JF, Anz AW, LaPrade RF. Chondral Lesions of the Knee: An evidence-based approach. Journal of Bone And Joint Surgery. 2021;103(7):629–45. https://doi.org/10.2106/JBJS.20.01161
4. Ali E, Smaida R, Meyer M, Ou W, Li Z, Han Z, et al. iPSCs chondrogenic differentiation for personalized regenerative medicine: a literature review. Stem Cell Res Ther. 2024;15(1):e185. https://doi.org/10.1186/s13287-024-03794-1
5. Li M, Xiao R, Li J, Zhu Q. Regenerative approaches for cartilage repair in the treatment of osteoarthritis. Osteoarthritis and Cartilage. 2017;25(10):1577–87. https://doi.org/10.1016/j.joca.2017.07.004
6. Szirmai JA, ed. The concept of the chondron as a biomechanical unit. In F. Hartmann. Biopolymere und Biomechanik von Bindegewebssystemen. Heidelberg: Springer-Verlag Berlin; 1974. https://doi.org/10.1007/978-3-642-65963-8_9
7. Wang Q, El Haj A, Kuiper N. Glycosaminoglycans in the pericellular matrix of chondrons and chondrocytes. J Anat. 2008;213(3):266–73. https://doi.org/10.1111/j.1469-7580.2008.00942.x
8. Sophia Fox J, Bedi A, Rodeo S. The basic science of articular cartilage: structure, composition, and function. Sports Health. 2009;1(6):461–8. https://doi.org/10.1177/1941738109350438
9. Roughley PJ, Mort JS. The role of aggrecan in normal and osteoarthritic cartilage. J exp ortop. 2014;1:e8. https://doi.org/10.1186/s40634-014-0008-7
10. Han B, Li Q, Wang C, Chandrasekaran P, Zhou Y, Qin L, et al. Differentiated activities of decorin and biglycan in the progression of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 2021;29(8):1181–92. https://doi:10.1016/j.joca.2021.03.019
11. Tang F, Lord MS, Stallcup WB, Whitelock JM. Cell surface chondroitin sulphate proteoglycan 4 (CSPG4) binds to the basement membrane heparan sulphate proteoglycan, perlecan, and is involved in cell adhesion. J Biochem. 2018;163(5):399–412. https://doi.org:10.1093/jb/mvy008
12. Lee G, Loeser R. Interactions of the chondrocyte with its pericellular matrix. Cells Mater. 1998;8:135–49.
13. Vonk L, Roël G, Hernigou J, Kaps C, Hernigou P. Role of Matrix-Associated Autologous Chondrocyte Implantation with Spheroids in the Treatment of Large Chondral Defects in the Knee: A Systematic Review. Int J Mol Sci. 2021;22(13):e7149. https://doi.org/10.3390/ijms22137149
14. Prittinen J, Ylärinne J, Piltti J, Karhula S, Rieppo L, Ojanen S, et al. Effect of centrifugal force on the development of articular neocartilage with bovine primary chondrocytes. Cell Tissue Res. 2019;375(3):629–39. https://doi.org/10.1007/s00441-018-2938-3
15. Caron MM, Emans PJ, Coolsen MM, Voss L, Surtel DA, Cremers A, et al. Redifferentiation of dedifferentiated human articular chondrocytes: comparison of 2D and 3D cultures. Osteoarthritis Cartilage. 2012;20(10):1170–8. https://doi.org/10.1016/j.joca.2012.06.016
16. Исследование состава гликозаминогликанов, синтезируемых хондроцитами различного генеза in vitro. Тезисы докладов 77-й Международной школы-конференции молодых ученых «БИОСИСТЕМЫ: организация, поведение, управление». Нижний Новгород; 2024. EDN: QOPJWI
17. Hu J, Athanasiou K. Chondrocytes from different zones exhibit characteristic differences in high density culture. Connect Tissue Res. 2006;47(3):133–40. https://doi.org/10.1080/03008200600685392
18. Bekkers J, Saris D, Tsuchida A, van Rijen M, Dhert W, Creemers L. Chondrogenic potential of articular chondrocytes depends on their original location. Tissue Eng. 2024;20(3–4):663–71. https://doi.org/10.1089/ten.TEA.2012.0673
19. Sodhi H, Panitch A. Glycosaminoglycans in Tissue Engineering: A Review. Biomolecules. 2021;11(1):e29. https://doi.org/10.3390/biom11010029
20. Holmqvist S, Lehtonen Š, Chumarina M, Puttonen K, Azevedo C, Lebedeva O, et al. Creation of a library of induced pluripotent stem cells from Parkinsonian patients. NPJ Parkinsons Dis. 2016;2:e16009. https://doi.org/10.1038/npjparkd.2016.9
21. Eremeev A, Belikova L, Ruchko E, Volovikov E., Zubkova O., Emelin A., et al. Brain Organoid Generation from Induced Pluripotent Stem Cells in Home-Made Mini Bioreactors. J Vis Exp. 2021;178:e62987. https://doi.org/10.3791/62987
22. Баринова АА, Пикина АС, Голубинская ПА, Ручко ЕС, Еремеев АВ. In vitro оценка иммуногенности хондроцитов, полученных из индуцированных плюрипотентных стволовых клеток с нокаутом B2M. Медицина экстремальных ситуаций. 2024;26(1):32–42. https://doi.org/10.47183/mes.2024.001
23. Yishan C, Yu Y, Wen Y, Chen J, Lin J, Sheng Z, et al. A high-resolution route map reveals distinct stages of chondrocyte dedifferentiation for cartilage regeneration. Bone Res. 2022;10:e38 https://doi.org/10.1038/s41413-022-00209-w
24. Ma B, Leijten JC, Wu L, Kip M, van Blitterswijk CA, Post JN, Karperien M. Gene expression profiling of dedifferentiated human articular chondrocytes in monolayer culture. Osteoarthritis and Cartilage. 2013;21(4):599–603. https://doi.org/10.1016/j.joca.2013.01.014
25. Vakhrushev IV, Basok YB, Baskaev KK, Novikova VD, Leonov GE, Grigoriev AM, et al. Cartilage-Specific Gene Expression and Extracellular Matrix Deposition in the Course of Mesenchymal Stromal Cell Chondrogenic Differentiation in 3D Spheroid Culture. Int. J. Mol. Sci. 2024;25:e5695. https://doi.org/10.3390/ijms25115695
26. Yen BL, Hsieh CC, Hsu PJ, Chang CC, Wang LT, Yen ML. Three-Dimensional Spheroid Culture of Human Mesenchymal Stem Cells: Offering Therapeutic Advantages and In Vitro Glimpses of the In Vivo State. Stem Cells Translational Medicine. 2023;12(5):235–44. https://doi.org/10.1093/stcltm/szad01
Об авторах
П. А. ГолубинскаяРоссия
Голубинская Полина Александровна - канд. мед. наук
Москва
Е. С. Ручко
Россия
Ручко Евгений Сергеевич
Москва
А. С. Пикина
Россия
Пикина Арина Сергеевна
Москва
И. П. Смирнов
Россия
Смирнов Игорь Павлович - канд. хим. наук
Москва
Т. В. Владимирова
Россия
Владимирова Татьяна Викторовна
Москва
В. Д. Гордеева
Россия
Гордеева Вероника Дмитриевна - канд. биол. наук
Москва
Г. П. Арапиди
Россия
Арапиди Георгий Павлович - канд. биол. наук
Москва
А. В. Еремеев
Россия
Еремеев Артем Валерьевич - канд. биол. наук
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Голубинская П.А., Ручко Е.С., Пикина А.С., Смирнов И.П., Владимирова Т.В., Гордеева В.Д., Арапиди Г.П., Еремеев А.В. Определение состава протеогликанов, синтезируемых in vitro хондроцитами различного генеза. Медицина экстремальных ситуаций. 2025;27(1):97-106. https://doi.org/10.47183/mes.2025-27-1-97-106
For citation:
Golubinskaya P.A., Ruchko E.S., Pikina A.S., Smirnov I.P., Vladimirova T.V., Gordeeva V.D., Arapidi G.P., Eremeev A.V. Composition analysis of proteoglycans synthesized in vitro by chondrocytes of various origins. Extreme Medicine. 2025;27(1):97-106. https://doi.org/10.47183/mes.2025-27-1-97-106

















