Перейти к:
Гибридные методы лучевой диагностики в оценке эпилептогенных очагов: разбор диагностического случая
https://doi.org/10.47183/mes.2025-240
Аннотация
Введение. Локализация эпилептогенного очага (ЭО) у пациентов с фармакорезистентной фокальной эпилепсией нередко бывает затруднительной, а выявление множественных ЭО ограничивает возможности хирургического лечения. Более точная характеристика структуры и метаболизма ЭО может дать дополнительную информацию в рамках ведения таких пациентов.
Описание клинического случая. Пациент 35 лет с фармакорезистентной фокальной эпилепсией, дебютировавшей в 24 года генерализованными тонико-клоническими приступами, а затем фокальными эпизодами с замиранием и тоническим напряжением левой руки. На МРТ выявлен двусторонний мезиальный темпоральный склероз с более выраженными изменениями слева, однако ЭЭГ показала эпилептиформную активность в правой височной области, что создало диагностические сложности в определении первичной эпилептогенной зоны. Для уточнения локализации очага было проведено комплексное обследование, включавшее ПЭТ/МРТ, выявившую выраженный гипометаболизм в правой височной доле (с разницей до 31% по сравнению с контралатеральной стороной) при сохранении симметричного накопления РФП в гиппокампах. Дополнительно выполнена диффузионно-куртозисная МРТ, которая показала значимое снижение показателей радиального и среднего куртозиса, а также аксональной фракции воды в правой височной доле (до 1,33 SD от нормы). Инвазивный ЭЭГ-мониторинг подтвердил билатеральный характер эпилептогенности с преобладанием правополушарной инициации приступов.
Выводы. Комбинированное применение ПЭТ/МРТ и диффузионно-куртозисной МРТ повышает точность выявления эпилептогенных очагов при фармакорезистентной эпилепсии. Методы позволяют комплексно оценивать метаболические и микроструктурные изменения, что важно для планирования хирургического лечения. Интеграция данных способствует дифференциации первичных и вторичных очагов, оптимизируя тактику ведения пациентов. Перспективно внедрение автоматизированного анализа для стандартизации диагностики.
Ключевые слова
Для цитирования:
Наделяев Р.В., Долгушин М.Б., Ростовцева Т.М., Баранова Е.А., Воронкова Ю.А., Гаврилова Э.Ю., Рублева Ю.В. Гибридные методы лучевой диагностики в оценке эпилептогенных очагов: разбор диагностического случая. Медицина экстремальных ситуаций. 2025;27(2):176-182. https://doi.org/10.47183/mes.2025-240
For citation:
Nadelyaev R.V., Dolgushin M.B., Rostovtseva T.M., Baranova E.A., Voronkova Yu.A., Gavrilova E.Yu., Rubleva Yu.V. Hybrid imaging techniques in the assessment of epileptic foci: A clinical case. Extreme Medicine. 2025;27(2):176-182. https://doi.org/10.47183/mes.2025-240
ВВЕДЕНИЕ
Структурная фокальная эпилепсия в 30–40% случаев носит фармакорезистентный характер [1]. Подобное течение заболевания вынуждает специалистов прибегать к хирургическим методам лечения [2]. Современная концепция, описывающая патофизиологические основы структурной фокальной эпилепсии, подразумевает наличие в веществе головного мозга эпилептогенной зоны (ЭЗ), которая, в свою очередь, включает в себя не только очаг морфологических изменений, но и участки функциональных изменений [16][17]. В связи с этим полноценная резекция эпилептогенной зоны является одним из самых эффективных хирургических методов достижения долгосрочного бесприступного периода [3]. До 57% пациентов, перенесших процедуру резекции предполагаемого эпилептогенного очага (ЭО), становятся полностью свободными от приступов (по шкале исходов хирургического лечения эпилепсии по J. Engel — Ia) [4][5], а у 87% пациентов исчезают тяжелые эпилептические приступы (по шкале исходов хирургического лечения эпилепсии по J. Engel — Ib-d) [5]. В связи с этим выявление эпилептогенной зоны и определение границ резекции на этапе предоперационного планирования критически важно.
Конвенциональный набор диагностических методов в виде анализа клинической картины, неинвазивной скальповой электроэнцефалографии (ЭЭГ) и магнитно-резонансной томографии (МРТ) головного мозга по эпилептическому протоколу не всегда позволяют латерализовать и локализовать ЭО. В свою очередь, инвазивный ЭЭГ-мониторинг с установкой глубинных электродов, хотя и обладает высокой чувствительностью и является золотым стандартом в локализации и оценке распространенности ЭО [6], не исключает определенные сложности и риски возникновения различного рода осложнений [7]. В аспекте изучения эпилепсии постоянно ведется поиск все более точных и безопасных методов диагностики, поэтому в рамках представленного клинического случая мы хотим продемонстрировать возможности гибридного метода лучевой диагностики ПЭТ/МРТ с 18F-фтордезоксиглюкозой (ФДГ) и перспективной методики диффузионной куртозисной МРТ [8] в оценке эпилептогенных зон у пациента со структурной фокальной эпилепсией.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациент А., 35 лет, поступил в неврологическое отделение ФГБУ «ФЦМН» ФМБА России с жалобами на приступы по типу «замирания», иногда в сочетании с тоническим напряжением левой руки, с последующей амнезией, а также генерализованные судорожные приступы. Дебют заболевания в 24 года с генерализованного судорожного приступа, развившегося во время сна, сопровождавшегося хрипом, цианозом и постприступной спутанностью сознания. Пациент обратился к неврологу лишь через год, после повторного приступа; по результатам обследования был выставлен диагноз — эпилепсия неуточненной этиологии с билатеральными тонико-клоническими приступами. На МРТ головного мозга была выявлена биполушарная кортикальная атрофия, высказано предположение о возможном склеротическом изменении правого гиппокампа, на ЭЭГ зарегистрирована интериктальная эпилептиформная активность в правой лобно-височной области. На фоне дуотерапии противоэпилептическими препаратами генерализованные приступы купировались, но возникли фокальные немоторные приступы по типу замирания с частотой в среднем 1 раз в месяц. Несмотря на неоднократное изменение схемы лечения, приступы сохранялись, в связи с чем пациент обратился в ФГБУ «ФЦМН» ФМБА России для прохождения углубленного обследования с целью локализации эпилептогенной зоны и рассмотрения возможности хирургического лечения эпилепсии.
Пациенту были выполнены МРТ головного мозга по эпилептическому протоколу (изотропные Т1 и Т2 FLAIR ИП 1×1×1 мм, Т2 ИП в плоскости гиппокампов, Т2 и Т2 FLAIR ИП перпендикулярно плоскости гиппокампов, Т2 ИП в плоскости передней и задней комиссур) и суточный видео-ЭЭГ-мониторинг. При анализе МР-изображений было выявлено уменьшение объема обоих гиппокампов с нарушением их структуры, что было расценено как двусторонний мезиальный темпоральный склероз, при этом изменения были заметно более выражены в левом амигдалярно-гиппокампальном комплексе (рис. 1). Других структурных изменений, характерных в отношении потенциальной эпилептогенной зоны, обнаружено не было.
Согласно МР-данным, представленным на рисунке 1, у пациента отмечалось двустороннее уменьшение объемов гиппокампов с признаками их структурных изменений в виде гиперинтенсивного сигнала, что являлось убедительным признаком двустороннего мезиального темпорального склероза.
При суточном видео-ЭЭГ-мониторинге была зарегистрирована эпилептиформная активность, представленная комплексами «острая-медленная волна» в правой височной области, эпизодически с распространением на правую лобно-центральную область. Эпилептических приступов зафиксировано не было.
Учитывая неполное соответствие данных ЭЭГ и МРТ, затрудняющее латерализацию потенциальной первичной эпилептогенной зоны, было принято решение о проведении данному пациенту ПЭТ/МРТ головного мозга с 18F-ФДГ с использованием интегрированной ПЭТ/МР-системы SIGNA PET/MR (GE Healthcare, США) (рис. 2). Был произведен визуальный и полуколичественный анализ изображений ПЭТ/МРТ с подсчетом стандартизированного объема накопления радиофармпрепарата (РФП) (standardized uptake volume, SUV) в областях интереса и в контралатеральных областях. По данным проведенного исследования отмечалась выраженная гипофиксация РФП веществом передних отделов правой височной доли в сравнении с контралатеральной стороной и разницей до 31%. Накопление 18F-ФДГ в гиппокампах и амигдалах оставалось симметричным.
Как видно из данных, представленных на рисунке 2, в правой височной доле отмечается выраженное снижение накопления 18F-ФДГ, что свидетельствует о гипометаболической активности в веществе правой височной доли.
В дополнение к ПЭТ/МРТ головного мозга в рамках этого же исследования пациенту была выполнена диффузионно-куртозисная МРТ (ДК МРТ). ДК МРТ проводилась на том же томографе SIGNA PET/MR с мощностью магнитного поля 3Т с использованием 24-канальной головной катушки по протоколу с тремя b-факторами (0, 1000, 2500) и с градиентами в 60 направлениях, изотропным размером вокселя 3×3×3 мм и матрицей 80×80 вокселей. Постобработка осуществлялась в программном обеспечении Explore DTI и SPM12 (Matlab R2023a). Она включала в себя коррекцию движения 4D диффузионных объемов, коррекцию «выбросов» Гиббса и гауссовское сглаживание. Были получены 10 параметрических карт, впоследствии cкорегистрированных с анатомической T1 FSPGR серией. Области интереса (обе височные доли) полуавтоматически сегментировались на основании индивидуального анатомического атласа, предварительно сгенерированного при помощи FastSurferCNN с использованием T1 FSPGR серии (атлас Desikan-Killiany) [19]. Наибольший интерес вызвали карты среднего (МК) и радиального (RК) куртозиса, а также карта аксональной фракции воды (AWF) (рис. 3). Именно эти параметры ДК МРТ в правой височной доле продемонстрировали наибольшее снижение относительно небольшой базы норм, набранной ранее из здоровых добровольцев (n = 15) в рамках стороннего исследования [8]. Фиксировалось снижение более чем на одно стандартное отклонение (до 1,33 SD) от среднего значения по базе норм. Помимо этого, отмечали визуальное и количественное снижение показателей МК, RК и AWF в веществе передних отделов правой височной доли относительно контралатеральной стороны.
На рисунке 3 карты радиального (рис. 3а), среднего (рис. 3б) куртозиса и аксональной фракции воды (рис. 3в) демонстрируют визуальную асимметрию интенсивности сигнала между височными долями (D < S), что подтверждается при количественном сравнении с базой норм (наибольшее снижение на 1.33 SD наблюдается на карте радиального куртозиса).
Для подтверждения или опровержения предположения о наличии первичной эпилептогенной зоны в правой височной доле было принято решение о проведении инвазивного ЭЭГ-мониторинга. Было установлено 4 интракраниальных электрода: по одному в гиппокамп и амигдалярное тело с обеих сторон; мониторинг проводился в течение 9 суток. По результатам исследования под всеми электродами была зафиксирована интериктальная эпилептиформная активность высокого индекса с большей представленностью справа, иктальная активность в виде электрографических приступов, также чаще с инициацией справа. При проведении электростимуляции фокальные вегетативные приступы были зарегистрированы с одинаковой частотой при стимуляции как левого, так и правого амигдалярного тела (рис. 4, 5).
На рисунке 4 продемонстрирован электрографический приступ с зоной инициации в левом гиппокампе: низкоамплитудная быстроволновая активность в области левого гиппокампа (электрод № 4, контакты 1–2) с распространением на 2–4-й контакты гиппокампа и на амигдалярное тело (электрод № 95, контакты 1–3) c эволюцией по частоте и амплитуде.
На рисунке 5 зафиксирован электрографический приступ с зоной инициации в правом гиппокампе: ритмичная быстроволновая активность в области правого гиппокампа (электрод № 64, контакты 2–3) с распространением на 1–2-й контакты гиппокампа и на амигдалярное тело (электрод № 4, 2–3-й контакты → эволюция иктальной активности по частоте и амплитуде).
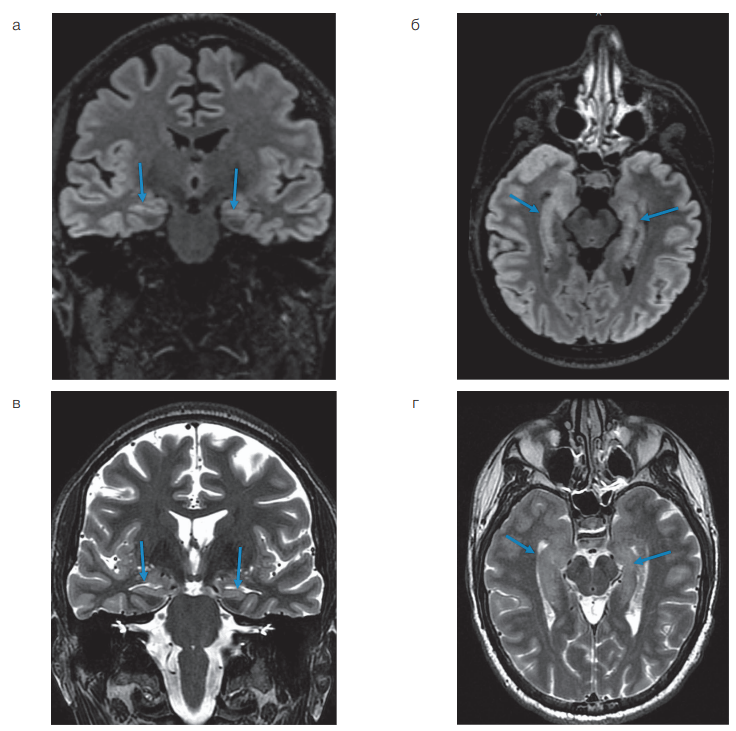
Рисунок подготовлен авторами по собственным данным
Рис. 1. МРТ головного мозга по эпилептическому протоколу у пациента с двусторонним мезиальным темпоральным склерозом: а — Т2 FLAIR изображение в корональной плоскости, выстроенной по длинной оси гиппокампов; б — Т2 FLAIR изображение в аксиальной плоскости, выстроенной по длинной оси гиппокампов; в — Т2-взвешенное изображение в корональной плоскости, выстроенной по длинной оси гиппокампов; г — Т2-взвешенное изображение в аксиальной плоскости, выстроенной по длинной оси гиппокампов. Стрелками указаны гиппокампы
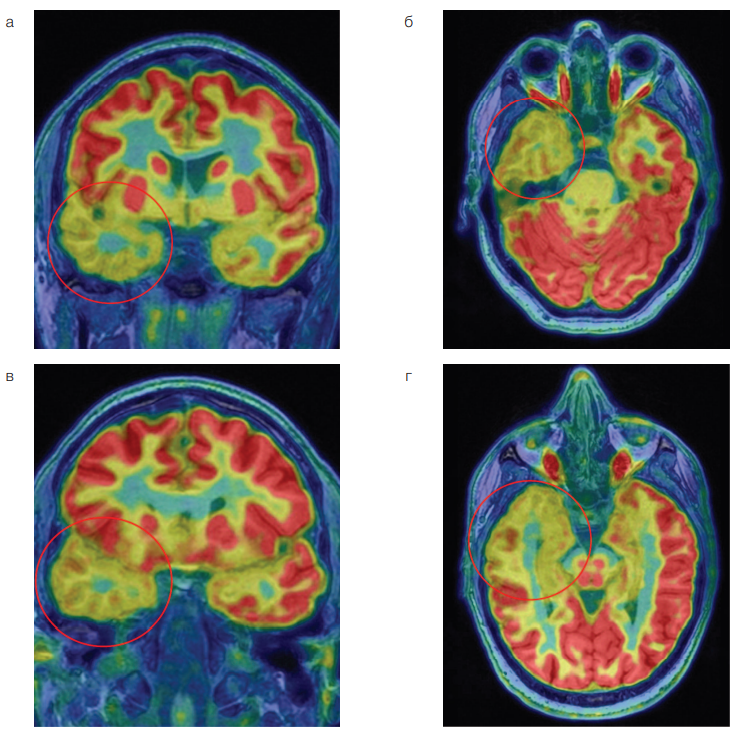
Рисунок подготовлен авторами по собственным данным
Рис. 2. ПЭТ/МРТ головного мозга у пациента с двусторонним мезиальным темпоральным склерозом: а — совмещенные ПЭТ и Т1-взвешенное изображения в корональной плоскости; б — совмещенные ПЭТ и Т1-взвешенное изображения в аксиальной плоскости; в — совмещенные ПЭТ и Т1-взвешенное изображения в косой корональной плоскости; г — совмещенные ПЭТ и Т1-взвешенное изображения в косой аксиальной плоскости. Меткой указана область гипометаболизма 18F-ФДГ в правой височной доле
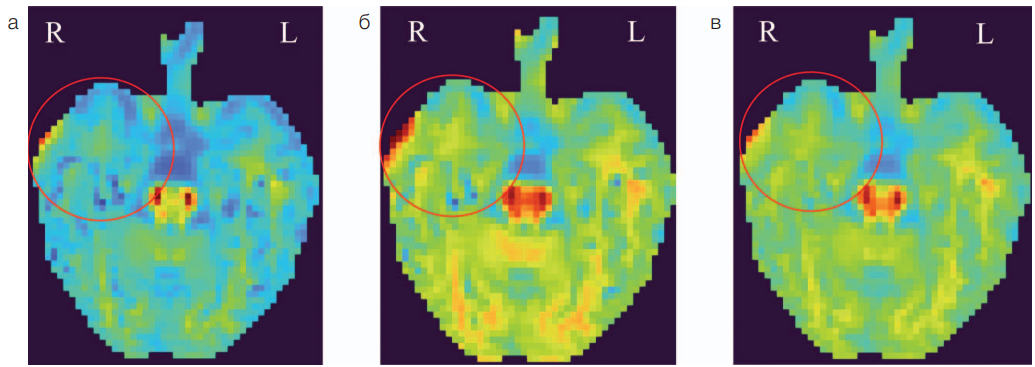
Рисунок подготовлен авторами по собственным данным
Рис. 3. Параметрические карты ДК МРТ у пациента с фокальной эпилепсией и двусторонним мезиальным темпоральным склерозом: а — параметрическая карта радиального куртозиса; б — параметрическая карта среднего куртозиса; в — параметрическая карта аксональной фракции воды. Меткой указана зона снижения показателей ДК МРТ в правой височной доле; R — правое полушарие; L — левое полушарие
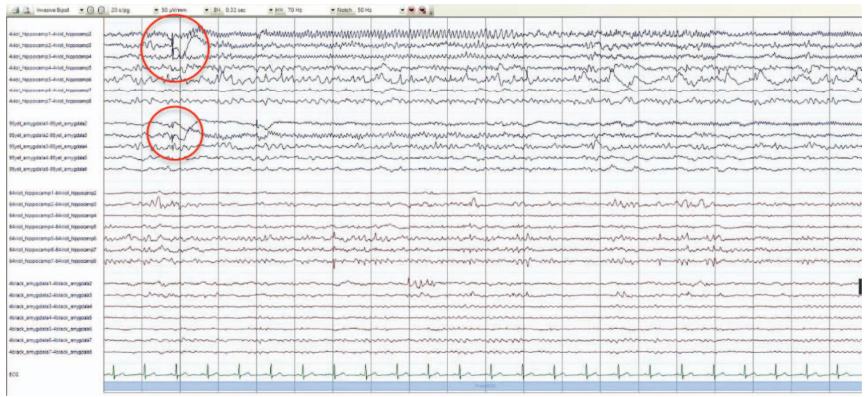
Рисунок подготовлен авторами по собственным данным
Рис. 4. Результаты инвазивного ЭЭГ-мониторинга
Примечание: метками показаны зоны начала электрографического приступа.
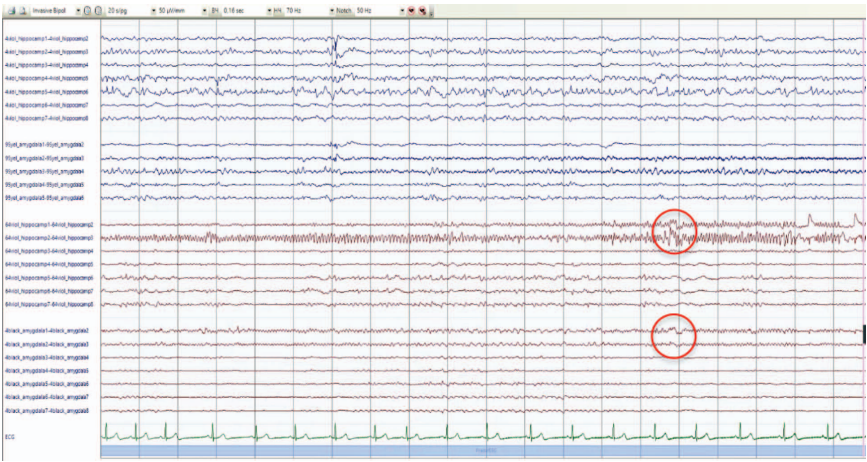
Рисунок подготовлен авторами по собственным данным
Рис. 5. Результаты инвазивного ЭЭГ-мониторинга
Примечание: метками показаны зоны начала электрографического приступа.
ОБСУЖДЕНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Локализация ЭО затруднена у 30% пациентов с фармакорезистентной фокальной эпилепсией [9]. Чаще всего это связано с тем, что МРТ головного мозга по эпилептическому протоколу позволяет выявлять макроструктурные, но не функциональные изменения. Тем не менее нередки и случаи, когда при анализе МРТ выявляются структурные изменения множественных локализаций, в том числе и в разных полушариях [10]. Такие структурные изменения могут носить характер вторичного эпилептогенеза, который часто наблюдается в контралатеральном полушарии [11]. Вторичные ЭО также обладают эпилептогенной активностью, и, следовательно, хирургическое резективное лечение у подобных пациентов в некоторых случаях представляется неэффективным и нецелесообразным [12]. Однако на примере описанного случая было показано, что новейшие неинвазивные методики визуализации в виде ПЭТ/МРТ и ДК МРТ могут давать дополнительную информацию о характере изменений в потенциальных ЭО, а также об их вкладе в течение эпилепсии у конкретного пациента. Это может быть полезно для пациентов с дискордантными результатами продолженного ЭЭГ-мониторинга и конвенциональной МРТ головного мозга по эпилептическому протоколу, что было отмечено у описанного пациента. Параметры ДК МРТ позволяют оценить микроструктурные изменения в веществе головного мозга, которые не могут быть отражены на конвенциональных МР-последовательностях [13][14]. В свою очередь, функциональные и метаболические изменения, обусловленные микроструктурными повреждениями, могут быть оценены при проведении ПЭТ/МРТ [15]. По данным литературных источников, метод ПЭТ/МРТ демонстрирует более высокую чувствительность в диагностике структурной фокальной эпилепсии по сравнению с ПЭТ, ПЭТ/КТ и МРТ [18].
В данном конкретном случае выявленные изменения у описанного пациента свидетельствуют о более выраженном микроструктурном повреждении вещества правой височной доли, что можно интерпретировать как потенциальные маркеры более активного ЭО или первичного, более длительно существующего ЭО. Пациент был выписан с рекомендациями по продолжению терапии, а также направлен в учреждение по месту жительства для наблюдения. В дальнейшем запланирована госпитализация в ФГБУ «ФЦМН» ФМБА России для последующего контроля и определения тактики лечения.
ЗАКЛЮЧЕНИЕ
Комбинированное применение ПЭТ/МРТ и диффузионно-куртозисной МРТ открывает новые возможности в прехирургической диагностике пациентов с фокальной эпилепсией, особенно в сложных случаях с множественными потенциальными эпилептогенными очагами. Эти методы обеспечивают мультимодальную оценку патологических изменений, сочетая данные о метаболических нарушениях (ПЭТ) и микроструктурных особенностях ткани (ДК МРТ), что позволяет выявлять даже субклинические или морфологически не выраженные эпилептогенные зоны. Интеграция результатов помогает дифференцировать первичные и вторичные очаги, определять их функциональную активность и оптимизировать тактику лечения. Это особенно важно при планировании хирургического вмешательства. Кроме того, выявление наиболее активных эпилептогенных участков также может влиять на тактику ведения таких пациентов. Таким образом, ПЭТ/МРТ и ДК МРТ в сочетании с традиционными методами повышают точность топической диагностики и способствуют персонализированному лечению фармакорезистентной эпилепсии. Перспективным направлением является разработка алгоритмов автоматизированного анализа данных для стандартизации диагностического процесса.
Список литературы
1. Rugg-Gunn F, Miserocchi A, McEvoy A. Epilepsy surgery. Practical Neurology. 2020;20:4–14. https://doi.org/10.1136/practneurol-2019-002192
2. Mula M, Cock HR. More than seizures: improving the lives of people with refractory epilepsy. Eur J Neurol. 2015;22(1):24–30 https://doi.org/10.1111/ene.12603
3. Thijs RD, Surges R, O’Brien TJ, Sander JW. Epilepsy in adults. Lancet. 2019;393(10172):689–701. https://doi.org/10.1016/s0140-6736(18)32596-0
4. de Tisi J, Bell GS, Peacock JL, McEvoy AW, Harkness WF, Sander JW, et al. The long-term outcome of adult epilepsy surgery, patterns of seizure remission, and relapse: a cohort study. Lancet. 2011;378(9800):1388–95 https://doi.org/10.1016/s0140-6736(11)60890-8
5. Mathon B, Bielle F, Samson S, Plaisant O, Dupont S, Bertrand A, Miles R, Nguyen-Michel VH, Lambrecq V, Calderon-Garcidueñas AL, Duyckaerts C, Carpentier A, Baulac M, Cornu P, Adam C, Clemenceau S, Navarro V. Predictive factors of long-term outcomes of surgery for mesial temporal lobe epilepsy associated with hippocampal sclerosis. Epilepsia. 2017;58(8):1473–85. https://doi.org/10.1111/epi.13831
6. Felix Rosenow, Hans Lüders. Presurgical evaluation of epilepsy. Brain. 2001;124(9):1683–700. https://doi.org/10.1093/brain/124.9.1683
7. Männlin J, San Antonio-Arce V, Reinacher PC, Scheiwe C, Shah MJ, Urbach H, Schulze-Bonhage A. Safety profile of subdural and depth electrode implantations in invasive EEG exploration of drug-resistant focal epilepsy. Seizure. 2023;110:21–7. https://doi.org/10.1016/j.seizure.2023.05.022
8. Долгушин МБ, Наделяев РВ, Мартынов МЮ, Рублева ЮВ, Дворянчиков АВ, Бурд СГ и др. Микроструктурные изменения головного мозга у пациентов с фокальной височной эпилепсией по данным диффузионно-куртозисной МРТ. Журнал неврологии и психиатрии им. С.С. Корсакова. 2024;124(11):171–7. https://doi.org/10.17116/jnevro2024124111171
9. Kanber B, Vos SB, de Tisi J, et al. Detection of covert lesions in focal epilepsy using computational analysis of multimodal magnetic resonance imaging data. Epilepsia. 2021;62(3):807–16 https://doi.org/10.1111/epi.16836
10. Iwasaki M, Jin K, Nakasato N, Tominaga T. Non-invasive Evaluation for Epilepsy Surgery. Neurol Med Chir. 2016;56(10):632–40. https://doi.org/10.2176/nmc.ra.2016-0186
11. Shen Y, Gong Y, Ruan Y, Chen Z, Xu C. Secondary Epileptogenesis: Common to See, but Possible to Treat? Front Neurol. 2021;12:747372. https://doi.org/10.3389/fneur.2021.747372
12. Dalkilic EB. Neurostimulation Devices Used in Treatment of Epilepsy. Curr Treat Options Neurol. 2017;19(2):7 https://doi.org/10.1007/s11940-017-0442-9
13. Steven AJ, Zhuo J, Melhem ER. Diffusion kurtosis imaging: an emerging technique for evaluating the microstructural environment of the brain. AJR Am J Roentgenol. 2014;202(1):W26–33. https://doi.org/10.2214/ajr.13.11365
14. Bartoňová M, Bartoň M, Říha P, Vojtíšek L, Brázdil M, Rektor I. The benefit of the diffusion kurtosis imaging in presurgical evaluation in patients with focal MR-negative epilepsy. Sci Rep. 2021;11(1):14208. https://doi.org/10.1038/s41598-021-92804-w
15. Miller-Thomas MM, Benzinger TL. Neurologic Applications of PET/MR Imaging. Magn Reson Imaging Clin N Am. 2017;25(2):297–313. https://doi.org/10.1016/j.mric.2016.12.003
16. Jehi L. The Epileptogenic Zone: Concept and Definition. Epilepsy Curr. 2018;18(1):12–6. https://doi.org/10.5698/1535-7597.18.1.12
17. Spencer SS. Neural networks in human epilepsy: evidence of and implications for treatment. Epilepsia. 2002;43(3):219–27. https://doi.org/10.1046/j.1528-1157.2002.26901.x
18. Tóth M, Barsi P, Tóth Z. The role of hybrid FDG-PET/MRI on decision-making in presurgical evaluation of drug-resistant epilepsy. BMC Neurol. 2021;21(1):363. https://doi.org/10.1186/s12883-021-02352-z
19. Desikan RS, Ségonne F, Fischl B, et al. An automated labeling system for subdividing the human cerebral cortex on MRI scans into gyral based regions of interest. Neuroimage. 2006;31(3):968–80. https://doi.org/10.1016/j.neuroimage.2006.01.021
Об авторах
Р. В. НаделяевРоссия
Наделяев Ростислав Валерьевич
Москва
М. Б. Долгушин
Россия
Долгушин Михаил Борисович, д-р мед. наук
Москва
Т. М. Ростовцева
Россия
Ростовцева Татьяна Михайловна
Москва
Е. А. Баранова
Россия
Баранова Елена Анатольевна, канд. мед. наук
Москва
Ю. А. Воронкова
Россия
Воронкова Юлия Алексеевна
Москва
Э. Ю. Гаврилова
Россия
Гаврилова Эльмира Юрьевна
Москва
Ю. В. Рублева
Россия
Рублева Юлия Владимировна
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Наделяев Р.В., Долгушин М.Б., Ростовцева Т.М., Баранова Е.А., Воронкова Ю.А., Гаврилова Э.Ю., Рублева Ю.В. Гибридные методы лучевой диагностики в оценке эпилептогенных очагов: разбор диагностического случая. Медицина экстремальных ситуаций. 2025;27(2):176-182. https://doi.org/10.47183/mes.2025-240
For citation:
Nadelyaev R.V., Dolgushin M.B., Rostovtseva T.M., Baranova E.A., Voronkova Yu.A., Gavrilova E.Yu., Rubleva Yu.V. Hybrid imaging techniques in the assessment of epileptic foci: A clinical case. Extreme Medicine. 2025;27(2):176-182. https://doi.org/10.47183/mes.2025-240

















