Перейти к:
Применение альгинатного полимерного полисахаридного гемостатического гидрогеля при продолжающемся артериальном кровотечении из пептической язвы гастроэнтероанастомоза (клинический случай)
https://doi.org/10.47183/mes.2025-243
Аннотация
Введение. Проблема лечения гастродуоденальных кровотечений язвенной этиологии — одна из наиболее сложных в экстренной хирургии. Даже при использовании комбинированной технологии эндогемостаза продолжающегося артериального язвенного кровотечения частота рецидивных кровотечений может достигать 21,3%, что указывает на необходимость совершенствования технологий эндогемостаза кровоточащей гастродуоденальной язвы. В совершенствовании комбинированных технологий эндогемостаза перспективным представляется использование тройной терапии, включающей применение традиционных способов (обкалывание, коагуляция, клипирование) с дополнительным включением местных гемостатических систем.
Описание клинического случая. Описан клинический случай применения комбинированной технологии эндоскопического гемостаза продолжающегося артериального кровотечения из пептической язвы гастроэнтероанастомоза с применением обкалывания 5%ным раствором аминокапроновой кислоты с адреналином в сочетании с аргоноплазменной коагуляцией и пневмоинсуффляцией альгинатного полимерного полисахаридного гемостатического гидрогеля на источник кровотечения.
Выводы. Использование персонализированного подхода к эндоскопическому гемостазу артериального кровотечения из пептической язвы гастроэнтероанастомоза с применением альгинатного полимерного полисахаридного гемостатического гидрогеля в комплексной терапии позволило улучшить результаты лечения пациента: обеспечить окончательный гемостаз, избежать неотложной операции на «высоте» кровотечения и улучшить качество заживления язвенного дефекта.
Ключевые слова
Для цитирования:
Баранников С.В., Чередников Е.Ф., Полубкова Г.В., Банин И.Н., Болховитинов А.Е., Бережной С.И., Слюсарева Е.Е. Применение альгинатного полимерного полисахаридного гемостатического гидрогеля при продолжающемся артериальном кровотечении из пептической язвы гастроэнтероанастомоза (клинический случай). Медицина экстремальных ситуаций. 2025;27(2):235-242. https://doi.org/10.47183/mes.2025-243
For citation:
Barannikov S.V., Cherednikov E.F., Polubkova G.V., Banin I.N., Bolkhovitinov A.E., Berezhnoy S.I., Slyusareva E.E. Application of alginate polymer polysaccharide hemostatic hydrogel for ongoing arterial bleeding from peptic ulcer of gastroenteroanastomosis (A clinical case). Extreme Medicine. 2025;27(2):235-242. https://doi.org/10.47183/mes.2025-243
ВВЕДЕНИЕ
Язвенная болезнь желудка и двенадцатиперстной кишки (ЯБ) — широко распространенное заболевание, поражающее преимущественно пациентов молодого и трудоспособного возраста. Частота и распространенность ЯБ в Российской Федерации в период с 2006 по 2017 г. снизилась со 128,7 до 79,5 на 100 000 населения1. Однако частота осложнений ЯБ не имеет тенденции к снижению. Наиболее частым осложнением ЯБ является желудочно-кишечное кровотечение. Согласно данным главного хирурга Российской Федерации А.Ш. Ревишвили, в 2023 г. в России зарегистрировано 47 224 случая язвенных гастродуоденальных кровотечений (ЯГДК), общая летальность при которых составила от 1,49 до 17,81%, а послеоперационная летальность — 6,17–62,5%2.
Особую группу больных с гастродуоденальными кровотечениями составляют кровоточащие пептические язвы гастроэнтероанастомозов (ГЭА). Согласно статистическим данным в настоящее время частота постгастрорезекционных пептических язв составляет от 0,5 до 15%. При этом известно, что от 90 до 98% пептических язв ГЭА развиваются после резекции желудка, выполненной по поводу язв двенадцатиперстной кишки (ДПК). Основными причинами формирования пептических язв ГЭА являются: экономная резекция (менее ⅔) желудка; оставление части антральной слизистой оболочки желудка в культе ДПК при резекции по способу Бильрот-2; гипертонус блуждающих нервов и неполная ваготомия, если она выполнялась в сочетании с экономной резекцией желудка; неблагоприятное воздействие на слизистую культи желудка билиарного и панкреатического секрета при формировании анастомозов, отличных от отключенной по Ру петле. Особую проблему составляют осложнения пептических язв ГЭА, которые наблюдаются у 75–80% пациентов с данной патологией. Среди осложнений пептических язв ГЭА наиболее частым является желудочно-кишечное кровотечение [1][2].
Одной из наиболее сложных групп пациентов с кровоточащими гастродуоденальными язвами являются пациенты с продолжающимся артериальным кровотечением Forrest IA (Классификация интенсивности кровотечения J. Forrest [3]). Согласно эпидемиологическим данным этот тип кровотечения в структуре ЯГДК составляет около 7,7% случаев, однако лечение данных больных представляет существенные трудности для клинической медицины. В лечении таких больных крайне важно надежно остановить продолжающееся артериальное ЯГДК и создать условия для профилактики его возобновления [4][5].
Несмотря на развитие технологий эндоваскулярного гемостаза ЯГДК, по-прежнему ведущее значение в лечении таких больных принадлежит лечебной эндоскопии. Современные технологии эндоскопического гемостаза (ЭГ) продолжающегося артериального ЯГДК включают инъекционный, физический, механический и комбинированный ЭГ. Эндоскопическое обкалывание источника кровотечения различными растворами уменьшает или останавливает артериальное ЯГДК за счет сужения сосудов и местной тампонады. Эффективность инъекционного ЭГ при продолжающемся кровотечении достигает 85–92%. Однако инъекционную монотерапию не рекомендуют из-за ее временного эффекта и высокой частоты рецидивных кровотечений, достигающих 17,6–24,0%. Среди физических методов ЭГ особое место занимает аргоноплазменная коагуляция (АПК). Данный метод является бесконтактным и не сопровождается привариванием диатермозонда к коагуляционному струпу. Эффективность АПК при первичном ЭГ достигает 95–100%. В то же время метод АПК также не лишен недостатков: при нарушении техники коагуляции возможна перфорация стенки органа, как и при других коагуляционных методах, возможны рецидивы кровотечений, наблюдаемые в 12,5–25,0% случаев [6][7].
Одной из наиболее эффективных технологий ЭГ артериального ЯГДК является клипирование, заключающееся в сдавлении источника кровотечения металлической клипсой. Механизм ЭГ с применением клипс аналогичен механизму хирургического прошивания кровоточащего сосуда. Клипсу проводят через инструментальный канал эндоскопа и фиксируют клипатором на основании сосуда, при этом достигается надежная остановка кровотечения. Преимуществом клипирования считают его эффективность при кровотечениях из крупных аррозированных сосудов (более 2 мм в диаметре), а также высокую эффективность у пациентов с выраженной гипокоагуляцией. Однако к недостаткам клипирования следует отнести техническую сложность манипуляции. Кроме того, эндоклипсы сложно применять в труднодоступных анатомических областях, таких как малая кривизна желудка, кардия и задняя стенка ДПК. При использовании эндоклипс возможны рецидивы ЯГДК, наблюдаемые в 8–37% случаев [8][9].
Наиболее совершенной технологией ЭГ артериального ЯГДК в настоящее время считается комбинированный ЭГ. Часто используют обкалывание источника кровотечения с последующим клипированием аррозированного сосуда или обкалывание в сочетании с АПК. Комбинированная терапия (двойная терапия), то есть инфильтрация в сочетании с коагуляцией источника кровотечения либо механической компрессией с помощью гемоклипс, остается оптимальной эндоскопической терапией, рекомендованной в основных международных клинических рекомендациях по лечению пациентов с ЯГДК. Однако, согласно данным Н.В. Лебедева, даже при использовании комбинированных технологий ЭГ продолжающегося артериального ЯГДК частота рецидивных кровотечений может достигать 21,3%, что свидетельствует о необходимости совершенствования технологий ЭГ [9–11].
Перспективным методом ЭГ ЯГДК является использование гемостатических порошков и гелей. Гемостатические порошки абсорбируют кровь, оказывают механическое тампонирующее действие и активируют каскад свертывания крови [12]. Распространение в клинической практике получили эндоскопические порошкообразные системы Hemospray (TC-325) и EndoClot зарубежного производства. Однако время действия Hemospray и EndoClot ограничено менее чем 24 часами и они не способствуют регенерации тканей [13]. Следует отметить, что в Российской Федерации, в Воронежском городском специализированном центре по лечению больных с гастродуоденальными кровотечениями, накоплен большой опыт применения порошкообразных гранулированных сорбентов (Сефадекс®, Гелевин, Асептисорб® и др.) в лечении желудочно-кишечных кровотечений. При нанесении данных сорбентов на источник кровотечения формируется мягкоэластичный гель, сохраняющийся на поверхности дефектов до 4 суток, что способствует улучшению качества заживления гастродуоденальных язв. Однако, как показывают авторы, использование порошкообразных гемостатических систем в ЭГ продолжающегося артериального струйного ЯГДК имеет низкую эффективность [14].
Возможность применения гранулированного сорбента Диовин с гемостатиками Желпластан и Лиофилизат НовоСэвн® в комбинированном эндоскопическом лечении ЯГДК описали в своей работе М.Н. Романцов и соавт. Применение данной технологии позволило получить хорошие результаты: уменьшить риск рецидивов ЯГДК до 5,01% и снизить летальность до 1,7% [15].
Японские ученые T. Uraoka, N. Uedo et al. сообщают об успешном применении инновационной технологии ЭГ с использованием гелеобразного гемостатического матрикса при кровотечениях из желудочно-кишечного тракта после эндоскопической субмукозной диссекции. Гелеобразный гемостатический матрикс представляет собой вязкий прозрачный пептид, который после контакта с тканью или кровью образует герметизирующий слой. Применение данного матрикса снижает потребность в коагуляции для остановки гастродуоденального кровотечения [16].
В совершенствовании комбинированных технологий ЭГ ЯГДК перспективным представляется использование тройной терапии, включающей применение традиционных способов ЭГ (обкалывание, коагуляция, клипирование) с дополнительным включением в ЭГ местных гемостатических систем. Перспективной отечественной технологией комбинированного ЭГ ЯГДК является cпособ ЭГ кровоточащей гастродуоденальной язвы с использованием альгинатного полимерного полисахаридного гемостатического гидрогеля [17].
Ранее мы приводили результаты экспериментального исследования возможности применения альгинатного полимерного полисахаридного гемостатического гидрогеля (АППГГ) в лечении кровоточащих дефектов желудка [18] и первого опыта клинического применения АППГГ в комплексном эндоскопическом лечении нестабильно остановившегося язвенного кровотечения [19]. В настоящее время продолжается клиническое исследование по изучению возможности применения АППГГ в комбинированном ЭГ ЯГДК. В настоящей статье мы приводим описание использования АППГГ в комплексном лечении продолжающегося артериального ЯГДК у пациента с пептической язвой ГЭА.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Больной Я., 73 года, поступил 13.10.2024 в 7 часов 56 минут в экстренном порядке в приемное отделение БУЗ ВО «ВГКБСМП № 1» г. Воронежа.
При поступлении больной предъявлял жалобы на рвоту кровью со сгустками, черный жидкий «мазутообразный» кал, выраженную слабость, головокружение.
Считает себя больным с 1995 г., когда по поводу профузного кровотечения из язвы ДПК была проведена резекция ⅔ желудка по Бильрот-2. В период с 1995 по 2023 г. жалоб со стороны органов желудочно-кишечного тракта не предъявлял. В 2023 г. было выявлено кровотечение из пептической язвы ГЭА, по поводу которого лечился в хирургическом отделении г. Казани. Ухудшение состояния 13.10.2024: появилась выраженная слабость, головокружение, обморочное состояние, снижение АД до 90/60 мм рт. ст., черный жидкий стул и рвота кровью со сгустками. В анамнезе острый инфаркт миокарда, сахарный диабет 2-го типа, подагра; на постоянной основе принимает Аспирин®.
Объективные данные. Осмотр в противошоковом зале приемного отделения. При поступлении состояние больного тяжелое. Сознание ясное, по Шкале комы Глазго (ШКГ) 15 баллов, артериальное давление (АД) — 90/60 мм рт. ст., частота сердечных сокращений (ЧСС) — 110 в мин., частота дыхательных движений (ЧДД) — 18 в мин., SPO2 — 98%.
Общее состояние тяжелое, кожные покровы бледные. При аускультации легких по всем легочным полям везикулярное дыхание, хрипов нет. Тоны сердца приглушены, ритмичны. Язык сухой, обложен белым налетом. Живот не вздут. На передней брюшной стенке имеется старый послеоперационный рубец от верхне-средне-срединной лапаротомии. При пальпации живот мягкий, безболезненный во всех отделах. Инфильтраты в брюшной полости; печень, селезенка, почки не пальпировались. Перитонеальные симптомы отрицательные во всех отделах живота. При перкуссии печеночная тупость сохранена, смещаемое притупление в боковых отделах живота не определялось. Аускультативно выслушивали нормальные кишечные шумы. Симптом поколачивания по поясничной области отрицателен с обеих сторон. Per rectum: на перчатке следы жидкого черного кала. Поставлен назогастральный зонд, по зонду получена измененная кровь. Одновременно с проведением интенсивной терапии в приемном отделении проведены диагностические исследования: общий и биохимический анализы крови, исследование системы гемостаза, определение группы крови и резус- фактора, электрокардиографическое исследование, ультразвуковое исследование органов брюшной полости и осмотр терапевта.
Основной диагноз: пептическая язва гастроэнтероанастомоза с кровотечением (МКБ 10 — К28.4). Осложнение основного диагноза: кровопотеря тяжелой степени по А.И. Горбашко (1982 г.), постгеморрагическая анемия 3-й степени.
Сопутствующий диагноз: ишемическая болезнь сердца; кардиосклероз постинфарктный и атеросклеротический; атеросклероз аорты коронарных артерий; гипертоническая болезнь 3-й стадии; риск сердечно-сосудистых осложнений 4; хроническая сердечная недостаточность класс I, функциональный класс 1; сахарный диабет тип 2; индивидуальный целевой уровень HbA1c менее 7,5%; миокардиодистрофия; диабетическая полинейропатия; диабетическая энцефалопатия; подагра вне обострения.
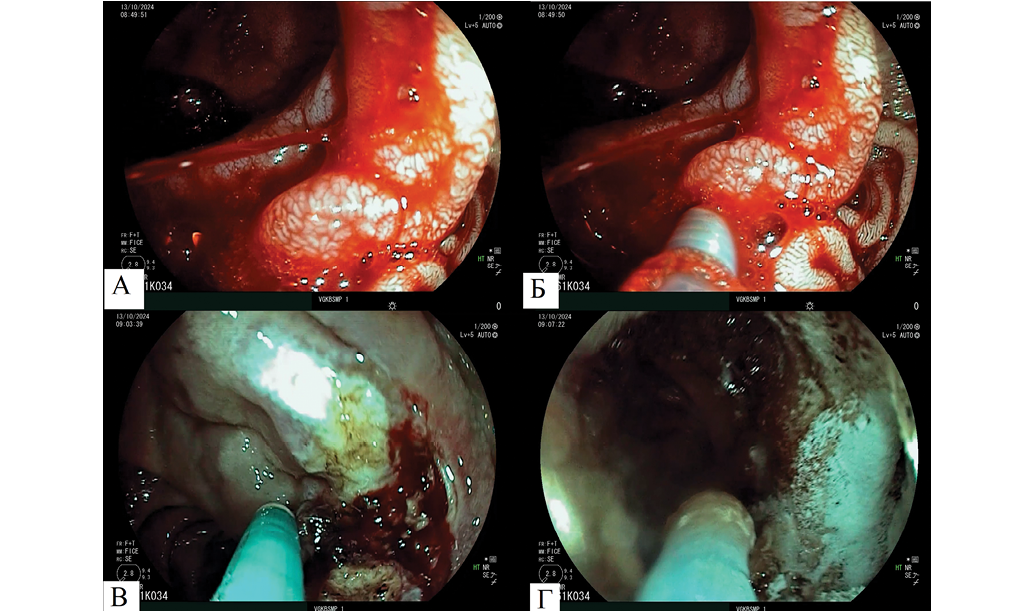
Медицинские вмешательства. В экстренном порядке (через 30 минут после поступления) выполнена неотложная эзофагогастродуоденоскопия (ЭГДС) (рис. 1).
При осмотре гастроэнтероанастомоза (резекция по типу Бильрот-2): культя желудка содержала умеренное количество измененной крови, за счет чего детальный осмотр был затруднен. Складки желудка невысокие, продольно извитые, воздухом расправляются. Перистальтика удовлетворительная, ровными волнами во всех отделах. Слизистая ближе к гастроэнтероанастомозу была покрыта свежей кровью. Гастроэнтероанастомоз широкий, свободно проходим, отмечалась неполная визуализация слизистой оболочки из-за остатков крови. В районе шпоры анастомоза отмечали струйное поступление крови из аррозированного сосуда 1,0 мм в диаметре, основание сосуда в поле зрения не выводили (рис. 1А). Паравазально в область анастомоза с помощью одноразового эндоскопического инъектора с диаметром иглы 0,7 мм и длиной иглы 4 мм был введен 5%-ный раствор аминокапроновой кислоты с 0,1%-ным раствором адреналина до создания инфильтрата (рис. 1Б). Активное кровотечение прекратилось. После отмывания на шпоре анастомоза выявлен плоскоповерхностный язвенный дефект 7 мм в диаметре, глубиной 1,5 мм, в дне которого фиксированный сгусток крови 5 мм в диаметре. Попытка ирригатором удалить сгусток и визуализировать аррозированный сосуд не дала эффекта. Провести клипирование технически не представлялось возможным.
Произведена АПК источника кровотечения через сгусток с помощью коагулятора электрохирургического с принадлежностями ERBE APC 2 (Elektromedizin): рабочий режим FORCED APC, мощность 30 ватт (макс), расход 1,0 л/мин; зонд для аргоноплазменной коагуляции — Flexible Argonsonde REF 932-149 (BOWA) диаметром 2,3 мм. После АПК отмечалось диффузное подтекание крови (рис. 1В). С целью достижения окончательного гемостаза на источник кровотечения с использованием эндоскопической помпы для нагнетания воздушной смеси (EndoClot Air Compressor, EPAC-2, EndoClot Plus. Inc., США) в режиме подачи воздуха 1,3 л/мин через эндоскопический катетер диаметром 2,5 мм произведена инсуффляция порошкообразного АППГГ в количестве 0,5 г. После инсуффляции на источник кровотечения при контакте с кровью и слизью порошкообразный гемостатик активно пропитался кровью, превратившись в гидрогель. Окончательный гемостаз достигнут, подтекание крови прекратилось (рис. 1Г).
Дальнейшее лечение пациента проведено в отделении реанимации и интенсивной терапии (ОРИТ). От проведения эндоскопического мониторинга после проведения ЭГ пациент отказался. Для контроля рецидива ЯГДК стоял назогастральный зонд.
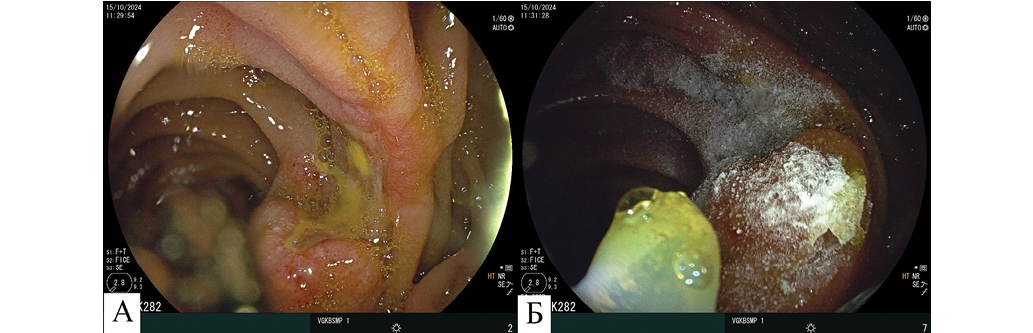
На 3-и сутки стационарного лечения (15.10.2024) произведена контрольная ЭГДС (рис. 2). Культя желудка содержала умеренное количество вспененной желчи. Крови, гематина нет. Язвенный дефект на шпоре анастомоза 0,7 см в диаметре, поверхностный, дно было закрыто альгинатным гидрогелем, пропитанным желчью (рис. 2А). Гидрогель удален, в дне язвенного дефекта содержался фибрин. С целью профилактики рецидива кровотечения и цитопротективного лечения на язвенный дефект с использованием эндоскопической помпы для нагнетания воздушной смеси в режиме подачи воздуха 1,3 л/мин через эндоскопический катетер диаметром 2,5 мм произведена инсуффляция АППГГ в количестве 0,5 г (рис. 2Б). Экспресс-тест на выявление Helicobacter pylori положительный. После динамической ЭГДС пациент переведен в общую палату.
В течение последующих 3 суток статус пациента без существенных изменений. На 6-е сутки стационарного лечения (18.10.2024) проведена контрольная ЭГДС (рис. 3).
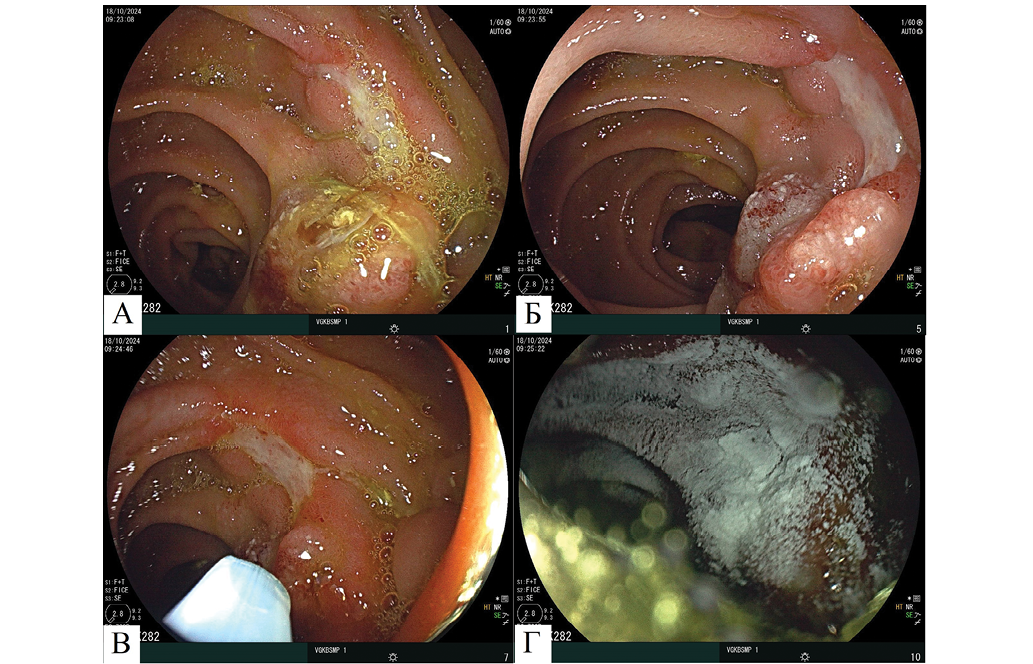
В осмотренных отделах культи желудка следов крови, гематина не выявлено (вспененная желчь). Язва шпоры гастроэнтероанастомоза уменьшилась в размерах до 5×4 мм, поверхностная, прикрыта прозрачным гидрогелем, пропитанным желчью (рис. 3А), после чего гидрогель был удален (рис. 3Б). Дно язвы покрыто фибрином с островками грануляционной ткани, наблюдалась краевая эпителизация.
С целью профилактики кровотечения и цитопротективного лечения с использованием эндоскопической помпы для нагнетания воздушной смеси в режиме подачи воздуха 1,3 л/мин через эндоскопический катетер диаметром 2,5 мм произведена инсуффляция АППГГ (рис. 3В, Г). Пациент выписан из стационара, направлен на амбулаторное лечение в поликлинику по месту жительства. 29.10.2024 на амбулаторном этапе лечения проведена контрольная ЭГДС (рис. 4).
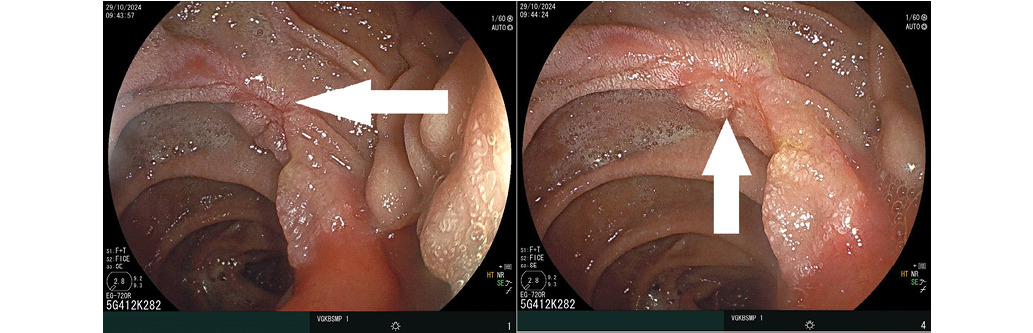
При осмотре: желудок резецирован по типу Бильрот-2, культя его небольшая, гастроэнтероанастомоз нешироко зияет. На шпоре гастроэнтероанастомоза нежный белесоватый линейной формы рубчик. У пациента установлен умеренный риск повторных гастродуоденальных кровотечений согласно цифровой программе «Профилактика гастродуоденальных кровотечений: индивидуализированная схема оценки фактов рисков, формирование рекомендаций по тактике ведения пациента» [20]. Пациенту даны персонализированные рекомендации по профилактике повторных гастродуоденальных кровотечений.
Фотография выполнена авторами
Рис. 1. Эндоскопические изображения гастроэнтероанастомоза, осмотр в белом свете: А — язвенный дефект гастроэнтероанастомоза с продолжающимся струйным кровотечением из аррозированного сосуда; Б — инъекционная компрессия аррозированного сосуда; В — аргоноплазменная коагуляция источника кровотечения; Г — инсуффляция АППГГ на язвенный дефект
Фотография выполнена авторами
Рис. 2. Эндоскопические изображения гастроэнтероанастомоза на 3-и сутки стационарного лечения, осмотр в белом свете: А — фиксированный АППГГ, пропитанный желчью, в области язвенного дефекта; Б — дополнительная инсуффляция АППГГ на язвенный дефект
Фотография выполнена авторами
Рис. 3. Эндоскопические изображения гастроэнтероанастомоза на 6-е сутки стационарного лечения, осмотр в белом свете: А — фиксированный АППГГ, пропитанный желчью, в области язвенного дефекта; Б — язвенный дефект на шпоре гастроэнтероанастомоза после отмывания АППГГ; В — начало инсуффляции АППГГ на язвенный дефект; Г — фиксированный АППГГ в области язвенного дефекта
Фотография выполнена авторами
Рис. 4. Эндоскопические изображения гастроэнтероанастомоза на 17-е сутки лечения, осмотр в белом свете. Стрелкой указан нежный белесоватый линейной формы рубчик на шпоре гастроэнтероанастомоза
ОБСУЖДЕНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Количество больных с ЯБ в Российской Федерации имеет выраженную тенденцию к снижению. Это происходит благодаря достижениям отечественной медицины: программе диспансеризации с широким охватом населения, доступности эндоскопического обследования, а также применению высокоэффективных схем лечения. Однако частота осложненных форм язвенной болезни, и прежде всего ЯГДК, в России сохраняется на высоком уровне и за последние годы не снижается3.
Современные достижения хирургии в вопросах лечения ЯГДК (применение ЭГ, совершенствование медикаментозного гемостаза, использование эндоваскулярного гемостаза и др.) значительно улучшили результаты лечения пациентов с ЯГДК. Однако в ситуации, когда ЯГДК не удается остановить с использованием консервативных методов, хирурги вынуждены проводить экстренные оперативные вмешательства в неблагоприятных условиях на «высоте» кровотечения. Основными видами оперативных вмешательств у таких пациентов является прошивание кровоточащего сосуда в язве и реже резекция желудка [21][22].
Сегодня уже ни у кого нет сомнения, что ведущая роль в лечении пациентов с ЯГДК принадлежит лечебной эндоскопии. Мировое сообщество активно занимается разработкой и применением локальных гемостатических систем в виде порошков, гелей и др. для ЭГ кровоточащей гастродуоденальной язвы [23]. Большинство современных порошкообразных эндоскопических систем — препараты зарубежного производства. Развитие отечественных технологий эндогемостаза является важным направлением в рамках программы технологического суверенитета и лидерства, что служит основанием для изучения возможности применения АППГГ в клинической практике.
Альгинатный полимерный полисахаридный гемостатический гидрогель является порошкообразным мелкодисперсным гемостатическим средством, производные которого — альгинат натрия, сорбат калия, бензоат натрия, йодоформ, трикальций фосфат. При контакте с кровоточащей поверхностью и слизью данный гемостатик превращается в гидрогель, плотно фиксирующийся в области источника кровотечения и обеспечивающий пролонгированный местный гемостаз. Предварительные экспериментальные исследования по применению АППГГ в лечении кровоточащих дефектов желудка показали, что его использование позволяет не только сократить время остановки экспериментального кровотечения, но и улучшить качество заживления дефектов верхнего отдела пищеварительного тракта, что подтверждено морфологическими исследованиями [18].
Важно отметить, что ЯБ — хроническое заболевание, поэтому крайне важный момент в лечении гастродуоденальных язв — качество заживления язвенного дефекта, так как, по утверждению Л.И. Аруина, «именно грубый рубец является патоморфологическим субстратом обострения ЯБ» [24].
В настоящей статье описан опыт применения АППГГ в комплексном лечении пациента. Анализируя данный клинический случай, следует отметить, что в сложной ситуации на фоне продолжающегося струйного артериального ЯГДК был произведен комбинированный ЭГ путем обкалывания источника кровотечения с последующей АПК аррозированного сосуда.
После АПК сохранялось диффузное подтекание крови, и врач-эндоскопист имел возможность продолжить АПК источника кровотечения. При этом всегда необходимо помнить, что интенсивная длительная коагуляция может приводить к перфорации стенки полого органа и развитию перитонита. Данное осложнение является крайне грозным и на фоне острой кровопотери зачастую может приводить к летальному исходу. Решить проблему подтекания крови и достижения окончательного гемостаза позволило нанесение АППГГ на кровоточащий дефект. Проведенные повторные ЭГДС установили отсутствие рецидива кровотечения и выраженные цитопротективные свойства АППГГ, который благодаря выраженным адгезивным свойствам удерживался на язвенном дефекте до 3 сут. ЭГДС на 6-е сутки позволила выявить признаки заживления язвенного дефекта в виде краевой эпителизации, а на 17-е сутки — полное заживление пептической язвы ГЭА в виде «нежного рубчика».
Резюмируя представленный клинический случай, можно заключить, что использование персонализированного подхода к эндоскопическому гемостазу артериального кровотечения из пептической язвы ГЭА у пациента с выраженной соматической патологией и высокой степенью операционного риска, применение АППГГ в комплексной терапии позволило улучшить результаты лечения пациента: обеспечить окончательный гемостаз, избежать неотложного оперативного вмешательства на «высоте» кровотечения и улучшить качество заживления язвенного дефекта. Данные аспекты крайне важны в лечении пациентов с ЯГДК с различной сопутствующей соматической патологией, у которых в случае невозможности остановки кровотечения консервативными методами приходится проводить оперативные вмешательства, зачастую заканчивающиеся летальными исходами.
ЗАКЛЮЧЕНИЕ
Таким образом, применение АППГГ в комплексном эндоскопическом лечении продолжающегося струйного язвенного ГДК позволило обеспечить надежный гемостаз, избежать развития рецидива кровотечения и неотложной операции. Следует отметить, что в настоящей публикации описан первый опыт применения данной технологии у пациента с продолжающимся артериальным кровотечением из пептической язвы ГЭА. Накопление данных и более детальный анализ на большей выборке пациентов в будущем позволит показать более надежные результаты возможности применения данной технологии ЭГ в клинической хирургической практике.
1. Клинические рекомендации «Язвенная болезнь». Министерство здравоохранения Российской Федерации; 2024.
2. Ревишвили АШ, Оловянный ВЕ, Гогия БШ, Гурмиков БН, Марков ПВ, Ручкин ДВ. и др. Хирургическая помощь в Российской Федерации. М., 2024.
3. Котова ЕГ, Кобякова ОС, Александрова ГА, Голубев НА, Оськов ЮИ, Поликарпов АВ, Шелепова ЕА. Заболеваемость всего населения России в 2021 году: статистические материалы. М.: ЦНИИОИЗ Минздрава России. 2022.
Список литературы
1. Черноусов АФ, Хоробрых ТВ, Богопольский ПМ. Хирургия язвенной болезни желудка и двенадцатиперстной кишки. М.: Практическая медицина; 2016.
2. Любивый ЕД, Ким ВЛ, Людовских ИВ, Евтихов АВ. Лечение пептической язвы гастроэнтероанастомоза, осложненной продолжающимся кровотечением. Наблюдение из практики. Вестник Балтийского федерального университета им. И. Канта. Серия: Естественные и медицинские науки. 2021;2:84–92. EDN: ZEZJTO
3. Forrest JA, Finlayson ND, Shearman DJ. Endoscopy in gastrointestinal bleeding. Lancet. 1974;2(7877):394–7. https://doi.org/10.1016/s0140-6736(74)91770-x
4. Barannikov SV, Cherednikov EF, Yuzefovich IS, Banin IN, Polubkova GV, Vysotskaya AT, et al. Modern Clinical and Epidemiological Features and New Technological Possibilities in the Treatment of Bleeding Gastroduodenal Ulcers. International Journal of Biomedicine. 2021;11(4):428–34. https://doi.org/10.21103/Article11(4)_OA6
5. Веденин ЮИ, Мандриков ВВ, Орешкин АЮ, Ногина АА, Михайличенко ГВ, Жуликова СВ. Эндоскопический гемостаз при желудочно-кишечных язвенных кровотечениях: регламентированный подход или личные предпочтения? Эндоскопическая хирургия.2024;30(3):29–33. https://doi.org/10.17116/endoskop20243003129
6. Lau JYW, Yu Y, Tang RSY, et al. Timing of Endoscopy for Acute Upper Gastrointestinal Bleeding. N Engl J Med. 2020;382(14):1299–308. https://doi.org/10.1056/NEJMoa1912484
7. Лебедев НВ, Климов АЕ, Бархударов АА. Гастродуоденальные язвенные кровотечения. Хирургия. Журнал им. Н.И. Пирогова. 2014;8:23–7.
8. Schmidt A, Gölder S, Goetz M, et al. Over-the-Scope Clips Are More Effective Than Standard Endoscopic Therapy for Patients With Recurrent Bleeding of Peptic Ulcers.Gastroenterology. 2018;155(3):674–86.e6. https://doi.org/10.1053/j.gastro.2018.05.037
9. Лебедев НВ, Климов АЕ, Мороз ВА. Гастродуоденальные кровотечения. М.: Бином; 2015.
10. Barkun AN, Almadi M, Kuipers EJ, et al. Management of Nonvariceal Upper Gastrointestinal Bleeding: Guideline Recommendations From the International Consensus Group. Ann Intern Med. 2019;171(11):805–22. https://doi.org/10.7326/M19-1795
11. Laine L, McQuaid KR. Endoscopic therapy for bleeding ulcers: an evidence-based approach based on meta-analyses of randomized controlled trials. Clin Gastroenterol Hepatol. 2009;7(1):33–2. https://doi.org/10.1016/j.cgh.2008.08.016
12. Aziz M, Weissman S, Mehta TI, et al. Efficacy of Hemospray in non-variceal upper gastrointestinal bleeding: a systematic review with meta-analysis. Ann Gastroenterol. 2020;33(2):145–54. https://doi.org/10.20524/aog.2020.0448
13. Lee AY, Cho JY. Advancements in hemostatic strategies for managing upper gastrointestinal bleeding: A comprehensive review. World J Gastroenterol. 2024;30(15):2087–90. https://doi.org/10.3748/wjg.v30.i15.2087
14. Cherednikov EF, Barannikov SV, Yuzefovich IS, Chernykh AV, Berezhnova TA, Polubkova GV, et al, Ovsyannikov ES, Shkurina IA. Modern Technologies of Endoscopic Hemostasis in the Treatment of Ulcer Gastroduodenal Bleeding: A Literature Review. International Journal of Biomedicine. 2022;12(1):9–18. https://doi.org/10.21103/Article12(1)_RA1
15. Романцов МН, Чередников ЕФ, Глухов АА, Фурсов КО. Новые технологии эндоскопического гемостаза в протоколе лечения пациентов с гастродуоденальными кровотечениями. Вестник экспериментальной и клинической хирургии. 2018;11(1):16–23. https://doi.org/10.18499/2070-478X-2018-11-1-16-23
16. Uraoka T, Uedo N, Oyama T, et al. Efficacy and Safety of a Novel Hemostatic Peptide Solution During Endoscopic Submucosal Dissection: A Multicenter Randomized Controlled Trial. Am J Gastroenterol. 2023;118(2):276–83. https://doi.org/10.14309/ajg.0000000000002060
17. Баранников СВ, Чередников ЕФ, Юзефович ИС, Банин ИН, Бондаренко АА, Малеев ЮВ. Способ эндоскопического гемостаза кровоточащей гастродуоденальной язвы. Патент № 2762120 C1; 2021. EDN: DSFKJA
18. Баранников СВ, Чередников ЕФ, Шишкина ВВ, Самойленко ТВ, Малеев ЮВ, Леонтьев АВ и др. Морфологические особенности заживления кровоточащих моделированных дефектов желудка при эндоскопическом лечении альгинатным полимерным полисахаридным гемостатическим гидрогелем. Доказательная гастроэнтерология. 2024;13(2):14–24. https://doi.org/10.17116/dokgastro20241302114
19. Баранников СВ, Чередников ЕФ, Полубкова ГВ, Воронцов АК, Малеев ЮВ, Болховитинов АЕ и др. Первый опыт применения альгинатного полимерного полисахаридного гемостатического гидрогеля в комплексном эндоскопическом лечении нестабильно остановившегося язвенного гастродуоденального кровотечения: клинические случаи. Кубанский научный медицинский вестник. 2024;31(3):73–92. https://doi.org/10.25207/1608-6228-2024-31-3-73-92
20. Банин ИН, Чередников ЕФ, Баранников СВ, Юзефович ИС. Профилактика гастродуоденальных кровотечений: индивидуализированная схема оценки фактов рисков, формирование рекомендаций по тактике ведения пациента Свидетельство о государственной регистрации программы для ЭВМ № 2023667560; 2023. EDN: BUHKEI
21. Tuerk E, Doss S, Polsley K. Peptic Ulcer Disease. Prim Care. 2023;50(3):351–62. https://doi.org/10.1016/j.pop.2023.03.003
22. Wang A, Yerxa J, Agarwal S, et al. Surgical management of peptic ulcer disease. Curr Probl Surg. 2020;57(2):100728. https://doi.org/10.1016/j.cpsurg.2019.100728
23. Lau LHS, Sung JJY. Treatment of upper gastrointestinal bleeding in 2020: New techniques and outcomes. Dig Endosc. 2021;33(1):83–94. https://doi.org/10.1111/den.13674
24. Аруин ЛИ. Качество заживления гастродуоденальных язв: функциональная морфология, роль методов патогенетической терапии. Экспериментальная и клиническая гастроэнтерология. 2006;5:40–50. EDN: PBZWJR
Об авторах
С. В. БаранниковРоссия
Баранников Сергей Викторович, канд. мед. наук
Воронеж
Е. Ф. Чередников
Россия
Чередников Евгений Федорович, д-р мед. наук
Воронеж
Г. В. Полубкова
Россия
Полубкова Галина Владимировна, канд. мед. наук
Воронеж
И. Н. Банин
Россия
Банин Игорь Николаевич, канд. мед. наук
Воронеж
А. Е. Болховитинов
Россия
Болховитинов Алексей Евгеньевич
Воронеж
С. И. Бережной
Россия
Бережной Сергей Игоревич
Воронеж
Е. Е. Слюсарева
Россия
Слюсарева Ева Евгеньевна
Воронеж
Дополнительные файлы
Рецензия
Для цитирования:
Баранников С.В., Чередников Е.Ф., Полубкова Г.В., Банин И.Н., Болховитинов А.Е., Бережной С.И., Слюсарева Е.Е. Применение альгинатного полимерного полисахаридного гемостатического гидрогеля при продолжающемся артериальном кровотечении из пептической язвы гастроэнтероанастомоза (клинический случай). Медицина экстремальных ситуаций. 2025;27(2):235-242. https://doi.org/10.47183/mes.2025-243
For citation:
Barannikov S.V., Cherednikov E.F., Polubkova G.V., Banin I.N., Bolkhovitinov A.E., Berezhnoy S.I., Slyusareva E.E. Application of alginate polymer polysaccharide hemostatic hydrogel for ongoing arterial bleeding from peptic ulcer of gastroenteroanastomosis (A clinical case). Extreme Medicine. 2025;27(2):235-242. https://doi.org/10.47183/mes.2025-243

















