Перейти к:
Биосовместимые гели на основе хитозана и крахмала в качестве чернил для 3D-печати
https://doi.org/10.47183/mes.2025-272
Аннотация
Введение. Носители, предназначенные для культивирования и трансплантации клеток, находят широкое применение в современной тканевой инженерии. Создание чернил для печати таких носителей позволяет в широких пределах варьировать их форму и архитектуру. Хитозан — природный полимер, который уже находит применение в различных областях регенеративной медицины. Скаффолды на его основе являются искусственным прототипом внеклеточного матрикса in vitro. Метод трехмерной печати позволит максимально приблизить структуру такого матрикса к свойствам нативной ткани. Однако для улучшения качества печати необходимо как разработать состав чернил на основе хитозана, так и подобрать оптимальные параметры печати.
Цель. Разработка биосовместимых чернил на основе хитозана с оптимальными реологическими свойствами, пригодными для 3D-печати.
Материалы и методы. В исследовании для создания биочернил применялся хитозан фирмы BiologHeppe (Германия) с молекулярной массой 164 кДа и степенью деацетилирования 92,5%. Для модификации биочернил использовали крахмал фирмы Merck (Германия). Для получения трехмерных матриц применяли метод экструзионной 3D-биопечати. В работе использовали 3D-биопринтер фирмы Rokit Invivo (Республика Корея), в котором установлено программное обеспечение Android OS. 3D-печатные матрицы изготавливали из биочернил с различным содержанием хитозана: 4 и 6%. Для исследования биосовместимости печатных конструкций проводили посев культуры мезенхимальных стволовых клеток кролика.
Результаты. Чернила на основе хитозана и крахмала продемонстрировали увеличение вязкости раствора и наилучшие характеристики напечатанных конструкций. Улучшение реологических параметров, оптимальных для печати, происходит при увеличении концентрации хитозана в растворе до 6%, а также при добавлении в раствор крахмала с аналогичной концентрацией. Исследование in vitro также показало биосовместимость напечатанных конструкций по отношению к мезенхимным стромальным клеткам.
Выводы. Разработанные чернила могут быть использованы для формирования скаффолдов методом трехмерной печати.
Для цитирования:
Малик Е.А., Нащекина Ю.А., Барсук И.А., Головко К.П., Александров В.Н., Елоховский В.Ю., Юдин В.Е. Биосовместимые гели на основе хитозана и крахмала в качестве чернил для 3D-печати. Медицина экстремальных ситуаций. 2025;27(1):88-96. https://doi.org/10.47183/mes.2025-272
For citation:
Malik E.A., Nashchekina Y.A., Barsuk I.A., Golovko K.P., Alexandrov V.N., Elokhovskiy V.Y., Yudin V.E. Biocompatible chitosan- and starch-based gels for 3D printable inks. Extreme Medicine. 2025;27(1):88-96. https://doi.org/10.47183/mes.2025-272
ВВЕДЕНИЕ
Аддитивные технологии, в число которых входит 3D-печать, являются движущей силой крупных инноваций во многих областях науки, в том числе в медицине и биологии.
В качестве материала для печати используются различные полимеры природного и синтетического происхождения, а созданные на их основе конструкции могут стать базой для изготовления функциональных трехмерных тканей [1]. Эти биоматериалы называются чернилами, они имитируют состав тканей человеческого или животного организма. Преимуществом 3D-печати является возможность воспроизведения геометрии трехмерной структуры, которая более похожа на естественную биологическую систему, чем двухмерная in vitro модель. Структурное сходство напечатанной конструкции может привести к более физиологически релевантным функциональным результатам. Ни одна другая технология не может обеспечить такого уровня геометрической сложности и подобия живым тканям [2].
3D-печать может применяться для создания объемных трехмерных носителей, обеспечивающих трехмерное культивирование клеток с целью их дальнейшей трансплантации в поврежденные органы и ткани [2]. Напечатанные конструкции вместе с культивируемыми на них клетками могут быть использованы в качестве моделей тканей для тестирования новых лекарственных препаратов [3].
Параметры биопечати можно определить как настройки биопринтера (входные данные встроенного программного обеспечения — ПО), которые необходимы для правильного создания 3D-печатных структур. В этом смысле для 3D-печати подходит только определенный диапазон значений, а их выбор является ключевым фактором для получения жизнеспособных структур. Эти значения зависят от состава чернил, который следует тщательно подбирать в каждом конкретном случае [4].
К основным параметрам печати относят температуру диспенсера, температуру подложки, скорость печати и параметры входящего потока (скорость и давление). Скорость печати (движение в плоскости XY) важна, поскольку она напрямую связана с общим временем 3D-печати. Кроме того, при методе экструзионной печати поток гидрогеля (ширина нити) контролируется преимущественно за счет скорости печати и скорости ретракции. Используемые значения скорости печати варьируют от 0,2 до 150 мм/с, но наиболее часто находятся в диапазоне 1–30 мм/с [4].
Точные размеры напечатанной 3D-структуры сохраняются при правильном выборе входящего потока, который указывается в процентах. Этот параметр отвечает за количество чернил, экструдируемых принтером. Калибровка входящего потока также улучшает настройки ретракции [4].
К основным свойствам чернил для 3D-печати относятся пригодность для печати, вязкоупругие свойства, биодеградируемость, цитосовместимость [5]. 3D-матрица должна имитировать биологическую среду и облегчать клеточное прикрепление, пролиферацию и рост клеток, способствовать диспергированию биоактивных молекул и факторов роста, а также содержать пространство для размещения внеклеточного матрикса [6].
В качестве чернил могут использоваться как природные, так и синтетические полимеры, однако предпочтение отдается природным материалам из-за их высокой биосовместимости, хотя они часто обладают недостаточными механическими свойствами [7]. Наиболее часто применяемыми компонентами в чернилах являются хитозан и альгинат, далее — желатин, гиалуроновая кислота, фиброин шелка и полиэтиленгликоль [8]. Гидрогели могут имитировать, например, модуль упругости мягких тканей человеческого тела. Для самых прочных тканей, таких как кости или зубы, требуются другие материалы — термопластичные полимеры с добавлением гидрогелей [8].
Хитозан является одним из перспективных материалов для 3D-печати. Хитозан имеет три типа реакционноспособных функциональных групп: аминогруппы, а также первичные и вторичные гидроксильные группы в положениях С-2, С-3 и С-6 соответственно. Положительный заряд его функциональных групп делает хитозан единственным положительно заряженным природным полисахаридом. Следовательно, хитозан может взаимодействовать с отрицательно заряженными биомолекулами, липидами, белками, дезоксирибонуклеиновой кислотой (ДНК) и различными клеточными рецепторами, которые запускают каскад взаимосвязанных реакций в живых организмах, что обусловливает его уникальные характеристики [9]. Примером таких характеристик биочернил на основе хитозана являются хорошее взаимодействие клеток и матрицы, имитация структуры нативной ткани, создание микросреды для обмена кислородом и питательными веществами, а также благоприятный иммунный ответ после имплантации.
По данным авторов J. Huang, H. Fu et al., 3D-печатные структуры проявляли биомолекулярную адаптацию, стабильную биосовместимость и биологическую активность даже после различных постпечатных модификаций [10]. Однако хитозан обладает и некоторыми недостатками, такими как медленная скорость гелеобразования, термолабильность и низкая механическая прочность материалов на его основе.
Важно отметить, что физическая стабильность и механическая прочность чернил для 3D-печати зависят от их вязкоупругих свойств. Обеспечить вязкоупругие свойства хитозана можно за счет физических или химических методов сшивания, а также путем добавления дополнительных компонентов. Поэтому хитозан часто структурно армируется другим биополимером, в том числе полисахаридами. В качестве такого армирующего биополимера может быть использован крахмал [11]. Крахмал состоит из углеводов и обладает такими свойствами, как гидрофильность, биосовместимость, низкая стоимость, хорошая биоразлагаемость и нетоксичность [12]. Крахмал состоит из зернистой формы с линейной амилозой и большим количеством разветвленного амилопектина. Структура крахмала является полукристаллической, в которой добавление ограниченного количества воды и обработка теплом и сдвигом приведут к разрушению водородной связи. На этой стадии крахмал расплавится, и это приведет к образованию термопластичного крахмала. Таким образом, мы предположили, что сочетание таких биосовместимых и биодеградируемых биополимеров, как хитозан и крахмал, компенсирует недостатки каждого биополимера в отдельности, а их совместное использование позволит получить чернила с оптимальными характеристиками для формирования носителей с заданными структурными характеристиками методом 3D-печати. Для получения прогнозируемого результата, а именно матриц с заданными структурными характеристиками, такими как размер и высота ячеек, необходимо определить оптимальное соотношение хитозана и крахмала, а также точные параметры печати.
Цель исследования — разработка биосовместимых чернил с оптимальным соотношением хитозана и крахмала, пригодных для 3D-печати.
МАТЕРИАЛЫ И МЕТОДЫ
Для получения чернил использовали хитозан (BiologHeppe, Германия) с молекулярной массой 164 кДа и степенью деацетилирования 92,5% и крахмал (9005-25-8, ХЧ, Merck, Германия).
В работе использовали мезенхимальные стволовые клетки (МСК), полученные из жировой ткани кролика по методике [13][14] и предоставленные Центром клеточных технологий Института цитологии РАН. Жировую ткань промывали в фосфатно-солевом буфере, затем обрабатывали коллагеназой и после инактивации коллагеназы клетки центрифугировали. Культивирование клеток проводили в питательной среде α-MEM (модифицированная среда «Игла») с добавлением L-глютамина, 10% бычьей эмбриональной сыворотки и антибиотиков 100 ед./мл пенициллина, 100 мкг/мл стрептомицина (все реактивы Gibco, США). В работе использовали клетки 4–9 пассажей.
Методика приготовления раствора
Для получения матрицы на основе чистого хитозана и хитозана с добавлением крахмала применяли следующую методику. Хитозан перемешивали с водой при комнатной температуре в течение 15 мин на лабораторной мешалке (OSC-10L, Россия) при скорости перемешивания 1000 об/мин для получения суспензии, в которую затем добавили уксусную кислоту (в концентрации 97%, 2% от объема раствора), а также крахмал в концентрации от 0 до 6%.
Состав перемешивали в течение 1,5 ч на лабораторной мешалке (OSC-10L, Россия) со скоростью 1000 об/мин до полного растворения хитозана. Растворы с добавлением крахмала в течение 15 минут дополнительно перемешивали при температуре 100 °C на водяной бане для набухания крахмала. Объем хитозана, крахмала и уксусной кислоты рассчитывали в массовых процентах. Содержание хитозана и крахмала в растворе варьировали. Составы растворов представлены в таблице 1. Названия растворов представлены в формате Х/К (4/0), где Х — хитозан, К — крахмал, а в скобках — концентрация хитозана/концентрация крахмала.
Таблица 1. Расчетные концентрации хитозана и крахмала в растворах
Растворы | Концентрация хитозана, % | Концентрация крахмала, % |
Х/К (4/0) | 4 | 0 |
Х/К (6/0) | 6 | 0 |
Х/К (4/4) | 4 | 4 |
Х/К (6/6) | 6 | 6 |
Таблица составлена авторами по собственным данным
Реология растворов
Зависимость сдвиговой вязкости гидрогелей от скорости деформации измеряли на реометре AntonPaar (модель Physica MCR-301, Австрия) в измерительном узле конус/плоскость СP25 [d = 1 mm] в сдвиговом и динамическом режимах в режимах падения и роста скорости деформации (круговой частоты). Проведен тест на релаксацию вязкости при двух скоростях сдвига: 100 и 0,01 с–1.
3D-биопечать
Для получения трехмерных матриц применяли метод экструзионной 3D-биопечати. В работе использовали 3D-биопринтер фирмы Rokit Invivo (Республика Корея), в котором установлено программное обеспечение Android OS.
Для создания дизайна объемной матрицы использовали компьютерную программу для проектирования Autodesk Fusion 360, в которой создали параллелепипед со сторонами 16, 10 и 0,2 мм.
Для задания настроек 3D-принтера и преобразования созданной модели в G-код использовали программу для слайсинга NewCreator K.
Скорость печати (мм/с) — это линейная скорость движения печатного столика. Входящий поток (%) — это давление, оказываемое на гель в шприце. Выбранные параметры печати представлены в таблице 2.
Таблица 2. Параметры печати для растворов
Растворы | Скорость печати, мм/с | Входящий поток, % |
Х/К (4/0) | 1–5 | 25–75 |
Х/К (6/0) | 1–5 | 75–125 |
Х/К (4/4) | 3–7 | 125–175 |
Х/К (6/6) | 3–7 | 125–175 |
Таблица составлена авторами по собственным данным
В результате 3D-биопечати получали объемные матрицы. Далее их осаждали в 10% растворе гидроксида натрия в течение 5 мин, после чего промывали дистиллированной водой для удаления остатков щелочи. После этого обрабатывали 96% этанолом для дополнительной стерилизации и еще раз промывали дистиллированной водой.
Анализ качества печати
Основным параметром, описывающим качество печати, в данной работе является пригодность для печати (strand printability, SP), которая рассчитывается по формуле 1:
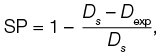
где Dexp — экспериментальный диаметр напечатанных полос (мм);
Ds — теоретически найденный стандартный диаметр (мм).
Экспериментальный диаметр напечатанного волокна измеряли в программе ImageJ. Затем рассчитывали пригодность для печати по формуле 1.
Результат печати считали удовлетворительным при SP = 1 ± 0,1 [12].
В качестве стандартного диаметра Ds принимали диаметр сопла печатающей головки, равный 0,9 мм.
Измерение Dexp проводили 30 раз для каждого образца на разных участках матрицы с помощью программы ImageJ. Значения диаметра получали путем сравнения измеренной величины с эталоном.
Культивирование клеточных культур in vitro
Для исследования биосовместимости печатных конструкций проводили посев культуры мезенхимальных стволовых клеток кролика на все напечатанные матрицы. Для этого в каждую чашку Петри добавили по 300 мкл суспензии с клетками с концентрацией 5×105 мкл–1. Далее инкубировали при 37 °С в течение 40 мин. После этого к каждому образцу добавляли по 8 мл готовой питательной среды, содержащей питательную среду α-MEM (модифицированная среда «Игла») с добавлением L-глютамина, 10% бычьей эмбриональной сыворотки и антибиотиков (100 ед./мл) пенициллина, 100 мкг/мл стрептомицина (все реактивы Gibco, США).
Культивирование клеток осуществляли в асептических условиях при постоянной температуре 37 °С, концентрации СО2 5% и влажности 98%. Для анализа взаимодействия клеток с матрицами были сделаны фотографии через 1 ч, 1, 3 и 7 дней от начала исследования. Все эксперименты проводились в 3–5 повторностях. Прижизненная визуализация клеток проведена с помощью фотофиксации камерой Nikon (США); размерная шкала 200 мкм.
Статистический анализ
Статистический анализ выполнен с использованием программного обеспечения Microsoft Excel, для оценки статистически значимых различий между конкретными образцами использовали t-тест Стьюдента. Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Данные динамической вязкости образцов с разной концентрацией хитозана и крахмала демонстрируют увеличение вязкости раствора полимера с увеличением в растворе концентрации хитозана, а также концентрации крахмала, что вполне естественно (рис. 1). Переход от высокой скорости сдвига (100 с–1), которая имитирует движение раствора полимера в сопле экструдера, к низкой скорости сдвига (0,01 с–1), которая имитирует состояние раствора на столике печатного устройства, демонстрирует наиболее высокую способность восстановления и сохранения формы изделия для состава Х/К (6/6).
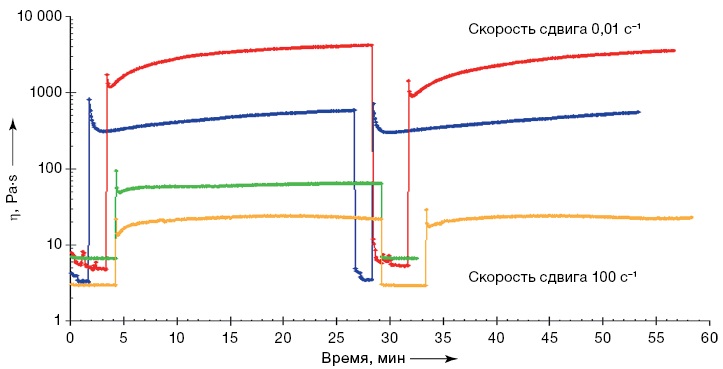
Рисунок подготовлен авторами по собственным данным
Рис. 1. Динамическая вязкость гидрогелей с разным соотношением хитозана/крахмала (ось X (time t) — время, мин; ось Y (η) — сдвиговая вязкость (Pa·s или Па·с)
Примечание: желтый цвет линии — содержание в растворе 4% хитозана; зеленый цвет линии — содержание в растворе 4% хитозана и 4% крахмала в соотношении 1:1; синий цвет линии — содержание в растворе 6% хитозана; красный цвет линии — содержание в растворе 6% хитозана и 6% крахмала в соотношении 1:1.
В первой части эксперимента изменяли скорость печати при постоянном входящем потоке. Во второй части изменяли величину входящего потока при постоянной скорости печати.
На рисунках 2–5 изображены гистограммы, с помощью которых визуально оценивали отношение стандартного диаметра, то есть диаметра сопла (0,9 мм, светлые столбцы), к экспериментальному диаметру (яркие столбцы). Гистограммы с голубыми столбцами 2А — с изменяющейся скоростью, с фиолетовыми 2Б — с изменяющимся входящим потоком. Над столбцами подписаны значения среднего экспериментального диаметра с учетом погрешности. Над гистограммами — фотографии исследуемых образцов. Их делали с одинаковой высоты рядом с миллиметровой бумагой, что позволяет оценить реальные размеры матрицы и рассчитать экспериментальные диаметры.
Результаты показали, что наиболее приближенные значения экспериментального диаметра к стандартному для раствора с содержанием хитозана 4% и крахмала 4% (Х/К– 4/4) удалось получить при установке скорости печати 3 мм/м, а входящего потока — 50%. Соответствующие данные представлены на рисунке 2.
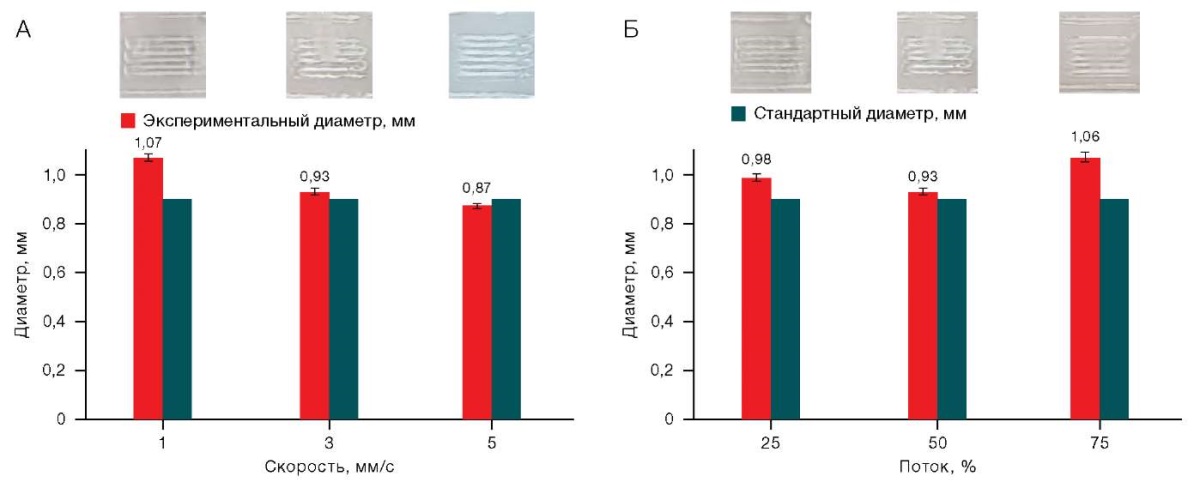
Рисунок подготовлен авторами по собственным данным
Рис. 2. Влияние скорости печати (А) и величины потока (Б) на качество печати для раствора Х/К (4/0)
Для раствора Х/К (6/0) точное значение экспериментального диаметра было достигнуто только при установке скорости печати 3–5 мм/с и входящего потока 100%. Как и в предыдущем случае, данный диапазон можно считать достаточно узким. Соответствующие данные представлены на рисунке 3.
Рисунок подготовлен авторами по собственным данным
Рис. 3. Влияние скорости печати (А)(А) и величины потока (А)(Б) на качество печати для раствора Х/К (6/0)
Для раствора Х/К (4/4) получили широкий диапазон настроек, при которых экспериментальный диаметр достаточно близок к стандартному: 3–5 мм/с при 150% входящего потока и 5 мм/с при 175% входящего потока. Данные представлены на рисунке 4.
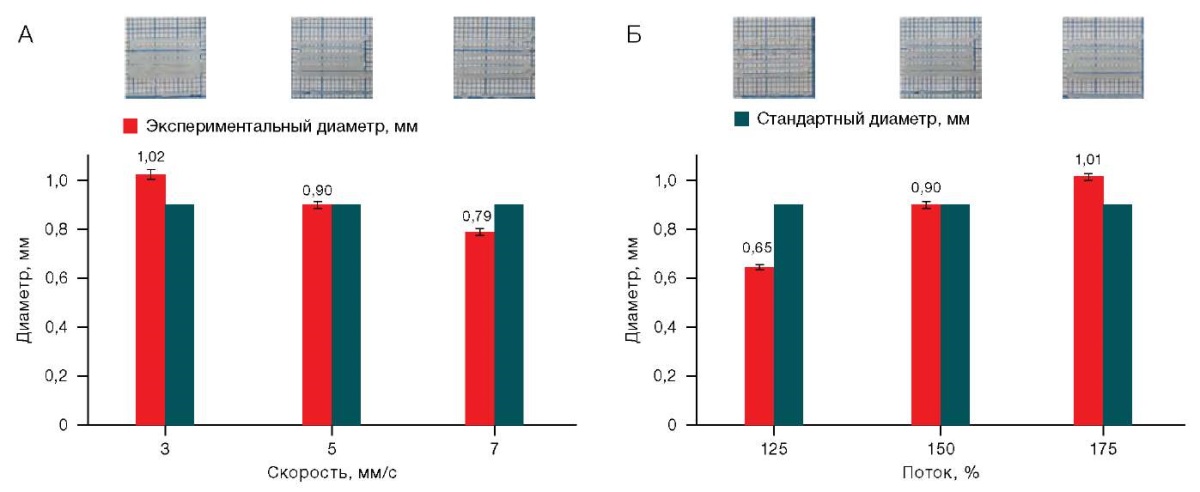
Рисунок подготовлен авторами по собственным данным
Рис. 4. Влияние скорости печати (А)(А) и величины потока (А)(Б) на качество печати для раствора Х/К (4/4)
Значение экспериментального диаметра в образце Х/К (6/6) оказалось самым стабильным (рис. 5) при изменении параметров печати. Таким образом, достаточно точной печати (близости реальных размеров теоретическим) можно добиться при установке скорости печати от 3 до 7 мм/с при величине входящего потока от 125 до 150%.
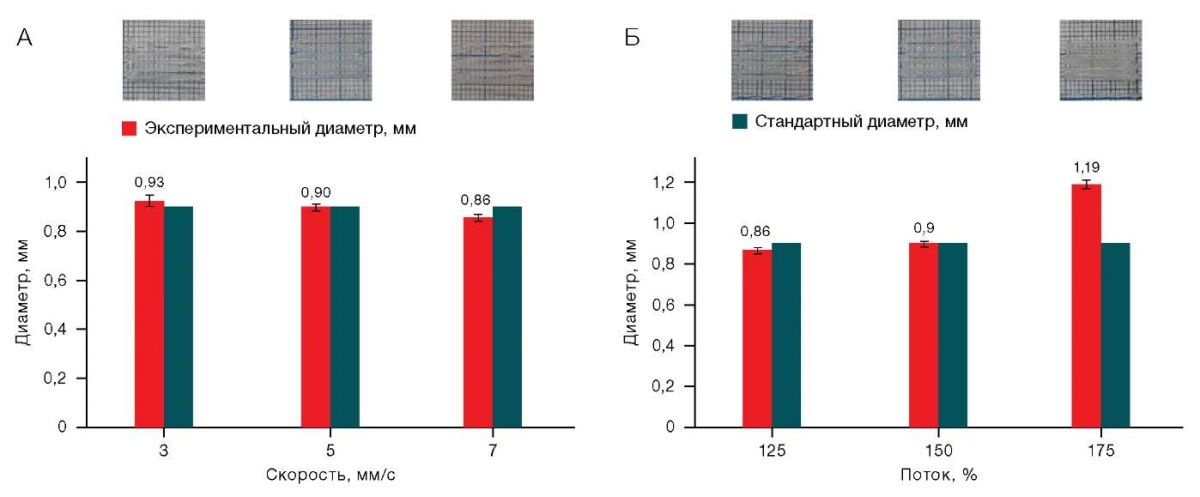
Рисунок подготовлен авторами по собственным данным
Рис. 5. Влияние скорости печати (А)(А) и величины потока (А)(Б) на качество печати для раствора Х/К (6/6)
В таблице 3 представлены результаты вычислений пригодности для печати всех образцов.
Таблица 3. Влияние скорости печати и входящего потока на пригодность для печати чернил на основе растворов хитозана и крахмала
Растворы | Скорость потока, мм/с | Входящий поток, % | Пригодность для печати |
Х/К (4/0) | 1 | 50 | 1,19 ± 0,12 |
3 | 50 | 1,03 ± 0,13 | |
5 | 50 | 0,97 ± 0,10* | |
3 | 25 | 1,09 ± 0,13♦ | |
3 | 75 | 1,18 ± 0,14 | |
Х/К (6/0) | 1 | 100 | 1,34 ± 0,12 |
3 | 75 | 0,84 ± 0,10 | |
3 | 125 | 1,15 ± 0,12 | |
5 | 100 | 0,92 ± 0,10 | |
3 | 100 | 1,00 ± 0,10 | |
Х/К (4/4) | 5 | 175 | 1,13 ± 0,14 |
7 | 150 | 0,88 ± 0,12 | |
3 | 150 | 1,14 ± 0,15 | |
5 | 150 | 1,00 ± 0,12 | |
5 | 125 | 0,72 ± 0,10 | |
Х/К (6/6) | 3 | 150 | 1,03 ± 0,16 |
5 | 125 | 0,96 ± 0,13 | |
5 | 150 | 1,00 ± 0,13 | |
7 | 150 | 0,95 ± 0,12 | |
5 | 175 | 1,32 ± 0,16■ |
Таблица составлена авторами по собственным данным
Примечание: * p < 0,01; ♦ p < 0,001; ■ p < 0,0001.
Приемлемыми считали значения, близкие к 1,0 ± 0,1. Во всех группах наблюдали снижение пригодности для печати до 0,9 при увеличении скорости печати или снижении входящего потока, а в предельных случаях — нарушение целостности печатаемой конструкции. При понижении скорости печати и повышении входящего потока экспериментальный диаметр становится больше приемлемого, то есть значение пригодности для печати превышало 1,1. В некоторых случаях встречается слияние полос, что делает невозможным определение экспериментального диаметра и пригодности для печати.
Можно считать удовлетворительным результат при повышении скорости печати до 5 мм/с (p < 0,01) при том же значении входящего потока. Следовательно, наблюдали достаточно узкий диапазон настроек, при котором экспериментальный диаметр близок к стандартному.
При установке значения входящего потока меньше среднего (25%, p < 0,001) зафиксировали превышение экспериментального диаметра над стандартным, что не соответствует результатам всех остальных групп. Данное отклонение может быть объяснено неравномерным распределением биочернил по площади печатаемой конструкции из-за плохой адгезии к стеклу.
При увеличении входящего потока до 175% (p < 0,0001) экспериментальный диаметр превышает допустимые значения (напечатанные линии толще, чем требуется).
Таким образом, можно сделать общий вывод: при повышении скорости печати и снижении входящего потока независимо друг от друга наблюдали уменьшение толщины печатаемой линии. Обратное отмечали при понижении скорости печати и повышении входящего потока.
Пригодность для печати повышается при одновременном увеличении скорости печати и входящего потока для растворов с более высокой вязкостью (рис. 1), таких как Х/К (4/4), Х/К (6/6). Кроме того, для этих растворов характерен широкий диапазон параметров, при которых пригодность для печати близка к 1, а значит, реальные размеры матриц достаточно близки к теоретическим. Использование растворов с меньшей плотностью (Х/К (4/0), Х/К (6/0)) в качестве биочернил требует более тщательного выбора настроек печати. Для таких растворов удалось подобрать только одно значение входящего потока, при котором пригодность для печати близка к 1.
В течение 7 дней МСК культивировали как на поверхности матриц, так и рядом с напечатанными филаментами.
На рисунке 6 представлены результаты культивирования МСК спустя 1 ч после посева. Возле матрицы Х/К (4/0) и на ее поверхности МСК образуют агрегаты (рис. 6А). На рисунке 6Б видно, что клетки распределены равномерно по поверхности чашки, небольшое скопление присутствует на поверхности матрицы. Наибольшее количество клеток наблюдали на матрице Х/К (4/4) (рис. 6В), при этом клетки были сконцентрированы и не агрегировали. На рисунке 6Г наблюдали неравномерное распределение клеток при их большой концентрации на поверхности матрицы Х/К (6/6).

Фотографии выполнены авторами
Рис. 6. Результаты культивирования МСК через 1 ч после посева: А — матрица Х/К (4/0); Б — матрица Х/К (6/0); В — матрица Х/К (4/4); Г — матрица Х/К (6/6)
На рисунке 7 изображены фотографии, сделанные через 1 день после посева. На рисунке 7А наблюдали распластанность клеток на поверхности чашки, в то время как на поверхности матрицы Х/К (4/0) клетки образовывали крупные неприкрепленные агрегаты. В случае использования матрицы Х/К (6/0) (рис. 7Б) отмечали большую концентрацию клеток вблизи поверхности. Как и в предыдущем случае, на самой матрице клеток было значительно меньше. На рисунке 7В наблюдали большое количество не распластанных клеток на поверхности матрицы Х/К (4/4). На чашке Петри клетки распластались на некотором расстоянии от матрицы. Матрица Х/К (6/6) имеет очень неоднородную структуру, что видно на рисунке 7Г, по которой сложно оценить количество клеток. Между напечатанными полосами концентрация клеток низкая.
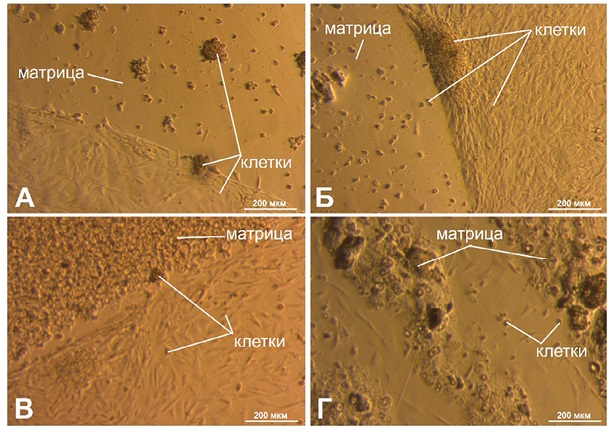
Фотографии выполнены авторами
Рис. 7. Результаты культивирования МСК через 1 день после посева: А — матрица Х/К (4/0); Б — матрица Х/К (6/0); В — матрица Х/К (4/4); Г — матрица Х/К (6/6)
На рисунке 8 приведены фотографии, сделанные через 3 дня после посева. На рисунках 8А и 8Г наблюдали распластанность клеток на поверхности чашки Петри. На поверхности матриц Х/К (4/0) и Х/К (6/0) (рис. 8А и Б) клетки в небольшой концентрации и не распластаны. На рисунке 8В наблюдали клетки на поверхности матрицы Х/К (4/4) в высокой концентрации. На рисунке 8Г видно, что клетки распластались на расстоянии от поверхности матрицы Х/К (6/0).
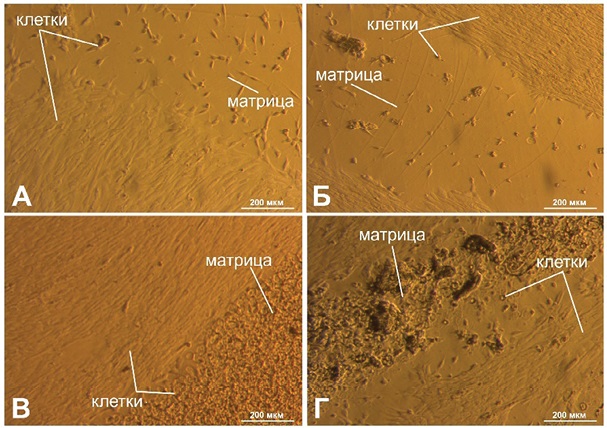
Фотографии выполнены авторами
Рис. 8. Результаты культивирования МСК через 3 дня после посева: А — матрица Х/К (4/0); Б — матрица Х/К (6/0); В — матрица Х/К (4/4); Г — матрица Х/К (6/6)
На рисунке 9 представлены результаты культивирования МСК спустя 7 дней после посева. На рисунке 9 (А–В) видно, что клетки распластаны по поверхности чашки Петри и плотно прилегают к поверхности образцов по бокам. Таким образом, можно сделать предположение о биосовместимости матриц. С другой стороны, на рисунке 9Г клетки адгезируют на некотором расстоянии от матрицы Х/К (6/6), что делает ее наименее предпочтительной для использования. Клетки не распластались по поверхности ни одной из матриц, но наибольшее их количество наблюдается на матрице Х/К (4/4), что может говорить о положительном результате добавления крахмала.

Фотографии выполнены авторами
Рис. 9. Результаты культивирования МСК через 7 дней после посева: А — матрица Х/К (4/0); Б — матрица Х/К (6/0); В — матрица Х/К (4/4); Г — матрица Х/К (6/6)
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования были разработаны чернила на основе хитозана и крахмала, подходящие для 3D-биопечати. Показано, что увеличение концентрации хитозана в растворе до 6%, а также добавление крахмала способствует увеличению динамической вязкости и способствует быстрому восстановлению и сохранению формы раствора полимера во времени после его вытекания из сопла экструдера. В процессе выполнения экспериментальной работы подобраны оптимальные параметры печати, а именно скорость и входящий поток, которые позволили создать полимерные матрицы с контролируемыми характеристиками структуры. Предварительные эксперименты in vitro продемонстрировали биосовместимость полученных конструкций по отношению к мезенхимным стромальным клеткам человека, что позволяет рассчитывать на использование подобных полимерных композиций при разработке раневых покрытий для лечения поврежденных кожных покровов.
Список литературы
1. Borah A, Kumar DS. Overcoming the barriers of two-dimensional cell culture systems with three-dimensional cell culture systems: Techniques, drug discovery, and biomedical applications. Biomedical Product and Materials Evaluation. 2022;7:179–229. https://doi.org/10.1016/B978-0-12-823966-7.00003-7
2. Pai RR, Sekar JA, Ajit S, Velayudhan S, Kasoju N, Kumar A. Three-dimensional bioprinting of tissues and organs. Biomedical Product and Materials Evaluation. 2022;5:135–50. https://doi.org/10.1016/B978-0-12-823966-7.00018-9
3. Chircov C, Grumezescu AM. Three-dimensional bioprinting in drug delivery. Materials for Biomedical Engineering. 2019;2:19–40. https://doi.org/10.1016/B978-0-12-816913-1.00002-7
4. Mancha Sánchez E, Gómez-Blanco JC, López Nieto E, et al. Hydrogels for Bioprinting: A Systematic Review of Hydrogels Synthesis, Bioprinting Parameters, and Bioprinted Structures Behavior. Frontiers in Bioengineering and Biotechnology. 2020;8:776. https://doi.org/10.3389/fbioe.2020.00776
5. Mukherjee P, Rani A, Saravanan P. Polymeric Materials for 3D Bioprinting. 3D Printing Technology in Nanomedicine. 2019;4:63–81. https://doi.org/10.1016/B978-0-12-815890-6.00004-9
6. Iordache F. Bioprinted Scaffolds. Materials for Biomedical Engine-ering: Hydrogels and Polymer-based Scaffolds. 2019;2:35–60. https://doi.org/10.1016/B978-0-12-816901-8.00002-X
7. Goel A, Meher MK, Gulati K, Poluri KM. Fabrication of Biopolymer-Based Organs and Tissues Using 3D Bioprinting. 3D Printing Technology in Nanomedicine. 2019;3:43–62. https://doi.org/10.1016/B978-0-12-815890-6.00003-7
8. Islam MM, Shahruzzaman M, Biswas S, Nurus Sakib M, Rashid TU. Chitosan based bioactive materials in tissue engineering applications-A review. Bioactive Materials. 2020;5(1):164–83. https://doi.org/10.1016/j.bioactmat.2020.01.012
9. Rajabi M, McConnell M, Cabral J, Ali MA. Chitosan hydrogels in 3D printing for biomedical applications. Carbohydrate Polymers. 2021;260:117768. https://doi.org/10.1016/j.carbpol.2021.117768
10. Huang J, Fu H, Wang Z, Meng Q, Liu S, Wang H et al. BMSCs-laden gelatin/sodium alginate/carboxymethyl chitosan hydrogel for 3D bioprinting. RSC Advances. 2016;6(110):108423–30. https://doi.org/10.1039/C6RA24231F
11. Butler HM, Naseri E, MacDonald DS., Tasker AR, Ali Ahmadi A. Optimization of starch- and chitosan-based bio-inks for 3D bioprinting of scaffolds for neural cell growth. Materialia. 2020;(12):100737. https://doi.org/10.1016/j.mtla.2020.100737
12. Ghosh S, Gutierrez V, Fernández C, Rodriguez-Perez M, Viana JC, Reis RL, Mano JF. Dynamic mechanical behavior of starch-based scaffolds in dry and physiologically simulated conditions: effect of porosity and pore size. Acta Biomaterialia. 2008;4(4):950–9. https://doi.org/10.1016/j.actbio.2008.02.001
13. Krawczenko A, Klimczak A. Adipose Tissue-Derived Mesenchymal Stem/Stromal Cells and Their Contribution to Angiogenic Processes in Tissue Regeneration. International Journal of Molecular Sciences. 2022:23(5):2425. https://doi.org/10.3390/ijms23052425
14. Naghieh S, Sarker M, Sharma NK, Barhoumi Z, Chen X. Printability of 3D Printed Hydrogel Scaffolds: Influence of Hydrogel Composition and Printing Parameters. Applied Sciences. 2020;10(1):292. https://doi.org/10.3390/app10010292
Об авторах
Е. А. МаликРоссия
Малик Елена Андреевна
Санкт-Петербург
Ю. А. Нащекина
Россия
Нащекина Юлия Александровна - канд. биол. наук
Санкт-Петербург
И. А. Барсук
Россия
Барсук Илья Александрович
Москва; Санкт-Петербург
К. П. Головко
Россия
Головко Константин Петрович - д-р мед. наук, доцент
Санкт-Петербург
В. Н. Александров
Россия
Александров Виктор Николаевич - д-р мед. наук, профессор
Санкт-Петербург
В. Ю. Елоховский
Россия
Елоховский Владимир Юрьевич - канд. тех. наук
Санкт-Петербург
В. Е. Юдин
Россия
Юдин Владимир Евгеньевич - д-р физ.-мат. наук, профессор
Санкт-Петербург
Дополнительные файлы
Рецензия
Для цитирования:
Малик Е.А., Нащекина Ю.А., Барсук И.А., Головко К.П., Александров В.Н., Елоховский В.Ю., Юдин В.Е. Биосовместимые гели на основе хитозана и крахмала в качестве чернил для 3D-печати. Медицина экстремальных ситуаций. 2025;27(1):88-96. https://doi.org/10.47183/mes.2025-272
For citation:
Malik E.A., Nashchekina Y.A., Barsuk I.A., Golovko K.P., Alexandrov V.N., Elokhovskiy V.Y., Yudin V.E. Biocompatible chitosan- and starch-based gels for 3D printable inks. Extreme Medicine. 2025;27(1):88-96. https://doi.org/10.47183/mes.2025-272

















