Перейти к:
Возможности применения отдельных метаболитов цикла трикарбоновых кислот у спортсменов (обзор литературы)
https://doi.org/10.47183/mes.2025-288
Аннотация
Введение. Многие метаболиты цикла трикарбоновых кислот (цикл Кребса, ЦТК) применяются в медицине. Развитие методов химического синтеза и удешевление производства отдельных метаболитов ЦТК делает их перспективными субстанциями для создания средств повышения адаптационного потенциала организма человека.
Цель. Выявление физиологических эффектов основных метаболитов ЦТК, позволяющих использовать продукцию на их основе для медико-биологического обеспечения спортсменов.
Обсуждение. На основе анализа литературы изучены физиологические эффекты субстратов энергетического обмена — метаболитов ЦТК, которые применяются в спортивной медицине. В настоящее время нашли обоснованное применение сукцинат, цитрат, малат, оксалоацетат. В ряде исследований отмечался антикатаболический эффект альфа-кетоглутарата, но уровень доказательности его недостаточен. Перспективным для использования в спортивной медицине, но недостаточно изученным на настоящий момент является изоцитрат.
Выводы. Физиологические эффекты большинства основных метаболитов ЦТК позволяют использовать продукцию на их основе в качестве антигипоксантов, антиоксидантов, нейропротекторов, средств коррекции метаболизма. Ряд метаболитов ЦТК являются перспективными субстанциями для создания новой продукции для медико-биологического обеспечения спортсменов, но их физиологические эффекты требуют дополнительного изучения.
Ключевые слова
Для цитирования:
Яшин Т.А., Гришина Ж.В., Парастаев С.А., Жолинский А.В. Возможности применения отдельных метаболитов цикла трикарбоновых кислот у спортсменов (обзор литературы). Медицина экстремальных ситуаций. 2025;27(2):249-256. https://doi.org/10.47183/mes.2025-288
For citation:
Yashin T.A., Grishina Zh.V., Parastaev S.A., Zholinsky A.V. Applicability of individual metabolites of the tricarboxylic acid cycle in athletes (A literature review). Extreme Medicine. 2025;27(2):249-256. https://doi.org/10.47183/mes.2025-288
ВВЕДЕНИЕ
В современной спортивной медицине актуальным направлением является поиск новых безопасных веществ, способных оптимизировать обменные процессы у атлетов на фоне высоких профессиональных нагрузок. Снижение частоты возникновения нарушений энергетического обмена при глубоких изменениях гипоксического и ишемического характера может быть достигнуто благодаря своевременному применению антигипоксантов, непосредственно влияющих на окислительно-восстановительные процессы [1–3].
В качестве средств, препятствующих возникновению нарушений энергетического обмена на фоне профессиональных спортивных нагрузок, представляет интерес группа веществ, относящихся к метаболитам цикла трикарбоновых кислот (ЦТК, цикл Кребса, цикл лимонной кислоты).
Цикл трикарбоновых кислот является центральным путем превращения органических кислот при анаэробном окислении глюкозы в клетке с выделением энергии в форме АТФ, играет ключевую роль в клеточном дыхании, являясь основным источником энергии в аэробных условиях1. Глюкоза в анаэробных условиях окисляется до пировиноградной кислоты (ПВК), которая под действием ферментов превращается в ацетил-коэнзим А (ацетил-КоА), с которого начинается ЦТК (рис. 1).
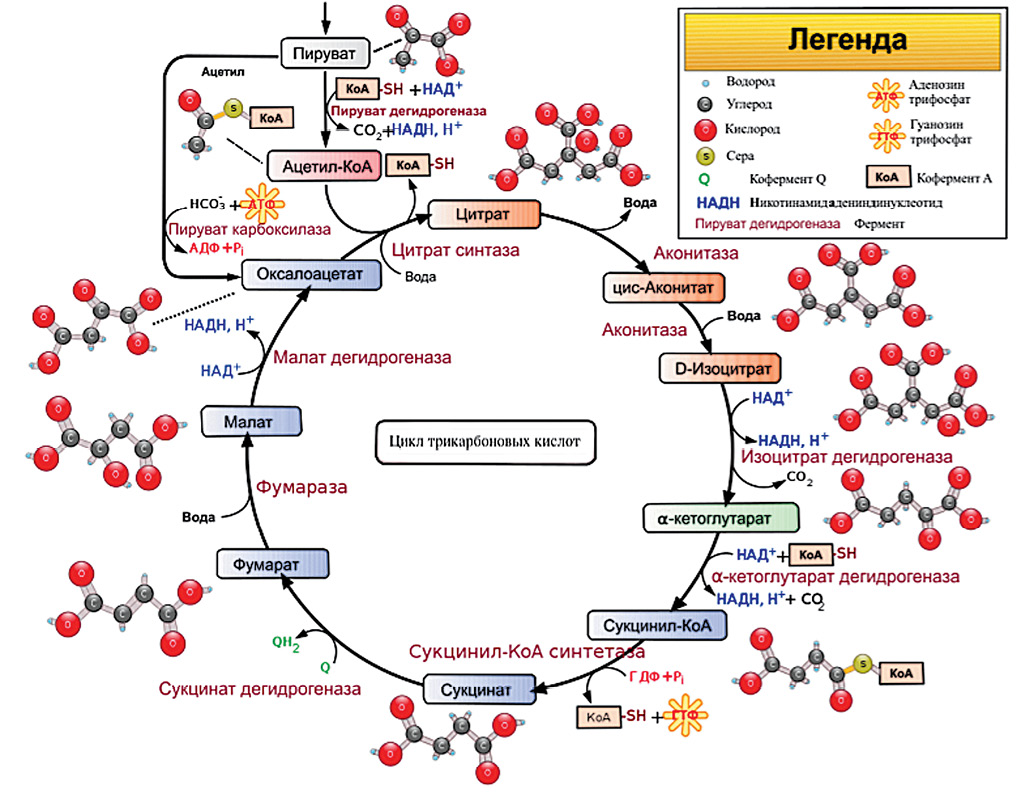
Рисунок подготовлен авторами по данным источника2
Рис. 1. Схема цикла трикарбоновых кислот
У спортсменов ЦТК имеет свои особенности: так, во время физических упражнений с интенсивностью выше 50% от максимального потребления кислорода (МПК) наблюдается увеличение общей концентрации промежуточных продуктов ЦТК в скелетных мышцах. Это явление носит название «анаплероз» [4–6]. Анаплероз, как правило, связан с увеличением активности фермента аланинаминотрансфераза (АЛТ) за счет повышенной доступности пирувата, когда в результате гликолиза скорость его образования превышает скорость окисления: глутамат + пируват ↔ аланин + альфа-кетоглутарат. Одна из ведущих на настоящий момент гипотез возникновения явления анаплероза на фоне спортивных нагрузок заключается в том, что наблюдаемое увеличение пула промежуточных продуктов ЦТК в мышцах необходимо для достижения высоких темпов обеспечения аэробного пути энергообразования. Вот почему увеличение пула промежуточных продуктов ЦТК с помощью экзогенного добавления отдельных метаболитов ЦТК может являться фактором улучшения пиковой окислительной способности мышц, что особенно актуально для профессиональных спортсменов [5][6].
Цель исследования — выявление физиологических эффектов основных метаболитов ЦТК, позволяющих использовать продукцию на их основе для медико-биологического обеспечения спортсменов.
МАТЕРИАЛЫ И МЕТОДЫ
Поиск научной литературы выполнен в электронных библиографических базах данных на русском (eLibrary, CyberLeninka) и английском (Web of Science, Scopus, PubМed) языках. Поисковые запросы включали в себя слова: цикл Кребса; трикарбоновые кислоты; цикл трикарбоновых кислот; энергообмен; субстраты энергетического обмена; спорт высших достижений; антиоксиданты; антигипоксанты; изолимонная кислота. Глубина поиска составила 30 лет. Критериями включения было наличие данных о результатах рандомизированных контролируемых исследований, в том числе данных доклинических исследований.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Цикл трикарбоновых кислот является центральным звеном энергетического метаболизма клетки. Ряд веществ, относящихся к метаболитам ЦТК, нашли свое применение в медицине в целом и в спортивной медицине в частности. Подобные средства актуальны для использования спортсменами, в том числе с целью повышения адаптационного потенциала организма, оптимизации энергопродукции в мышечных клетках, защиты организма от воздействия различных неблагоприятных факторов на фоне повышенных нагрузок. Далее приводится обобщенная информация по метаболитам ЦТК.
Лимонная кислота (цитрат) — первый метаболит ЦТК, который образуется при конденсации двух молекул ПВК3. При повышенном содержании глюкозы образуется большое количество цитрата, при этом происходит ингибирование фермента фосфофруктокиназы и замедление гликолиза, что для клетки энергетически выгодно, т.к. высокие концентрации цитрата указывают на наличие большого запаса молекул-предшественников, поэтому фосфофруктокиназа не отправляет молекулы фруктозо-6-фосфата в гликолиз и происходит экономия энергетических субстратов [7].
Препараты лимонной кислоты и ее солей достаточно широко используются в медицине. Например, цитраты используются для ощелачивания мочи (в качестве альтернативы бикарбонату натрия) в условиях, когда по показаниям здоровья желательно поддержание ее pH на щелочном уровне в течение определенного промежутка времени. Это свойство производных лимонной кислоты актуально в отношении спортсменов, у которых на фоне приема препаратов на их основе происходит повышение буферной емкости жидких сред организма и в связи с этим отложенное наступление утомления из-за снижения уровня кислотности в организме [8][9].
Цитрат проявляет также свойства антиоксиданта, обладая синергическим действием с витамином Е [8][9]. Использование цитрата способствует ослаблению нагрузки на компоненты антиоксидантной системы организма (АОС), что проявляется снижением активности ферментов супероксиддисмутазы (СОД), каталазы, глутатионпероксидазы, уровня восстановленного глутатиона, а также активности некоторых НАДФН-генерирующих ферментов, в том числе при напряженной физической работе [8]. Кроме этого, цитрат способен проявлять цитопротекторные свойства и выступать активатором биосинтеза жирных кислот и поставщиком ацетильных фрагментов для восстановления мембран клеток [7]. Еще одним важным свойством цитрата является его способность удерживать магний внутри митохондрий, защищая тем самым их от повреждения [9, 10]. Все вышеперечисленные физиологические свойства цитрата и его производных делают использование препаратов на его основе актуальным на фоне высоких нагрузок на организм, характерных для профессионального спорта.
Следующий важный метаболит ЦТК — изоцитрат (изолимонная кислота, ИЛК). ИЛК синтезируется из лимонной кислоты через промежуточную цис-аконитовую кислоту под действием фермента аконитазы. Считается, что именно реакция превращения изолимонной кислоты в альфа-кетоглутарат является реакцией, лимитирующей скорость протекания всего ЦТК. Несмотря на этот факт, изолимонная кислота на сегодня является одним из наименее изученных метаболитов ЦТК в отношении влияния на организм человека. Долгое время изоцитрат использовался только в качестве специфического биохимического реагента для анализа активности аконитатгидратазы, NAD-изоцитратдегидрогеназы, NADP-изоцитратдегидрогеназы, изоцитратлиазы и других ферментов [11][12]. Относительно недавно ИЛК начала изучаться как природное профилактическое и терапевтическое средство, была описана ее эффективность в терапии железодефицитной анемии и при терапевтическом тромболизисе [12].
В ряде исследований была продемонстрирована эффективность применения изолимонной кислоты при анемии, возникающей при хронических заболеваниях и воспалительных процессах (anemia of chronic disease and inflammation, ACDI), а также на фоне профессиональных спортивных нагрузок [13][14]. При помощи изоцитрата можно терапевтически манипулировать эритропоэзом без использования препаратов железа. Это особенно актуально в тех случаях, когда нагрузка организма железом нежелательна или неэффективна [13, 14].
В экспериментальной модели на крысах были продемонстрированы антиоксидантные свойства изоцитрата: было обнаружено, что монокалиевая соль изоцитрата является более эффективным антиоксидантом, чем аскорбиновая кислота. Монокалиевая соль изоцитрата также смягчала нейротоксический эффект солей свинца и молибдена, уменьшала угнетение обучения и памяти у крыс, отравленных тяжелыми металлами, и противодействовала окислительному стрессу, вызванному тяжелыми металлами [15].
В работе С.А. Прибыловой и соавт. был продемонстрирован стресс-протекторный эффект на фоне 10-суточного приема изолимонной кислоты при антигипертензионной терапии. Этот эффект, вероятно, связан с влиянием изоцитрата на процессы возбуждения и торможения в ЦНС. Также в работе был отмечен антигипертензивный эффект, выражающийся в достоверном снижении среднесуточного диастолического артериального давления при приеме изолимонной кислоты; этот эффект ранее в литературе не описан [16].
Кроме того, в контроле ЦТК при физических упражнениях центральное место отводится ферменту изоцитратдегидрогеназе (IDH) [17]. Изоформы IDH играют важную роль в защите клеток от окислительного повреждения благодаря реакции прямого окислительного декарбоксилирования и в качестве источника NADPH [17].
Еще одна область исследования физиологических эффектов изоцитрата — его антигипоксические эффекты. Гипоксия по-разному влияет на ферменты, участвующие в ЦТК. В частности, в условиях гипоксии аконитаза подавляется, тогда как IDH не затрагивается или активируется. Было показано, что IDH необходима для альтернативных метаболических путей, которые поддерживают функцию клеток в условиях гипоксии. Предполагается, что добавление экзогенного изоцитрата снимает ингибирование аконитазы и служит субстратом IDH для обеспечения альтернативного источника энергии при гипоксии [18][19]. Данный эффект изоцитрата может использоваться в видах спорта, в которых присутствуют гипоксические условия, а также при тренировках в горах.
Изоцитрат является перспективным веществом для создания препаратов и специализированной пищевой продукции для применения в медико-биологическом обеспечении спортсменов. Однако для обоснованного применения данной органической кислоты в спортивной медицине требуется дальнейшее изучение ее влияния на организм, в том числе на фоне повышенных физических и психоэмоциональных нагрузок.
Альфа-кетоглутаровая кислота (альфа-кетоглутарат, АКГ, 2-оксоглутарат) является важным промежуточным продуктом в ЦТК, идущим после изоцитрата до сукцинил-КоА [15][19]. Анаплеротические реакции могут пополнять ЦТК на этом этапе путем синтеза альфа-кетоглутарата в результате переаминирования глутамата или под действием глутаматдегидрогеназы. Другая функция этого метаболита заключается в предотвращении перегрузки клеток азотом благодаря тому, что альфа-кетоглутарат соединяется с избыточным азотом и направляет его в цикл мочевины [19]. Кроме этого, альфа-кетоглутарат вступает в реакцию переаминирования с глутамином с образованием возбуждающего нейромедиатора глутамата. Затем глутамат может быть декарбоксилирован (требуется витамин B6) в тормозной нейромедиатор гамма-аминомасляную кислоту (ГАМК) [20].
В исследованиях H. Yamamoto et al. на мышах было показано, что альфа-кетоглутаровая кислота проявляет антиоксидантные свойства и может предотвратить повреждение митохондриальной ДНК, вызванное свободными радикалами в нервных клетках [21].
Альфа-кетоглутаровая кислота также может функционировать как сигнальная молекула, регулируя функцию G-белка. Сигнализация через этот путь мобилизует внутриклеточный Ca2+, который действует как диффузионный второй мессенджер, регулирующий широкий спектр жизненно важных функций клеток, включая клеточный метаболизм и рост, а также деление и дифференциацию клеток [22]. Также есть исследования, демонстрирующие эффективность АКГ в ускорении восстановления тканей после хирургических вмешательств, травм и ожогов [19][23].
Как предшественник глутамина альфа-кетоглутарат является молекулой с высоким потенциалом при коррекции состояний с повышенным катаболизмом белка, возникающих в том числе на фоне длительных аэробных нагрузок у спортсменов. Было показано, что добавка АКГ улучшает азотистый баланс организма, поддерживает уровень анаболических гормонов и гормоноподобных соединений (инсулина, гормона роста и инсулиноподобного фактора роста) на фоне хирургических вмешательств, травм и ожогов [23]. Помимо этого, было показано, что АКГ способствовал защите клеток печени от повреждений и предотвращению снижения активности семейства цитохрома P-450. Данный эффект гепатопротектора также может быть актуален в спортивной медицине [23].
Описанный в ряде работ положительный эффект от применения альфа-кетоглутаровой кислоты на метаболизм в костной ткани предполагает его потенциальное применение в профилактике нарушений формирования костного матрикса, в лечении заболеваний с прогрессирующей потерей костной массы, таких как остеопороз, или в улучшении костной массы организма, что также актуально для профессиональных спортсменов [24].
В исследовании Y. Yuan et al. было показано, что значительное накопление АКГ в крови является метаболическим сигналом результативности упражнений на сопротивление. Интересно, что его уровень в плазме крови отрицательно коррелирует с индексом массы тела. В данной работе на мышах in vivo установлено, что повышение циркулирующего в крови АКГ, вызванного его экзогенным поступлением в организм, способствует гипертрофическим изменениям мышечной ткани, термогенезу за счет бурого жира и липолизу белого жира. Также было обнаружено, что он стимулирует высвобождение адреналина. Результаты данных исследований показывают недооцененный механизм АКГ в качестве молекулы в стимуляции надпочечников для гипертрофии мышц и потери жира в упражнениях на сопротивление [25].
В настоящее время в практике спортивной медицины АКГ используется в сочетании с аминокислотой L-аргинин в качестве компонента специализированной пищевой продукции, имеющей общее название «AAKG». В отдельных работах были выявлены анаболизирующие и антикатаболические эффекты от применения AAKG [26]. Однако в настоящее время из-за недостаточной изученности и ограниченного числа исследований на спортсменах AAKG относится к специализированной пищевой продукции, имеющей малую степень доказательной эффективности при использовании в профессиональном спорте [27].
Янтарная кислота (ЯК, сукцинат) образуется из альфа-кетоглутарата через сукцинил-КоА. Все метаболические пути, которые взаимосвязаны с ЦТК, включая метаболизм углеводов, аминокислот, жирных кислот, холестерина и гема, зависят от временного образования сукцината.
Сукцинат может выходить из митохондриального матрикса и функционировать как в цитоплазме, так и во внеклеточном пространстве, изменяя паттерны экспрессии генов, модулируя эпигенетический ландшафт или демонстрируя гормоноподобную сигнализацию. Например, в адипоцитах сигнальный каскад, активируемый сукцинатом, ингибирует липолиз. Чаще всего передача сигналов сукцинатом происходит в ответ на гипоксические условия [26].
Окисляясь, сукцинат монополизирует дыхательную цепь, что приводит к быстрому ресинтезу АТФ клетками и более выраженно, чем другие субстраты ЦТК, повышает количество восстановленных митохондриальных НАД+, стимулируя протекание восстановительного синтеза в клетке и поддерживая транспорт кальция. Его положительное влияние на функции органов связано с энергизирующим воздействием на функциональное состояние структур, оказывающих центральное регуляторное действие [28].
Этот метаболит является точкой повторного входа для шунта ГАМК в ЦТК, в котором синтезируется и перерабатывается ГАМК, чем объясняется его антистрессорный эффект [29]. Кроме того, сукцинат может усиливать адаптивный иммунитет, запуская активность антигенов, которые активируют Т-клетки. Также было показано, что накопление сукцината регулирует выработку воспалительных цитокинов [30].
В работах Ariza et al. изучались антигипоксические и антиоксидантные эффекты сукцината, которые основаны не только на способности активировать IDH (путь ресинтеза АТФ), снижать уровень НАД-зависимых субстратов ЦТК и жирных кислот, но и связаны со стимуляцией активности цитохромоксидазы, которая является ключевым ферментом дыхательной цепи митохондрий. Сукцинат способствует нормализации уровня гистамина и серотонина в крови и эпидермисе, а также оказывает благоприятное действие на микроциркуляторное русло, не влияя на уровень артериального давления (АД) и функцию сердца [30].
В работе de Castro et al. исследовался гепатопротекторный эффект сукцината, который заключается в активации фермента сукцинатдегидрогеназы (СДГ) в митохондриях гепатоцитов, что приводит к нормализации нарушений синтеза мочевины, явлений печеночного холестаза, предупреждает жировое перерождение печени, а также развитие в ней коллагенозной ткани [31].
В экспериментах на модели иммобилизационного стресса и стресса, спровоцированного ожогом, электрическим шоком, переохлаждением, описано адаптогенное действие сукцината [31]. Также известно, что при тяжелых физических нагрузках сукцинат способствует ускоренному восстановлению4.
Одним из ограничений применения сукцината в спортивной медицине является его биодоступность, которая ниже, чем у фумарата, малата или цитрата. Для повышения биодоступности сукцината используют его соединения с другими метаболитами ЦТК в виде солей5.
В настоящее время в отечественной спортивной медицине широко применяется сукцинат-содержащий препарат метаболического типа действия Мексидол® (3-окси-6-метил-2-этилпиридина сукцинат), обладающий мощным ингибирующим действием на процессы перекисного окисления липидов, а также способствующий нейтрализации свободных радикалов и активации СОД. Мексидол® способствует активации сукцинатоксидазного пути окисления, благодаря чему на начальных этапах гипоксии в условиях угнетения НАД-зависимого окисления в митохондриях сохраняется определенный уровень окислительного фосфорилирования [32]. Однако стоит заметить, что использование Мексидола® профессиональными спортсменами разрешено в форме таблеток, тогда как внутривенные инфузии и/или инъекции в объеме более 100 мл в течение 12-часового периода запрещены кодексом Всемирного антидопингового агентства (ВАДА). Это же правило касается и препарата Реамберин®, который в своем составе содержит меглюмина натрия сукцинат6.
Кроме препарата Мексидол® в настоящее время достаточно широкое использование в качестве компонента медико-биологического обеспечения спортсменов в нашей стране получил препарат Цитофлавин®, активными веществами которого являются собственно янтарная кислота в сочетании с инозином, никотинамидом и рибофлавином. Установлено, что на фоне напряженной физической нагрузки Цитофлавин® усиливает клеточное дыхание, обеспечивая оптимальный уровень поглощения кислорода клетками [32][33]. Также показано, что курсовое использование Цитофлавина® положительно влияет на метаболические процессы в организме: поддерживает белково-синтетическую функцию, способствует поглощению клетками глюкозы и жирных кислот, улучшая клеточную обеспеченность энергией, и восстановлению активности ферментов антиоксидантной системы. Данный препарат можно отнести к категории препаратов, проявляющих адаптогенные и стресс-протекторные свойства [32][34][35]. В работе В.В. Куршева выявлены эффекты Цитофлавина® по улучшению работоспособности профессиональных хоккеистов в предсоревновательном периоде [33][34].
Фумаровая кислота (фумарат) образуется в результате окисления сукцината с участием фермента СДГ, который также участвует в митохондриальной цепи переноса электронов (дыхательный комплекс II). Фумарат функционирует как промежуточный продукт синтеза мочевины и окисления фенилаланина, тирозина, лейцина, триптофана и лизина [36][37]. Имеются данные о производных фумарата как средств, повышающих аппетит, оказывающих противогрибковое действие, используемых в качестве транквилизаторов, рентгеноконтрастных препаратов, при нарушениях свертывания крови (бенциклан гидрофумарат), рините [36–38].
Фумарат хорошо проникает через мембраны и легко утилизируется в митохондриях. Это соединение, подобно лактату и ацетату натрия, способствует ликвидации ацидемии путем химической нейтрализации кислых продуктов метаболизма. Однако преимущество фумарата перед лактатом и ацетатом заключается в том, что он метаболизируется при тяжелой гипоксии, причем его утилизация сопровождается образованием АТФ [37][38].
Практическое использование в качестве антигипоксантов начали находить препараты на основе фумарата, поддерживающие активность сукцинатного звена на фоне гипоксии различного генеза. Одним из таких препаратов является Мафусол® (1 л водного раствора для инъекций содержит натрия хлорида 6,0 г, калия хлорида 0,3 г, магния хлорида 0,12 г и натрия фумарата 14,0 г) [40]. Мафусол® также может применяться в спортивной медицине, если это не противоречит антидопинговому правилу ВАДА: внутривенные инфузии и/или инъекции в объеме более 100 мл в течение 12-часового периода запрещены.
Яблочная кислота (малат) образуется из фумарата в аэробных условиях. Малат обладает свойствами клеточного протектора и способен увеличивать за счет усиления экспрессии матричной РНК активность таких ферментных комплексов, как СОД и глутатионпероксидаза [3].
Было отмечено, что в сердечной мышце активность переносчика малат-аспартат более чем в 10 раз превосходит все остальные известные системы транспорта электронов. Исследование кардиомиоцитов на фоне ишемии и в момент постишемической реперфузии показало колоссальную важность данной системы в адекватном обеспечении клеток энергией. Кроме того, малат-аспартатный механизм является звеном антиоксидантной защиты и участвует в синтезе инсулина [3][39][40].
Малат выполняет различные функции переключателя путей метаболизма: принимает участие в гликолизе, бета-окислении жирных кислот, синтезе аминокислот, играет важную роль в транспортном сообщении между митохондриями и цитозолем, оказывая анаплеротическое или катаплеротическое действие на ЦТК [3][39][40]. Известно, что малат может опосредованно оказывать антигипоксический эффект, предварительно дегидратируясь до фумарата [3][39][40].
В спортивной медицине используется соединение яблочной кислоты с аминокислотой цитруллин, которое оказывает тонизирующее воздействие, снижает чувство усталости и повышает выносливость [41][42]. Примером такого препарата является Стимол®, который широко используется спортивными врачами для ускорения восстановления спортсмена после тяжелых нагрузок. В работе С. Олейника et al. продемонстрировано ускоренное выведение лактата из мышц у спортсменов-спринтеров при применении данного препарата [43].
Щавелевоуксусная кислота (ЩУК, оксалоацетат) — еще один важный метаболит ЦТК. Его синтез поддерживается главным образом за счет карбоксилирования пирувата, поэтому сниженная интенсивность гликолиза при гипогликемии и истощении гликогенных депо приводит к дефициту пирувата и, как следствие, к недостатку оксалоацетата. Это ограничивает не только вход ацетил-КоА в ЦТК, но и течение других важных адаптивных реакций [3][44].
Оксалоацетат принимает участие в глюконеогенезе, цикле мочевины, глиоксилатном цикле, синтезе аминокислот, синтезе жирных кислот. Он важен для образования незаменимых и заменимых аминокислот: аспартата, аспарагина, метионина, лизина, треонина [44][45].
На основе производных оксалоацетата разработаны биоэнергетические препараты для повышения уровня энергии клеток, которые обладают протективным, промитохондриальным действиями, препятствуют нейровоспалению, нейродегенерации [44][45]. Оксалоацетат действует как нейропротектор благодаря способности уменьшать содержание глутамата в головном мозге в результате активации фермента глутамат-оксалоацетаттрансаминазы, который катализирует обратимое превращение оксалоацетата и глутамата в аспартат и альфа-кетоглутарат. Он способствует восстановлению после черепно-мозговой травмы (ЧМТ), вызывая нейрореабилитационные эффекты, что также имеет перспективы применения в спортивной медицине при реабилитации после ЧМТ, полученных во время тренировок или соревнований [45].
Продолжая перечислять свойства оксалоацетата, важно отметить участие данного интермедиата в процессах глюконеогенеза и глицерогенеза. Оксалоацетат способен увеличивать объем митохондрий в поперечнополосатой мускулатуре, что положительно сказывается на выносливости и уменьшает мышечное утомление [44][45]. Другим важным преимуществом, связанным с введением оксалоацетата, является увеличение митохондриального биогенеза [45].
ЗАКЛЮЧЕНИЕ
Большинство метаболитов ЦТК активно используются в медицине в качестве антигипоксантов, антиоксидантов, нейропротекторов, средств метаболической терапии. В спортивной медицине нашли свое применение сукцинат и его производные (эргогенные, антигипоксические препараты Цитофлавин®, Мексидол®), цитрат (в качестве буферного средства и переносчика магния), альфа-кетоглутарат (для подавления катаболизма, стимуляции анаболизма, гепатопротекции), малат (в форме цитруллин малата для повышения выносливости, препарат стимол), оксалоацетат (в качестве компонента препаратов, действие которых направлено на восстановление после ЧМТ, снижение уровня утомления и метаболическую регуляцию глюконеогенеза).
В настоящее время не все метаболиты ЦТК имеют достаточный уровень изученности и широкое использование в медико-биологическом обеспечении профессиональных спортсменов. Так, например, альфа-кетоглутарат в качестве компонента специализированной пищевой продукции в комбинации с аминокислотой L-аргинин, несмотря на показанные в отдельных работах антикатаболический и анаболический эффекты, имеет на сегодняшний день низкую степень доказательной эффективности при использовании в профессиональном спорте. Изоцитрат, несмотря на свою безопасность и перспективность в качестве компонента препаратов и специализированной пищевой продукции, используемой в спортивной медицине, пока не получил широкого распространения ввиду того, что его синтез был долгое время дорогостоящим. Однако в последние годы произошло кратное удешевление процесса производства изоцитрата, что позволило сделать данное вещество более доступным для использования его в практике спортивного врача.
1. Несен ЭН, Волков НИ, Осипенко АА, Корсун СН. Биохимия мышечной деятельности. Киев: Олимпийская литература; 2013.
2. https://chemicalportal.ru/compounds/tsikl-trikarbonovyh-kislot
3. Кулиненков ОС, Лапшин ИА. Биохимия в практике спорта: Справочник. М.: Спорт; 2019.
4. Исаков ВА, Сологуб ТВ, Коваленко АЛ, Романцов МГ. Реамберин в терапии критических состояний. Руководство для врачей. СПб.: СП Минимакс; 2001.
5. Там же.
6. Там же.
Список литературы
1. Gibala MJ, Peirce N, Constantin-Teodosiu D, Greenhaff PL. Exercise with low muscle glycogen augments TCA cycle anaplerosis but impairs oxidative energy provision in humans. J Physiol. 2002;540(3):1079–86. https://doi.org/10.1113/jphysiol.2001.012983
2. Маевский ЕИ, Гришина ЕВ. Биохимические основы механизма действия фумарат-содержащих препаратов. Medline.ru. Российский биомедицинский журнал. 2017;18:50–80. EDN: YRIDMT
3. Колотьева НА, Гильмиярова ФН. Роль малых молекул в регуляции обмена веществ (обзор литературы). Клиническая лабораторная диагностика. 2019;64(12):716–22.
4. Mourtzakis M, Graham TE, González-Alonso J, Saltin B. Glutamate availability is important in intramuscular amino acid metabolism and TCA cycle intermediates but does not affect peak oxidative metabolism. Journal of Applied Physiology. 2008;105(2):547–54. https://doi.org/10.1152/japplphysiol.90394.2008
5. Gibala MJ, González-Alonso J, Saltin B. Dissociation between muscle tricarboxylic acid cycle pool size and aerobic energy provision during prolonged exercise in humans. J Physiol. 2002;545: 705–13. https://doi.org/10.1113/jphysiol.2002.028084
6. Howarth KR, LeBlanc PJ, Heigenhauser GJF, Gibala MJ. Effect of endurance training on muscle TCA cycle metabolism during exercise in humans. J Appl Physiol. 2004;97:579–84. https://doi.org/10.1152/japplphysiol.01344.2003
7. Hu YY, Rawal A, Schmidt-Rohr, K. Strongly bound citrate stabilizes the apatite nanocrystals in bone. Proceedings of the National Academy of Sciences. 2010;107(52):22425–9. https://doi.org/10.1073/pnas.1009219107
8. Сафонова ОА, Попова ТН, Саиди Л. Активность некоторых НАДФН-продуцирующих ферментов в тканях крыс при токсическом гепатите и действии цитрата. Фундаментальные исследования. 2008;7:39–40. EDN: JKFPRN
9. Громова ОА, Торшин ИЮ, Гришина ТР. Мировой опыт применения цитрата магния в медицине. Трудный пациент. 2010;8:35–44. EDN: OGBOIV
10. Westergaard N, Waagepetersen HS, Belhage B, Schousboe A. Citrate a Ubiquitous Key Metabolite with Regulatory Function in the CNS. Neurochem Res. 2017;42(6):1583–8. https://doi.org/10.1007/s11064-016-2159-7
11. Finogenova TV, Morgunov IG, Kamzolova SV, Chernyavskaya OG. Organic acid production by the yeast Yarrowia lipolytica: a review of prospects. Appl Biochem Microbiol. 2005;41:418–25. https://doi.org/10.1007/s10438-005-0076-7
12. Yang J, Kim MJ, Yoon W, Kim EY, Kim H, Lee Y, Min B, Kang KS, Son JH, Park HT, Chung J, Koh H. Isocitrate protects DJ-1 null dopaminergic cells from oxidative stress through NADP+-dependent isocitrate dehydrogenase (IDH). PLoS Genet. 2017;13(8):e1006975. https://doi.org/10.1371/journal.pgen.1006975
13. Richardson CL, Delehanty LL, Bullock GC, Rival CM, Tung KS, Kimpel DL, Gardenghi S, Rivella S, Goldfarb AN. Isocitrate ameliorates anemia by suppressing the erythroid iron restriction response. J Clin Invest. 2013;123(8):3614–23. https://doi.org/10.1172/JCI68487
14. Goodnough LT, Nemeth E, Ganz T. Detection, evaluation, and management of iron-restricted erythropoiesis. Blood. 2010;116(23):4754–61. https://doi.org/10.1182/blood-2010-05-286260
15. Morgunov IG, Karpukhina OV, Kamzolova SV, Samoilenko VA, Inozemtsev AN. Investigation of the effect of biologically active threo-Ds-isocitric acid on oxidative stress in Paramecium caudatum. Prep Biochem Biotechnol. 2017;48(1):1–5. https://doi.org/10.1080/10826068.2017.1381622
16. Прибылова СА, Песков АБ, Хохлов МП, Сытник ВВ, Лыкова НС, Керова ИР. Результаты применения изолимонной и α-кетоглутаровой кислот в комплексной терапии артериальной гипертензии. Вестник новых медицинских технологий. 2012;1:31–35. EDN: PKJWGR
17. Howlett RA, Willis WT. Fiber-type-related differences in the enzymes of a proposed substrate cycle. Biochim Biophys Acta. 1998;25;1363(3):224–30. https://doi.org/10.1016/s0005-2728(98)00002-4
18. Metallo CM, Gameiro PA, Bell EL, Mattaini KR, Yang J, Hiller K. Reductive glutamine metabolism by IDH1 mediates lipogenesis under hypoxia. Nature. 2012;481:380–4. https://doi.org/10.1038/nature10602
19. Zdzisińska B, Żurek A, Kandefer-Szerszeń M. Alpha-Ketoglutarate as a Molecule with Pleiotropic Activity: Well-Known and Novel Possibilities of Therapeutic Use. Arch Immunol Ther Exp (Warsz). 2017;65(1):21–36. https://doi.org/10.1007/s00005-016-0406-x
20. Newsholme P, Procopio J, Ramos Lima MM, et al. Glutamine and glutamate—their central role in cell metabolism and function. Cell Biochem. 2009;21:1–9. https://doi.org/10.1002/cbf.1003
21. Yamamoto H, Mohanan PV. Effect of α-ketoglutarate and oxaloacetate on brain mitochondrial DNA damage and seizures induced by kainic acid in mice. Toxicol Lett. 2003;143:115–22. https://doi.org/10.1016/S0378-4274(03)00114-0
22. He W, Miao FJ, Lin DC, et al. Citric acid cycle intermediates as ligands for orphan G-protein-coupled receptors. Nature. 2004;429:188–93. https://doi.org/10.1038/nature02488
23. Cynober L, Lasnier E, Le Boucher J, et al. Effect of ornithine alpha-ketoglutarate on glutamine pools in burn injury: evidence of component interaction. Intensive Care Med. 2007;33:538–41. https://doi.org/10.1007/s00134-006-0511-0
24. Tatara MR, Krupski W, Tymczyna B, et al. Effects of combined maternal administration with alpha-ketoglutarate (AKG) and beta-hydroxy-methylbutyrate (HMB) on prenatal programming of skeletal properties in the offspring. Nutr Metab. 2012;9:39. https://doi.org/10.1186/1743-7075-9-39
25. Yuan Y, Xu P, Jiang Q, Cai X, Wang T, Peng W. Exercise-induced α-ketoglutaric acid stimulates muscle hypertrophy and fat loss through OXGR1-dependent adrenal activation. EMBO J. 2020;39(7):e103304. https://doi.org/10.15252/embj.2019103304
26. Bill Campbell MS, et al. Pharmacokinetics, safety, and effects on exercise performance of l-arginine α-ketoglutarate in trained adult men. Nutrition. 2006;22(9):872–81. https://doi.org/10.1016/j.nut.2006.06.003
27. Kerksick CM, Wilborn CD, Roberts MD, et al. ISSN exercise & sports nutrition review update: research & recommendations. J Int Soc Sports Nutr. 2008;15:38. https://doi.org/10.1186/s12970-018-0242-y
28. Tretter L, Patocs A, Chinopoulos C. Succinate, an intermediate in metabolism, signal transduction, ROS, hypoxia, and tumorigenesis. Biochimica et Biophysica Acta (BBA) Bioenergetics. 1857(8):1086–101. https://doi.org/10.1016/j.bbabio.2016.03.012
29. Olsen RW, DeLorey TM, In S, Agranoff BW, Albers RW, et al. Basic Neurochemistry: Molecular, Cellular and Medical Aspects. 6th ed. Philadelphia: Lippincott-Raven;1999.
30. Ariza AC, Deen PM, Robben JH. The succinate receptor as a novel therapeutic target for oxidative and metabolic stress-related conditions. Frontiers in Endocrinology. 2012;3:22. https://doi.org/10.3389/fendo.2012.00022
31. de Castro FМ, Aguiar CJ, da Rocha Franco JA, Gingold RN, Leite MF. GPR91: expanding the frontiers of Krebs cycle intermediates. Cell Communication and Signaling. 2016;14:3. https://doi.org/10.1186/s12964-016-0126-1
32. Галенко-Ярошевский ПА, Чекман ИС, Горчакова НА. Очерки фармакологии средств метаболической терапии. М.: Медицина; 2001. EDN: QIYLHN
33. Куршев ВВ, Заборова ВА, Ачкасов ЕЕ, Небожаева СФ. Динамика лабораторных показателей под влиянием метаболической коррекции у хоккеистов высшей квалификации в подготовительном периоде. Актуальные вопросы диагностики и лечения: Сборник научных трудов. М.: Медицина; 2018. EDN: XWUSPZ
34. Ачкасов ЕЕ, Куршев ВВ, Заборова ВА, Небожаева СФ. Влияние ступенчатой терапии цитофлавином на динамику лабораторных показателей у профессиональных спортсменов — хоккеистов на первом этапе подготовки к игровому сезону. Клиническая медицина. 2018;96(4):354–60. https://doi.org/10.30906/0869-2092-2017-80-10-36-39
35. Косинец ВА, Столбицкий ВВ, Штурич ИП. Опыт применения цитофлавина в спортивном питании. Клиническая медицина. 2012:90(7):56–9. EDN: RBINKP
36. Сухомлин АК, Великий КФ, Алексеева НН, Алексеева НН. Эффективность фумаратсодержащих антигипоксантов в коррекции системной гипоксии и эндогенной интоксикации при разлитом перитоните (экспериментальные и клинические исследования). Журнал международной медицины. 2016;2:67–70. EDN: YJQLXB
37. Шахмарданова СА, Гулевская ОН, Хананашвили ЯА, Зеленская АВ, Нефедов ДА, Галенко-Ярошевский ПА. Препараты янтарной и фумаровой кислот как средства профилактики и терапии различных заболеваний. Журнал фундаментальной медицины и биологии. 2016;3:16–30. EDN: XQSIDV
38. Слепнева ЛВ, Хмылова ГА, Алексеева НН, Селиванова ЕА. Лекарственное средство антигипоксического действия. Патент Российской Федерации № 2189813;2002.
39. Сафонова ОА, Попова ТН, Матасова ЛВ. Некоторые кинетические параметры и регуляторные свойства НАДФ-зависимой малатдегидрогеназы из кардиомиоцитов крысы в норме и при ишемии. Вестник ВГУ. Химия. Биология. Фармация. 2004;1:142–6. EDN: OITHUB
40. Wang W, Karamanlidis G, Tian R. Novel targets for mitochondrial medicine. Sci Transl. Med. 2016;8:326. https://doi.org/10.1126/scitranslmed.aac7410
41. Bendahan D, Mattei JP, Ghattas B. Citrulline/malate promotes aerobic energy production in human exercising muscle. British Journal of Sports Medicine. 2002;36:282–9. https://doi.org/10.1136/bjsm.36.4.282
42. Pérez-guisado J, Jakeman PM. Citrulline malate enhances athletic anaerobic performance and relieves muscle soreness. J Strength Cond Res. 2010;24(5):1215–22. https://doi.org/10.1519/JSC.0b013e3181cb28e0
43. Divito B, McLaughlin M, Jacobs I. The Effects of L-Citrulline on Blood-Lactate Removal Kinetics Following Maximal-Effort Exercise. J Diet Suppl. 2022;19(6):704–16. https://doi.org/10.1080/19390211.2021.1926392
44. Zlotnik A, Gruenbaum SE, Artru AA, Rozet I, Dubilet M. The neuroprotective effects of oxaloacetate in closed head injury in rats is mediated by its blood glutamate scavenging activity: evidence from the use of maleate. J Neurosurg Anesthesiol. 2009;21(3):235–41. https://doi.org/10.1097/ANA.0b013e3181a2bf0b
45. Wilkins HM, Koppel S, Carl SM, et al. Oxaloacetate enhances neuronal cell bioenergetic fluxes and infrastructure. J Neurochem. 2016;137(1):76–87. https://doi.org/10.1111/jnc.13545
Об авторах
Т. А. ЯшинРоссия
Яшин Тимофей Александрович
Москва
Ж. В. Гришина
Россия
Гришина Жанна Валерьевна, канд. биол. наук
Москва
С. А. Парастаев
Россия
Парастаев Сергей Андреевич, д-р мед. наук, профессор
Москва
А. В. Жолинский
Россия
Жолинский Андрей Владимирович, канд. мед. наук
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Яшин Т.А., Гришина Ж.В., Парастаев С.А., Жолинский А.В. Возможности применения отдельных метаболитов цикла трикарбоновых кислот у спортсменов (обзор литературы). Медицина экстремальных ситуаций. 2025;27(2):249-256. https://doi.org/10.47183/mes.2025-288
For citation:
Yashin T.A., Grishina Zh.V., Parastaev S.A., Zholinsky A.V. Applicability of individual metabolites of the tricarboxylic acid cycle in athletes (A literature review). Extreme Medicine. 2025;27(2):249-256. https://doi.org/10.47183/mes.2025-288
















