Перейти к:
Роль изменений системы фибринолиза в развитии постинсультных когнитивных нарушений
https://doi.org/10.47183/mes.2025-293
Аннотация
Введение. Постинсультные когнитивные нарушения (ПИКН) представляют собой важную медицинскую и социальную проблему. Их распространенность после перенесенного инсульта достигает 74%.
Цель. Изучение взаимосвязи между интегральными параметрами, характеризующими процессы коагуляции и фибринолиза и определяемыми при помощи динамической тромбофотометрии, и формированием ПИКН для оценки возможности прогнозирования ПИКН и неблагоприятных исходов заболевания.
Материалы и методы. В исследование были включены 35 пациентов, перенесших ишемический инсульт в срок до 24 ч от начала заболевания: 20 (57,1%) женщин и 15 (42,9%) мужчин; медианный возраст 66,5 [62,3–73,3] года. Группу сравнения составили 45 условно здоровых добровольцев. Оценка состояния системы гемостаза проведена при поступлении в стационар, на 6–8 и 13–15-е сут. Исследовали интегральные показатели, оценивающие системы коагуляции, фибринолиза и гемостаза в целом с помощью метода «Фибринодинамика». Когнитивные функции оценивали на 10–14-е сут по Монреальской шкале оценки когнитивных функций (MoCA). Функциональный исход заболевания определяли по Модифицированной шкале Рэнкина (МШР) на 28-е сут. Для статистического анализа использовали программное обеспечение SPSS 27.0 (IBM, США). Ассоциации между непрерывными данными оценивали при помощи коэффициента корреляции Спирмена, одномерных и многомерных линейных регрессионных моделей. Статистически значимыми считали различие при уровне p ≤ 0,05.
Результаты. Выявлена обратная корреляционная связь средней яркости сгустка при интегральном моделировании (НВ) процессов гемостаза при поступлении и уровнем когнитивной дисфункции по шкале MoCA (rs = -0,409; p = 0,02); более высокие исходные значения HB были ассоциированы с выраженными постинсультными когнитивными нарушениями. Напротив, отмечалась прямая связь исходного процесса фибринолиза образующегося сгустка (FB) и когнитивных нарушений по шкале MoCA (r = 0,512, p = 0,003); более высоким значениям FB соответствовала большая оценка по шкале MoCA и более высокий уровень когнитивных функций.
Выводы. В прогностических многомерных линейных регрессионных моделях, включавших возраст и исходную тяжесть инсульта, установлено, что каждые 11,5 усл. ед. увеличения исходной HB или 9,8 усл. ед. снижения исходной FB соответствовали ухудшению когнитивного статуса при его оценке по MoCA на 1 балл. Пациенты с высокими исходными значениями FB имели более благоприятные функциональные исходы заболевания по МШР. Применение расширенной динамической тромбофотометрии позволяет комплексно оценивать сдвиги системы гемостаза у пациентов с ишемическим инсультом. Более высокие значения HB и более низкие значения FB дают возможность прогнозировать неблагоприятный исход заболевания и более тяжелые ПИКН на ранних этапах, в то время как гипоактивация фибринолитической системы ассоциирована с большей тяжестью ПИКН и менее благоприятным функциональным исходом.
Ключевые слова
Для цитирования:
Кольцов И.А., Щукин И.А., Фидлер М.С., Карпова Н.С., Брусов О.С., Шилов Ю.Е., Коваленко Е.А., Бойко А.Н. Роль изменений системы фибринолиза в развитии постинсультных когнитивных нарушений. Медицина экстремальных ситуаций. 2025;27(2):169-175. https://doi.org/10.47183/mes.2025-293
For citation:
Koltsov I.A., Shchukin I.A., Fidler M.S., Karpova N.S., Brusov O.S., Shilov Yu.E., Kovalenko E.A., Boyko A.N. Role of fibrinolytic system changes in the development of post-stroke cognitive impairments. Extreme Medicine. 2025;27(2):169-175. https://doi.org/10.47183/mes.2025-293
ВВЕДЕНИЕ
Церебральный инсульт является ведущей причиной инвалидизации в мире [1]. Современное развитие реперфузионных технологий в лечении ишемического инсульта позволило существенно улучшить исходы заболевания, в то же время постинсультные когнитивные нарушения (ПИКН) и в особенности постинсультная деменция (ПД) по-прежнему остаются значимыми состояниями, существенно ухудшающими качество жизни как самих пациентов, так и их окружения [2]. Распространенность ПИКН, по данным разных источников, составляет от 4,4 до 73% [3]. Следует отметить, что ПИКН являются неблагоприятным исходом не только ишемического, но и геморрагического инсульта [4]. Как правило, формирование стойкого симптомокомплекса ПИКН наступает в раннем восстановительном периоде, т.е. от 3 до 6 месяцев после инсульта. Помимо характерных нарушений высших корковых функций (афатических нарушений, нарушений памяти, агнозий и апраксий), связанных непосредственно с поражением определенных зон мозга, у пациентов с ПИКН прогрессируют типичные для сосудистых когнитивных нарушений (КН) симптомы: ухудшение внимания и регуляторных функций [3].
Острая церебральная ишемия представляет собой сложный каскад, состоящий из множества патофизиологических звеньев, включающих протромботическую и провоспалительную активацию как на системном, так и на локальном уровнях. С одной стороны, тромбоз крупных и мелких церебральных сосудов приводит к разной степени ишемического повреждения вещества мозга, с другой стороны, параллельно с протромботическими процессами происходит избыточное высвобождение провоспалительных цитокинов и лейкоцитарная инфильтрация ишемизированных областей мозга [5]. Связь процессов тромбоза и воспаления принято обозначать термином «тромбовоспаление», и, согласно мнению некоторых исследователей, это является одной из причин стойких постинсультных нарушений, включая ПИКН [6][7].
Динамическая тромбофотометрия — новый метод оценки состояния системы гемостаза, позволяющий моделировать и регистрировать in vitro процессы индуцированного тканевым фактором роста фибринового сгустка в условиях, приближенных к физиологическим. Особенный интерес представляет модификация метода с возможностью одновременного моделирования процессов роста и лизиса фибринового сгустка с последующим вычислением значений ряда интегральных показателей: «Фибринодинамика» (ФД) [8]. Этот метод позволяет оценивать не только активацию систем коагуляции и фибринолиза, но и смещение баланса между ними в сторону тромбообразования или гипокоагуляции. Кроме того, данный метод позволяет определить опосредованный вклад дополнительных факторов, таких как воспаление и эндотелиальная дисфункция, в общий баланс системы гемостаза в рамках концепции тромбовоспаления-иммунотромбоза [9].
В рамках предыдущего этапа научно-исследовательской работы нами было изучено состояние коагуляционного звена гемостаза у пациентов с ишемическим инсультом (ИИ) методом динамической тромбофотометрии. Отмечено, что нарастание оптической плотности фибринового сгустка и ее высокие значения можно рассматривать как вероятный прогностически значимый биомаркер раннего формирования ПИКН [10]. В настоящее время продолжается изучение перспективных направлений использования метода динамической тромбофотометрии, в частности его модификации ФД в прогнозировании ранних проявлений ПИКН.
Цель исследования — изучение взаимосвязи между интегральными параметрами, характеризующими процессы коагуляции и фибринолиза, определяемыми при помощи динамической тромбофотометрии, и формированием ПИКН для оценки возможности прогнозирования ПИКН и неблагоприятных исходов заболевания.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено неинтервенционное исследование интегральных параметров систем коагуляции, фибринолиза и гемостаза на клинических базах кафедры неврологии, нейрохирургии и медицинской генетики лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. Основную группу составили 35 пациентов, перенесших ишемический инсульт в срок до 24 часов от начала заболевания: 20 (57,1%) женщин и 15 (42,9%) мужчин. Медианный возраст составил 66,5 [ 62,3–73,3] года.
В качестве группы сравнения была сформирована база данных результатов лабораторных исследований 45 условно здоровых добровольцев: 20 (44,4%) мужчин и 25 (55,6%) женщин, медианный возраст которых составил 31,0 [ 23,5–44,5] года. Группа сравнения была создана в связи с тем, что настоящее исследование было пилотным и отмечалась необходимость сопоставления полученных результатов с условно физиологически нормальными значениями у людей из общей популяции, не страдающих хроническими заболеваниями. Включение пациентов-добровольцев в базу данных проводили в соответствии с принципами надлежащей клинической практики и подписанием информированного добровольного согласия на взятие образцов венозной крови и проведение лабораторных исследований.
Критериями включения в основную группу являлись: подтвержденный в соответствии с требованиями клинических рекомендаций1 диагноз ИИ, поступление в стационар в срок до 24 часов от начала заболевания, возраст ≥ 40 лет (для пациентов в возрасте 40–59 лет — наличие хотя бы одного подтвержденного фактора риска ишемического инсульта в анамнезе), балл ≤ 10 по шкале инсульта Национального института здоровья (National Institutes of Health Stroke Scale — NIHSS), которая применяется для оценки неврологического статуса, локализации инсульта, дифференциальной диагностики и результатов лечения, планирования тромболитической терапии и контроля ее эффективности. Шкала NIHSS, перевод которой представлен в соответствующих клинических рекомендациях2, включает ряд параметров, отражающих уровни нарушения вследствие острого цереброваскулярного заболевания: уровень сознания — уровень бодрствования, движения глазными яблоками, исследование полей зрения, определение функционального состояния лицевого нерва, оценку двигательной функции верхних конечностей, оценку координации движений, проверку чувствительности, выявление расстройства речи, выявление нарушения восприятия — гемиигнорирование, или неглект, а также ориентировочный прогноз заболевания. Также критериями включения в исследование были отсутствие речевых и двигательных нарушений, препятствующих объективизации когнитивного статуса пациентов, согласие на участие в исследовании, отсутствие анамнестических признаков наличия предшествующих инсульту КН.
Критерии невключения были следующие: поступление в стационар в срок позднее 24 часов от начала заболевания, регресс неврологической симптоматики с установленным диагнозом транзиторной ишемической атаки, выявление ишемического инсульта иной уточненной этиологии (мигренозного, гемодинамического и т.п.), наличие онкологических, терминальных, соматических или иных заболеваний, достоверно вызывающих изменения показателей гемостаза (в т.ч. тромбофилии, гемофилии, ДВС-синдрома, сепсиса и др.), беременность, отказ от участия в научно-исследовательской работе.
Для исследования лабораторных показателей использовали образцы венозной крови, полученные в соответствии с регламентом, установленным клиническими рекомендациями3.
Определение показателей гемостаза проводили в образцах цитратной периферической венозной крови в соотношении 1:10. Осуществляли двухэтапное центрифугирование до получения бестромбоцитарной плазмы (15 минут при относительном центробежном ускорении 1500 g и 5 минут при 10 000 g) с применением центрифуг CM-6M (ELMI, Латвия) и Microspin 12 (Biosan, Латвия). Для оценки состояния системы гемостаза была использована лабораторно-диагностическая система «Регистратор тромбодинамики Т-2» (Гемакор, Россия). Применяли расширенную методику с одновременным моделированием процессов коагуляции и фибринолиза [8]. На основании результатов исследования рассчитывали параметры, характеризующие функционирование систем коагуляции, фибринолиза и гемостаза в целом по формуле:
FB = СВ – НВ, (1)
где СВ (coagulation brightness, усл. ед.) — средняя яркость сгустка при моделировании процесса коагуляции;
НВ (hemostasis brightness, усл. ед.) — средняя яркость сгустка при интегральном моделировании процессов гемостаза;
FB (fibrinolysis brightness, усл. ед.) — параметр, характеризующий выраженность процесса фибринолиза образующегося сгустка.
В основной группе оценку состояния системы гемостаза проводили при поступлении в стационар, на 6–8 и 13–15-е сут. Кроме того, в указанные временные интервалы выполняли стандартное клинико-инструментально-лабораторное обследование, оценивали тяжесть неврологического дефицита по шкале NIHSS. Когнитивные функции пациентов оценивали на 10–14-е сутки при помощи Монреальской шкалы оценки когнитивных функций (MoCA) [11]. Функциональный исход определяли на 28-е сутки с помощью Модифицированной шкалы Рэнкина (МШР), позволяющей комплексно оценить развитие как постинсультной инвалидизации, так и летального исхода [12].
Исходная характеристика пациентов основной группы представлена в предыдущей части работы [10]. Артериальная гипертензия (любая степень) отмечалась у 27 (77,1%) пациентов, сахарный диабет 2-го типа — у 11 (31,4%), фибрилляция предсердий (любая форма) — у 9 (25,7%), стеноз инфаркт-зависимой артерии более 50% просвета — у 14 (40,0%). Оценка NIHSS при поступлении составляла 5 баллов [4–8]. Характеристики пациентов, а также распределение патогенетических подтипов ишемического инсульта соответствовали отечественным и зарубежным литературным данным.
В группе сравнения лабораторное исследование проводили однократно.
Для статистического анализа использовали программное обеспечение SPSS 27.0 (IBM, США). Итоговый объем выборки был определен по результатам промежуточного статистического анализа данных (статистическая мощность 0,95, пороговое значение α = 0,05). Соответствие полученных данных нормальному распределению оценивалось при помощи критерия Шапиро-Уилка. Экстремальные значения данных при их наличии исключались из расчета. Числовые данные в работе представлены в виде медианы с верхним и нижним квартилями. Для сопоставления показателей, не соответствующих нормальному распределению, применяли критерий Манна-Уитни в независимых выборках и критерий Уилкоксона в зависимых выборках. Ассоциации между непрерывными данными оценивали при помощи коэффициента корреляции Спирмена, одномерных и многомерных линейных регрессионных моделей.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты исследования интегральных показателей коагуляции и фибринолиза в разные временные промежутки у пациентов из основной группы были сопоставлены с данными условно здоровых добровольцев; соответствующие показатели приведены в таблице. Выводы об отсутствии сопутствующих гематологических заболеваний, вызывающих значимое смещение коагулологических показаний, делали на основании отсутствия отклонений при поступлении показателей стандартной коагулографии.
В основной группе при поступлении значения интегральных показателей CB и HB были сопоставимыми с группой условно здоровых добровольцев, что подтверждало схожую активность системы коагуляции и схожую функциональную активность системы фибринолиза в обеих группах (табл.). При этом у пациентов с ишемическим инсультом при поступлении отмечена тенденция к гипофибринолизу (более низким значениям параметра FB): 18,3 [ 10,0–31,9] против 25,3 [ 21,7–29,9] усл. ед., (p = 0,068) при сопоставлении результатов добровольцев из группы сравнения. Это характеризовало общее протромбогенное состояние при ишемическом инсульте с большей сопротивляемостью фибриновых сгустков процессу фибринолиза. Статистическая значимость различий этих показателей не была достигнута вследствие наличия в группе сравнения нескольких условно здоровых добровольцев с крайне низкими значениями FB.
К концу 1-й недели у пациентов с ишемическим инсультом отмечали резкое статистически значимое падение показателей CB, HB и FB до 1,3, 1,2 и 1,6% от исходных значений соответственно, со сдвигом в сторону гипокоагуляции относительно результатов у испытуемых из группы сравнения, что может быть связано с инициацией антитромботической терапии с первых дней нахождения в стационаре. Совокупно смещение всех показателей было обусловлено тем, что в основе метода лежит изучение процесса роста фибринового сгустка от поверхности, покрытой тканевым фактором, в связи с чем активная антитромботическая терапия приводила к соответствующему сдвигу всех показателей. К 13–15-м сут в основной группе пациентов отмечали постепенное восстановление общей активности системы коагуляции, но значения по-прежнему оставались ниже, чем в группе сравнения, в связи с продолжением антитромботической терапии. Учитывая соответствующее смещение, показатели пациентов из основной группы на 6–8 и 13–15-е сут с пациентами группы сравнения не сопоставлялись.
В основной группе пациентов в ходе исследования ассоциаций между показателем CB при поступлении и когнитивным статусом выявлено не было.
У пациентов с ишемическим инсультом была проведена оценка взаимосвязи HB при поступлении с баллом по шкале MoCA: более высоким исходным значениям HB соответствовало более выраженное постинсультное когнитивное снижение (rs = -0,409; p = 0,02); эти данные представлены на рисунке 1. Для уточнения данной ассоциации была построена простая линейная регрессионная модель (коэффициент регрессии β = -0,106; 95% ДИ 0,188–0,024; p = 0,022).
Для учета влияния дополнительных факторов (возраст и исходная тяжесть инсульта по шкале NIHSS) была построена многомерная линейная регрессионная модель (коэффициент регрессии β = -0,087; 95% ДИ от -0,159 до -0,015; p = 0,019). Установлено, что каждые 11,5 усл. ед. увеличения исходной HB соответствовали ухудшению впоследствии когнитивного статуса по MoCA (внимания и концентрации, управляющих функций, памяти, языковых функций, зрительно-конструктивных навыков, абстрактного мышления, счета и ориентации) на 1 балл. К 6–8 и 13–15-м сут данная взаимосвязь показателей имела схожую направленность, но не достигла статистической значимости.
Также была проведена оценка ассоциации исходной выраженности процесса фибринолиза и когнитивной функции по шкале MoCA. Выявлено, что более высоким значениям FB соответствует бóльшая оценка по шкале MoCA и, следовательно, более высокий уровень когнитивных функций (rs = 0,512; p = 0,003); соответствующие данные представлены на рисунке 2.
Для детальной количественной оценки прогностической значимости данной взаимосвязи была построена простая линейная регрессионная модель (коэффициент регрессии β = 0,121; 95% ДИ от 0,018 до 0,223; p = 0,022).
Для того чтобы учесть влияние возраста и исходной тяжести очаговой неврологической симптоматики по шкале NIHSS на формирование в дальнейшем когнитивных нарушений, была построена многомерная модель (коэффициент регрессии β = 0,102; 95% ДИ от 0,014 до 0,190; p = 0,025). Установлено, что каждые 9,8 усл. ед. сдвига исходной FB в сторону гипофибринолиза соответствовали ухудшению когнитивного статуса при его оценке по MoCA на 1 балл. Данная взаимосвязь сохранялась к 6–8 и 13–15-м сут наблюдения, но не достигала при этом статистической значимости.
Также было отмечено, что пациенты с ишемическим инсультом (n = 17), имеющие завышенные значения FB, которые характеризуют выраженную активность фибринолитической системы, имели более благоприятные функциональные исходы заболевания при выписке с оценкой по модифицированной шкале Рэнкина 0–1 балл по сравнению с пациентами, имевшими оценку по модифицированной шкале Рэнкина 2–6 баллов (21,2 [ 16,6–35,0] и 16,2 [ 1,9–27,4] усл. ед. соответственно; p = 0,033) (рис. 3).
В ходе исследования в первые сутки у пациентов с ишемическим инсультом не отмечено значимых признаков резкого смещения активности коагуляционного и фибринолитического звеньев системы гемостаза за пределы уровня «гематологической нормы». В то же время выявлена тенденция к снижению показателя FB относительно группы сравнения, что может указывать на относительное гипофибринолитическое состояние при остром ишемическом инсульте [13][14]. Было установлено, что более высокие значения показателя HB пациента в первые сутки инсульта потенциально связаны с большей тяжестью когнитивных нарушений по шкале MoCA. Напротив, более высокие исходные значения показателя FB пациентов, характерные для относительного гипофибринолиза, ассоциированы с меньшим когнитивным дефектом впоследствии, а также с более благоприятным функциональным исходом по модифицированной шкале Рэнкина. Сопоставимые результаты, свидетельствующие о значимости гиперкоагуляционных состояний при острых сосудистых заболеваниях, представлены и в отношении ишемической болезни сердца [15].
Учитывая вышеизложенное, можно предположить, что важный вклад в развитие ПИКН вносит не только поражение определенного объема вещества головного мозга в результате критической ишемии, связанной с окклюзией питающего соответствующую зону сосуда [16], но и изменения на уровне микроциркуляторного русла [17], такие как развивающийся микротромбоз более мелких сосудов перифокальной ядру инфаркта области гипоперфузии [18][19].
Пациенты, у которых процессы фибринолиза были интенсивнее, имели более благоприятные исходы. Данные, полученные в настоящей работе, соотносятся с результатами первой части нашего исследования, в которой было показано, что более высокая оптическая плотность фибринового сгустка связана с более низкими баллами по шкале MoCA у таких пациентов [10]. Следует отметить, что в последнее время появился ряд работ, в которых показана роль фибрина в запуске процессов тромбовоспаления, в частности имеются данные, что при коронавирусной инфекции фибрин, связываясь с белками вируса, образует тромбы, активирующие системную воспалительную реакцию, потенцирующую дальнейшие тромботические осложнения [20].
Таблица. Динамика показателей системы гемостаза в основной группе и группе сравнения
Параметр | Основная группа (n = 35) | Группа сравнения (n = 45) | ||
При поступлении | 6–8-е сутки | 13–15-е сутки | ||
CB, усл. ед. | 64,0 [ 42,4–72,8] | 0,8 [ 0,1–7,5]* | 14,9 [ 9,1–22,7]* | 63,3 [ 53,7–73,6] |
HB, усл. ед. | 33,9 [ 24,8–51,4] | 0,4 [ 0,1–3,0]* | 8,4 [ 6,3–7,6]* | 37,4 [ 31,0–49,4] |
FB, усл. ед. | 18,3 [ 10,0–31,9] | 0,3 [ 0–3,6]* | 5,6 [ 3,4–7,6]* | 25,3 [ 21,7–29,9] |
Таблица составлена авторами по собственным данным
Примечание: * p < 0,001 уровень статистической значимости по сравнению со значениями при поступлении (критерий Уилкоксона).

Рисунок подготовлен авторами по собственным данным
Рис. 1. Ассоциация между интегральной оценкой активности системы гемостаза HB и баллом по шкале MoCA
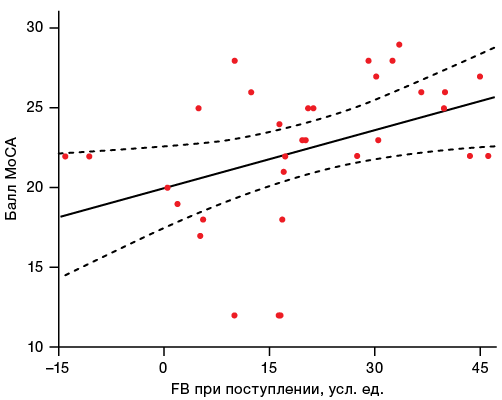
Рисунок подготовлен авторами по собственным данным
Рис. 2. Ассоциация между интегральной оценкой фибринолиза (FB) и когнитивным статусом, оцененным по шкале MoCA
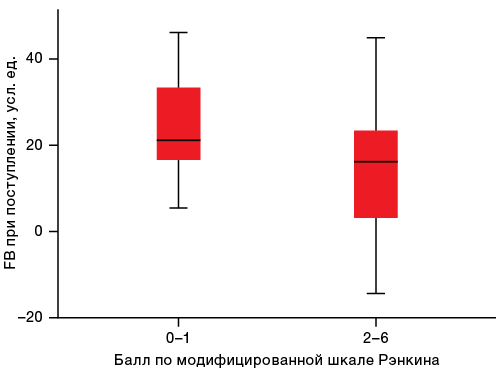
Рисунок подготовлен авторами по собственным данным
Рис. 3. Интегральная оценка фибринолиза в зависимости от функционального исхода заболевания
ЗАКЛЮЧЕНИЕ
Постинсультные когнитивные нарушения, включая ПД, составляют важную медицинскую и социальную проблему. Исследование различных предикторов развития ПИКН на этапе острейшего периода инсульта представляется крайне актуальным, т.к. это может потенциально позволить разработать новые лечебные и реабилитационные подходы, способные улучшить функциональный исход у пациентов с острыми нарушениями мозгового кровообращения.
Совокупная лабораторная оценка механизмов, лежащих в основе развития гиперкоагуляции и гипофибринолиза, с помощью метода динамической тромбофотометрии и его расширенного варианта ФД позволяет комплексно оценить сдвиги системы гемостаза у пациентов с инсультом, а также оценить совокупный вклад ряда системных и локальных эффектов, таких как тромбовоспаление, в активность системы гемостаза.
В настоящей работе была уточнена динамика оптической плотности фибринового сгустка при моделировании процесса фибринолиза при исследовании интегрального показателя HB. Выявлено, что нарастание показателя оптической плотности фибринового сгустка, характеризующего коагуляционную активность, ассоциировано с низким баллом по шкале MoCA.
В прогностических многомерных линейных регрессионных моделях, включавших возраст и исходную тяжесть инсульта, было показано, что каждые 11,5 усл. ед. увеличения исходной HB соответствует ухудшению когнитивного статуса при его оценке по MoCA на 1 балл. Смещение на 9,8 усл. ед. исходных значений показателя FB в сторону гипофибринолиза было ассоциировано с ухудшением когнитивного статуса и сдвигом балла по шкале MoCA на 1. Совокупность параметров HB и FB позволила прогнозировать более тяжелые ПИКН.
Таким образом, исследование системы гемостаза методом динамической тромбофотометрии и его расширенного варианта ФД представляется крайне актуальным и перспективным у пациентов с различными сосудистыми заболеваниями. Данный метод позволяет уточнить вероятность неблагоприятных исходов инсульта. Кроме того, изменения фибринолитической активности и состояния системы коагуляции напрямую связаны с активизацией процессов системного воспаления, оценка которого в совокупности с исследованием показателей динамической тромбофотометрии является перспективным, но малоизученным научным направлением.
1. Клинические рекомендации «Ишемический инсульт и транзиторная ишемическая атака у взрослых». Министерство здравоохранения Российской Федерации; 2021.
2. Там же.
3. Там же.
Список литературы
1. GBD 2017 DALYs and HALE Collaborators. Global, regional, and national disability-adjusted life-years (DALYs) for 359 diseases and injuries and healthy life expectancy (HALE) for 195 countries and territories, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet Lond Engl. 2018;392(10159):1859–922. https://doi.org/10.1016/S0140-6736(18)32335-3
2. Jokinen H, Melkas S, Ylikoski R, et al. Post-stroke cognitive impairment is common even after successful clinical recovery. Eur J Neurol. 2015;22(9):1288–94. https://doi.org/10.1111/ene.12743
3. Rost NS, Brodtmann A, Pase MP, et al. Post-Stroke Cognitive Impairment and Dementia. Circ Res. 2022;130(8):1252–71. https://doi.org/10.1161/CIRCRESAHA.122.319951
4. Moulin S, Labreuche J, Bombois S, et al. Dementia risk after spontaneous intracerebral haemorrhage: a prospective cohort study. Lancet Neurol. 2016;15(8):820–9. https://doi.org/10.1016/S1474-4422(16)00130-7
5. Steubing RD, Szepanowski F, David C, et al. Platelet depletion does not alter long-term functional outcome after cerebral ischaemia in mice. Brain Behav Immun — Health. 2022;24:100493. https://doi.org/10.1016/j.bbih.2022.100493
6. De Meyer SF, Langhauser F, Haupeltshofer S, Kleinschnitz C, Casas AI. Thromboinflammation in Brain Ischemia: Recent Updates and Future Perspectives. Stroke. 2022;53(5):1487–99. https://doi.org/10.1161/STROKEAHA.122.038733
7. Szepanowski RD, Haupeltshofer S, Vonhof SE, Frank B, Kleinschnitz C, Casas AI. Thromboinflammatory challenges in stroke pathophysiology. Semin Immunopathol. 2023;45(3):389–410. https://doi.org/10.1007/s00281-023-00994-4
8. Karpova NS, Brusov OS, Oleichik IV, Stolyarov SA, Klyushnik TP. Hemostasis System in Patients with Schizophrenia and Schizophrenia Spectrum Disorders. Bull Exp Biol Med. 2024;176(3):390–3. https://doi.org/10.1007/s10517-024-06030-1
9. Кольцов ИА, Щукин ИА, Чубыкин ВИ, Фидлер МС. Механизмы нейровоспаления и тромбовоспаления при цереброваскулярной патологии и сосудистых когнитивных нарушениях. Терапия. 2022;9. https://doi.org/10.18565/therapy.2022.9.75-81
10. Кольцов ИА, Щукин ИА, Коваленко ЕА, Карпова НС, Шилов ЮЕ, Брусов ОС. Связь постинсультных когнитивных нарушений и изменений коагуляционного звена гемостаза. Журнал неврологии и психиатрии им. С.С. Корсакова. 2024;124(3-2):23–9. https://doi.org/10.17116/jnevro202412403223
11. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, Cummings JL, Chertkow H. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc. 2005;53(4):695–9. https://doi.org/10.1111/j.1532-5415.2005.53221.x
12. van Swieten JC, Koudstaal PJ, Visser MC, Schouten HJ, van Gijn J. Interobserver agreement for the assessment of handicap in stroke patients. Stroke. 1988;19(5):604–7. https://doi.org/10.1161/01.str.19.5.604
13. Barakzie A, Jansen AJG, Ten Cate H, de Maat MPM. Coagulation biomarkers for ischemic stroke. Res Pract Thromb Haemost. 2023;7(4):100160. https://doi.org/10.1016/j.rpth.2023.100160
14. de Bruijne EL, Gils A, Rijken DC, de Maat MP, Guimarães AH, Poldermans D, Declerck PJ, Leebeek FW. High thrombin activatable fibrinolysis inhibitor levels are associated with an increased risk of premature peripheral arterial disease. Thromb Res. 2011;127(3):254–8. https://doi.org/10.1016/j.thromres.2010.11.026
15. Reddel CJ, Curnow JL, Voitl J, Rosenov A, Pennings GJ, Morel-Kopp MC, Brieger DB. Detection of hypofibrinolysis in stable coronary artery disease using the overall haemostatic potential assay. Thromb Res. 2013;131(5):457–62. https://doi.org/10.1016/j.thromres.2013.03.015
16. Lee M, Yeo NY, Ahn HJ, Lim JS, Kim Y, Lee SH, Oh MS, Lee BC, Yu KH, Kim C. Prediction of post-stroke cognitive impairment after acute ischemic stroke using machine learning. Alzheimers Res Ther. 2023;15(1):147 (In Russ.). https://doi.org/10.1186/s13195-023-01289-4
17. He Z, Sun J. The role of the neurovascular unit in vascular cognitive impairment: Current evidence and future perspectives. Neurobiol Dis. 2025;204:106772. https://doi.org/10.1016/j.nbd.2024.106772
18. Jacqmarcq C, Picot A, Flon J, Lebrun F, Martinez de Lizarrondo S, Naveau M, Bernay B, Goux D, Rubio M, Malzert-Fréon A, Michel A, Proamer F, Mangin P, Gauberti M, Vivien D, Bonnard T. MRI-based microthrombi detection in stroke with polydopamine iron oxide. Nat Commun. 2024;15(1):5070. https://doi.org/10.1038/s41467-024-49480-x
19. De Silva TM, Faraci FM. Microvascular Dysfunction and Cognitive Impairment. Cell Mol Neurobiol. 2016;36(2):241–58. https://doi.org/10.1007/s10571-015-0308-1
20. Ryu JK, Yan Z, Montano M, et al. Fibrin drives thromboinflammation and neuropathology in COVID-19. Nature. 2024;633(8031). https://doi.org/10.1038/s41586-024-07873-4
Об авторах
И. А. КольцовРоссия
Кольцов Иван Алексеевич, канд. мед. наук
Москва
И. А. Щукин
Россия
Щукин Иван Александрович, канд. мед. наук
Москва
М. С. Фидлер
Россия
Фидлер Михаил Сергеевич
Москва
Н. С. Карпова
Россия
Карпова Наталья Сергеевна
Москва
О. С. Брусов
Россия
Брусов Олег Сергеевич, канд. биол. наук
Москва
Ю. Е. Шилов
Россия
Шилов Юрий Евгеньевич, канд. биол. наук
Москва
Е. А. Коваленко
Россия
Коваленко Екатерина Андреевна, канд. мед. наук
Москва
А. Н. Бойко
Россия
Бойко Алексей Николаевич, д-р мед. наук
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Кольцов И.А., Щукин И.А., Фидлер М.С., Карпова Н.С., Брусов О.С., Шилов Ю.Е., Коваленко Е.А., Бойко А.Н. Роль изменений системы фибринолиза в развитии постинсультных когнитивных нарушений. Медицина экстремальных ситуаций. 2025;27(2):169-175. https://doi.org/10.47183/mes.2025-293
For citation:
Koltsov I.A., Shchukin I.A., Fidler M.S., Karpova N.S., Brusov O.S., Shilov Yu.E., Kovalenko E.A., Boyko A.N. Role of fibrinolytic system changes in the development of post-stroke cognitive impairments. Extreme Medicine. 2025;27(2):169-175. https://doi.org/10.47183/mes.2025-293

















