Перейти к:
Альгинатные гели, модифицированные природными аминокислотами, для регенеративной медицины
https://doi.org/10.47183/mes.2025-294
Аннотация
Введение. Альгинат — природный полисахарид, который зарекомендовал себя как перспективный нетоксичный материал для формирования раневых покрытий в виде гелей. Такие природные аминокислоты, как аргинин и лизин, являются важными составляющими при синтезе внеклеточного матрикса, а также участвуют во многих жизненно важных процессах в организме.
Цель. Формирование альгинатных гелей, совместимых с фибробластами кожи и модифицированных природными аминокислотами аргинином и лизином, а также исследование скорости выхода данных аминокислот из геля.
Материалы и методы. Работа выполнена на 3 видах водных растворов 3% альгината натрия с содержанием аминокислоты аргинина или лизина в количестве 5, 10 и 20% от сухой массы альгината. Для оценки стабильности гелей с лизином во времени их инкубировали в течение 1, 3 и 7 сут в 600 мкл воды при комнатной температуре. Интенсивность выхода аминокислот из альгинатного геля оценивали спектрофотометрическим методом после проведения нингидриновой реакции. В качестве модельных объектов в работе была использована клеточная линия DF2 (фибробласты кожи человека, «Коллекция культур клеток позвоночных» ИНЦ РАН). На полученных гелях культивировали дермальные фибробласты человека. Оценку клеток на гелях проводили с помощью оптической микроскопии. Статистический анализ выполнен с использованием программного обеспечения Microsoft Excel, для оценки различий между образцами использовали t-тест Стьюдента. Различия считали статистически значимыми при p < 0,05.
Результаты. Установлено, что для геля с минимальной концентрацией лизина (5%) выход аминокислоты в первые сутки составил почти 16% от исходного ее количества, а при длительном инкубировании геля доля десорбированного лизина относительно исходного количества уменьшалась. Получены статистически достоверные отличия между образцами альгинатных гелей с содержанием лизина 5 и 20% (p ≤ 0,05). При увеличении доли лизина в геле его выход снижался: чем большая концентрация лизина была в геле, тем меньшее количество его обнаруживали по истечении 7 сут инкубирования. Показано, что в образце геля с содержанием лизина 5% при инкубировании в большом объеме воды (соотношение геля по отношению к воде — 11%) уже за первый час инкубирования более 40% лизина десорбировалось в воду, т.е. лизин на 4,3% более интенсивно десорбируется из альгинатного геля по сравнению с аргинином. Установлена закономерность в виде снижения процента выхода лизина практически в два раза при увеличении соотношения геля к воде с 11 до 20%.
Выводы. В ходе выполнения исследования были сформированы альгинатные гели, модифицированные аминокислотами. Установлено, что чем больше концентрация аминокислоты в составе геля, тем менее интенсивно она выходит из него. Скорость выхода аминокислоты из геля прямо пропорциональна объему жидкости, в котором инкубировали гель. Фибробласты кожи человека лучше адгезировали на альгинатных гелях, модифицированных аминокислотами, по сравнению с клетками на альгинатных гелях без модификации. В результате исследования получены гели с контролируемой десорбцией аминокислот, способствующие адгезии фибробластов кожи человека.
Для цитирования:
Консон В.А., Барсук И.А., Нащекина Ю.А. Альгинатные гели, модифицированные природными аминокислотами, для регенеративной медицины. Медицина экстремальных ситуаций. 2025;27(2):229-234. https://doi.org/10.47183/mes.2025-294
For citation:
Konson V.A., Barsuk I.A., Nashchekina Yu.A. Alginate gels modified with natural amino acids for regenerative medicine. Extreme Medicine. 2025;27(2):229-234. https://doi.org/10.47183/mes.2025-294
ВВЕДЕНИЕ
Заживление ран является серьезной проблемой для систем здравоохранения во всем мире [1]. Использование раневых повязок может обеспечить физический барьер для предотвращения дальнейшего инфицирования в процессе заживления ран [2]. Идеальные раневые повязки должны быть биосовместимыми и биоразлагаемыми, предотвращать потерю биологических жидкостей, удалять экссудат, защищать рану от патогенов, демонстрировать хорошую воздухопроницаемость и влагопроницаемость, способствовать пролиферации клеток и ускорять заживление ран [3].
Альгинат — анионный линейный блочный полисахарид, состоящий из повторяющихся мономерных единиц (1-4)-β-D-маннуроновой кислоты (M) и (1-4)-α-L-гулуроновой кислоты (G), способный формировать достаточно удобные в применении гели [4]. Раневые повязки из альгината доступны в форме гидрогелей, пен, пленок, нановолокон и губок. Альгинатные повязки поглощают раневую жидкость, в результате чего образуются гели, которые поддерживают физиологически влажную среду и минимизируют тем самым присоединение/развитие бактериальных инфекций в ране [5]. Их можно адаптировать так, чтобы они были химически стабильными или разрушались при контакте с биологическими жидкостями в течение определенного периода времени. Гидрогели используются для заживления ран благодаря их биосовместимости, а также способности загружать и высвобождать биоактивные вещества умеренной пористости, высокого содержания воды и гибкости [6].
Успешное заживление ран сопровождается синтезом внеклеточного матрикса. Аргинин и лизин — незаменимые аминокислоты, которые участвуют в синтезе внеклеточного матрикса. Аргинин является α-аминокислотой, причем L-форма является одной из двадцати наиболее распространенных природных аминокислот. L-аргинин обладает множеством биологических активностей [7]. Аргинин выступает в роли одного из ключевых метаболитов, участвующих в процессах азотистого обмена, в частности в орнитиновом цикле, характерном для млекопитающих. Аргинин участвует в процессе синтеза оксида азота (NO), оказывающего множественные эффекты, начиная от противовоспалительного действия до влияния на сосуды (вазодилатация) и стимуляции процесса ангиогенеза. Благодаря биосовместимости и биоразлагаемости L-аргинин используют при разработке компонентов многих биомедицинских матриц [8]. Показано, что передозировка L-аргинина не сопровождается развитием серьезных побочных эффектов, поскольку избыток выводится с мочой в течение нескольких часов [8]. В то же время L-аргинин принимает активное участие в регенерации ран, поэтому пролонгированное и контролируемое введение этой аминокислоты является актуальной задачей регенеративной медицины [9].
Необходимо отметить, что аминокислота лизин также может улучшить заживление ран в организме. Лизин принимает участие в формировании коллагена, белка, который действует как каркас: поддерживает и придает структуру коже и костям. Лизин может действовать как связующее вещество, увеличивая количество новых клеток в ране [10].
Процесс восстановления поврежденных тканей достаточно длительный; в этой связи повысить эффективность регенерации, в том числе синтез нового внеклеточного матрикса, возможно путем дозированного ввода аминокислот в раневое ложе. Создание раневого покрытия, которое бы обладало не только барьерными, бактерицидными, но и регенерирующими свойствами, является актуальной задачей современной регенеративной медицины.
Цель исследования — формирование совместимых с фибробластами кожи альгинатных гелей, модифицированных природными аминокислотами аргинином и лизином, а также исследование скорости выхода данных аминокислот из геля.
МАТЕРИАЛЫ И МЕТОДЫ
Формирование гелей
Для экспериментов было подготовлено 3 вида водных растворов 3% альгината натрия (Sigma-Aldrich, США) с содержанием аминокислот аргинина или лизина (Sigma-Aldrich, США) в количестве 5, 10 и 20% от сухой массы альгината.
Аминокислоты добавляли в сухом виде, полученный раствор тщательно перемешивали на магнитной мешалке (Tagler MM 135H, Россия) при комнатной температуре на протяжении 10 мин. Далее раствор альгината с аминокислотой вносили в 24-луночную плату по 300 мкл геля на лунку. Для образования геля альгинат в лунках опрыскивали 10% раствором хлорида кальция (CaCl2) из распылителя и оставляли на 20 мин. при комнатной температуре.
После желирования гели трижды промывали деионизированной водой для удаления неабсорбированных гелем аминокислот. Затем гели заливали фиксированным объемом воды (600–2500 мкл) для последующего инкубирования и измерения количества вышедших из них аминокислот.
Для оценки стабильности гелей с лизином во времени их инкубировали в течение 1, 3 и 7 сут в 600 мкл воды при комнатной температуре.
Для оценки влияния объема жидкости, в котором находился гель, на скорость выхода аргинина из геля каждый образец объемом 300 мкл с содержанием аргинина 5, 10 и 20% от массы альгината выдерживали в 600, 1200 и 2500 мкл воды при комнатной температуре в течение 1 часа; альгинатный гель по отношению к воде занимал 33, 20 и 11%. Для сравнения выхода аргинина и лизина гели инкубировали в течение 1 часа в 600 мкл воды при комнатной температуре.
Определение количества вышедших из гелей аминокислот
Количество вышедших из гелей аминокислот оценивали спектрофотометрическим методом (спектрофотометр ПЭ-5400УФ, «Экрос», Россия). Для этого проводили нингидриновую реакцию, в ходе которой происходило взаимодействие аминогрупп с нингидрином. Далее измеряли оптическую плотность продукта реакции: фиолетово окрашенного комплекса при длине волны 400 нм. Данный метод очень чувствителен и позволяет определить аминокислоты в малых концентрациях [11].
Для построения калибровочных графиков зависимости оптической плотности от концентрации аминокислоты были приготовлены следующие растворы: 0,2% раствор нингидрина (Sigma-Aldrich, США) в деионизированной воде, 0,2% растворы лизина и аргинина в деионизированной воде. Растворы лизина и аргинина в концентрации 0,2% использовали по пять проб объемом 50, 100, 200, 300 мкл, в которых содержалось 0,1; 0,2; 0,4; 0,6 мкг аминокислоты соответственно. В каждую пробирку добавляли по 250 мкл раствора нингидрина. Затем пробирки помещали в термостат и инкубировали при температуре 100 °С на 3 мин. Объем растворов в каждой пробирке доводили до 6 мл деионизированной водой и измеряли оптическую плотность растворов при длине волны 400 нм. По полученным значениям строили калибровочные кривые зависимости оптической плотности раствора от количества аминокислот в растворе.
Количество вышедших из гелей аминокислот в экспериментах было рассчитано с помощью калибровочных кривых, для этого в каждом опыте отбирали по 500 мкл жидкости, в которой инкубировали гели. В пробирки с жидкостью добавляли по 250 мкл раствора нингидрина, далее пробирки помещали в термостат при t = 100 °С на 3 мин. Объем растворов в каждой пробирке доводили до 6 мл деионизированной водой и измеряли оптическую плотность растворов на спектрофотометре при длине волны 400 нм.
Исследования in vitro
В качестве модельных объектов в работе была использована клеточная линия DF2 (фибробласты кожи человека, «Коллекция культур клеток позвоночных» ИНЦ РАН). Для экспериментов с клетками альгинат предварительно стерилизовали под действием озона. После приготовления стерильных гелей с 5% содержанием аминокислот на гели диаметром 1 см наносили суспензию клеток объемом 300 мкл, содержание клеток в которой составило 30 000 клеток на лунку, и инкубировали в среде DMEM/F-12 («Биолот», Россия) с содержанием 10% эмбриональной телячьей сыворотки (FBS) (Gibco, США) в течение 3 сут. Фиксацию результатов проводили фотосъемкой с помощью инвертированного микроскопа (Nikon eclipse, TS 100, Япония).
Статистический анализ выполнен с использованием программного обеспечения Microsoft Excel, для оценки статистически значимых различий между конкретными образцами использовали t-тест Стьюдента. Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние сроков инкубирования на процент выхода лизина из альгинатного геля
Первоначально исследовали кинетику десорбции лизина из альгинатных гелей. Гели с разным содержанием лизина (5, 10 и 20%) инкубировали в воде в течение 7 сут. При сравнении влияния сроков инкубирования на количество связанного с гелем лизина было выявлено, что для геля с минимальной концентрацией лизина (5%) выход аминокислоты в первые сутки составил почти 16% от исходного ее количества; соответствующие данные представлены на рисунке 1. При более длительном инкубировании геля доля десорбированного лизина относительно исходного количества уменьшалась. Однако статистически достоверные отличия обнаружили между образцами с содержанием лизина 5 и 20%. Очевидно, этот результат обусловлен концентрационным равновесием, которое возникает в системе при длительном инкубировании гелей в воде.
Далее в течение 7 сут количество вышедшего из геля лизина не менялось. При увеличении доли лизина в геле его выход снижался в течение всей недели: чем больше лизина было в геле, тем меньшее количество его обнаруживали по истечении 7 сут инкубирования. Это можно объяснить тем, что между гелем и раствором установилось концентрационное равновесие.
При изучении влияния объема жидкости, в которой инкубировали гель, на процент выхода лизина установлено, что чем больше объем воды, в которой инкубировали гель, тем больше аминокислоты десорбируется из геля. На рисунке 2 показано, что выход лизина из геля увеличивался при увеличении объема жидкости, в которой его инкубировали.
Так, в образце геля с содержанием лизина 5% при инкубировании в большом объеме воды (соотношение геля по отношению к воде — 11%) уже за первый час инкубирования более 40% лизина десорбировалось в воду. Однако при увеличении доли геля по отношению к воде в три раза, до 33%, наблюдали уменьшение интенсивности выхода лизина до 15%, что приблизительно в три раза меньше по сравнению с образцом, где соотношение геля к воде составило 11%. В данном случае также прослеживается закономерность снижения процента выхода лизина в два раза при увеличении соотношения геля к воде с 11 до 20%. Отмеченные изменения можно объяснить тем, что в процессе выхода лизина из геля происходило насыщение окружающего водного раствора аминокислотой и уменьшение скорости десорбции лизина.
Сравнение процента выхода лизина и аргинина из геля спустя 1 час инкубации
В организме человека есть две аминокислоты, которые участвуют в метаболизме и построении новых белков. Поэтому присутствие обеих аминокислот может способствовать более быстрой регенерации тканей. Поскольку лизин и аргинин имеют разные структурные особенности, следует ожидать, что способность их десорбироваться из гелей также будет различной.
При инкубировании гелей как с лизином, так и с аргинином в 600 мкл воды установлено, что лизин выходил из геля интенсивнее, чем аргинин (рис. 3). Причем выход лизина варьировал от 15 до 11% в зависимости от исходного его содержания, а выход аргинина — с 14 до 7% для образцов гелей с содержанием аминокислоты от 5 до 20%.
При увеличении объема воды с 600 до 2500 мкл при инкубировании гелей разницы в интенсивности десорбции между аргинином и лизином обнаружено не было.
На основании результатов, представленных на рисунках 3 и 4, установлено, что при инкубировании гелей в небольшом объеме воды (600 мкл) лизин из геля выходил быстрее, чем аргинин, в среднем на 4,3%. При увеличении объема воды до 2500 мкл статистически достоверных отличий между десорбцией аргинина и лизина обнаружено не было. Также следует отметить, что для обеих аминокислот интенсивность их десорбции из альгинатного геля увеличивается в несколько раз при увеличении объема воды с 600 до 2500 мкл.
Для объяснения полученных результатов необходимо рассмотреть структуру молекул этих аминокислот. Благодаря своему строению молекула аргинина способна придавать белкам бóльшую стабильность, чем лизин [10]. Гуанидиновая группа аргинина обеспечивает взаимодействие с другими молекулами в трех различных направлениях, в то время как дополнительная аминогруппа лизина — только в одном направлении. Эта особенность позволяет аргинину образовывать множество электростатических и водородных связей и обеспечивать более прочное взаимодействие, чем лизин [12].
Следует принять во внимание также ионное взаимодействие, которое у аргинина должно быть более стабильным, особенно при высоких значениях pH, в связи с более высокой константой диссоциации кислоты (pKa) по сравнению с лизином [13].
Нужно отметить, что дальнейшее увеличение содержания аминокислот в растворе альгината препятствовало образованию геля. При проведении эксперимента необходимо было учесть, что вязкость альгината зависит от кислотности среды. Так, по данным KY Lee & Mooney, она увеличивается при уменьшении кислотности, достигая максимума при значении pH 3–3,5 [14].
При физиологических условиях (pH = 7) аминокислоты L-аргинин и L-лизин имеют положительный заряд. Однако при измерении pH растворов альгината с этими аминокислотами оказалось, что его значение равно 11. Несмотря на большое значение pKa, особенно для аргинина, это могло оказать влияние как на заряд аминокислот, так и на стабильность альгинатного геля [15][16].
Фибробласты кожи человека наносили на поверхность альгинатных гелей и анализировали гели с помощью оптической микроскопии (рис. 5). В качестве контроля использовали поверхность культурального пластика. Как видно на рисунке 5, после 3 сут культивирования клетки на пластике имели веретеновидную форму, характерную для фибробластоподобных клеток. При нанесении суспензии клеток на альгинатные гели без модификации мы не наблюдали клеток на гелях, все клетки мигрировали на поверхность культурального пластика и пролиферировали только на поверхности культурального сосуда. При нанесении клеточной суспензии на альгинатные гели, модифицированные аминокислотами, клетки адгезировали на гели, однако их морфология имела сферическую форму. Действительно, такая форма типична для клеток, культивируемых на альгинатных гелях, поскольку отрицательный заряд альгината препятствует распластыванию клеток, но присутствие в гелях таких положительно заряженных аминокислот, как лизин и аргинин, способствовало достаточно высокой адгезии клеток к модифицированным альгинатным гелям. Следовательно, внесение аминокислот в альгинатные гели, модифицированные аминокислотами, способствует адгезии клеток.
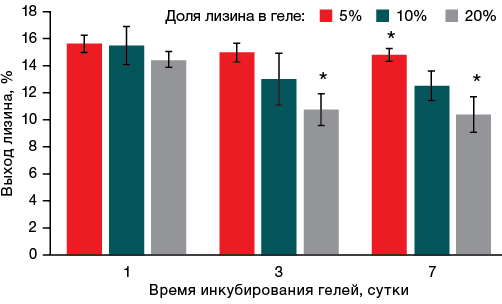
Рисунок подготовлен авторами по собственным данным
Рис. 1. Кинетика выхода лизина из гелей
Примечание: * уровень статистической значимости p ≤ 0,05.
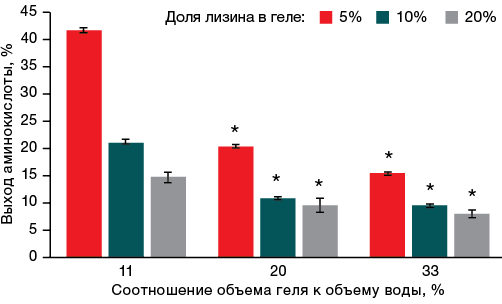
Рисунок подготовлен авторами по собственным данным
Рис. 2. Влияние соотношения геля и воды на количество десорбированного лизина из геля
Примечание: * уровень статистической значимости p ≤ 0,05.
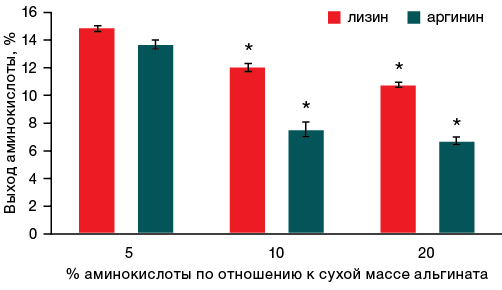
Рисунок подготовлен авторами по собственным данным
Рис. 3. Динамика выхода аминокислот из геля с различным соотношением аминокислоты и альгината спустя 1 час инкубации в 600 мкл жидкости
Примечание: * уровень статистической значимости p ≤ 0,05.
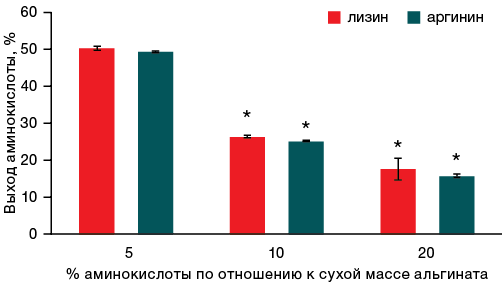
Рисунок подготовлен авторами по собственным данным
Рис. 4. Динамика выхода аминокислот из геля с различным соотношением аминокислоты и альгината спустя 1 час инкубации в 2500 мкл жидкости
Примечание: * уровень статистической значимости p ≤ 0,05.

Рисунок подготовлен авторами по собственным данным
Рис. 5. Оптическая микроскопия клеток линии DF2 на альгинатных гелях
Примечание: стрелкой показаны клетки на поверхности чашки и внутри геля.
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований были сформированы гели, модифицированные природными аминокислотами — аргинином и лизином. Было показано, что варьирование содержания аминокислот в составе модифицированного альгинатного геля может контролировать скорость десорбции аминокислоты из геля: чем выше концентрация аминокислоты, тем меньше аминокислоты выходит из геля. Также интенсивность десорбции аминокислоты можно повысить, увеличивая объем воды. Скорость десорбции лизина выше скорости десорбции аргинина из альгинатного геля. Достаточно высокая адгезионная способность фибробластов кожи человека к альгинатным гелям, модифицированным аминокислотами, позволяет сделать предположение, что такие раневые покрытия могут быть использованы не только как носители для трансплантируемых клеток, но и будут способствовать миграции собственных клеток пациента из граничащих с раневым ложем окружающих тканей.
Список литературы
1. Dong R, Guo B. Smart wound dressings for wound healing. Nano Today 2021;41:101290. https://doi.org/10.1016/j.nantod.2021.101290
2. Teoh JH, Tay SM, Fuh J, Wang CH. Fabricating scalable, personalized wound dressings with customizable drug loadings via 3D printing. J Contr Release. 2022;341:80. https://doi.org/10.1016/j.jconrel.2021.11.017
3. Liang Y, Liang Y, Zhang H, Guo B. Antibacterial biomaterials for skin wound dressing. Asian J Pharm Sci 2022;17(3):353. https://doi.org/10.1016/j.ajps.2022.01.001
4. Wang L, Sun L, Gu Z, Li W, Guo L, Ma S, et al. N-carboxymethyl chitosan/sodium alginate composite hydrogel loading plasmid DNA as a promising gene activated matrix for in-situ burn wound treatment. Bioactive Mat. 2022;15:330–42. https://doi.org/10.1016/j.bioactmat.2021.12.012
5. Song J, Chen Z, Liu Z, Yi Y, Tsigkou O, Li J, Li Y. Controllable release of vascular endothelial growth factor (VEGF) by wheel spinning alginate/silk fibroin fibers for wound healing. Mat & Des. 2021;212:110231. https://doi.org/10.1016/j.matdes.2021.110231
6. Sikareepaisan P, Ruktanonchai U, Supaphol P. Preparation and characterization of asiaticoside-loaded alginate films and their potential for use as effectual wound dressings. Carbohydr Polym 2011;83:1457. https://doi.org/10.1016/j.carbpol.2010.09.048
7. Wu G, Jaeger LA, Bazer FW, Rhoads JM. Arginine deficiency in preterm infants: biochemical mechanisms and nutritional implications. J Nutr Biochem 2004;15(8):442. https://doi.org/10.1016/j.jnutbio.2003.11.010
8. Trischitta F, Pidala P, Faggio C. Nitric oxide modulates ionic transport in the isolated intestine of the eel, Anguilla anguilla. Comp Biochem Physiol A Mol Integr Physiol. 2007;148A(2):368. https://doi.org/10.1016/j.cbpa.2007.05.025
9. Gould AN, Candy GP. The Role of l-Arginine in Wound Healing. L-Arginine in Clinical Nutrition. Nutrition and Health. Humana Press, Cham; 2017. https://doi.org/10.1007/978-3-319-26009-9_45
10. Zhang L, Yao K, Wei J, Li G, Lin Y, Zhou YL, Yang Y. Convenient in situ synthesis of injectable lysine-contained peptide functionalized hydrogels for spinal cord regeneration. Appl Mat Today 2022;27:101506. https://doi.org/10.1016/j.apmt.2022.101506
11. Nashchekina YA, Kurdyukova KE, Zorin IM, Mikhailova NA, Bilibin AY. Spectrophotometric Evaluation of L-Lysine Concentrations in Water–Organic Solutions. Tech Phys 2018;63:1341. https://doi.org/10.1134/S106378421809013X
12. Shi J, Zhang J, Shen Y, Tang L, Zhao J, Tu J, et al. Arginine-stabilized mPEG-PDLLA (50/50) polymeric micelles of docetaxel by electrostatic mechanism for tumor-targeted delivery. Drug Delivery 2015;22(2):168–81. https://doi.org/10.3109/10717544.2013.849779
13. André I, Linse S, Mulder FA. Residue-specific pKa determination of lysine and arginine side chains by indirect 15N and 13C NMR spectroscopy: application to apo calmodulin. J Am Chem Soc. 2007;129(51):15805. https://doi.org/10.1021/ja0721824
14. Lee KY, Mooney DJ. Alginate: properties and biomedical applications. Prog Polym Sci. 2012;37(1):106. https://doi.org/10.1016/j.progpolymsci.2011.06.003
15. Li L, Vorobyov I, Allen TW. The different interactions of lysine and arginine side chains with lipid membranes. J Phys Chem B. 2013;117(40):11906–20. https://doi.org/10.1021/jp405418y
16. Eldin M, Kamoun M, Sofan EA. Mamdouh A,Elbayomi Smaher M. l-Arginine grafted alginate hydrogel beads: A novel pH-sensitive system for specific protein delivery. Arab J Chem. 2015;8:355. https://doi.org/10.1016/j.arabjc.2014.01.007
Об авторах
В. А. КонсонРоссия
Консон Валентина Александровна
Санкт-Петербург
И. А. Барсук
Россия
Барсук Илья Александрович
Москва
Ю. А. Нащекина
Россия
Нащекина Юлия Александровна, канд. биол. наук
Санкт-Петербург
Дополнительные файлы
Рецензия
Для цитирования:
Консон В.А., Барсук И.А., Нащекина Ю.А. Альгинатные гели, модифицированные природными аминокислотами, для регенеративной медицины. Медицина экстремальных ситуаций. 2025;27(2):229-234. https://doi.org/10.47183/mes.2025-294
For citation:
Konson V.A., Barsuk I.A., Nashchekina Yu.A. Alginate gels modified with natural amino acids for regenerative medicine. Extreme Medicine. 2025;27(2):229-234. https://doi.org/10.47183/mes.2025-294

















