Перейти к:
Роль регуляторных Т-лимфоцитов в формировании иммуносупрессивного микроокружения при глиобластоме
https://doi.org/10.47183/mes.2025-299
Аннотация
Введение. Глиобластома является серьезнейшей проблемой для современной нейроонкологии, поскольку представляет собой наиболее частую опухоль центральной нервной системы с крайне неблагоприятным прогнозом для пациентов. Применяемая в настоящий момент стандартная терапия недостаточно эффективна, поэтому существует необходимость в создании новых подходов.
Цель. Анализ механизмов функционирования регуляторных T-лимфоцитов (Treg) в микроокружении опухоли как потенциальной мишени для терапии, а также выявление перспективных терапевтических методов, используемых для снижения супрессорного действия регуляторных T-лимфоцитов при глиобластоме.
Обсуждение. Устойчивость глиобластомы к противоопухолевому иммунитету и низкая эффективность некоторых видов лечения во многом обусловлена иммуносупрессивным микроокружением опухоли, одним из ключевых компонентов которого являются Treg. Они подавляют противоопухолевый ответ посредством секреции противовоспалительных цитокинов, перфоринов и гранзимов, а также экспрессии ингибиторных молекул. Препараты, селективно воздействующие на метаболические пути активации, дифференцировки и миграции регуляторных T-клеток, способны снижать их активность и общее число в микроокружении.
Выводы. Treg могут выступать в качестве мишени для терапии, направленной на подавление иммуносупрессивного опухолевого микроокружения, снижение активности и прогрессирования глиобластомы. Новые подходы таргетной терапии могут внести изменения в существующие стандарты лечения глиобластомы.
Ключевые слова
Для цитирования:
Янышева Э.П., Баклаушев В.П., Юсубалиева Г.М. Роль регуляторных Т-лимфоцитов в формировании иммуносупрессивного микроокружения при глиобластоме. Медицина экстремальных ситуаций. 2025;27(2):183-190. https://doi.org/10.47183/mes.2025-299
For citation:
Yanysheva E.P., Baklaushev V.P., Yusubalieva G.M. Role of regulatory T lymphocytes in the formation of immunosuppressive microenvironment in glioblastoma. Extreme Medicine. 2025;27(2):183-190. https://doi.org/10.47183/mes.2025-299
ВВЕДЕНИЕ
Глиобластома — самая распространенная и агрессивная опухоль головного мозга, характеризующаяся крайне высокой летальностью. В среднем медиана выживаемости пациентов составляет 13,5 месяца, а общая пятилетняя выживаемость — около 5,8% [1].
В соответствии с классификацией ВОЗ 2021 года глиобластома относится к диффузным глиомам IV степени злокачественности (Grade IV). Дифференцируют первичную форму глиобластомы, возникающую de novo, и вторичную, которая развивается в результате прогрессирования глиом более низкой степени злокачественности (Grade II и III). При этом первичный тип встречается чаще (до 90% от общего числа случаев), отличается высокой инвазивностью и стремительным развитием [2].
К факторам, которые могут провоцировать развитие злокачественных глиом головного мозга, относят генетические аберрации, вирусные инфекции (цитомегаловирус, герпес и др.) и ионизирующее излучение, а также наличие в анамнезе синдрома Туркота, нейрофиброматоза I и II типа или туберозного склероза [3]. При этом с возрастом риск развития заболевания повышается вследствие снижения эффективности процессов репарации ДНК и ослабления иммунного ответа [4].
В качестве стандартного лечения пациентов с глиобластомой применяется хирургическая резекция опухоли, радиотерапия и химиотерапия темозоломидом. Хирургическое вмешательство осложняется тем, что для глиобластомы характерен инвазивный рост, препятствующий полному иссечению патологической ткани, что впоследствии может приводить к рецидивам заболевания. Прогноз для каждого отдельно взятого пациента индивидуален и зависит от многих факторов (локализации новообразования, подтипа опухоли, времени постановки диагноза и начала терапии и т. д.). Химио- и радиотерапия во многих случаях сопровождается формированием резистентности [5]. Таким образом, стандартная терапия, используемая в настоящее время, является недостаточно эффективной, обладает рядом негативных побочных эффектов и нередко приводит к рецидивам [6]. При этом в случае повторного возникновения опухоль зачастую имеет более агрессивный характер течения и повышенную терапевтическую резистентность [7].
Сравнительно высокая устойчивость глиобластомы к разным видам терапии вызвана гетерогенностью опухоли и иммуносупрессивным микроокружением [8]. Поэтому остро стоит вопрос разработки новых методов лечения, учитывающих особенности, характерные для глиобластомы. В этом отношении большим потенциалом обладает иммунотерапия [9]. Посредством данного терапевтического подхода возможно напрямую или опосредованно модулировать иммунный ответ, стимулируя естественный противоопухолевый иммунитет пациента и снижая выраженную иммуносупрессию в очаге глиомы для повышения эффективности других видов лечения в составе комбинированной терапии.
Цель исследования — анализ механизмов функционирования регуляторных T-лимфоцитов (Treg) в микроокружении опухоли как потенциальной мишени для терапии, а также выявление перспективных терапевтических методов, используемых для снижения супрессорного действия регуляторных T-лимфоцитов при глиобластоме.
МАТЕРИАЛЫ И МЕТОДЫ
Поиск литературы осуществлялся в базах данных PubMed, Google Academy и eLibrary по ключевым словам «глиобластома», «глиома», «регуляторные T-лимфоциты», «иммуносупрессия», «микроокружение» и «иммунотерапия». Преимущественно приведены исследования, опубликованные за последние 5 лет.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Иммуносупрессивное микроокружение при глиобластоме
По мере развития глиобластомы происходит формирование опухолевого микроокружения (tumor microenvironment, TME), играющего важную роль в инициировании неоваскуляризации, прогрессии, инвазии и метастазировании глиомы [10]. В результате этого процесса образуется сложная гетерогенная система, состоящая из собственно опухолевых клеток, а также экстрацеллюлярного матрикса, фибробластов, эндотелиоцитов, перицитов, иммунных клеток и выделяемых этими клетками сигнальных молекул [11]. По данным M. Dinevska et al., компоненты TME взаимодействуют друг с другом и опухолевыми клетками посредством межклеточных контактов и секреции различных цитокинов, хемокинов и факторов роста [12].
R.Qiu, Y.Zhong et al. отмечают, что глиобластома значительно влияет на иммунные клетки и моделирует их фенотип, секретируя целый спектр биологически активных молекул [13]. В свою очередь, иммунные клетки микроокружения поддерживают высокий уровень иммуносупрессии в микросреде глиомы, что способствует опухолевой прогрессии.
В очаге глиобластомы присутствуют иммунные клетки, функцией которых является воспаление и противоопухолевый ответ: цитотоксические T-лимфоциты (ЦТЛ), натуральные киллеры, T-хелперы, дендритные клетки, B-лимфоциты, нейтрофилы, моноциты и М-1-поляризованные макрофаги. Инфильтрация опухоли эффекторными клетками имеет положительное прогностическое значение при глиобластоме [14]. Но зачастую клетки, присутствующие в TME, характеризуются сниженной противоопухолевой активностью или приобретают проопухолевый фенотип под воздействием глиомы.
Микроокружение, сформированное под влиянием глиобластомы, способствует успешному ускользанию опухоли от иммунологического надзора, приводя к подавлению активации и пролиферации цитотоксических T-лимфоцитов и NK-клеток, B-лимфоцитов, нарушению презентации опухолевых антигенов на главном комплексе гистосовместимости (major histocompatibility complex, MHC) дендритных клеток и привлечению в микроокружение регуляторных T-клеток [15]. Отсутствие достаточного уровня презентации антигенов, ассоциированных с глиобластомой, закономерно ведет к низкой эффективности адаптивного иммунного ответа.
Клетки, главным образом обеспечивающие иммуносупрессию в опухолевом микроокружении, — опухоль-ассоциированные макрофаги (tumor-associated macrophages, TAMs), супрессорные клетки миелоидного происхождения (myeloid-derived suppressor cell, MDSCs) и регуляторные T-лимфоциты (regulatory T cells, Treg) [16][17].
Опухоль-ассоциированные макрофаги, включающие в себя микроглию головного мозга и макрофаги периферического происхождения, являются наиболее многочисленными неопухолевыми популяциями в микроокружении опухоли при глиобластоме. Популяция макрофагов обладает пластичностью: клетки могут поляризоваться как в провоспалительный, так и в противовоспалительный фенотип [18].
Супрессорные клетки миелоидного происхождения представляют собой гетерогенную популяцию миелоидных клеток-предшественников на разных стадиях дифференцировки, которые вызывают ингибирование активности цитотоксических T-лимфоцитов, подавление функции NK-клеток, макрофагов и дендритных клеток, а также индукцию регуляторных T- и B-лимфоцитов в опухолевом микроокружении [19].
Регуляторные T-лимфоциты — основная популяция клеток, с одной стороны, поддерживающая гомеостаз иммунной системы, с другой стороны, играющая ключевую роль в ускользании глиобластомы от иммунного ответа. Таким образом, регуляторные T-клетки представляют интерес в качестве мишени для терапии злокачественных глиом, но неселективное воздействие на популяцию Treg сопряжено со многими побочными эффектами.
В микроокружении глиобластомы MDSC, TAM и Treg вступают в синергию, дополняя и усиливая проопухолевые эффекты друг друга. Регуляторные T-лимфоциты стимулируют поляризацию опухоль-ассоциированных макрофагов, а TAM, в свою очередь, поддерживают супрессивную активность Treg [20]. Также Treg усиливают экспансию и ингибиторную функцию супрессорных клеток миелоидного происхождения; MDSC же способствуют пролиферации и индукции регуляторных T-клеток [21].
Авторы M. Iglesias-Escudero, N. Arias-González et al. сообщают о регуляторных B-лимфоцитах и регуляторных NK-клетках как о компонентах иммуносупрессивного микроокружения [22]. Регуляторные B-клетки осуществляют функции иммунорегуляции посредством секреции цитокинов и межклеточных контактов. В опухолевом микроокружении регуляторные B-клетки ингибируют эффекторные T-лимфоциты, индуцируя активацию Treg и воздействуя на другие клетки, инфильтрирующие TME, такие как MDSC, NK-клетки и макрофаги [23]. NK-клетки в микроокружении опухоли могут выполнять регуляторную функцию, оказывая влияние на созревание дендритных клеток и приводя к снижению активации ЦТЛ [24].
Популяция регуляторных T-лимфоцитов
Регуляторные T-клетки представляют собой субпопуляцию CD4+ T-лимфоцитов и выполняют функции контроля продолжительности иммунного ответа и поддержания доминантной иммунологической толерантности к собственным антигенам. Нарушение нормального функционирования Treg играет важную роль в патогенезе реакции «трансплантат против хозяина», аутоиммунных, аллергических и онкологических заболеваний [25].
Регуляторные T-лимфоциты имеют достаточно широкий репертуар специфичностей T-клеточных рецепторов (T-cell receptor, TCR) и преимущественно распознают собственные пептиды. Большая часть Treg образуется в тимусе как функционально зрелые T-лимфоциты (естественные Treg), а меньшая часть — индуцируется из наивных T-клеток после антиген-зависимой дифференцировки на периферии (адаптивные Treg) [26]. Популяция естественных регуляторных T-лимфоцитов обеспечивает толерантность к аутоантигенам, в то время как адаптивные Treg ограничивают воспаление при инфекции и подавляют патологический иммунный ответ, связанный с трансплантацией и аллергическими состояниями.
Популяция Treg высоко гетерогенна: экспрессия многих мембранных и внутриклеточных маркеров этих клеток, включая FOXP3 и CD25, значительно варьирует в зависимости от ряда факторов, в том числе от функционального состояния клеток, тканевой локализации, наличия патологии и присутствия в среде цитокинов [27].
Маркеры CD3, CD4, CD25, CD127 и FOXP3 являются основными необходимыми маркерами для определения Treg-клеток человека. Окрашивание на Ki67 и CD45RA дает дополнительную информацию о статусе активации Treg. Каждый из маркеров регуляторных T-лимфоцитов несет свое функциональное значение и необходим для корректной работы клеток:
- мультипротеиновый комплекс CD3 представляет собой основной корецептор T-клеточного рецептора и экспрессируется на поверхности мембраны всех субпопуляций T-лимфоцитов;
- трансмембранный гликопротеин надсемейства иммуноглобулинов CD4 играет роль корецептора αβ-TCR, принимая участие в распознавании представляемого антигенпрезентирующими клетками антигена;
- протеин CD25 является альфа-субъединицей низкоаффинного рецептора к противовоспалительному цитокину IL-2 и обнаруживается на Treg, а также на активированных B-клетках, NK-клетках, миелоидных предшественниках и олигодендроцитах;
- транскрипционный фактор forkhead box protein P3, или скурфин (FOXP3), является специфическим белком для активированных CD4+CD25+ Стабильная экспрессия FOXP3 необходима для регуляции дифференцировки и функций регуляторных T-лимфоцитов. Дефекты в гене FOXP3 приводят к дефициту или отсутствию нормально функционирующих Treg. Но также FOXP3 имеет важное значение для функционирования Treg и в опухолевом микроокружении [28];
- CD127 представляет собой альфа-цепь рецептора IL-7. Было выявлено, что для регуляторных T-клеток его экспрессия обратно пропорциональна экспрессии FOXP3, поэтому CD127 используется в качестве отрицательного маркера Treg.
Среди CD4+CD25+ лимфоцитов выделяют клетки со стабильной и нестабильной экспрессией транскрипционного фактора FOXP3. При этом клетки, не экспрессирующие FOXP3, не проявляют супрессорных свойств. Было отмечено, что для некоторого процента общей популяции Treg существует возможность трансформации Treg/Tconv [29], то есть клеток, обладающих супрессорными эффектами, и нерегуляторными T-хелперами.
Роль регуляторных T-клеток в опухолевом микроокружении
Регуляторные T-лимфоциты, функционирование которых необходимо для поддержания адекватного уровня иммунного ответа, являются также важным компонентом опухолевого микроокружения. Treg проявляют значительную пластичность и функциональное разнообразие в различных опухолях в пределах микроокружения [30].
Долгое время головной мозг считался органом, изолированным от периферической иммунной системы, но в настоящий момент все чаще признается вовлеченным в структуру системного иммунитета. Интеграция и взаимодействие мозга с компонентами периферического иммунитета требуют строгого контроля и тонкой регуляции. Ключевой популяцией, обеспечивающей дополнительные механизмы иммунорегуляции в мозге, являются регуляторные T-лимфоциты [31]. Но в случае развития злокачественных новообразований Treg могут способствовать развитию опухоли и ее ускользанию от иммунного надзора. На поздних стадиях развития высокозлокачественных глиом часто происходит повреждение гематоэнцефалического барьера, что дополнительно способствует миграции Treg и других иммунных клеток в периопухолевое пространство [32].
Опухоли, и в частности глиомы, поддерживают высокий уровень иммуносупрессии в микроокружении за счет инфильтрации регуляторными клетками. Авторами L.G. Richardson et al. отмечено, что при IDH-мутантной глиоме инфильтрация TME Treg менее выражена по сравнению с более агрессивной глиобластомой IDH-дикого типа [33]. В очаге опухоли накапливается большое количество Treg посредством селективного, опосредованного хемокинами, рекрутирования периферических T-лимфоцитов. Отмечено, что Treg у пациентов с глиобластомой имеют значительно более высокие уровни экспрессии рецептора CCL2 CCR4, чем Treg у здоровых людей [34]. Помимо привлечения периферических регуляторных T-клеток, опухоли стимулируют приобретение регуляторного фенотипа наивными CD4+ T-клетками [35]. Было установлено, что кондиционированная среда глиобластомы может способствовать экспансии Treg in vitro, что указывает на прямое влияние факторов, продуцируемых клетками опухоли, на регуляторные T-лимфоциты [36].
Регуляторные T-лимфоциты оказывают иммуносупрессивное действие в опухолевом микроокружении за счет нескольких основных механизмов (рис. 1).
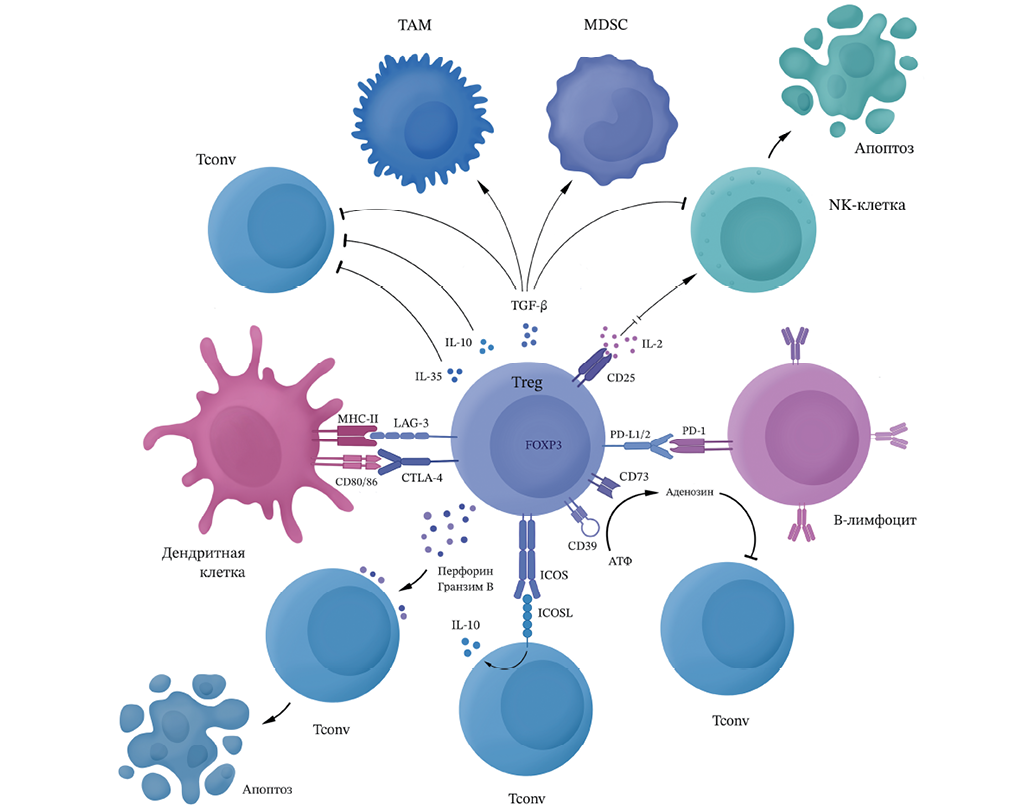
Рисунок подготовлен авторами по данным источника [37]
Рис. 1. Механизмы иммуносупрессивного действия регуляторных T-лимфоцитов в опухолевом микроокружении
Регуляторные T-клетки вырабатывают гранзим В и перфорин, воздействуя на эффекторные клетки и стимулируя их апоптоз.
- Treg секретируют ингибирующие цитокины TGF-β, IL-10, и IL-35, которые подавляют активность ЦТЛ, связываясь с рецепторами на поверхности CD8+клеток.
- Цитотоксический Т-лимфоцитарный белок 4 (CTLA-4) на мембране регуляторных T-лимфоцитов конкурирует с CD80/CD86 на поверхности T-киллеров, что приводит к подавлению их активности и способствует секреции индоламин-2,3-диоксигеназы (IDO); IDO активирует сигнальные пути апоптоза эффекторных T-клеток. Также взаимодействие CTLA-4 и LAG-3 с CD80/CD86 и MHC-II на поверхности дендритных клеток приводит к подавлению их созревания и снижению эффективной презентации антигенов.
- ICOS (индуцируемый костимулятор T-лимфоцитов) на поверхности Treg связывается с ICOSL (лиганд индуцируемого костимулятора) на мембране эффекторных клеток, стимулируя выработку противовоспалительного цитокина IL-10.
- Эктонуклеотидазы CD39/CD73 на мембране Treg превращают АТФ в аденозин, связывающийся с рецепторами ЦТЛ, что приводит к снижению их функциональной активности.
Ускользание глиобластомы от противоопухолевого иммунитета регуляторные Т-клетки обеспечивают главным образом за счет ингибирования CD8+ цитотоксических лимфоцитов и снижения функциональной активности NK-клеток посредством межклеточных взаимодействий и секреции растворимых факторов [38]. Помимо этого, за счет выработки TGF-β и IDO и снижения секреции IL-2 и IFN-γ регуляторные T-лимфоциты могут подавлять антигенпрезентирующие клетки и повышать активность TAM и MDSC, что вносит существенный вклад в поддержание иммуносупрессивной микросреды в очаге глиомы. Также было отмечено, что транскрипционный фактор FOXP3 может индуцировать экспрессию гем-оксигеназы HO-1, что приводит к экспансии и повышению выживаемости популяции Treg, а также к снижению экспрессии провоспалительных цитокинов и подавлению пролиферации эффекторных T-лимфоцитов [39]. В дополнение к этому регуляторные T-клетки могут вызывать репликативное старение и гибель эффекторных CD4+ T-лимфоцитов, ЦТЛ, B-лимфоцитов и NK-клеток in vitro и in vivo [40].
TGF-β, секретируемый регуляторными T-лимфоцитами, не только участвует в поддержании иммуносупрессии, но и действует на опухолевые клетки, индуцируя экспрессию основных генов, связанных со стволовыми клетками глиомы (CD133, SOX2, NESTIN, MUSASHI1 и ALDH1A), а также сигнальный путь NF-κB-IL6-STAT3, что приводит к усилению канцерогенного потенциала и стволовости глиобластомы [41].
Множество механизмов иммуносупрессивного действия регуляторных T-лимфоцитов в микроокружении глиобластомы, с одной стороны, может служить основой для разработки таргетных препаратов, нацеленных на определенные метаболические пути и эффекты Treg, с другой стороны, подобное разнообразие создает сложности выбора необходимых точек воздействия для терапии.
Мишени регуляторных T-лимфоцитов для таргетной терапии
Регуляторные T-лимфоциты вносят существенный вклад в опухолевую прогрессию, инвазию и терапевтическую резистентность и могут выступать в качестве мишени для лечения пациентов с глиобластомой [42]. В настоящее время для таргетной терапии разрабатываются и проходят доклинические и клинические исследования препараты, направленные на различные типы мишеней и метаболические процессы Treg [43].
Системная деплеция регуляторных T-клеток может приводить к повышению противоопухолевого иммунитета, однако при этом сопровождается развитием тяжелых аутоиммунных реакций. Поэтому во многих исследованиях предпринимались попытки избирательного истощения регуляторных T-клеток только в опухоли, без воздействия на Tregs в здоровых тканях. Снижение активности и пролиферации эффекторных Т-клеток (в том числе за счет воздействия Treg) приводит к низкой эффективности, например, CAR-T-терапии. При этом было выявлено, что при комбинировании с терапией, направленной на истощение общего числа T-клеток, наблюдается повышение эффективности лечения CAR-T [44], а также радиоиммунотерапии [45].
Одним из подходов селективного воздействия на Treg являются препараты, нацеленные на рецепторы к определенным интерлейкинам, необходимым для функционирования регуляторных T-лимфоцитов. К таким, например, можно отнести препараты против альфа-цепи рецептора IL-2, CD25 [46]. Член суперсемейства рецепторов фактора некроза опухоли (TNF) OX40 (CD134) в основном экспрессируется CD4+ и CD8+ T-клетками, при этом инфильтрирующие опухоль Treg демонстрируют более высокую экспрессию OX40, чем периферические Treg. После активации TCR на TILs OX40 временно экспрессируется для передачи мощного костимулирующего сигнала, когда он связан с OX40L. Таким образом, агонисты OX40 могут усиливать противоопухолевый иммунитет [47]. Также в качестве мишени может выступать рецептор TNF CD27, а также его лиганд CD70 [48].
В качестве мишени для таргетных препаратов могут выступать метаболические пути активации и ингибирования регуляторных T-клеток, а также факторы транскрипции и различные костимулирующие молекулы [49]. К препаратам такого типа относятся, например, ингибиторы контрольных точек (CTLA-4, IDO, белка программированной клеточной смерти 1 или PD-1, T-клеточного иммуноглобулина 3 или Tim-3, сигнального пути STAT3 и др.), которые успешно применяют при некоторых злокачественных новообразованиях [50]. Рецептор CTLA-4 конститутивно экспрессируется на наивных Treg и других популяциях T-лимфоцитов, но в наибольшей степени его экспрессия выражена у опухоль-инфильтрирующих Treg. Моноклональные антитела против CTLA-4 могут истощать клетки Treg в опухолевом микроокружении посредством механизма антителозависимой клеточно-опосредованной цитотоксичности и тем самым усиливать противоопухолевый иммунитет [51]. У многих пациентов с глиобластомой лечение с помощью ICB (в том числе наиболее широко применяемых блокаторов PD-1 [52]) не показало достаточного эффекта, но, возможно, препараты нового поколения ингибиторов окажутся более эффективными [53].
Явление взаимной трансформации активированных Treg и нерегуляторных T-лимфоцитов, не экспрессирующих FOXP3 (Treg/Tconv), потенциально может быть использовано для терапии глиобластомы: смещение баланса в пользу неактивных регуляторных T-лимфоцитов снизит выраженность иммуносупрессии в микроокружении, что, в свою очередь, приведет к большей эффективности собственного иммунного ответа пациента и других видов терапии [54].
В настоящее время появляются данные о том, что Treg играют не такую однозначную роль в очаге опухоли, как считалось ранее. Многие исследования подтверждают противоопухолевую активность Treg и их корреляцию с улучшенным прогнозом при некоторых типах злокачественных новообразований (рак желудка, плоскоклеточный рак головы и шеи, колоректальный рак и др.) [55]. Регуляторные T-клетки, с одной стороны, подавляют воспалительные реакции, способствующие прогрессированию определенных видов опухолей, с другой стороны, некоторые субпопуляции Treg могут усиливать противоопухолевый иммунитет. Например, нацеливание на глюкокортикоид-индуцированный TNFR-связанный рецептор (GITR) регуляторных T-клеток с помощью агонистического антитела (α-GITR) способствует дифференцировке CD4+ Treg в эффекторные T-клетки. Перепрограммированные регуляторные T-лимфоциты экспрессируют гены, характерные для Th1, продуцируют IFN-γ и приобретают цитотоксическую активность против клеток глиомы, теряя при этом свою супрессорную функцию. В свою очередь, α-GITR и α-PD1 в сочетании со стандартным лечением впервые диагностированной глиобластомы повышали показатели выздоровления на экспериментальных моделях [56].
Помимо воздействия непосредственно на регуляторные T-лимфоциты, возможно влияние на привлечение Treg из периферической крови в микроокружение глиобластомы [57]. Модуляция взаимодействия хемокинов и рецепторов к ним может использоваться для разработки иммунотерапевтических препаратов для лечения злокачественных глиом.
ЗАКЛЮЧЕНИЕ
Выраженная иммуносупрессия и высокая клеточная гетерогенность в очаге глиобластомы препятствуют развитию естественного противоопухолевого ответа и снижают результативность применяемых стандартных методов лечения.
Регуляторные T-лимфоциты играют неоднозначную роль: с одной стороны, Treg необходимы для поддержания иммунного гомеостаза в организме, с другой стороны, в микроокружении глиобластомы регуляторные T-клетки обеспечивают ускользание опухоли от иммунологического надзора. За счет межклеточных контактов и секреции противовоспалительных цитокинов, перфоринов, гранзимов и других биологически активных молекул регуляторные T-лимфоциты подавляют активность и пролиферацию эффекторных клеток в микроокружении, способствуя росту и прогрессии глиобластомы.
Разработка эффективной и высокоселективной терапии злокачественных глиом в настоящее время остается актуальной задачей для исследователей. Испытания новых терапевтических препаратов и модифицированных схем лечения необходимы для повышения уровня жизни и общей выживаемости пациентов с глиобластомой, а также снижения частоты возникновения побочных эффектов и рецидивов заболевания. Регуляторные T-клетки вносят существенный вклад в подавление противоопухолевого иммунитета и могут выступать в качестве мишени для онкотерапии. Для снижения активности и общего числа Treg применяют препараты, воздействующие на рецепторы к интерлейкинам, хемокинам, костимулирующие молекулы, метаболические пути регуляторных T-клеток и т. д.
Помимо лечения, направленного на регуляторные T-лимфоциты, в настоящее время происходит разработка, а также доклинические и клинические испытания других подходов: CAR-T-терапии, дендритных вакцин, микроРНК, мРНК, терапии онколитическими вирусами и др. Стоит отметить, что результативность лечения пациентов с глиобластомой (в особенности иммунотерапии и терапии онколитическими вирусами) во многом зависит от уровня локальной и системной супрессии иммунного ответа, что требует внимания при индивидуальном подборе терапии.
Более глубокое изучение функционального разнообразия и особенностей метаболизма регуляторных T-лимфоцитов как ключевого компонента опухолевой иммуносупрессии, а также исследование их взаимодействия с другими клетками в микроокружении может открыть новые возможности для терапии злокачественных глиом. В будущем применение различных терапевтических методов в составе комбинированного лечения, в том числе с таргетными препаратами Treg, может продемонстрировать большую эффективность в сравнении со стандартным подходом.
Список литературы
1. Marenco-Hillembrand L, Wijesekera O, Suarez-Meade P, Mampre D, Jackson C, Peterson J, et al. Trends in glioblastoma: outcomes over time and type of intervention: a systematic evidence based analysis. J Neurooncol. 2020;147:297–307. https://doi.org/10.1007/s11060-020-03451-6
2. Lah TT, Novak M, Breznik B. Brain malignancies: Glioblastoma and brain metastases. Seminars in Cancer Biology. 2020;60:262–73. https://doi.org/10.1016/j.semcancer.2019.10.010
3. Smith CJ, Perfetti TA, Chokshi C, Venugopal C, Ashford JW, Singh SK. Risk factors for glioblastoma are shared by other brain tumor types. Hum Exp Toxicol. 2024;43:9603271241241796. https://doi.org/10.1177/09603271241241796
4. Colopi A, Fuda S, Santi S, Onorato A, Cesarini V, Salvati M, et al. Impact of age and gender on glioblastoma onset, progression, and management. Mech Ageing Dev. 2023;211:111801. https://doi.org/10.1016/j.mad.2023.111801
5. Khan I, Mahfooz S, Elbasan EB, Karacam B, Oztanir MN, Hatiboglu MA. Targeting Glioblastoma: The Current State of Different Therapeutic Approaches. Curr Neuropharmacol. 2021;19:1701–15. https://doi.org/10.2174/1570159X19666210113152108
6. Wu W, Klockow JL, Zhang M, Lafortune F, Chang E, Jin L, et al. Glioblastoma multiforme (GBM): An overview of current therapies and mechanisms of resistance. Pharmacological Research. 2021;171:105780. https://doi.org/10.1016/j.phrs.2021.105780
7. Wang X, Ge Y, Hou Y, Wang X, Yan Z, Li Y, et al. Single-cell atlas reveals the immunosuppressive microenvironment and Treg cells landscapes in recurrent Glioblastoma. Cancer Gene Ther. 2024;31:790–801. https://doi.org/10.1038/s41417-024-00740-4
8. Lin H, Liu C, Hu A, Zhang D, Yang H, Mao Y. Understanding the immunosuppressive microenvironment of glioma: mechanistic insights and clinical perspectives. J Hematol Oncol. 2024;17:31. https://doi.org/10.1186/s13045-024-01544-7
9. Medikonda R, Dunn G, Rahman M, Fecci P, Lim M. A review of glioblastoma immunotherapy. J Neurooncol. 2021;151:41–53. https://doi.org/10.1007/s11060-020-03448-1
10. Bikfalvi A, da Costa CA, Avril T, Barnier J-V, Bauchet L, Brisson L, et al. Challenges in glioblastoma research: focus on the tumor microenvironment. Trends Cancer. 2023;9:9–27. https://doi.org/10.1016/j.trecan.2022.09.005
11. Bugakova AS, Chudakova DA, Myzina MS, Yanysheva EP, Ozerskaya IV, Soboleva AV, et al. Non-Tumor Cells within the Tumor Microenvironment — The «Eminence Grise» of the Glioblastoma Pathogenesis and Potential Targets for Therapy. Cells. 2024;13. https://doi.org/10.3390/cells13100808
12. Dinevska M, Widodo SS, Furst L, Cuzcano L, Fang Y, Mangiola S, et al. Cell signaling activation and extracellular matrix remodeling underpin glioma tumor microenvironment heterogeneity and organization. Cell Oncol (Dordr). 2023;46:589–602. https://doi.org/10.1007/s13402-022-00763-9
13. Qiu R, Zhong Y, Li Q, Li Y, Fan H. Metabolic Remodeling in Glioma Immune Microenvironment: Intercellular Interactions Distinct From Peripheral Tumors. Front Cell Dev Biol. 2021;9:693215. https://doi.org/10.3389/fcell.2021.693215
14. Pereira MB, Barros LRC, Bracco PA, Vigo A, Boroni M, Bonamino MH, et al. Transcriptional characterization of immunological infiltrates and their relation with glioblastoma patients overall survival. Oncoimmunology. 2018;7:1431083. https://doi.org/10.1080/2162402X.2018.1431083
15. Stepanenko AA, Sosnovtseva AO, Valikhov MP, Chernysheva AA, Abramova OV, Pavlov KA, et al. Systemic and local immunosuppression in glioblastoma and its prognostic significance. Front Immunol. 2024;15. https://doi.org/10.3389/fimmu.2024.1326753
16. Dapash M, Hou D, Castro B, Lee-Chang C, Lesniak MS. The Interplay between Glioblastoma and Its Microenvironment. Cells. 2021;10:2257. https://doi.org/10.3390/cells10092257
17. Himes BT, Geiger PA, Ayasoufi K, Bhargav AG, Brown DA, Parney IF. Immunosuppression in Glioblastoma: Current Understanding and Therapeutic Implications. Front Oncol. 2021;11:770561. https://doi.org/10.3389/fonc.2021.770561
18. Du M, Sun L, Guo J, Lv H. Macrophages and tumor-associated macrophages in the senescent microenvironment: From immunosuppressive TME to targeted tumor therapy. Pharmacological Research. 2024;204:107198. https://doi.org/10.1016/j.phrs.2024.107198
19. Mi Y, Guo N, Luan J, Cheng J, Hu Z, Jiang P, et al. The Emerging Role of Myeloid-Derived Suppressor Cells in the Glioma Immune Suppressive Microenvironment. Front Immunol. 2020;11. https://doi.org/10.3389/fimmu.2020.00737
20. Vilbois S, Xu Y, Ho P-C. Metabolic interplay: tumor macrophages and regulatory T cells. Trends Cancer. 2024;10:242–55. https://doi.org/10.1016/j.trecan.2023.11.007
21. Dysthe M, Parihar R. Myeloid-Derived Suppressor Cells in the Tumor Microenvironment. Adv Exp Med Biol. 2020;1224:117–40. https://doi.org/10.1007/978-3-030-35723-8_8
22. Iglesias-Escudero M, Arias-González N, Martínez-Cáceres E. Regulatory cells and the effect of cancer immunotherapy. Molecular Cancer. 2023;22:26. https://doi.org/10.1186/s12943-023-01714-0
23. Shang J, Zha H, Sun Y. Phenotypes, Functions, and Clinical Relevance of Regulatory B Cells in Cancer. Front Immunol. 2020;11:582657. https://doi.org/10.3389/fimmu.2020.582657
24. Zwirner NW, Domaica CI, Fuertes MB. Regulatory functions of NK cells during infections and cancer. Journal of Leukocyte Biology. 2021;109:185–94. https://doi.org/10.1002/JLB.3MR0820-685R
25. Zhang Z, Guo J, Jia R. Treg plasticity and human diseases. Inflamm Res. 2023;72:2181–97. https://doi.org/10.1007/s00011-023-01808-x
26. Чуров АВ, Новицкая АВ, Жулай ГА. Иммунотерапия нового поколения: регуляторные T-клетки. Гены и клетки. 2021;16(3);16–32. https://doi.org/10.23868/202110003
27. Blinova VG, Zhdanov DD. Many Faces of Regulatory T Cells: Heterogeneity or Plasticity? Cells. 2024;13:959. https://doi.org/10.3390/cells13110959
28. Wang J, Gong R, Zhao C, Lei K, Sun X, Ren H. Human FOXP3 and tumour microenvironment. Immunology. 2023;168:248–55. https://doi.org/10.1111/imm.13520
29. Sadlon T, Brown CY, Bandara V, Hope CM, Schjenken JE, Pederson SM, et al. Unravelling the molecular basis for regulatory T-cell plasticity and loss of function in disease. Clin Transl Immunology. 2018;7(2):1011. https://doi.org/10.1002/cti2.1011
30. Glasner A, Plitas G. Tumor resident regulatory T cells. Semin Immunol. 2021;52:101476 https://doi.org/10.1016/j.smim.2021.101476
31. Liston A, Pasciuto E, Fitzgerald DC, Yshii L. Brain regulatory T cells. Nat Rev Immunol. 2024;24:326–37. https://doi.org/10.1038/s41577-023-00960-z
32. Ratnam NM, Gilbert MR, Giles AJ. Immunotherapy in CNS cancers: the role of immune cell trafficking. Neuro-Oncology. 2019;21:37–46. https://doi.org/10.1093/neuonc/noy084
33. Richardson LG, Nieman LT, Stemmer-Rachamimov AO, Zheng XS, Stafford K, Nagashima H, et al. IDH-mutant gliomas harbor fewer regulatory T cells in humans and mice. Oncoimmunology. 2020;9:1806662. https://doi.org/10.1080/2162402X.2020.1806662
34. Panek WK, Toedebusch RG, Mclaughlin BE, Dickinson PJ, Van Dyke JE, Woolard KD, et al. The CCL2-CCR4 axis promotes Regulatory T cell trafficking to canine glioma tissues. J Neurooncol. 2024;169:647–58. https://doi.org/10.1007/s11060-024-04766-4
35. Canella A, Artomov M, Ukhatov A, Rajendran S, Perez P, Saini U, et al. Primary murine high-grade glioma cells derived from RCAS/tv-a diffuse glioma model reprogram naive T cells into immunosuppressive regulatory T lymphocytes. Mol Ther Oncol. 2024;32:200861. https://doi.org/10.1016/j.omton.2024.200861
36. Crane CA, Ahn BJ, Han SJ, Parsa AT. Soluble factors secreted by glioblastoma cell lines facilitate recruitment, survival, and expansion of regulatory T cells: implications for immunotherapy. Neuro-Oncology. 2012;14:5:584–95. https://doi.org/10.1093/neuonc/nos014
37. Dikiy S, Rudensky AY. Principles of regulatory T cell function. Immunity. 2023;56:240–55. https://doi.org/10.1016/j.immuni.2023.01.004
38. Lu L, Sun J, Su H, Luo S, Chen J, Qiu S, et al. Antitumor CD8 T cell responses in glioma patients are effectively suppressed by T follicular regulatory cells. Exp Cell Res. 2021;407:112808. https://doi.org/10.1016/j.yexcr.2021.112808
39. Luu Hoang KN, Anstee JE, Arnold JN. The Diverse Roles of Heme Oxygenase-1 in Tumor Progression. Front Immunol. 2021;12. https://doi.org/10.3389/fimmu.2021.658315
40. Zhdanov DD, Gladilina YA, Pokrovsky VS, Grishin DV, Grachev VA, Orlova VS, et al. Murine regulatory T cells induce death of effector T, B, and NK lymphocytes through a contact-independent mechanism involving telomerase suppression and telomereassociated senescence. Cell Immunol. 2018;331:146–60. https://doi.org/10.1016/j.cellimm.2018.06.008
41. Liu S, Zhang C, Wang B, Zhang H, Qin G, Li C, et al. Regulatory T cells promote glioma cell stemness through TGF-β–NF-κB–IL6–STAT3 signaling. Cancer Immunol Immunother. 2021;70:2601–16. https://doi.org/10.1007/s00262-021-02872-0
42. Wang Y, Huang T, Gu J, Lu L. Targeting the metabolism of tumor-infiltrating regulatory T cells. Trends in Immunology. 2023;44:598–612. https://doi.org/10.1016/j.it.2023.06.001
43. Chen B-J, Zhao J-W, Zhang D-H, Zheng A-H, Wu G-Q. Immunotherapy of Cancer by Targeting Regulatory T cells. Int Immunopharmacol. 2022;104:108469. https://doi.org/10.1016/j.intimp.2021.108469
44. Wang AX, Ong XJ, D’Souza C, Neeson PJ, Zhu JJ. Combining chemotherapy with CAR-T cell therapy in treating solid tumors. Front Immunol. 2023;14. https://doi.org/10.3389/fimmu.2023.1140541
45. van Hooren L, Handgraaf SM, Kloosterman DJ, Karimi E, van Mil LWHG, Gassama AA, et al. CD103 + regulatory T cells underlie resistance to radio-immunotherapy and impair CD8 + T cell activation in glioblastoma. Nat Cancer. 2023;4:665–81. https://doi.org/10.1038/s43018-023-00547-6
46. Peng Y, Tao Y, Zhang Y, Wang J, Yang J, Wang Y. CD25: A potential tumor therapeutic target. Int J Cancer. 2023;152:1290–303. https://doi.org/10.1002/ijc.34281
47. Buchan SL, Rogel A, Al-Shamkhani A. The immunobiology of CD27 and OX40 and their potential as targets for cancer immunotherapy. Blood. 2018;131:39–48. https://doi.org/10.1182/blood-2017-07-741025
48. Muth S, Klaric A, Radsak M, Schild H, Probst HC. CD27 expression on Treg cells limits immune responses against tumors. J Mol Med (Berl). 2022;100:439–49. https://doi.org/10.1007/s00109-021-02116-9
49. Li Q, Lu J, Li J, Zhang B, Wu Y, Ying T. Antibody-based cancer immunotherapy by targeting regulatory T cells. Front Oncol. 2023;13:1157345. https://doi.org/10.3389/fonc.2023.1157345
50. Zhulai G, Oleinik E. Targeting regulatory T cells in anti-PD-1/PD-L1 cancer immunotherapy. Scand J Immunol. 2022;95:13129. https://doi.org/10.1111/sji.13129
51. Arrieta VA, Dmello C, McGrail DJ, Brat DJ, Lee-Chang C, Heimberger AB, et al. Immune checkpoint blockade in glioblastoma: from tumor heterogeneity to personalized treatment. The Journal of Clinical Investigation. 2023;133:163447. https://doi.org/10.1172/JCI163447
52. Yang T, Kong Z, Ma W. PD-1/PD-L1 immune checkpoint inhibitors in glioblastoma: clinical studies, challenges and potential. Hum Vaccin Immunother. 2021;17:546–53. https://doi.org/10.1080/21645515.2020.1782692
53. Badani A, Ozair A, Khasraw M, Woodworth GF, Tiwari P, Ahluwalia MS, et al. Immune checkpoint inhibitors for glioblastoma: emerging science, clinical advances, and future directions. J Neurooncol. 2025;171:531–47. https://doi.org/10.1007/s11060-024-04881-2
54. Whiteside SK, Grant FM, Alvisi G, Clarke J, Tang L, Imianowski CJ, et al. Acquisition of suppressive function by conventional T cells limits anti-tumor immunity upon Treg depletion. Sci Immunol. 2023;8:5558. https://doi.org/10.1126/sciimmunol.abo5558
55. Li Y, Zhang C, Jiang A, Lin A, Liu Z, Cheng X, et al. Potential anti-tumor effects of regulatory T cells in the tumor microenvironment: a review. J Transl Med. 2024;22:293. https://doi.org/10.1186/s12967-024-05104-y
56. Amoozgar Z, Kloepper J, Ren J, Tay RE, Kazer SW, Kiner E, et al. Targeting Treg cells with GITR activation alleviates resistance to immunotherapy in murine glioblastomas. Nat Commun. 2021;12:2582. https://doi.org/10.1038/s41467-021-22885-8
57. Panek WK, Pituch KC, Miska J, Kim JW, Rashidi A, Kanojia D, et al. Local Application of Autologous Platelet-Rich Fibrin Patch (PRF-P) Suppresses Regulatory T Cell Recruitment in a Murine Glioma Model. Mol Neurobiol. 2019;56:5032–40. https://doi.org/10.1007/s12035-018-1430-0
Об авторах
Э. П. ЯнышеваРоссия
Янышева Эльвира Петровна
Москва
В. П. Баклаушев
Россия
Баклаушев Владимир Павлович, д-р мед. наук
Москва
Г. М. Юсубалиева
Россия
Юсубалиева Гаухар Маратовна, канд. мед. наук
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Янышева Э.П., Баклаушев В.П., Юсубалиева Г.М. Роль регуляторных Т-лимфоцитов в формировании иммуносупрессивного микроокружения при глиобластоме. Медицина экстремальных ситуаций. 2025;27(2):183-190. https://doi.org/10.47183/mes.2025-299
For citation:
Yanysheva E.P., Baklaushev V.P., Yusubalieva G.M. Role of regulatory T lymphocytes in the formation of immunosuppressive microenvironment in glioblastoma. Extreme Medicine. 2025;27(2):183-190. https://doi.org/10.47183/mes.2025-299

















