Перейти к:
Трансгенез по гену ACE2 усиливает память о психофизиологической травме в модели посттравматического стрессового расстройства у мышей
https://doi.org/10.47183/mes.2025-321
Аннотация
Введение. Развитие симптомов посттравматического стрессового расстройства (ПТСР) определяется комплексом факторов, которые не ограничиваются принадлежностью к классическим нейротрансмиттерным системам мозга или стрессовым гормонам. В частности, в механизмы ПТСР возможно вовлечение ренин-ангиотензин-альдостероновой системы мозга.
Цель. Изучение влияния экспрессии гена hACE2 ангиотензинпревращающего фермента 2-го типа (ACE2) на тревожность и восприимчивость к психофизиологическому стрессу при моделировании ПТСР-подобного состояния у мышей, осуществленному с применением электрошока (ЭШ) конечностей.
Материалы и методы. Эксперименты были проведены на самцах мышей линий C57Bl/6N и k18-hACE2 возрастом 4–5 месяцев. Было сформировано три группы мышей линии C57Bl/6N: группа «контроль» (n = 7); группа «электрошок (ЭШ)» (n = 7); группа «ЭШ + лизиноприл» (n = 7); две группы мышей линии k18-hACE2: группа «контроль» (n = 7); группа «ЭШ» (n = 8). Проведено обусловливание реакции страха по Павлову с использованием ЭШ конечностей в качестве безусловного стимула. Мыши группы «ЭШ + лизиноприл» в течение 28 дней после психофизиологической травмы получали лизиноприл в дозе 10 мг/кг в сутки с питьевой водой. Оценку экспрессии реакции страха, отражающей память о психофизиологической травме, проводили на 7-е и 28-е сутки после воздействия ЭШ. Величину экспрессии реакции страха оценивали по относительному времени замирания. Для оценки общей локомоторной активности использовали тест «открытое поле». Оценку стратегии стресс-зависимого поведения изучали в тесте подвешивания за хвост; оценку тревожности — в тестах «светло-темная камера» и «приподнятый крестообразный лабиринт». Оценку пространственной навигации и динамики пространственного обучения проводили в тесте «лабиринт Барнса». Поведенческие параметры оценивали при помощи программного обеспечения ANY-maze Video-Tracking Software. Статистический анализ проведен с помощью пакета ПО Prism GraphPad 10.0.
Результаты. При моделировании ПТСР-подобного состояния с помощью ЭШ конечностей у мышей линии k18-hACE2 с экспрессией гена гуманизированного ACE2 под контролем промотора гена цитокератина выявлена более выраженная способность, по сравнению с мышами линии C57Bl/6N, к запоминанию и удержанию памяти об условном стимуле/контексте травмирующего события. После воздействия ЭШ у мышей линии k18-hACE2 тревожность в тесте «светло-темная камера» была ниже по сравнению с мышами линии C57Bl/6N. При этом наблюдали снижение двигательной активности в тесте «открытое поле» и не обнаруживали изменений в пространственной памяти в тесте «лабиринт Барнса». Применение лизиноприла, ингибитора ACЕ, у мышей линии C57Bl/6N в течение 28 дней после ЭШ не приводило к снижению травматической памяти, что свидетельствует о том, что промнестический эффект экспрессии гена hACE2 не является следствием системной гипотензии, и указывает на участие центральных механизмов в реализации эффекта гена hACE2 при формировании патологического фенотипа.
Выводы. Полученные данные свидетельствуют о влиянии гена hACE2 на формирование реакции на стресс у мышей, а именно, экспрессия hACE2 у мышей сопровождается усилением памяти о психофизиологической травме и снижением экстинкции памяти о травме по сравнению с мышами дикого типа, что может определяться модуляцией активности ACE2-зависимого каскада ренин-ангиотензин-альдестероновой системы в мозге. Уменьшение регулирования активности РААС при применении ингибитора ACE лизиноприла с гипотензивным действием не оказывало влияния на память у мышей дикого типа.
Для цитирования:
Тимошина Ю.А., Дейнекина Т.С., Савинкова Е.В., Юдин В.С., Кескинов А.А., Макаров В.В., Андяржанова Э.А. Трансгенез по гену ACE2 усиливает память о психофизиологической травме в модели посттравматического стрессового расстройства у мышей. Медицина экстремальных ситуаций. 2025;27(3):341-350. https://doi.org/10.47183/mes.2025-321
For citation:
Timoshina Yu.A., Deinekina T.S., Savinkova E.V., Yudin V.S., Keskinov A.A., Makarov V.V., Anderzhanova E.A. ACE2 gene transgenesis enhances memory of psychophysiological trauma in mouse models of post-traumatic stress disorder. Extreme Medicine. 2025;27(3):341-350. https://doi.org/10.47183/mes.2025-321
ВВЕДЕНИЕ
Значимость посттравматического стрессового расстройства (ПТСР) в ряду других ассоциированных со стрессом заболеваний определяется высокой вероятностью ситуаций, в которых возникает угроза здоровью и жизни, высокой частотой следующих за ними нарушений психической деятельности и недостаточной эффективностью существующей профилактики и терапии заболевания [1].
Подходы к решению проблем прогнозирования исхода острого стресса высокой интенсивности и недостаточной эффективности терапии ПТСР в последнее время получают новые направления в связи с обнаружением ранее неизвестных факторов, определяющих дезадаптивные изменения в высшей нервной деятельности. Так, Hoffmann et al.; Li et al. [2] в исследовании последствий COVID-19 обнаружили, что ангиотензинпревращающий фермент 2-го типа (ACE2), выступающий в качестве основного рецептора субъединицы S1 спайкового белка вируса SARS-CoV-2, может определять не только инфицируемость, но и повышение уровня тревожности и развитие симптомов депрессии при вирусном заболевании [3].
Белок ACE2 — важный элемент ренин-ангиотензин-альдостероновой системы (РААС), компоненты которой в большой степени определяют величину системного давления в кровеносном русле. ACE2 осуществляет деградацию прессорного ангиотензина II (AngII) и таким образом функционально балансирует активность ACE-зависимого прогипертензивного каскада РААС [4, 5]. По данным исследования Yang et al., мыши со сверхэкспрессией гена гуманизированного ACE2 (hACE2) под контролем промотора гена цитокератина k18 рассматриваются как модель вирусной инфекции с высокой нейроинвазивностью [6], течение которой характеризуется негативными изменениями в центральной нервной системе [7]. Однако в условиях сверхэкспрессии гена ACE2 или его фармакологической активации возможно изменение баланса между AngII и его производным с антипрессорной активностью Ang1–7 в пользу последнего. Так, в исследованиях Lima et al.; Meng et al. показано, что снижение функциональной активности прогипертензивного каскада РААС в отсутствие инфекции может оказывать положительное влияние на процессы в мозге [8][9].
Имеющиеся данные также свидетельствуют о вовлечении локальной внутримозговой РААС в механизмы специфической активности нервной ткани [10]. В частности, в условиях острого стресса наблюдается увеличение внеклеточного содержания катепсина D в префронтальной коре [11]. Поскольку катепсин D — одна из эндопептидаз, определяющих превращение ангиотензиногена в AngI, [12][13], при остром стрессе в мозге увеличивается вероятность образования AngII из AngI и усиливается активность РААС. Показано также, что консолидация памяти в тесте активного избегания нарушается в условиях введения AngII в область СА1 гиппокампальной формации. Эффект опосредуется активацией рецептора ангиотензина 1-го типа (AGTR1) с вовлечением ERK1/2 сигнального внутриклеточного каскада [14]. В свою очередь, уменьшение характеристической тревожности у мышей в условиях тотальной сверхэкспрессии hACE2 связано с Ang1–7-опосредованной активацией Mas рецепторов и зависимого от нее изменения активности ГАМК-ергических нейронов в базолатеральном отделе миндалевидного тела [15][16].
Поскольку восприимчивость к стрессу может зависеть от уровня экспрессии / функциональной активности ACE2 и/или активности РААС, представляет интерес изучение стресс-опосредуемого поведения мышей в условиях экспрессии гена hACE2 [15] или в условиях хронического введения применяемого в клинике ингибитора ACE лизиноприла, проникающего через гематоэнцефалический барьер.
Все вышеизложенное определяет цель исследования как изучение влияния экспрессии гена hACE2 на тревожность и восприимчивость к психофизиологическому стрессу у мышей линии k18-hACE2 при моделировании ПТСР-подобного состояния, осуществленного с применением электрошока (ЭШ) конечностей.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты проводили на самцах мышей линий C57Bl/6N и k18-hACE2 (питомник «Андреевка» Научного центра биомедицинских технологий Федерального медико-биологического агентства и «ЦСП» ФМБА России) возрастом 4–5 месяцев. Животных содержали в клетках с искусственной вентиляцией по 5–7 особей в клетке при температуре 24 °С и цикле освещения 12 ч свет / 12 ч темнота (включение света 7:00; выключение света 19:00). Вода и стандартный комбикорм — ad libitum.
Исследования проведены в соответствии с Директивой 2010/63/EU Европейского парламента и совета Европейского союза от 22 сентября 2010 г. и одобрены Комиссией по биоэтике ФГБУ «ЦСП» ФМБА России (протокол № 2 от 15.02.2024).
Дизайн эксперимента
Для исследования животные случайным образом были распределены на группы по 7–8 особей.
Сформировано три группы мышей линии C57Bl/6N:
- группа «контроль» (n= 7);
- группа «ЭШ» (n= 7);
- группа «ЭШ + лизиноприл» (n= 7);
Две группы мышей линии k18-hACE2:
- группа «контроль» (n= 7);
- группа «ЭШ» (n= 8).
Учитывая, что лизиноприл применялся для фармакологического моделирования возможного гипотензивного эффекта экспрессии hACE2, дополнительную группу сравнения трансгенных мышей линии k18-hACE2 «ЭШ + лизиноприл» не вводили.
Моделирование ПТСР. После габитуации мышей к условиям содержания и друг к другу в сформированных группах проводили процедуру моделирования ПТСР-подобного состояния, осуществленного с применением ЭШ конечностей, как указано ранее [17, 18]. За 2–3 дня до начала эксперимента в течение 3 мин животных габитуировали к помещенной в звукоизолирующий короб тестовой камере (16×16×32 см3), сделанной из плексигласа и оборудованной полом с электродной решеткой, соединенной с генератором постоянного тока, и видеокамерой (Fear Conditioning System, UgoBasil, Италия). Во время тестовой сессии после 1-минутного периода покоя на пол подавались последовательно, с разницей в 1 мин, два импульса с величиной силы тока 1,5 мА и длительностью 2 сек. После второго импульса животное оставляли в камере еще на 1 мин, после чего возвращали в домашнюю клетку. Мыши из контрольных групп оставались в камере ЭШ в течение 5 мин.
Введение препарата. Мыши группы «ЭШ + лизиноприл» в течение 28 дней после психофизиологической травмы получали лизиноприл в дозе 10 мг/кг в сутки с питьевой водой. Используемая доза 10 мг/кг в сутки соответствует дозам препарата, рекомендованным при терапии артериальной гипертензии у людей. До начала эксперимента в течение недели провели мониторирование суточного потребления воды для оценки фоновых знаний и расчета рабочих концентраций раствора лизиноприла. Полученные значения среднесуточного потребления жидкости одним животным (4,46 мл/сутки) совпадали с данными о потреблении воды у взрослых мышей, известными из многочисленных источников литературы. На основании предварительной оценки потребления воды готовили раствор лизиноприла (АО «Алси Фарма», Россия) с такой рабочей концентрацией, чтобы ежесуточно каждое животное получало в среднем 10 мг/кг препарата. Каждый второй день раствор лизиноприла обновляли. В течение 28 дней терапевтического воздействия проводили оценку суточного потребления воды для контроля полученной дозы препарата. Тем не менее небольшие отклонения от среднего значения потребления могли оказывать влияние на выраженность конечного эффекта, что могло повлиять на конечный результат эксперимента.
Оценка памяти о ЭШ. На 7-е и 28-е сутки после воздействия ЭШ при помощи программного обеспечения ANY-maze Video-Tracking Software у мышей проводили оценку времени замирания при помещении их в тестовую камеру на 3 мин. Величину экспрессии реакции страха оценивали по относительному времени замирания (отсутствие в течение двух секунд и более любых движений, кроме как обусловленных дыхательной экскурсией грудной клетки).
Поведенческие реакции (двигательную активность, тревожность, стратегию стресс-зависимого поведения (копинга), пространственную навигацию/пространственное обучение) оценивали в батарее тестов на 29–32-й день после ЭШ.
Для оценки общей локомоторной активности использовали тест «открытое поле» (ОП). Для этого животных помещали на арену (41×41×33 см3) установки автоматической регистрации двигательной активности (Multiple Activity Cage, UgoBasil, Италия). Локомоторную активность и вертикализацию (суммарное количество стоек с опорой на стенки тестовой арены и без опоры на стенки тестовой арены) оценивали по общему числу пересечений лучей фотодетекторов, расположенных на расстоянии 2 см друг от друга на панелях по двум сторонам арены на двух горизонтальных уровнях. Тест проводили в течение 30 мин при освещении 300 люкс.
Для оценки стратегии стресс-зависимого поведения использовали тест подвешивания за хвост (ПХ). Оценку времени неподвижности проводили, регистрируя время замирания в первые три и вторые три минуты теста раздельно.
Для оценки тревожности животных использовали тест «светло-темная камера» (СТК). Тестирование проводили в камере (42×40×40 см3), разделенной на светлый и темный отсеки, равные по размеру (Light/Dark Box for Mice, UgoBasil, Италия). Оценку избегания отрытого пространства (латентный период от момента посадки экспериментального животного в центр светлой камеры (СК) до момента первого захода в темную камеру (ТК), число заходов в камеры, время, проведенное в камерах, а также общую пройденную дистанцию) проводили в течение 10 минут. Освещенность СК составляла 400 люкс.
Для изучения тревожного поведения применяли также тест «приподнятый крестообразный лабиринт» (ПКЛ). Лабиринт располагался на высоте 60 см от пола и состоял из открытого (80×5 см) и закрытого (80×5 см) рукавов, пересекающихся под прямым углом (Elevated Plus Maze for Mice, UgoBasil, Италия). Число заглядываний в открытые рукава (ОР), число заходов в ОР и закрытые рукава (ЗР), время, проведенное в ОР и ЗР, а также общую пройденную дистанцию оценивали в течение 5 мин. Освещенность отрытых рукавов составляла 400 люкс. По результатам тестирования в ПКЛ рассчитывали индекс тревожности (ИТ) согласно формуле: ИТ = 1 – [(время, проведенное в ОР) / общая длительность теста) + (число заходов в ОР / общее число заходов в рукава)] / 2 [17].
Оценку пространственной навигации и динамики пространственного обучения проводили в тесте «лабиринт Барнса» (ЛБ) с использованием открытой круглой арены диаметром 100 см (Barnes Maze for Mice, UgoBasil, Италия) при освещенности центральной части лабиринта 600–700 люкс. Лабиринт делили на 4 сегмента, под поверхностью одного из которых было размещено укрытие. Сессии обучения (первый и второй дни проведения теста, «день 1» и «день 2») и непосредственно тестирование (третий день проведения теста, «тест») длились по 3 минуты.
Детекцию параметров, оцениваемых в тестах СТК, ПКЛ, ЛБ, осуществляли с использованием программного обеспечения ANY-maze Video-Tracking Software, видеозапись производили при помощи видеокамеры DMK 22AUC03 (IMAGINSOURCE, Германия) с объективом Computar A4Z2812CS-MPIR (Megapixel, Китай).
Последовательность проведения манипуляций показана на рисунке 1.
Статистический анализ проводили с помощью пакета ПО Prism GraphPad 10.0 и выше. Данные представлены в виде среднего значения и стандартной ошибки среднего значения (M ± SEM). Учитывая размеры выборок, определявшиеся доступностью трансгенных животных, оценка нормальности распределения данных не проводилась. При этом все данные были проверены на наличие выбросов с использованием алгоритма, учитывающего нелинейную модель регрессии [19]. Для сравнения оцениваемых эффектов в группах применяли двухфакторный дисперсионный анализ (ANOVA); в случае обнаружения достоверного влияния любого исследуемого фактора проводили межгрупповые сравнения с использованием теста Тьюки (Tukey).
В зависимости от оцениваемого параметра и специфики тестирования устанавливали следующие основные пары главных факторов:
(1) «ЭШ» (однократное воздействие ЭШ или отсутствие ЭШ) × «генотип» (наличие или отсутствие трансгенеза по гену hACE2);
(2) «генотип» × «время» (минуты в тесте ОП, дни при оценке замирания);
(3) «ЭШ» × «время» (дни при оценке замирания и параметров теста ЛБ);
(4) «группы» (контроль, ЭШ, ЭШ + лизиноприл) × «время» (дни при оценке замирания и параметров теста ЛБ и ПХ).
В случае оценки эффекта лизиноприла во всех поведенческих тестах, кроме оценки замирания и поведения в ЛБ и ПХ, при сравнении групп («отсутствие ЭШ» по сравнению с «ЭШ» по сравнению с «ЭШ + лизиноприл») использовали однофакторный анализ вариаций. Различия принимали за статистически достоверные при уровне значимости р < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При сравнении поведенческих реакций интактных мышей линии C57Bl/6N и k18-hACE2 обнаружено влияние экспрессии hACE2 на параметры поведенческой активности. Обнаружено снижение пройденного расстояния в ОП у интактных мышей линии k18-hACE2 в 1,2 раза по сравнению с интактными мышами линии C57Bl/6N (генотип: F(1,12) = 16,83, p = 0,0015); соответствующие данные представлены на рисунке 2а. В тесте СТК у мышей линии k18-hACE2 обнаружено статистически достоверное увеличение латентного периода до первого захода в ТК в 15,4 раза и увеличение времени, проведенного в СК, в 1,9 раза (Fs > 7,98, p < 0,017), что подтверждается результатами post-hoc анализа (p < 0,0205); соответствующие данные представлены на рисунках 2д, 2ж.
При моделировании ПТСР-подобного состояния установлено, что мыши линии k18-hACE2 в условиях однократного ЭШ конечностей реагировали на шокирующее воздействие сильнее, чем мыши дикого типа (сравнение средних в тесте Стьюдента, t = 3,561, df = 13, p = 0,004), и запоминали условный стимул / контекст травмирующего события лучше, что выражалось в увеличении времени реакции замирания после психофизиологической травмы у трансгенных мышей по сравнению с мышами линии C57Bl/6N на 7-й и 28-й дни после воздействия ЭШ (генотип: (F(1,12) = 226,98, p < 0,001; время: (F(1,12) = 24,79, p = 0,0003; генотип × время: (F(1,12) = 8,113, p = 0,015)). Более того, у этих мышей не наблюдали экстинкции страха (post-hoc: 7-й день по сравнению с 28-м днем; p = 0,157) (рис. 3б), тогда как мыши линии C57Bl/6N через 28 дней демонстрировали уменьшение величины экспрессии страха (post-hoc: 7-й день по сравнению с 28-м днем; p = 0,0001) (рис. 3а).
Психофизиологическая травма вызывала у мышей линии k18-hACE2 отсроченные изменения в поведении, профиль которых отличался от наблюдаемых у мышей линии C57Bl/6N. Через месяц после ЭШ в тесте ПХ время неподвижности у мышей линии k18-hACE2 было в 2,4 раза меньше по сравнению с тем же показателем у мышей линии C57Bl/6N в первые три минуты (p = 0,049) и в 1,5 раза — во вторые три минуты (p = 0,0137) 6-минутного теста (эффект генотипа: (F(1,13) = 6,268, p = 0,029); соответствующие данные приведены на рисунке 2в.
У трансгенных мышей, получавших воздействие ЭШ, в 14,4 раза увеличивался латентный период до первого захода в ТК в тесте СТК по сравнению с мышами дикого типа (генотип: (F(1,11) = 43,91, p < 0,001; ЭШ: (F(1,12) = 9,201, p = 0,010; генотип × ЭШ: (F(1,11) = 7,276, p = 0,021) (рис. 2д). При сравнимом уменьшении числа заходов в СК и ТК у животных обеих экспериментальных групп после ЭШ (ЭШ: F(1,13) = 3,134, p = 0,101), только у трансгенных мышей наблюдали уменьшение времени нахождения в ТК, несимметричное увеличению времени нахождения в СК (ЭШ: (F(1,13) = 7,486, p = 0,017; генотип: Fs > 38,47, p < 0,001; генотип × ЭШ: (F(1,11) = 7,704, p = 0,017) (рис. 2е, 2ж).
При оценке тревожности в ПКЛ влияние ЭШ в целом не было селективным по отношению к мышам линии k18-hACE2 (ЭШ: Fs < 3,279, p > 0,097, генотип × ЭШ: Fs < 2,137, p > 0,16) (рис. 2з, и, к), хотя было обнаружено уменьшение дистанции, пройденной мышами линии k18-hACE2 в закрытых рукавах лабиринта, относительно величины, обнаруженной у мышей C57Bl/6N (post-hoc: p = 0,028) (рис. 2л). Средние величины ИТ для мышей контрольной группы линии C57Bl/6N составили 0,933 ± 0,019, для мышей линии C57Bl/6N, получивших ЭШ конечностей, — 0,954 ± 0,017, для контрольных мышей линии k18-hACE2 — 0,996 ± 0,004, для мышей линии k18-hACE2, получивших ЭШ конечностей, — 0,991 ± 0,008. Двухфакторный анализ дисперсии ИТ выявил эффект генотипа: F(1,12) = 15,52, p = 0,002; эффект ЭШ конечностей F(1,13) = 0,345, p = 0,567; эффект взаимодействия факторов F(1,12) = 1,063, p = 0,323. Последующий post-hoc тест указал на статистически достоверное различие между контрольными группами (p = 0,005).
Оценка двигательной активности в тесте ОП выявила влияние генотипа (F(1,12) = 16,830, p = 0,002) и ЭШ (F(1,13) = 5,810, p = 0,032) на локомоторную активность животных (рис. 2а), кроме этого, обнаружено селективное уменьшение вертикализации у мышей линии k18-hAce2 после ЭШ (генотип × ЭШ: (F(1,12) = 5,362, p = 0,039 (post-hoc: p = 0,007); ЭШ и генотип: Fs < 3,7495, p > 0,075) (рис. 2б).
Оценка пространственной навигации / пространственного обучения в ЛБ показала, что у мышей линии C57Bl/6N, но не у мышей линии k18-hACE2, стратегия нахождения укрытия после ЭШ оптимизируется в течение трех последовательных дней проведения теста, что выражается в увеличении доли исследования отверстий, находящихся в целевом сегменте (ЭШ: (F(1,12) = 2,150, p = 0,168; день: (F(1,12) = 4,434, p = 0,028, ЭШ × день: (F(2,24) = 1,693, p = 0,205 (post-hoc: день 1 по сравнению с третьим днем («тест»), p = 0,049) (рис. 2о). Это сопровождалось уменьшением времени, затраченного на нахождение укрытия (ЭШ: (F(1,12) = 1,011, p = 0,335; день: (F(1,12) = 6,561, p = 0,010, ЭШ × день: (F(2,24) = 0,266, p = 0,768 (post-hoc: день 1 по сравнению с третьим днем («тест»), p = 0,018) (рис. 2м). В отношении доли посещений сегмента с укрытием эффект ЭШ не был статистически достоверным (Fs < 0,285, p > 0,466) (рис. 2н).
Отдельно проанализировали эффект лизиноприла у мышей линии C57Bl/6N в модели ПТСР-подобного состояния. Лизиноприл при его хроническом пероральном применении (в дозе 10 мг/кг в сутки) не оказывал влияния на контекстуальную память в модели ПТСР-подобного состояния (post-hoc: 7 дней p = 0,609 и 28 дней p = 0,341) (рис. 3а). Средние величины ИТ для мышей контрольной группы линии C57Bl/6N составили 0,933 ± 0,019, для мышей линии C57Bl/6N, получивших ЭШ конечностей, — 0,954 ± 0,017, для мышей линии C57Bl/6N, получавших лизиноприл после ЭШ конечностей, — 0,927 ± 0,026 и однофакторный анализ дисперсии не выявил различий между группами F(2,18) = 0,446, p = 0,647.
Не обнаружено влияния лизиноприла и в тестах ОП, ПХ, СТК, ПКР, ЛБ (рис. 4а–к). Можно отметить вероятный эффект в отношении динамики пространственной навигации / пространственного обучения в ЛБ, но он не был подтвержден результатами статистического анализа (post-hoc: p > 0,073) (рис. 4з, и, к).
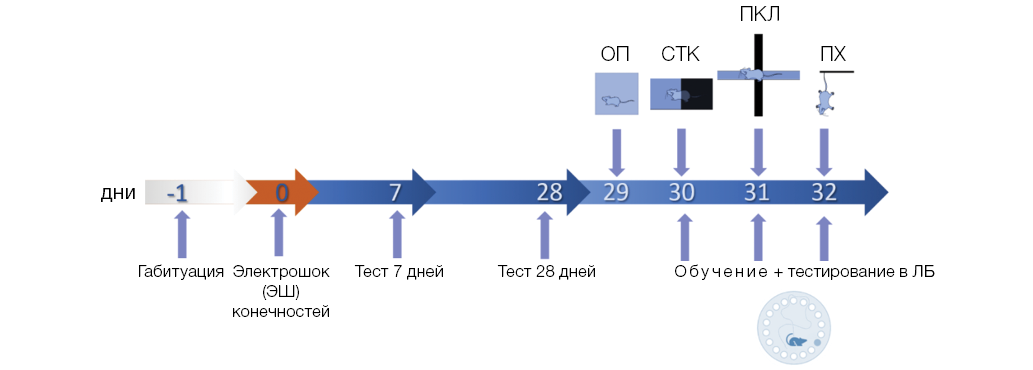
Рисунок подготовлен авторами по собственным данным
Рис. 1. Последовательность манипуляций для осуществления моделирования ПТСР-подобного состояния и его фенотипировани: ОП — тест «открытое поле»; СТК — тест «светло-темная камера»; ПКЛ — тест «приподнятый крестообразный лабиринт»; ПХ — тест «подвешивание за хвост»; ЛБ — тест «лабиринт Барнса»

Рисунок подготовлен авторами по собственным данным
Рис. 2. Сравнение поведенческого фенотипа мышей линий C57Bl/6N и k18-hACE2 в парадигме оценки отсроченного (29–32 дня) эффекта электрошока (ЭШ) конечностей: а — локомоторная активность; б — вертикализация в тесте ОП; в — время неподвижности в тесте ПХ; характеристическая тревожность в тесте СТК: г — суммарная дистанция, пройденная в СК и ТК; д — латентный период до момента первого захода в ТК; е — число заходов в СК или ТК; ж — время, проведенное в СК или ТК; характеристическая тревожность в тесте ПКЛ: з — число заглядываний в ОР; и — число заходов в ОР или ЗР; к — время, проведенное в ОР или ЗР; л — дистанция, пройденная в ОР или ЗР; динамика пространственной навигации в тесте ЛБ: м — время до нахождения укрытия; н — доля посещений сегмента с укрытием относительно посещения всех сегментов; о — доля исследования отверстий в сегменте с укрытием относительно исследования всех укрытий
Примечание: штриховка — трансгенный генотип; результаты post-hoc сравнения между группами: *p < 0,05, **p < 0,01, ***p < 0,001,****p < 0,0001; результаты post-hoc сравнения между днем 1 и тестом при оценке пространственной навигации: # p < 0,05.
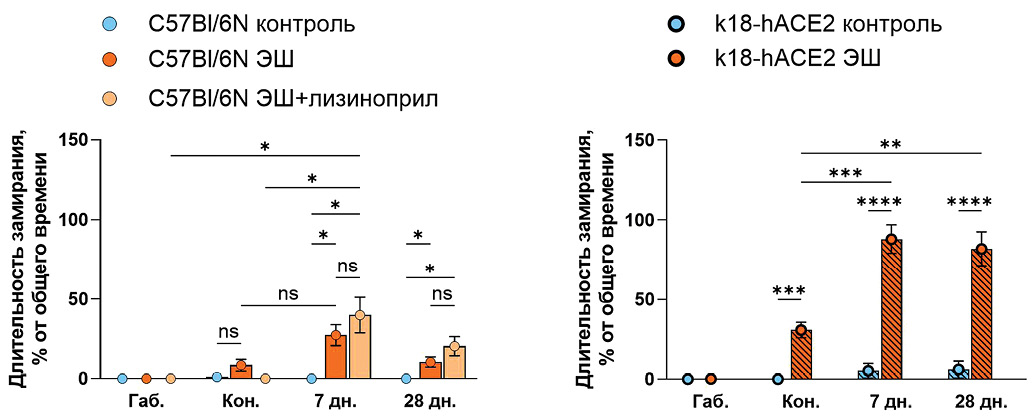
Рисунок подготовлен авторами по собственным данным
Рис. 3. Динамика длительности замирания у мышей линий C57Bl/6N и k18-hACE2: а — динамика длительности замирания и влиянии ингибитора ACE лизиноприла (10 мг/кг в сутки) на длительность замирания у мышей линии C57Bl/6N; б — сохранение памяти о травматическом событии у мышей линии k18-hACE2
Примечание: штриховка — трансгенный генотип; результаты post-hoc сравнения между группами: ns — not significant (не значимо), *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001; ЭШ — электрошок.
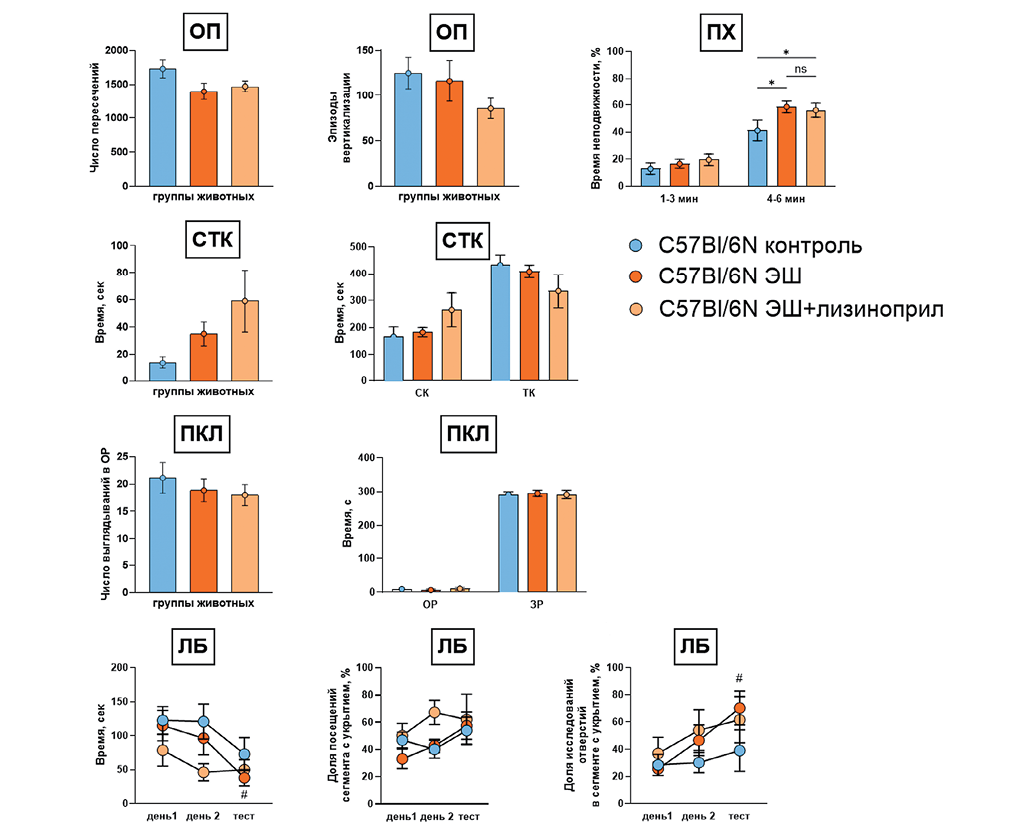
Рисунок подготовлен авторами по собственным данным
Рис. 4. Влияние ингибитора ACE лизиноприла на показатели локомоторной активности, тревожности, эмоционального копинга и пространственной навигации у мышей линии C57Bl/6N, получавших электрошок (ЭШ): а — локомоторная активность; б — вертикализация в тесте ОП; в — длительность замирания в тесте ПХ; г — латентный период до момента первого захода в ТК; д — время нахождения в светлой и темной камерах в тесте СТК; е — число заглядываний в открытый рукав; ж — время нахождения в открытом и закрытом рукавах в тесте ПКЛ; динамика пространственной навигации в тесте ЛБ: з — время до нахождения укрытия; и – доля посещений сегмента с укрытием относительно посещения всех сегментов; к — доля исследования отверстий в сегменте с укрытием относительно исследования всех укрытий
Примечание: результаты post-hoc сравнения между группами: ns — not significant (не существенно), *p < 0,05, **p < 0,01; результаты post-hoc сравнения между данными через 1 день и третьим днем («тест») при оценке пространственной навигации: # p < 0,05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные указывают на сложный профиль эффекта экспрессии гена hACE2 на поведение мышей. С одной стороны, интактные трансгенные мыши в тесте СТК демонстрировали увеличение резистентности к открытому освещенному пространству, что подтверждает ранее описанный анксиолитический эффект сверхэкспрессии гена гуманизированного ACE2 у интактных мышей [15][16]. С другой стороны, в нашем исследовании обнаружено влияние экспрессии гена hACE2 на формирование отсроченных последствий острого стресса при моделировании ПТСР-подобного состояния. Так, наблюдали более длительное исследование СК, опасной только эвентуально, в тесте СТК и увеличение неподвижности в тесте ПХ, потенциально носящее адаптивный характер. При этом экспрессия гена hACE2 способствовала усилению и удержанию памяти о травмирующем событии, что выражалось в увеличении времени замирания и отсутствии экстинкции реакции замирания (то есть в неэффективности переобучения актуальной безопасности тестовой камеры) в течение месяца после психофизиологической травмы.
Усиление памяти об ЭШ может быть опосредовано увеличением восприятия ЭШ: немедленная реакция трансгенных мышей на ЭШ во время обусловливания была выше. Следует заметить, что это, по всей видимости, определяется механизмами восприятия психологической компоненты стресса, а не увеличением болевой чувствительности, поскольку в литературе имеются сведения об уменьшении ноцицепции при уменьшении эффективности сигнальной цепи с вовлечением ACE2 [20], а используемая нами трансгенная модель, напротив, предполагает усиление функции ACE2. Действительно, сравнение полученных нами результатов с характеристиками поведенческого эндофенотипа, описанного у мышей со сверхэкспрессией гена hACE2 [15][16], указывает на повышение активности ACE2 у мышей линии k18-hACE2, что может быть опосредовано или сверхэкспрессией гуманизированного гена, или его повышенной активностью по сравнению с мышиным геном дикого типа. Повышение активности ACE2 у мышей линии k18-hACE2, в свою очередь, может определять увеличение продукции Ang1–7 и повышение активности ACE2/Ang1–7-зависимого каскада РААС. Соответствующая активация MasR-зависимого сигналинга в мозге мышей выступает как механизм, обеспечивающий нейропластичность и усиление памяти [21][22], а также анксиолитический и антидепрессивный эффект [23][24].
В исследованиях Correa et al., Fontes et al. регуляторы РААС рассматриваются в качестве потенциальных мишеней при терапии стресса [5][25]. В клинике ингибиторы ACE, AGTR1, а также бета-блокаторы показывают хорошие результаты при лечении ПТСР. Доклинические исследования выявляли эффекты разной направленности. В исследованиях Marvar et al. применение селективного ингибитора AGTR1 лозартана в модели ПТСР сопровождалось уменьшением памяти о травмирующем событии, увеличением ее экстинкции и сохранением уровня характеристической тревожности животных [26], тогда как Braszko; Raghavendra et al. [27][28] сообщают об усилении травматической памяти.
В нашем эксперименте мы изучили влияние гипотензивного препарата ингибитора ACE лизиноприла на поведенческие реакции при моделировании ПТСР-подобного состояния у мышей линии C57Bl/6N. Предполагалось, что в выбранной дозе 10 мг/кг в сутки, которая соответствует клиническому терапевтическому диапазону, анксиолитический эффект лизиноприла будет реализовываться за счет его антигипертензивного действия. Однако хроническое применение лизиноприла в течение 28 суток не повлияло ни на контекстуальную память, ни на уровень тревожности у мышей. В более ранних исследованиях Cohen et al.; Kao et al. не обнаруживали терапевтического эффекта бета-блокатора пропранолола при моделировании ПТСР-подобного состояния у мышей [17][29]. Взятые вместе эти данные указывают на ограниченность эффекта нормализации системного давления крови в реализации терапевтических эффектов бета-блокаторов, а также ингибиторов ACE, AGTR1 при терапии ПТСР.
Неэффективность лизиноприла в нашем исследовании может определяться и конечной третичной структурой гуманизированного энзима, поскольку известно, что направленность эффектов ингибиторов ACE при терапии ПТСР находится в зависимости от полиморфизма гена ACE, определяя резистентность к терапии при наличии нуклеотидного варианта ТС rs4311 [30]. Вероятное увеличение экспрессии гена ACE2 на фоне хронического применения лизиноприла, уже описанное в литературе [31–35], достаточное для развития специфичных для мозга ACE2/Ang1-7/MasR-зависимых механизмов, по всей видимости, тоже не было достигнуто.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о влиянии экспрессии гена hACE2 на восприимчивость мышей к психофизиологическому стрессу и указывают на значимость ACE2 в формировании памяти о психофизиологической травме при моделировании ПТСР-подобного состояния, а именно: экспрессия hACE2 у мышей сопровождается усилением памяти о психофизиологической травме и снижением экстинкции памяти о травме по сравнению с мышами дикого типа, что может опосредоваться модуляцией активности ACE2-зависимого каскада внутримозговой РААС. Уменьшение активности РААС при применении ингибитора ACE лизиноприла с гипотензивным действием не оказывало влияния на память у мышей дикого типа.
Список литературы
1. Wang CX, Kohli R, Olaker VR, Terebuh P, Xu R, Kaelber DC, et al. Risk for diagnosis or treatment of mood or anxiety disorders in adults after SARS-CoV-2 infection, 2020–2022. Molecular Psychiatry. 2024;29(5):1350–60. https://doi.org/10.1038/s41380-024-02414-x
2. Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020;181(2):271–80.e8. https://doi.org/10.1016/j.cell.2020.02.052
3. Li W, Moore MJ, Vasilieva N, Sui J, Wong SK, Berne M.A, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature. 2003;4269(6965):450–4. https://doi.org/10.1038/nature02145
4. Li XC, Zhang J, Zhuo JL. The vasoprotective axes of the renin-angiotensin system: Physiological relevance and therapeutic implications in cardiovascular, hypertensive and kidney diseases. Pharmacological Research. 2017;125:21–38. https://doi.org/10.1016/j.phrs.2017.06.005
5. Correa BHM, Becari L, Fontes MAP, Simões-e-Silva AC, Kangussu LM. Involvement of the Renin-Angiotensin System in Stress: State of the Artand Research Perspectives. Current Neuropharmacology. 2022;20(6):1212–28. https://doi.org/10.2174/1570159X19666210719142300
6. Yang XH, Deng W, Tong Z, Liu YX, Zhang LF, Zhu H, et al. Mice transgenic for human angiotensin-converting enzyme 2 provide a model for SARS coronavirus infection. Comparative Medicine. 2007;57(5):450–9.
7. Cheyne I, Gopinath VS, Muppa N, Armas AE, Gil Agurto MS, Akula SA, et al. The Neurological Implications of COVID-19: A Comprehensive Narrative Review. Cureus. 2024;16(5):e60376. https://doi.org/10.7759/cureus.60376
8. Lima AM, Xavier CH, Ferreira AJ, Raizada MK, Wallukat G, Velloso EP, et al. Activation of angiotensin-converting enzyme 2/ angiotensin-(1–7)/Mas axis attenuates the cardiac reactivity to acute emotional stress. American Journal of Physiology: Heart and Circulatory Physiology. 2013;305(7):H1057–67. https://doi.org/10.1152/ajpheart.00433.2013
9. Meng Y, Yu CH, Li W, Li T, Luo W, Huang S, et al. Angiotensin-Converting Enzyme 2/Angiotensin-(1-7)/Mas Axis Protects against Lung Fibrosis by Inhibiting the MAPK/ NF-κB Pathway. American Journal of Respiratory Cell and Molecular Biology. 2014;50(4):723–36. https://doi.org/10.1165/rcmb.2012-0451OC
10. Grobe JL, Xu D, Sigmund CD. An Intracellular Renin-Angiotensin System in Neurons: Fact, Hypothesis, or Fantasy. Physiology. 2008;23(4):187–93. https://doi.org/10.1152/physiol.00002.2008
11. Martinelli S, Anderzhanova EA, Bajaj T, Wiechmann S, Dethloff F, Weckmann K, et al. Stress-primed secretory autophagy promotes extracellular BDNF maturation by enhancing MMP9 secretion. Nature Communication. 2021;12(1):4643. https://doi.org/10.1038/s41467-021-24810-5
12. Azaryan A, Barkhudaryan N, Galoyan A, Lajtha A. Action of brain cathepsin B, cathepsin D, and high-molecular-weight aspartic proteinase on angiotensins I and II. Neurochemical Research. 1985;10(11):1525–32. https://doi.org/10.1007/BF02430602
13. Rukavina Mikusic NL, Pineda AM, Gironacci MM. Angiotensin-(1-7) and Mas receptor in the brain. Exploration of Medicine. 2021;2(3):268–93. https://doi.org/10.37349/emed.2021.00046
14. Kerr DS, Bevilaqua LRM, Bonini JS, Rossato JI, Köhler CA, Medina JH, et al. Angiotensin II blocks memory consolidation through an AT2 receptor-dependent mechanism. Psychopharmacology. 2005;179(3):529–35. https://doi.org/10.1007/s00213-004-2074-5
15. De Kloet AD, Cahill KM, Scott KA, Krause EG. Overexpression of angiotensin converting enzyme 2 reduces anxiety-like behavior in female mice. Physiology & Behavior. 2020;224:113002. https://doi.org/10.1016/j.physbeh.2020.113002
16. Wang L, De Kloet AD, Pati D, Hiller H, Smith JA, Pioquinto DJ, et al. Increasing brain angiotensin converting enzyme 2 activity decreases anxiety-like behavior in male mice by activating central Mas receptors. Neuropharmacology. 2016;105:114–23. https://doi.org/10.1016/j.neuropharm.2015.12.026
17. Kao CY, Stalla G, Stalla J, Wotjak CT, Anderzhanova E. Norepinephrine and corticosterone in the medial prefrontal cortex and hippocampus predict PTSD-like symptoms in mice. European Journal of Neuroscience. 2015;41(9):1139–48. https://doi.org/10.1111/ejn.12860
18. Kamprath K, Wotjak CT. Nonassociative learning processes determine expression and extinction of conditioned fear in mice. Learning Memory. 2004;11(6):770–86. https://doi.org/10.1101/lm.86104
19. Motulsky HJ, Brown RE. Detecting outliers when fitting data with nonlinear regression — a new method based on robust nonlinear regression and the false discovery rate. BMC Bioinformatics. 2006;7(1):123. https://doi.org/10.1186/1471-2105-7-123
20. Yamagata R, Nemoto W, Nakagawasai O, Takahashi K, Tan-No K. Downregulation of spinal angiotensin converting enzyme 2 is involved in neuropathic pain associated with type 2 diabetes mellitus in mice. Biochemical Pharmacology. 2020;174:113825. https://doi.org/10.1016/j.bcp.2020.113825
21. Albrecht D. Angiotensin-(1-7)-induced plasticity changes in the lateral amygdala are mediated by COX-2 and NO. Learning Memory. 2007;14(3):177–84. https://doi.org/10.1101/lm.425907
22. Hellner K, Walther T, Schubert M, Albrecht D. Angiotensin-(1-7) enhances LTP in the hippocampus through the G-protein-coupled receptor Mas. Molecular and Cellular Neuroscience. 2005;29(3):427–35. https://doi.org/10.1016/j.mcn.2005.03.012
23. Almeida-Santos AF, Kangussu LM, Moreira FA, Santos RAS, Aguiar DC, Campagnole-Santos MJ. Anxiolytic- and antidepressant-like effects of angiotensin-(1–7) in hypertensive transgenic (mRen2)27 rats. Clinical Science. 2016;130(14):1247–55. https://doi.org/10.1042/CS20160116
24. Kangussu LM, Almeida-Santos AF, Bader M, Alenina N, Fontes MA, Santos RA, et al. Angiotensin-(1-7) attenuates the anxiety and depression-like behaviors in transgenic rats with low brain angiotensinogen. Behavioural Brain Research. 2013;257:25–30. https://doi.org/10.1016/j.bbr.2013.09.003
25. Fontes MA, Martins Lima A, dos Santos RAS. Brain angiotensin-(1-7)/Mas axis: A new target to reduce the cardiovascular risk to emotional stress. Neuropeptides. 2016;56:9–17. https://doi.org/10.1016/j.npep.2015.10.003
26. Marvar PJ, Goodman J, Fuchs S, Choi DC, Banerjee S, Ressler KJ. Angiotensin Type 1 Receptor Inhibition Enhances the Extinction of Fear Memory. Biological Psychiatry. 2014;75(11):864–72. https://doi.org/10.1016/j.biopsych.2013.08.024
27. Braszko JJ. AT 2 but not AT 1 receptor antagonism abolishes angiotensin II increase of the acquisition of conditioned avoidance responses in rats. Behavioural Brain Research. 2002;131(1–2):79–86. https://doi.org/10.1016/S0166-4328(01)00349-7
28. Raghavendra V, Chopra K, Kulkarni SK. Comparative studies on the memory-enhancing actions of captopril and losartan in mice using inhibitory shock avoidance paradigm. Neuropeptides. 2001;35(1):65–9. https://doi.org/10.1054/npep.2000.0845
29. Cohen H, Kaplan Z, Koresh O, Matar MA, Geva AB, Zohar J. Early post-stressor intervention with propranolol is ineffective in preventing posttraumatic stress responses in an animal model for PTSD. European Neuropsychopharmacology. 2011;21(3):230–40. https://doi.org/10.1016/j.euroneuro.2010.11.011
30. Nylocks KM, Michopoulos V, Rothbaum AO, Almli L, Gillespie CF, Wingo A, et al. An angiotensin-converting enzyme (ACE) polymorphism may mitigate the effects of angiotensin-pathway medications on posttraumatic stress symptoms. American Journal of Medical Genetics Part B. 2015;168(4):307–15. https://doi.org/10.1002/ajmg.b.32313
31. Ferrario CM, Jessup J, Chappell MC, Averill DB, Brosnihan KB, Tallant EA, et al. Effect of Angiotensin-Converting Enzyme Inhibition and Angiotensin II Receptor Blockers on Cardiac Angiotensin-Converting Enzyme 2. Circulation. 2005;111(20):2605–10. https://doi.org/10.1161/CIRCULATIONAHA.104.510461
32. Imai Y, Kuba K, Rao S, Huan Y, Guo F, Guan B, et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature. 2005;436(7047):112–6. https://doi.org/10.1038/nature03712
33. Ishiyama Y, Gallagher PE, Averill DB, Tallant EA, Brosnihan KB, Ferrario CM. Upregulation of Angiotensin-Converting Enzyme 2 After Myocardial Infarction by Blockade of Angiotensin II Receptors. Hypertension. 2004;43(5):970–6. https://doi.org/10.1161/01.HYP.0000124667.34652.1a
34. Karram T, Abbasi A, Keidar S, Golomb E, Hochberg I, Winaver J, et al. Effects of spironolactone and eprosartan on cardiac remodeling and angiotensin-converting enzyme isoforms in rats with experimental heart failure. American Journal of Physiology: Heart and Circulatory Physiology. 2005;289(4):H1351–8. https://doi.org/10.1152/ajpheart.01186.2004
35. Supé S, Kohse F, Gembardt F, Kuebler WM, Walther T. Therapeutic time window for angiotensin-(1–7) in acute lung injury. British Journal of Pharmacology. 2016;173(10):1618–28. https://doi.org/10.1111/bph.13462
Об авторах
Ю. А. ТимошинаРоссия
Тимошина Юлия Анатольевна
Москва
Т. С. Дейнекина
Россия
Дейнекина Татьяна Сергеевна
Москва
Е. В. Савинкова
Россия
Савинкова Елена Владимировна
Москва
В. С. Юдин
Россия
Юдин Владимир Сергеевич, канд. биол. наук
Москва
А. А. Кескинов
Россия
Кескинов Антон Артурович, канд. мед. наук
Москва
В. В. Макаров
Россия
Макаров Валентин Владимирович, канд. биол. наук
Москва
Э. А. Андяржанова
Россия
Андяржанова Эльмира Алиякбяровна, канд. мед. наук
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Тимошина Ю.А., Дейнекина Т.С., Савинкова Е.В., Юдин В.С., Кескинов А.А., Макаров В.В., Андяржанова Э.А. Трансгенез по гену ACE2 усиливает память о психофизиологической травме в модели посттравматического стрессового расстройства у мышей. Медицина экстремальных ситуаций. 2025;27(3):341-350. https://doi.org/10.47183/mes.2025-321
For citation:
Timoshina Yu.A., Deinekina T.S., Savinkova E.V., Yudin V.S., Keskinov A.A., Makarov V.V., Anderzhanova E.A. ACE2 gene transgenesis enhances memory of psychophysiological trauma in mouse models of post-traumatic stress disorder. Extreme Medicine. 2025;27(3):341-350. https://doi.org/10.47183/mes.2025-321

















