Перейти к:
Перспективы применения интраназальных наноразмерных полимерных систем доставки лекарственных препаратов и антидотов в медицине экстремальных ситуаций
https://doi.org/10.47183/mes.2024-26-4-27-37
Аннотация
Введение. Создание усовершенствованных лекарственных форм антидотов и средств терапии, применение которых возможно не только квалифицированным медицинским персоналом, но и в порядке само- и взаимопомощи, является актуальной задачей медицины экстремальных ситуаций.
Цель. Оценка возможности применения наноразмерных полимерных систем доставки лекарственных средств и антидотов, предназначенных для введения в носовую полость (интраназально), в медицине экстремальных ситуаций.
Обсуждение. В ходе исследования были выделены основные полимерные носители субмикронного размера, которые являются перспективными для дальнейшего возможного создания интраназальной формы антидотов. На биодоступность доставляемого вещества влияют физико-химические характеристики самого носителя, условия его получения, а также физиологические и анатомические факторы. Представлены данные о возможных способах коррекции указанных факторов с целью повышения биодоступности. Вторая часть работы посвящена примерам применения полимерных наноносителей в терапии отравлений тяжелыми металлами, компонентами ракетного топлива и поражений, вызванных радиоактивными веществами. Показано, что в некоторых случаях носители (дендримеры, циклодекстрины) могут сами выступать в качестве антидотов. В исследовании представлен перечень антидотов, разрешенных к применению на территории Российской Федерации, для которых возможна с учетом их физико-химических и фармакокинетических свойств разработка интраназальных форм.
Выводы. На основании анализа данных литературы предложены наиболее перспективные полимерные носители субмикронного размера для интенсификации назальной доставки лекарственных средств и антидотов: дендримеры, липосомы, нанокапсулы, наночастицы и циклодекстрины. На примере перечня антидотов, разрешенных к применению на территории Российской Федерации, предложен список препаратов, для которых применение данных носителей является перспективным.
Для цитирования:
Федотова Е.В., Криворотов Д.В., Радилов А.С. Перспективы применения интраназальных наноразмерных полимерных систем доставки лекарственных препаратов и антидотов в медицине экстремальных ситуаций. Медицина экстремальных ситуаций. 2024;26(4):27-37. https://doi.org/10.47183/mes.2024-26-4-27-37
For citation:
Fedotova E.V., Krivorotov D.V., Radilov A.S. Prospects for the use of intranasal nanoscale polymer delivery systems for drugs and antidotes in extreme medicine. Extreme Medicine. 2024;26(4):27-37. https://doi.org/10.47183/mes.2024-26-4-27-37
ВВЕДЕНИЕ
В фармакологии/токсикологии антидотом принято называть любое лекарственное средство, способное обезвреживать токсикант и устранять вызываемый им патологический эффект. Для быстроты действия такие препараты, как правило, разрабатываются и производятся в лекарственной форме растворов для инъекций. Несмотря на успехи и достижения современной фармацевтической промышленности, по объективным фармакоэкономическим причинам в настоящее время как на мировом фармацевтическом рынке, так и в России как никогда наблюдается тенденция нехватки целого ряда лекарственных препаратов, применяемых в терапии острых и хронических отравлений тяжелыми металлами, наркотическими и фосфорорганическими соединениями (ФОС), цианидами и гидразином.
Антидотная терапия входит в состав комплексного лечения острых отравлений как бытового, так и техногенного характера и применяется врачами токсикологических бригад на догоспитальном этапе, врачами медицинских учреждений на госпитальном этапе, а также в порядке само- и взаимопомощи в мирное и военное время.
Растущая потребность в удобных и эффективных лекарственных препаратах (ЛП) для лечения и купирования последствий интоксикаций привела к существенному прогрессу фармацевтических технологий за последнее десятилетие [1]. Значительно возросло количество усовершенствованных лекарственных форм антидотов и средств терапии, применение которых возможно не только квалифицированным медицинским персоналом, но и в порядке само- и взаимопомощи. Также растет тенденция применения современных систем доставки для модифицирования детоксикационных свойств антидотов. При разработке новых лекарственных форм известных антидотов необходимо учитывать различия фармакокинетических показателей относительно их традиционных, преимущественно инъекционных лекарственных форм. Наибольший интерес в данном аспекте вызывают интраназальные формы ЛП, которые позволяют нивелировать различия в быстродействии между инвазивными и неинвазивными лекарственными формами введения, но не во всех случаях обеспечивают должную биодоступность и терапевтическое действие. Одним из возможных решений для разработки интраназальных ЛП является использование полимерных микро- и нанокапсул в качестве носителей для доставки антидотов, что является одной из актуальных тенденций в лечении отравлений металлами, предотвращении тяжелых отравлений наркотическими веществами и алкоголем [2][3].
Разработка неинвазивных лекарственных форм антидотов, в частности интраназальных форм с использованием полимерных наноносителей, может не только повысить эффективность известных препаратов, но и расширить сферы их медицинского применения. Однако следует учитывать, что система доставки ЛП, в том числе наноразмерная, не должна изменять исходные свойства антидота / лекарственного вещества или приводить к появлению побочных эффектов при их применении [4], например таких, как дыхательная депрессия, вызванная нежелательной доставкой лоперамида в центральную нервную систему (ЦНС) в случае его совместного приема с ингибиторами Р-гликопротеина [5]. Наоборот, наиболее перспективно применение интраназальной формы введения лекарственных препаратов в терапии острых отравлений нейротоксикантами в связи с возможностью интенсификации транспорта действующего вещества в ткани головного мозга, минуя гематоэнцефалический барьер (ГЭБ) и фазу метаболизма во внутренних органах. Например, при отравлении фосфорорганическими соединениями (ФОС) пралидоксим с низкой способностью проникновения через ГЭБ как антидот слабо влияет на центрально-опосредованное угнетение дыхания, вызываемое действием ФОС, но при интраназальном введении в форме катионных липосом хлорида пралидоксима (2-PAM) в качестве носителей способен снижать повреждение головного мозга и смертность у крыс при их отравлении параоксоном [6].
Отмечено, что интраназальные формы антидотов могут быть перспективными при выборе терапии отравлений, вызванных пульмонотоксикантами, везикантами и нервно-паралитическими отравляющими веществами, а также при острых радиационных поражениях [7][8]. Так, для купирования синдрома тошноты и рвоты назальная форма антиэметика существенно упрощает оказание помощи пострадавшему, тогда как прием традиционных средств в форме диспергируемых таблеток или буккальных пленок будет невозможен.
Современные наноносители, предлагаемые для модификации лекарственных препаратов, включают: наночастицы, такие как углеродные наночастицы (нанотрубки, графены), неуглеродные наночастицы (частицы железа, золота), наночастицы из биополимеров (капсулы, липосомы), нанороботы и наночипы [9–12]; дендримеры — трехмерные разветвленные монодисперстные полимеры; клатраты — комплексы бета-циклодекстрина; липосомы — биосовместимые и биодеградируемые двухслойные липидные везикулы размером до 0,5 мкм, способные инкапсулировать как полярные, так и неполярные соединения [13][14].
Основной отличительной характеристикой данных наноматериалов является их размер и состав. Именно они изначально определяют первичные физические и химические свойства будущего носителя: растворимость в воде и биологических жидкостях, поверхностный заряд, сорбционную, агрегационную и адгезионную способности, межмолекулярные взаимодействия, взаимодействие с клеточными мембранами и белками, цитотоксичность [15].
Лекарственные препараты на основе полимерных микро- и наноносителей могут быть введены различными путями: перорально, буккально, трансдермально, назально, парентерально и т.д.
При интраназальном пути введения всасывание веществ происходит главным образом в носовой полости [16][17] и зависит от различных факторов, приведенных на рисунке 1, особенности которых и способы их коррекции будут рассмотрены далее.
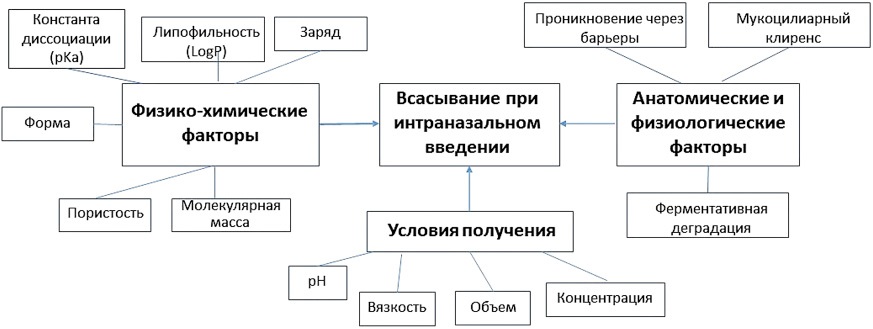
Рисунок подготовлен авторами по данным работы [15]
Рис. 1. Факторы, влияющие на всасывание систем доставки лекарств при интраназальном введении лекарственных препаратов
Интраназальный путь введения характеризуется отсутствием эффекта первого прохождения через печень. Ввиду анатомической особенности слизистой носа вещества попадают непосредственно в артериальный кровоток. Высокая биодоступность, удобство применения и высокая скорость развития эффекта позволяют рассматривать данный путь введения как перспективный для доставки лекарственных препаратов на основе полимерных микро- и наноносителей.
Цель работы — оценка возможности применения наноразмерных полимерных систем доставки лекарственных средств и антидотов, предназначенных для введения в носовую полость (интраназально), в медицине экстремальных ситуаций.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Физико-химические факторы всасывания веществ при интраназальном пути введения и способы их коррекции
На биодоступность веществ при интраназальном пути введения влияют физико-химические свойства наноносителей, такие как отношение поверхности к массе, прочность, проводимость, растворимость, стабильность и реакционная способность [17].
Разработка синтетических носителей, способных захватывать биомакромолекулы-мишени, — одно из направлений создания антидотов нового поколения. В природе взаимодействия между биомакромолекулами реализуются за счет слабых электростатических, гидрофобных, водородных и вандерваальсовых сил. При создании носителей-антидотов, способных захватывать молекулы-мишени, имитируются многоточечные электростатические взаимодействия путем включения функциональных мономеров (хелатирующих лигандов). Например, в качестве антидотов при отравлениях медью могут применяться наночастицы из поли(этилен-ко-глицидилметакрилата), функционализированные три-этилентетрамином, N,N-ди(2-пиридилметил)амином, 8-гидроксихинолином или 8-гидроксихинолин-2-сульфоновой кислотой [18].
Полимерные капсулы могут включать гидрофильные и гидрофобные антидоты, образуя с ними как ковалентные, так и нековалентные связи. Полимерные нанокапсулы способны защищать антидот от его деградации, вызванной белками крови или ферментами (пептидазы, фосфолипазы) гематоэнцефалического барьера. Высвобождение антидота из микро- и нанокапсул зависит от физико-химических характеристик лекарственного средства (размер частиц, концентрация и растворимость) и самого полимера (структура, молекулярная масса, пористость и механическая прочность).
Анатомические и физиологические факторы всасывания веществ при интраназальном пути введения и способы их коррекции
Физико-химические характеристики оказывают существенное влияние на дальнейшую судьбу препарата после интраназального введения. Если он имеет размер более 1 кДа, не растворяется в слизистой оболочке носа или обладает выраженным отрицательным зарядом (будет отталкиваться от отрицательно заряженной слизистой оболочки), то он не сможет проникать через слизистую оболочку носовых пазух. Проникновение веществ через слизистую оболочку может происходить несколькими путями, например трансклеточным проникновением и парацеллюлярно (между клетками). Липофильные вещества осуществляют трансцитоз путем пассивной диффузии и с помощью везикулярных транспортных механизмов, быстро абсорбируются. Поэтому применение липофильных систем доставки для нелипофильных антидотов может существенно повысить их эффективность. Полярные системы доставки антидота проходят через эпителий парацеллюлярно. Последний менее эффективен для крупных молекул (более 1000 Да) [16].
Возможность аксонального транспорта, который позволяет миновать ГЭБ, имеет значение, например, при интраназальной доставке многих анальгетиков и спазмолитиков, а также для купирования различных синдромов, вызванных действием токсикантов. Однако при данном пути носитель должен быть способен к ретроградному и антероградному перемещению в аксонах и дендритах [19]. Важными физико-химическими характеристиками наноносителей при данном пути проникновения являются их размер и химический состав поверхности. Наночастицы размером 20–50 нм способны проникать напрямую в центральную нервную систему путем аксонального транспорта и могут усиливать биодоступность [20]. Отрицательно заряженные наноносители притягиваются мембранами и синаптическими щелями нейронов. Следовательно, такие носители могут быть применимы для интраневральной доставки лекарственных веществ. Для положительно и нейтрально заряженных наноносителей характерен медленный перенос по аксонам, а для отрицательно заряженных носителей характерен быстрый перенос [21].
Влияние условий производства лекарственных форм на всасывание веществ при интраназальном пути введения
На всасывание вещества при интраназальном пути введения оказывают влияние условия производства наноразмерной системы доставки. Разработка каждой отдельно выбранной системы также требует индивидуального подхода и исследования ее токсичности. Применение токсичных органических растворителей (как в случае применения этиленгликоля при формировании некоторых нанокапсул) может позволить добиться желаемого уменьшения размера. Однако в некоторых случаях может привести к повышению токсичности при неполном его удалении. Способ получения наноносителя подбирается исходя из физико-химических свойств включаемого ЛП. Выбранный способ получения не должен негативно влиять на включаемое вещество (способствовать его разрушению или модифицировать его свойства).
Грамотный выбор полимера, из которого формируется наноноситель, включает в себя выполнение следующих условий: полимеры не должны быть токсичными, не должны вызывать канцерогенное или мутагенное действие, должны быть биосовместимыми. Известно, что некоторые разветвленные полимеры (дендримеры полипропилениминовые (PPI), полиамидаминовые (PAMAM) и полилизиновые (PLL)) обладают значительной цитотоксичностью вследствие большого содержания концевых аминогрупп [22]. Поэтому наиболее часто применяют носители не выше 4-го поколения. В большинстве случаев токсические эффекты, вызванные полимерными наноносителями, связаны с увеличением их цитотоксичности, а именно: снижением жизнеспособности клетки, ростом апоптоза, разрушением ДНК, разрывом клеточной мембраны и активацией перекисного окисления липидов [23].
Одним из существенных недостатков интраназального введения большинства ЛП является относительно низкая проницаемость слизистой полости носа для крупных макромолекул и интенсивный мукоцилиарный клиренс. Использование биоадгезивных полимеров (таких, как хитозан, карбопол, циклодекстрин и плюроник), входящих в состав наноносителя, позволит увеличить время пребывания препарата в полости носа, тем самым улучшая всасывание. Природа полимера влияет на его биоадгезивные качества, к тому же биоадгезивный полимер должен быть полярным и обладать достаточной вязкостью. На мукоадгезию полимеров существенно влияют гибкость полимерной цепи (жесткая сшивка цепей полимеров существенно ограничивает их диффузию через мембраны и взаимодействие с муцином), молекулярная масса (чем ниже молекулярная масса, тем легче проницаемость через слизистую), степень набухания, способность к образованию водородных связей.
Поскольку слизистая оболочка носа липофильна, можно предположить, что степень абсорбции липофильных носителей будет более эффективной. Для обеспечения адекватной фармакокинетики полимера, необходимой для реализации лечебного эффекта при интраназальном введении, используют специальные растворители и вещества-пенетранты, повышающие способность проникновения через биологические мембраны, и разнообразные системы частиц-носителей различной природы, формы, размера. Например, добавка хитозана способна увеличивать парацеллюлярный транспорт веществ при интраназальном введении капель 0,5% хитозана и 1% атропина сульфата в терапии отравлений фосфорорганическими соединениями [24]. В качестве носителя также может быть интересен циклодекстрин (диметил-бета-циклодекстрин) ввиду его способности не только переносить лекарственные вещества, но и, подобно хитозану, увеличивать их парацеллюлярный транспорт [25].
Несмотря на ряд существенных отличий фармакокинетики парентерального и интраназального способов введения, последний обладает существенным преимуществом: неинвазивность процедуры введения антидота, возможность снижения дозы за счет лучшей биодоступности, упрощение технологии производства, возможность самостоятельного введения [18][20].
При этом перспективные носители могут одновременно доставлять различные группы лекарственных средств (например, антиэметики и анальгетики). Применение носителей для лекарственных средств позволяет модифицировать их физико-химические свойства (увеличить гидрофильность, проницаемость биологических барьеров), повысить биологическую доступность и тем самым оптимизировать фармакокинетические показатели.
Из всего многообразия нами были выбраны четыре наиболее перспективных, на наш взгляд, субмикронных носителя для назального пути введения: липосомы, дендримеры, нанокапсулы и циклодекстрины.
Применение наноносителей для интенсификации проникновения ЛС и антидотов через гематоэнцефалический барьер
Многие опасные для человека вещества (наркотические вещества, фосфорорганические пестициды, нервно-паралитические отравляющие вещества и др.) легко преодолевают гематоэнцефалический барьер и проникают в ткани центральной нервной системы. При этом лишь небольшая часть используемых в медицине лекарственных препаратов способна эффективно преодолевать ГЭБ, что затрудняет разработку антидотов ЦНС-активных веществ. В большинстве случаев лишь гидрофильные соединения с молекулярной массой менее 150 Да и гидрофобные соединения с массой менее 600 Да способны проникать через ГЭБ путем пассивной диффузии [26–28]. Таким образом, многие из используемых ЛС не способны обеспечить эффективную защиту центральной нервной системы при интоксикациях различного генеза.
Скорость проникновения ЛС через ГЭБ определяет адекватность, своевременность и эффективность терапевтического действия [28]. Например, экспериментально установленная скорость поступления налоксона в головной мозг в 8–10 раз превышает скорость поступления морфина [29], что позволяет ему оказывать выраженное антидотное действие. Но в случае отравлений быстро проникающими через ГЭБ центрально-активными токсикантами антидотная активность налоксона существенно снижается [30]. При этом сочетание эффективных систем доставки и назального способа введения может существенно усилить действие традиционных антидотов и обеспечить их применение не только квалифицированным медицинским персоналом, но и в порядке само- и взаимопомощи [28].
Системы доставки на основе наноносителей могут обеспечить ЛС лучшую эффективность проникновения через ГЭБ четырьмя путями: посредством накопления на стенках кровеносных капилляров головного мозга, повышая градиент концентрации антидота между кровотоком и тканями ЦНС; путем прохождения в свободной форме или вместе с носителем за счет раскрытия плотных соединений между эндотелиальными клетками головного мозга; с помощью эндоцитоза эндотелиальными клетками и последующим высвобождением антидота в эндотелиальном слое и диффузией в ткани головного мозга; посредством трансцитоза через слой эндотелиальных клеток в головной мозг [31]. Наиболее часто для доставки лекарственных препаратов в головной мозг используют в качестве носителей наночастицы из биоразлагаемых полимеров, таких как полилактидгликолид (PLGA), человеческий сывороточный альбумин (HSA) и хитозан [32]. Например, применяемый как антидот мышьяка кверцетин, инкапсулированный в наночастицы PLGA, способен пересекать ГЭБ, что позволяет нивелировать истощение клеток головного мозга при отравлениях [33].
Как перспективные полимерные наноносители для антидотов нейротоксикантов хорошо показали себя дендримеры (трехмерные разветвленные монодисперсные полимеры), способные проходить через гематоэнцефалический барьер [32]. Так, конъюгаты низкомолекулярного антидота фосфорорганического соединения (ФОС) пиридин-альдоксима с полиамидаминовым дендримером (PAMAM) 5-го поколения показали свою эффективность в модели интоксикации параксоном на мышах [34]. Полиэфирные дендримеры 2,2-бис(гидроксиметил)пропановой кислоты (bis-MPA) способны связывать фосфорорганические соединения, в частности дихлофос, что позволило рассматривать такой полимерный наноноситель как самостоятельный антидот ФОС [35].
Применение полимерных наноносителей при отравлениях тяжелыми металлами
К группе тяжелых металлов относятся ртуть, свинец, кадмий, мышьяк, хром, кобальт, молибден, никель, сурьма, цинк, скандий, марганец, ванадий, стронций, барий, вольфрам. Их органические и неорганические соединения встречаются во многих отраслях промышленности, активно применяются в сельском хозяйстве и быту. Механизм действия многих тяжелых металлов основан на блокировании сульфгидрильных, аминных и карбоксильных групп белков-ферментов и структурных белков. В результате этого нарушается белковый, углеводный и жировой обмен в организме. Разработка новых антидотов и хелатов для лечения интоксикаций тяжелыми металлами остается важной и актуальной задачей [36].
Хелатотерапия — один из способов лечения отравлений тяжелыми металлами; она основана на формировании нерастворимого, менее токсичного комплекса металлов, который легко выводится из организма. Поэтому перспективным направлением в лечении отравлений тяжелыми металлами является использование полимерных наночастиц как в качестве носителей для доставки, так и самостоятельно, принимая во внимание наличие у данных соединений хелатирующих свойств.
Циклодекстрины — природные полимерные системы доставки, представители отдельного класса макроциклических лигандов в супрамолекулярной химии [36], характеризуемые как нетоксичные вещества, способные образовывать комплексы со многими токсикантами (рис. 2).
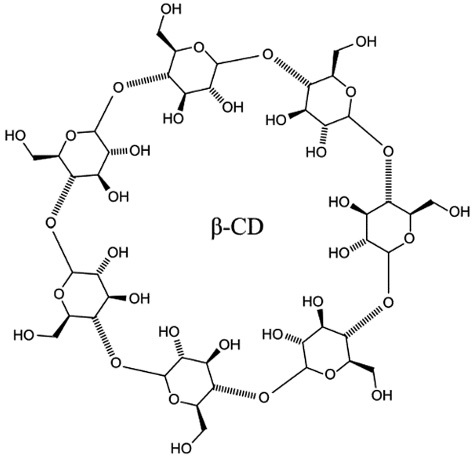
Рисунок подготовлен авторами по материалам PubChem [37]
Рис. 2. Структурная формула бета-циклодекстрина
Впервые об использовании циклодекстрина в качестве самостоятельного антидота стало известно в 2002 году, когда была продемонстрирована его способность нивелировать эффекты, вызванные курареподобными миорелаксантами [38], что позволило разработать лекарственный препарат для реверсии нейромышечной блокады на основе модифицированного гамма-циклодекстрина, вводимого внутривенно в дозах от 1 до 16 мг/кг. Такой путь введения и дозы позволяют рассматривать возможность интраназального пути введения циклодекстрина как альтернативу, особенно с учетом того, что данные соединения обладают способностью к связыванию со многими ксенобиотиками, в частности опиоидными анальгетиками, и, следовательно, могут найти применение как детоксицирующие вещества при отравлениях такими длительно действующими опиатами, как метадон, для которых не существует доступных антидотов [39]. Поскольку внешняя поверхность природных циклодекстринов содержит первичные и вторичные гидроксильные группы, которые могут ковалентно связываться с ионами тяжелых металлов, они могут выступать и как перспективные антидоты при отравлениях тяжелыми металлами, такими как медь, свинец (наиболее сильное сродство) и кадмий [40]. Так как некоторые циклодекстрины разрешены и для применения в пищевой промышленности при производстве продуктов специализированного питания, они могут быть рекомендованы в качестве лечебно-профилактического питания для сотрудников предприятий, контактирующих с тяжелыми металлами.
Для лечения хронических отравлений тяжелыми металлами (в частности свинцом) предлагается хелатная терапия димеркаптоянтарной кислотой (DMSA), динатрийэтилендиаминтетрауксусной кислотой кальция (EDTA), 2,3-димеркаптопропанолом (BAL) и D-пеницилламином. Однако к основным их недостаткам следует отнести слабую растворимость в воде, низкую биодоступность при приеме внутрь (перорально) и короткий период полувыведения, что значительно ограничивает их клиническое применение [41]. При этом адсорбенты тяжелых металлов, используемые в промышленности, такие как мезопористые кремниевые наночастицы (MSN) [10], потенциально могут применяться и в качестве адсорбента ЛС в организме, например для лечения случаев отравления тиоловыми ядами. Например, наночастицы MSN, модифицированные хелатором ЭДТА, показали хороший эффект при интоксикации железом [42]. Также для лечения отравлений тяжелыми металлами рассматривается куркумин, инкапсулированный в хитозановые нанокапсулы диаметром 50 нм. Хитозановая оболочка защищает соединение от поглощения ретикулоэндотелиальной системой (RES), повышает его биодоступность и позволяет более длительно циркулировать в крови. Такой подход дает возможность существенно снизить дозу куркумина при пероральном введении для эффективного выведения тяжелых металлов из организма [43]. Аналогично инкапсуляция селенометионина в PLGA-нанокапсулы приводила к 7-кратному повышению его детоксицирующей эффективности по отношению к ртутьсодержащим веществам по сравнению с традиционным способом введения [44].
Применение в качестве носителей дендримеров и дендриграфтов позволяет делать гидрофильными некоторые гидрофобные вещества. Их использование при комплексообразовании с водорастворимыми хелаторами, такими как DMSA, дает возможность получить гидрофильные комплексы с оптимальными показателями биодоступности [41], а водорастворимые комплексы дендримеров с полифенолом кверцетином обеспечивают способность к проникновению через ГЭБ и могут быть использованы для борьбы с окислительным стрессом при отравлениях мышьяком [33][45].
Применение полимерных наноносителей для доставки антидотов и радиопротекторов
Единственным эффективным антидотом при отравлении несимметричным диметилгидразином (НДМГ) считается пиридоксин (витамин В6) [46]. Данный препарат купирует судорожный синдром и уменьшает токсическое действие НДМГ и его метаболитов на ЦНС. Нейротоксическое действие несимметричного диметилгидразина проявляется в снижении содержания пиридоксальфосфата в результате его взаимодействия с пиридоксалем, содержащимся в клетках тканей головного мозга. В результате образуются токсичные пиридоксальгидразоны, угнетающие активность пиридоксалькиназы и блокирующие тем самым синтез в клетке пиридоксальфосфата [46].
Структура витамина В6 содержит гидроксильную группу, что предполагает возможность электростатического взаимодействия с полимерными носителями, имеющими положительно заряженные функциональные группы, например дендримеры. Полифенол куркумин, заключенный в нанолипосомальную форму (NLC), также проявил себя в качестве средства терапии отравления диметилгидразином у мышей. Введение нанолипосомального куркумина в дозе 150 мг/кг позволило значительно снизить показатели сывороточной аланинаминотрансферазы (АлАТ) и лактатдегидрогеназы (ЛДГ), которые повышались под действием диметилгидразина, а также заметно повысить уровень γ-аминомасляной кислоты (ГАМК) в гиппокампе [47].
Высокую опасность для человека проявляют соли синильной кислоты. При этом липосомальный метгемоглобин (MetHb@Lipo) показал свою эффективность в качестве нового антидота при отравлении цианидами [48], существенно увеличивая выживаемость животных после контакта с сероводородом за счет сохранения активности цитохром-С-оксидазы и подавления метаболического ацидоза [13].
Поражение радиоактивными веществами может происходить только при нештатных чрезвычайных ситуациях (транспортировка отходов, испытания и работа на установках с радиоактивными элементами). Разработка неинвазивной формы радиопротекторов также является важной задачей. Например, наиболее известный и эффективный радиопротектор Амифостин в настоящее время может быть введен только парентерально, но при таком способе введения он быстро выводится из организма. В связи с этим исследователи всего мира активно занимаются разработкой новой формы антидота, которая могла бы обеспечить более эффективное дозирование препарата и снизить его токсичность. Т.К. Mandal et al. разработали гибридные микрокапсулы из PLGA и хитозана, которые позволили эффективно инкапсулировать Амифостин. Такой состав микрокапсулы обеспечивал сокращение скорости высвобождения препарата на 45%. Кроме того, имеется предположение, что введение в оболочку хитозана позволит увеличить всасывание препарата и увеличить его биодоступность [49].
Применение полимерных наноносителей для разработки средств симптоматической терапии
Многие химические вещества вызывают при отравлении целый спектр патофизиологических процессов, которые представляют угрозу для жизни человека. В таких случаях требуется одновременное применение как средств этиотропной терапии, так и патогенетической, симптоматической терапии для устранения отдельных симптомов интоксикации. Совершенствование терапевтических препаратов для симптоматической терапии за счет разработки систем доставки предположительно может не только существенно облегчить процедуру их введения, но и повысить эффективность лечения. Например, модифицированные противорвотные препараты могут найти свое применение для купирования рвотного рефлекса при острых радиационных поражениях и отравлениях ФОВ. В настоящее время классическими путями введения данной группы препаратов является пероральный и парентеральный. Интраназальное введение противорвотных средств может существенно упростить процедуру введения препарата и нивелировать эффект первого прохождения через печень [50]. В исследовании Y. Ozsoy, S. Güngör назальное введение метоклопрамида in situ в виде гелей из полоксамера 405 позволяло повысить его биодоступность на 19% по сравнению с пероральным введением [51]. Высокая эффективность при интраназальном введении ондасетрона и гранистерона была получена благодаря их включению в микрочастицы из хитозана, сшитые глутаровым альдегидом [52]. Высокую антиэмическую активность при интраназальном введении показали препарат гранисетрона, инкапсулированный в микрочастицы на основе циклодекстрина и карбоксиметилцеллюлозы [53].
При отравлениях раздражающими веществами, ожогах, в стоматологической и хирургической практике для лечения боли используют анальгетики (опиоидные и неопиоидные анальгетики центрального действия, адъювантные анальгетики, нестероидные противовоспалительные препараты). Однако многие анальгетики имеют короткий период действия, что приводит к увеличению частоты его введения пациенту. В этом случае использование системы доставки может позволить обеспечить постепенное низкодозное контролируемое поступление препарата в организм пострадавшего при сохранении эффективности и снижении побочных эффектов. Например, включение бензокаина® в полимерные наночастицы (PLGA, PLA, PCL) позволяет пролонгировать обезболивающий эффект по сравнению с обычным препаратом [54].
Не менее важным при острых отравлениях многими токсикантами является купирование судорожного синдрома. Применение противосудорожных препаратов, таких как карбамазепин, в виде наночастиц из карбоксиметилхитозана, при интраназальном введении дает возможность обеспечить необходимую концентрацию препарата в мозге и, соответственно, повысить эффективность лечения [55].
Предложения по модификации антидотных средств, разрешенных к применению в Российской Федерации
На основании анализа отечественной и зарубежной литературы, а также исходя из структурных и физико-химических особенностей препаратов, рекомендованных для применения в качестве антидотов, нами предложены возможные полимерные носители для модификации некоторых антидотных средств, разрешенных в настоящее время к применению на территории Российской Федерации (табл. 1).
Таблица 1. Оценка перспективности разработки неинвазивных лекарственных форм отдельных разрешенных к применению на территории Российской Федерации антидотов с учетом их физико-химических и фармакокинетических свойств
Наименование антидота и показания к применению | Форма выпуска, доза препарата | Физико-химические свойства | Абсорбция | Целесообразность разработки неинвазивных лекарственных форм |
Галантамин
Отравление холинолитиками | Р-р для в/в и п/к введения 1 мг/мл | ММ = 368,27 г/моль Слаборастворим в воде и спирте Растворим в хлороформе pKa 8,32 | Галантамин купирует церебральный холинергический синдром. Абсолютная биодоступность при пероральном приеме составляет около 90%. Период полувыведения: 7 ч | Учитывая, что липосомы и дендримеры с размером частиц 3–5 мкм эффективно доставляют лекарственные вещества в головной мозг. На основании физико-химических свойств препарата перспективна разработка его липосомальной формы методом гидратации/регидратации тонкой пленки ввиду слабой растворимости в воде и спирте, но хорошей растворимости в хлороформе. Реакционная гидроксильная группа галантамина может электростатически связываться с дендримерами, имеющими положительно заряженные аминогруппы, в частности с полилизиновым дендримером третьего поколения, способным проникать через ГЭБ. Возникающая электростатическая связь достаточно непрочная и позволит обеспечить плавное высвобождение препарата из молекулы носителя. Ожидается эффективная доставка препарата в ЦНС при интраназальном применении, что может позволить обеспечить необходимую терапевтическую дозу галантамина |
Глюкагон® NH2-His-Ser-Gln-Gly-Thr-Phe- Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser- Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu- Met-Asn-Thr-COOH Передозировка блокаторами кальциевых каналов | Лиофилизат д/пригот. р-ра д/инъекц. 1 мг | ММ = 3485 г/моль Гидрофобный Растворы препарата стабильны в течение 48 ч при хранении при температуре 5 °C pKa 7,1 | При внутривенном введении глюкагона в дозе 1 мг/мл максимальная концентрация в крови на уровне 7,9 нг/мл достигается спустя 20 мин. При внутримышечном введении максимальная концентрация составляет 6,9 нг/мл через 13 мин. При интраназальном введении в дозе 3 мг максимальная концентрация составляет 6130 пг/мл через 15 мин | Рассмотрение строения и физико-химических свойств глюкагона позволяет ожидать включение данного пептида в гидрофобную часть липосомы, что может обеспечить его защиту от воздействия ферментов и деструкции. Заряженные реакционные концевые группы пептида (NH2 и COOH) позволяют предполагать возможность образования электростатических взаимодействий с заряженными дендримерами. При интерназальном введении такие препараты на основе липосом или дендримеров могут обеспечить требуемую концентрацию глюкагона, необходимую для обеспечения терапевтического действия |
Карбоксим®
Поражение ФОВ | Р-р для в/м введения 15% — 1 мл (150 мг) | ММ = 413,35 г/моль Гидрофильный | Является реактиватором холинэстераз центральной нервной системы. Восстанавливает нервно-мышечную проводимость | Ввиду своего строения карбоксим плохо проходит через ГЭБ. Для внутримышечной доставки данного препарата требуется большая доза. Применение правильно подобранного носителя для препарата может позволить существенно снизить его высокую дозу при сохранении терапевтического эффекта. В то же время обеспечение оптимальной биодоступности при интраназальном введении карбоксима может позволить создать антидот, удобный для применения в рамках само- и взаимопомощи. Некоторые функционализированные циклодекстрины стехиометрически способны поглощать ФОС. Интраназальная система доставки «реактиватор ацетилхолинэтеразы — циклодекстрин» позволит обеспечить парацеллюлярный транспорт препарата и, вероятно, даст возможность увеличить его эффективность. Поскольку карбоксим и другие реактиваторы ацетилхолинэстеразы — гидрофильные препараты, их можно включать и в нанокапсулы, и в липосомы. Однако наиболее перспективным решением является формирование комплекса дендример-карбоксим за счет заряженных фрагментов молекулы, что может повысить эффективность прохождения карбоксима через ГЭБ. Кроме того, дендример способен самостоятельно реагировать с некоторыми ФОС, что также позволит увеличить эффективность антидота |
Налоксон
Отравление наркотическими анальгетиками | Р-р для инъекций, 0,4 мг/мл, 1 мл, ампулы | ММ = 327,4 г/моль Гидрофильный pKa 7,9 | Является антагонистом μ-опиоидных рецепторов. Период полувыведения: 1–1,5 ч Биодоступность при приеме внутрь до 20% | Липосомальные и дендримерные формы антагонистов опиоидных рецепторов при интраназальном введении позволяют максимально увеличить биодоступность действующих веществ за счет увеличения их абсорбции путем простой диффузии, необходимой для надежного терапевтического эффекта при отравлениях наркотическими анальгетиками. При этом недостаток биодоступности при таком способе введения компенсируется прямым поступлением антагонистов в ткани ЦНС, что обеспечивает терапевтическое действие не хуже, чем у их инъекционных препаратов. Наоборот, при лечении социально значимых заболеваний (различные виды зависимостей) наиболее перспективно микрокапсулирование в биоразлагаемые полимеры, такие как PLGA или хитозан, что, как правило, обеспечивает медленное пролонгированное действие таких препаратов при введении депо-формы и обеспечивает их защиту от воздействия РЭС |
Налмефен
Лечение алкогольной зависимости | Таблетки, покрытые пленочной оболочкой, 18 мг | ММ = 339,4 г/моль Гидрофильный pKa 7,6 | Опиоидный антагонист длительного действия с сродством к к-опиоидному рецептору и μ-опиоидному рецептору. Не подвергается пресистемному метаболизму |
Таблица составлена авторами по материалам PubChem [37]
Очевидно, что далеко не все антидоты нуждаются в разработке интраназальной формы. Например, из нашего анализа были изначально исключены такие препараты, как этиловый спирт или глюконат кальция. Также разработка интраназальных форм для некоторых антидотов изначально нежелательна, поскольку может усилить эффект препарата и привести к возможным опасным побочным эффектам. Например, в случае применения антихолинэстеразного препарата прозерина нежелательно усиление его влияния на ЦНС. Некоторые из применяемых в медицине антидотов (такие, как атропина сульфат, купренил® и пиридоксина гидрохлорид) с хорошей биодоступностью и эффективностью в традиционных формах не нуждаются в существенных модификациях, кроме как из соображений удобства применения. Тем не менее разработка интраназальной формы пиридоксина может, например, оказаться перспективной в качестве возможного профилактического антидота для работников, имеющих профессиональный контакт с компонентами ракетного топлива. Структура как пиридоксина, так и атропина технически позволяет им электростатически связываться с концевыми группами дендримера, и, по нашим предположениям, такая система доставки может демонстрировать большую эффективность за счет интенсификации всасывания и проникновения через ГЭБ, что позволит при аварийных ситуациях оказывать введение антидота в порядке само- и взаимопомощи.
В некоторых случаях менее инвазивная интраназальная форма может являться альтернативой парентеральному и пероральному введению и найти свое применение, например, в педиатрии. Такой известный антидот, как Викасол, применяется при передозировке препаратами — антагонистами витамина К (варфарин, фениндион, аценокумарол). Разработка интраназальных лекарственных форм синтетического витамина К может иметь перспективу в педиатрии для профилактики витамин К-зависимого геморрагического синдрома у новорожденных. Парентеральное введение антидота детям с таким синдромом приводит к излишней травматизации, при этом липосомальная интраназальная форма витамина К позволит не только решить проблему упрощения введения лекарственного средства пациентам, но и обеспечить эффективную его доставку в организм.
Целесообразность разработки неинвазивных лекарственных форм, разрешенных в настоящее время к применению на территории Российской Федерации [56], с учетом их физико-химических и фармакокинетических свойств рассмотрена в таблице 1.
ЗАКЛЮЧЕНИЕ
Анализ результатов проведенного исследования позволяет заключить, что наиболее перспективными наноразмерными полимерными системами доставки лекарственных средств и антидотов, предназначенных для интраназального введения, являются дендримеры, липосомы, циклодекстрины и нанокапсулы.
На всасывание системы доставки лекарственного вещества и антидота при интраназальной доставке влияют физико-химические характеристики самого носителя (отношение поверхности к массе, прочность, проводимость, растворимость, стабильность и реакционная способность), физиологические и анатомические факторы (способность проникать через ГЭБ), а также условия получения носителей (наличие или отсутствие примесей в виде растворителей и веществ-пенетрантов).
Показано, что некоторые носители могут сами являться антидотами: дендримеры способны реагировать с ФОС (как в случае с полиэфирным дендримером bis-MPA и дихлофосом), циклодекстрины являются антидотами для курареподобных миорелоксантов.
При отравлениях тяжелыми металлами высокую эффективность на данный момент показали не только модифицированные хелатирующие вещества (такие как мезопористые кремниевые наночастицы, модифицированные ЭДТА), но и наночастицы хитозана, содержащие куркумин и инкапсулированный в PLGA-нанокапсулы селенометионин.
Интраназальный способ введения может быть удобен при радиационных поражениях, когда затруднен пероральный прием антидота (вследствие рвоты). Повышение эффективности известных радиопротекторов и снижение токсичности при одновременном их неинвазивном введении также перспективное и по сей день не решенное направление в данной области.
Оценена возможность применения полимерных наноносителей в целях совершенствования терапевтических препаратов для симптоматической терапии (антиэметики, противовоспалительные, противосудорожные, обезболивающие и антигистаминные препараты). На примере включения бензокаина в наночастицы PLGA продемонстрирована возможность пролонгирования обезболивающего эффекта препарата.
В обзоре даны предложения по модификации резерва антидотов, применяемых на территории Российской Федерации. Показано, что для многих их них интраназальная форма введения является наиболее перспективной ввиду ее неинвазивности (парентеральное введение вызывает дополнительную травматизацию пораженных тканей и может служить входными воротами для вторичной инфекции), простоты употребления, а также быстрой скорости доставки лекарственного препарата. В данной работе отмечено, что микрокапсулирование позволяет при необходимости добиться программируемого высвобождения препарата. Большинство наноносителей имеют как неоспоримые достоинства, так и ограничения. В связи с этим вопросы поиска наиболее эффективных интраназальных носителей на сегодняшний день остаются открытыми.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Федотова Е.В. — сбор и анализ данных для работы, составление проекта работы; Криворотов Д.В. — сбор и интерпретация данных для работы, критический анализ работы на предмет научной новизны; Радилов А.С. — интерпретация данных, дизайн исследования, окончательное утверждение версии для публикации.
Список литературы
1. Pitschmann V, Hon Z. Drugs as Chemical Weapons: Past and Perspectives. Toxics. 2023;11(1):52. https://doi.org/10.3390/toxics11010052
2. Manek E, Petroianu GA. Brain delivery of antidotes by polymeric nanoparticles. Journal of Applied Toxicology. 2021;41(1):20–32. https://doi.org/10.1002/jat.4029
3. Britch SC, Walsh SL. Treatment of opioid overdose: current approaches and recent advances. Psychopharmacology. 2022;239(7):2063–81. https://doi.org/10.1007/s00213-022-06125-5
4. Wunnapuk K. Toxicology and Safety of Nanoparticles in Drug Delivery System. Fundamentals of Drug Delivery. 2021:329–48. https://doi.org/10.1002/9781119769644.ch13
5. Kharasch ED, Hoffer C, Whittington D. The effect of quinidine, used as a probe for the involvement of P-glycoprotein, on the intestinal absorption and pharmacodynamics of methadone. British journal of clinical pharmacology. 2004;57(5):600–10. https://doi.org/10.1111/j.1365-2125.2003.02053.x
6. Pashirova TN, Zueva IV, Petrov KA, Lukashenko SS, Nizameev IR, et al. Mixed cationic liposomes for brain delivery of drugs by the intranasal route: The acetylcholinesterase reactivator 2-PAM as encapsulated drug model. Colloids and Surfaces B: Biointerfaces. 2018;171:358–67. https://doi.org/10.1016/j.colsurfb.2018.07.049
7. Иванов ИМ, Ивченко ЕВ, Юдин МА, Венгерович НГ, Никифоров АС. и др. Аспекты применения лекарственных препаратов для ингаляций на догоспитальном этапе медицинской эвакуации. Вестник Российской военномедицинской академии. 2021;23(4):247–55.
8. Ивницкий ЮЮ, Краснов КА, Иванов МБ, Рейнюк ВЛ, Головко АИ. Перспективы назального спрея в арсенале средств первой помощи при острых отравлениях. Токсикологический вестник. 2020;2(161):4–10.
9. Osman NS, Sabri MA, Sapawe N. Synthesis of Mesoporous Silica Nanoparticles from Oil Palm Frond Based Silica to Enhanced Removal of Heavy Metal. Trans Tech Publications Ltd. 2022;1076: 221–27. https://doi.org/10.4028/p-29dk6k
10. Laffleur F., Bauer B. Progress in nasal drug delivery systems. International Journal of Pharmaceutics. 2021;607:120994. https://doi.org/10.1016/j.ijpharm.2021.120994
11. Jain KK. An overview of drug delivery systems. Drug Delivery Systems. 2020:1–54. https://doi.org/10.1007/978-1-4939-9798-5_1
12. Aneebuddin MK, Kumar P. Recent Trends in the Chemistry of Polymers used in Oral Drug Delivery Systems. Chemistry Research Journal. 2022;7(6):97–106. https://doi.org/10.1186/s40824-020-00190-7
13. Suzuki Y, Taguchi K, Kure T, Enoki Y, Otagiri M, et al. Liposomal methemoglobin as a potent antidote for hydrogen sulfide poisoning. Toxicology and Applied Pharmacology. 2022;450:116159. https://doi.org/10.1016/j.taap.2022.116159
14. Suzuki Y, Taguchi K, Kure T, Sakai H, Enoki Y, et al. Liposome-encapsulated methemoglobin as an antidote against cyanide poisoning. Journal of Controlled Release. 2021;337:59–70. https://doi.org/10.1016/j.jconrel.2021.07.015
15. Illum L. Nasal drug delivery: new developments and strategies. Drug discovery today. 2002;7(23):1184–9. https://doi.org/10.1016/S1359-6446(02)02529-1
16. Rawal SU, Patel BM, Patel MM. New drug delivery systems developed for brain targeting. Drugs. 2022;82(7):749–92. https://doi.org/10.1007/s40265-022-01717-z
17. Pawar B, Vasdev N, Gupta T, Mhatre M, More A, et al. Current Update on Transcellular Brain Drug Delivery. Pharmaceutics. 2022;14(12):2719. https://doi.org/10.3390/pharmaceutics14122719
18. Weisman A, Chou B, O’Brien J, Shea KJ. Polymer antidotes for toxin sequestration. Advanced drug delivery reviews. 2015;90:81–100. https://doi.org/10.1016/j.addr.2015.05.011
19. Oberdörster G, Elder A, Rinderknecht A. Nanoparticles and the brain: cause for concern? Journal of nanoscience and nanotechnology. 2009;9(8):4996-5007. https://doi.org/10.1166/jnn.2009.GR02
20. Wang W, Hassan MM, Mao G. Colloidal Perspective on Targeted Drug Delivery to the Central Nervous System. Langmuir. 2023;39(9):3235–45. https://doi.org/10.1021/acs.langmuir.2c02949
21. Romashchenko AV, Petrovskii DV, Trotsky SY, et al. Quantitative tracking of trans-synaptic nose-to-brain transport of nanoparticles and its modulation by odor, aging, and Parkinson’s disease. Nano Res. 2023;16:7119–33. https://doi.org/10.1007/s12274-022-5302-6
22. Madaan K, Kumar S, Poonia N, Lather V, Pandita D. Dendrimers in drug delivery and targeting: Drug-dendrimer interactions and toxicity issues. Journal of Pharmacy and Bioallied Sciences. 2014;6(3):139–50. https://doi.org/10.4103/0975-7406.130965
23. Sairam AB, Sanmugam A, Pushparaj A, Mahesh Kumar G. Toxicity of polymeric nanodrugs as drug carriers. ACS Chemical Health & Safety. 2023;30(5):236–50. https://doi.org/10.1021/acs.chas.3c00008
24. Rajpal S, Mittal G, Sachdeva R, Chhillar M, Ali R, et al. Development of atropine sulphate nasal drops and its pharmacokinetic and safety evaluation in healthy human volunteers. Environmental Toxicology and Pharmacology. 2009;27(2):206–11. https://doi.org/10.1016/j.etap.2008.10.007
25. Haimhoffer Á, Rusznyák Á, Réti-Nagy K, Vasvári G, Váradi J, et al. Cyclodextrins in drug delivery systems and their effects on biological barriers. Scientia Pharmaceutica. 2019; 7(4):33. https://doi.org/10.3390/scipharm87040033
26. Praphawatvet T, Peters JI, Williams RO. Inhaled nanoparticles– An updated review. International Journal of Pharmaceutics. 2020;587:119671. https://doi.org/10.1016/j.ijpharm.2020.119671
27. Veronesi MC, Alhamami M, Miedema SB, Yun Y, Ruiz-Cardozo M, et al. Imaging of intranasal drug delivery to the brain. American journal of nuclear medicine and molecular imaging. 2020;10(1):1–31. PMCID: PMC7076302
28. Pajouhesh H, Lenz GR. Medicinal chemical properties of successful central nervous system drugs. NeuroRx. 2005;2:541–53. https://doi.org/10.1602/neurorx.2.4.541
29. Уйба ВВ, Криворотов ДВ, Забелин МВ, Радилов АС, Рембовский ВР. и соавт. Антагонисты опиоидных рецепторов. От настоящего к будущему. Медицина экстремальных ситуаций. 2018;20(3):356–70
30. Fishman J, Hahn EF, Norton BI. Comparative in vivo distribution of opiate agonists and antagonists by means of double isotope techniques. Life Sciences. 1975;17(7):1119–25. https://doi.org/10.1016/0024-3205(75)90333-1
31. Skolnick P. Treatment of overdose in the synthetic opioid era. Pharmacology & therapeutics. 2022;233:108019. https://doi.org/10.1016/j.pharmthera.2021.108019
32. Türker S, Onur E, Ózer Y. Nasal route and drug delivery systems. Pharmacy world and Science. 2004;26:137–42. https://doi.org/10.1023/B:PHAR.0000026823.82950.ff
33. Ghosh A, Mandal AK, Sarkar S, Panda S, Das N. Nanoencapsulation of quercetin enhances its dietary efficacy in combating arsenic-induced oxidative damage in liver and brain of rats. Life sciences. 2009;84(3-4):75–80. https://doi.org/10.1016/j.lfs.2008.11.001
34. Bharathi S, Wong PT, Desai A, Lykhytska O, Choe V, et al. Design and mechanistic investigation of oxime-conjugated PAMAM dendrimers as the catalytic scavenger of reactive organophosphate. Journal of Materials Chemistry B. 2014;2(8):1068–78. https://doi.org/10.1039/C3TB21267J
35. Duran-Lara EF, Marple JL, Giesen JA, Fang Y, Jordan JH, ́ et al. Investigation of lysine-functionalized dendrimers as dichlorvos detoxification agents. Biomacromolecules. 2015;16(11):3434–44. https://doi.org/10.1021/acs.biomac.5b00657
36. Yin H, Zhang X, Wei J, Lu S, Bardelang D, et al. Recent advances in supramolecular antidotes. Theranostics. 2021;11(3):1513. https://doi.org/10.7150/thno.53459
37. [Электронныйресурс]. URL: https://pubchem.ncbi.nlm.nih.gov/ (дата обращения: 26.04.2024)
38. Puskás I, Szente L, Szőcs L, Fenyvesi É. Recent List of Cyclodextrin-Containing Drug Products. Periodica Polytechnica Chemical Engineering. 2023;67(1):11–7. https://doi.org/10.3311/PPch.21222
39. Mayer BP, Kennedy DJ, Lau EY, Valdez CA. Evaluation of polyanionic cyclodextrins as high affinity binding scaffolds for fentanyl. Scientific Reports. 2023;13(1):2680. https://doi.org/10.1038/s41598-023-29662-1
40. He J, Li Y, Wang C, Zhang K, Lin D, et.al. Rapid adsorption of Pb, Cu and Cd from aqueous solutions by β-cyclodextrin polymers. Applied Surface Science. 2017;426:29–39. https://doi.org/10.1016/j.apsusc.2017.07.103
41. Wang H, Yao Q, Zhu W, Yang Y, Gao C, et al. Biomimetic antidote nanoparticles: a novel strategy for chronic heavy metal poisoning. Aaps Pharmscitech. 2022;24(1):12. https://doi.org/10.1208/s12249-022-02466-8
42. Farjadian F, et al. In vitro and in vivo assessment of EDTA-modified silica nano-spheres with supreme capacity of iron capture as a novel antidote agent. Nanomedicine: Nanotechnology, Biology and Medicine. 2017; 13(2): 745–53. http://dx.doi.org/10.1016/j.nano.2016.10.012
43. Yadav N, Mudgal D, Anand R, Jindal S, Mishra V, et al. Recent development in nanoencapsulation and delivery of natural bioactives through chitosan scaffolds for various biological applications. International Journal of Biological Macromolecules. 2022;1(220):537–72. https://doi.org/10.1016/j.ijbiomac.2022.08.098
44. Hu X, Tulsieram KL, Zhou Q, Mu L, Wen J. Polymeric nanoparticle–aptamer bioconjugates can diminish the toxicity of mercury in vivo. Toxicology Letters. 2012;208(1): 69–74. https://doi.org/10.1016/j.toxlet.2011.10.006
45. Yousefi M, Narmani A, Jafari SM. Dendrimers as efficient nanocarriers for the protection and delivery of bioactive phytochemicals. Advances in colloid and interface science. 2020;278: 102125. https://doi.org/10.1016/j.cis.2020.102125
46. Антушевич АЕ, Башарин ВА, Рейнюк ВЛ, Бугаев ПА. Эффективность инозина глицил-цистеинил-глутамата динатрия и пиридоксина гидрохлорида при остром отравлении несимметричным диметилгидразином. Вестник Российской военно-медицинской академии. 2018;1:164–67.
47. Kulabhusan PK., Agrawa lS, Jeevanandam J, Danquah MK. Nanoformulated Herbal Drug Delivery as Efficient Antidotes Against Systemic Poisons. Poisonous Plants and Phytochemicals in Drug Discovery. 2020;269–94. https://doi.org/10.1002/9781119650034.ch13
48. Fan N, Li Q, Liu Y, Ma B, Li M, et al. Preparation of an HI-6- loaded brain-targeted liposomes based on the nasal delivery route and the evaluation of its reactivation of central toxic acetylcholinesterase. European Journal of Pharmaceutical Sciences. 2023;184:106406. https://doi.org/10.1016/j.ejps.2023.106406
49. Pamujula S, Graves RA, Moiseyev R, Bostanian LA, Kishore V, Mandal TK. Preparation of polylactide-co-glycolide and chitosan hybrid microcapsules of amifostine using coaxial ultrasonic atomizer with solvent evaporation. Journal of Pharmacy and Pharmacology. 2008; 60(3):283–89. https://doi.org/10.1211/jpp.60.3.0002
50. Chavda VP, Jogi G, Shah N, Athalye MN, Bamaniya N, et al. Advanced particulate carrier-mediated technologies for nasal drug delivery. Journal of Drug Delivery Science and Technology. 2022;74:19. https://doi.org/10.1016/j.jddst.2022.103569
51. Ozsoy Y, Güngör S. Nasal route: an alternative approach for antiemetic drug delivery. Expert Opinion on Drug Delivery. 2011;8(11):1439–53. https://doi.org/10.1517/17425247.2011.607437
52. Pandey J, Shankar R, Kumar M, Shukla K, Kumari B. Development of nasal mucoadhesive microspheres of granisetron: A potential drug. Drug Research. 2020;70(8):367. https://doi.org/10.1055/a-1193-4781
53. Ruby JJ, Pandey VP. Antiemetic drugs as a nasal drug deliveryA review. International Journal of Pharmaceutical Sciences and Research. 2014;(5):1624. https://doi.org/10.13040/IJPSR.0975-8232.5(5).1624-29
54. Wang B, Wang S, Zhang Q, Deng Y, Li X. Recent advances in polymer-based drug delivery systems for local anesthetics. Acta biomaterialia. 2019;96:55–67. https://doi.org/10.1016/j.actbio.2019.05.044
55. Liu S, Yang S, Ho PC. Intranasal administration of carbamazepine-loaded carboxymethyl chitosan nanoparticles for drug delivery to the brain. Asian journal of pharmaceutical sciences. 2018;13(1):72–81. https://doi.org/10.1016/j.ajps.2017.09.001
56. Гладких ВД. и соавт. Нормативно-правовые и научно-производственные аспекты состояния и перспектив развития системы антидотной терапии в Российской Федерации. Вестник войск РХБ защиты. 2023;2(4):10–21.
Об авторах
Е. В. ФедотоваРоссия
Федотова (Попова) Елена Викторовна, канд. хим. наук
Ленинградская область; Санкт-Петербург
Д. В. Криворотов
Россия
Криворотов Денис Викторович, канд. хим. наук
Ленинградская область
А. С. Радилов
Россия
Радилов Андрей Станиславович, д-р. мед. наук, профессор
Ленинградская область
Дополнительные файлы
Рецензия
Для цитирования:
Федотова Е.В., Криворотов Д.В., Радилов А.С. Перспективы применения интраназальных наноразмерных полимерных систем доставки лекарственных препаратов и антидотов в медицине экстремальных ситуаций. Медицина экстремальных ситуаций. 2024;26(4):27-37. https://doi.org/10.47183/mes.2024-26-4-27-37
For citation:
Fedotova E.V., Krivorotov D.V., Radilov A.S. Prospects for the use of intranasal nanoscale polymer delivery systems for drugs and antidotes in extreme medicine. Extreme Medicine. 2024;26(4):27-37. https://doi.org/10.47183/mes.2024-26-4-27-37