Перейти к:
Экспериментальная модель судорожного синдрома на основе фенилкарбамата
https://doi.org/10.47183/mes.2024-26-4-38-48
Аннотация
Введение. Карбаматы широко используются в фармацевтической промышленности, сельском хозяйстве и бытовой химии. Являясь обратимыми ингибиторами холинэстераз, карбаматы могут вызывать развитие генерализованного судорожного синдрома. Несвоевременное лечение способствует формированию стойких неврологических нарушений. Для разработки и адекватной оценки специфической активности в доклинических исследованиях новых средств купирования судорожного синдрома при острых интоксикациях данной группой веществ необходима легко воспроизводимая экспериментальная модель судорожного синдрома на основе карбаматов.
Цель. Разработка экспериментальной модели генерализованного судорожного синдрома на крысах с применением фенилкарбамата как модельного токсиканта для тестирования в доклинических исследованиях средств терапии при отравлении ингибиторами холинэстераз.
Материалы и методы. Исследование проведено на беспородных половозрелых крысах-самцах возрастом 3 месяца (80 животных), распределенных на 4 группы (3 опытные и 1 контрольная). На первом этапе сравнивали параметры судорожного синдрома, вызываемого модельными токсикантами: фенилкарбаматом в дозе 1 мг/кг м.т., коразолом в дозе 65 мг/кг м.т. и тиосемикарбазидом в дозе 8 мг/кг м.т. Изучены: двигательная активность (в тесте «Открытое поле»), нейромоторные функции (тест на силу хвата), когнитивные функции (по условной реакции пассивного избегания болевого раздражения — УРПИ) и показатели сердечно-сосудистой системы (оценка ЭКГ и ритмограммы сердца). Выраженность судорожного синдрома определяли по шкале Racine. Дополнительно оценивали структуру тканей мозга гистологическими методами. На втором этапе изучали биохимические показатели в 3-х опытных (с токсикантами) и контрольной группах. В сыворотке крови изучены некоторые биохимические показатели, оценивающие функцию печени, почек, прооксидантной и антиоксидантной систем. На третьем этапе изучали активность холинэстеразы в крови и головном мозге у 30 контрольных и 30 опытных крыс после воздействия фенилкарбамата. Статистическая обработка результатов осуществлялась с помощью Statistica v.10.
Результаты. При моделировании судорожного синдрома у крыс по времени наступления латентного периода, продолжительности и интенсивности судорог фенилкарбамат сопоставим с коразолом. При реализации модели зафиксировано достоверное снижение частоты сердечных сокращений через 48 ч после введения. В тесте УРПИ установлено, что введение увеличивает время первого захода в темный отсек до обучения. Достоверные изменения маркеров функции печени (АЛТ, билирубин, холестерин, триглицериды), перекисного окисления липидов и антиоксидантной системы (МДА, ГП) подтверждают наличие комплексных механизмов развития судорог и неврологических нарушений. Результаты гистологического исследования тканей мозга свидетельствуют, что фенилкарбамат провоцирует выраженные нарушения структуры мозга в эксперименте на крысах.
Выводы. Разработанная экспериментальная модель судорожного синдрома у крыс на основе фенилкарбамата проста в воспроизведении и может эффективно применяться в доклинических исследованиях новых средств купирования судорожного синдрома при отравлении ингибиторами холинэстераз.
Ключевые слова
Для цитирования:
Мелехова А.С., Бельская А.В., Зорина В.Н., Мельникова М.В., Кубарская Л.Г., Гайкова О.Н. Экспериментальная модель судорожного синдрома на основе фенилкарбамата. Медицина экстремальных ситуаций. 2024;26(4):38-48. https://doi.org/10.47183/mes.2024-26-4-38-48
For citation:
Melekhova A.S., Belskaya A.V., Zorina V.N., Melnikova M.G., Kubarskaya L.G., Gaikova O.N. Experimental model of convulsive syndrome based on phenylcarbamate. Extreme Medicine. 2024;26(4):38-48. https://doi.org/10.47183/mes.2024-26-4-38-48
ВВЕДЕНИЕ
Карбаматы являются производными карбаминовой кислоты, амино- и карбоксильные окончания которой замещены структурно разнообразными алкильными, арильными или алкил-арильными группами [1]. Карбаматы структурно сходны с амидами и эфирами, их химическая и конформационная стабильность, устойчивость к протеолизу, а также способность многих представителей группы проходить через клеточную мембрану и гематоэнцефалический барьер обусловливают все более широкое применение карбаматов в фармацевтической промышленности как в качестве активного компонента лекарственных форм, так и в качестве носителей, заменяющих пептиды в готовых лекарственных формах [2]. Помимо фармацевтической промышленности, карбаматы активно применяются в сельском хозяйстве и в составе бытовой химии, что нередко служит причиной случайных или преднамеренных отравлений.
Ряд производных карбаминовой кислоты относится к высокотоксичным соединениям, обратимым (в отличие от фосфорорганических соединений — ФОС) ингибиторам холинэстераз, приводящим к формированию так называемого «холинэргического кризиса», сопряженного с развитием генерализованного судорожного синдрома, в тяжелых случаях заканчивающегося комой и летальным исходом. При действии карбаматов во время острой интоксикации за счет быстрого гидролиза связи С=О (декарбомилирования фермента) активность холинэстераз у выживших восстанавливается в течение нескольких часов, полное восстановление функции холинэстераз наблюдается через 24–48 ч [3]. Вместе с тем при отравлениях ингибиторами холинэстеразы наблюдаются воспалительные реакции в тканях нервной системы, апоптоз нервных клеток и нейродегенеративные изменения, потенцирующие развитие стойких неврологических нарушений у выживших.
Необходимо отметить, что смертность и инвалидизация при остром отравлении карбаматами достаточно высоки. Так, согласно данным ВОЗ от 2019 года, только в результате преднамеренного суицида с применением карбаматов в мире умерло более 1600 человек, количество несмертельных отравлений составляло от нескольких сотен тысяч до нескольких миллионов в год (по статистике разных стран). При неэффективном или несвоевременном лечении у значительной части выживших впоследствии часто наблюдались тремор, головокружения, головные боли, частичная потеря памяти, эмоциональная лабильность, спутанность сознания, когнитивные нарушения, периферическая нейропатия и вегетативная дисфункция [4].
Следует отметить, что при лечении острого отравления карбаматами применяются те же методы, что и при отравлении ФОС (атропинизация, введение препаратов бензодиазепинового ряда для купирования судорожного синдрома в первые 10–20 мин после воздействия) и методы лечения острых приступов истинной эпилепсии при развитии рефрактерных к бензодиазепинам судорог (введение барбитуратов, анестетиков) [5]. Эффективность антидотов высока только при их применении на самых ранних стадиях отравления [6].
В последнее время появляется все больше подтверждений тому, что патогенез отравлений карбаматами и ФОС включает в том числе проявления нехолинергической токсичности посредством индукции активных форм кислорода (АФК) и образования карбонилированных белков. ФОС и карбаматы также взаимодействуют с митохондриальными транслокационными белками, с рецепторами андрогенов, эстрогенов и глюкокортикоидов, участвующими в метаболизме холестерина, негативно влияя на их функции, при этом особенности механизмов и выраженность воздействия на организм у ФОС и карбаматов различаются [7][8]. Это обосновывает необходимость разработки новых средств терапии отравлений карбаматами. Однако она невозможна без применения адекватных экспериментальных моделей для оценки специфической активности новых средств в доклинических исследованиях. На сегодняшний день создание противосудорожных средств осуществляется преимущественно для терапии истинной эпилепсии; в качестве экспериментальных моделей используется максимальный электрошок, введение коразола и др. [9]. Для моделирования генерализованного судорожного синдрома на животных в эксперименте в качестве токсикантов-пестицидов, влияющих на активность холинэстеразы, обычно используют фосфорорганические соединения (диазинон, малаоксон, хлорфенвинфос и дихлофос) [10]. Экспериментальные модели генерализованного судорожного синдрома с применением карбаматов, предъявляющие значительно меньшие требования к обеспечению безопасности при проведении доклинических исследований, не описаны в научных публикациях.
Таким образом, цель работы — разработка экспериментальной модели генерализованного судорожного синдрома на крысах с применением фенилкарбамата как модельного токсиканта для тестирования в доклинических исследованиях средств терапии при отравлении ингибиторами холинэстераз.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на белых беспородных 3-месячных крысах-самцах массой 150–250 г, полученных из ФГУП «ПЛЖ «Рапполово» национального исследовательского центра «Курчатовский институт», Ленинградская область. Животные содержались в стандартных условиях вивария [11]. Поддерживался 12-часовой цикл освещения, корм и вода выдавались ad libitum.
В серии предварительных экспериментов определена среднесмертельная доза (ЛД50) фенилкарбамата (ФК) при внутрибрюшинном и внутрижелудочном путях введения крысам, составляющая 1,43 ± 0,12 и 10,0 ± 0,77 мг/кг массы тела соответственно [12]. Для лучшей воспроизводимости экспериментальной модели судорожного синдрома в доклинических исследованиях был выбран внутрибрюшинный путь введения фенилкарбамата, так как данный путь является альтернативным внутривенному пути введения и обеспечивает 100% биодоступность препарата. В наших предыдущих работах также была экспериментально подобрана судорожная доза фенилкарбамата 1 мг/кг м.т., обеспечивающая индукцию судорожного синдрома у 100% животных при минимальном проценте смертности.
Эксперимент состоял из трех последовательных этапов.
На первом этапе проводили оценку характера судорожного синдрома. Для этого лабораторные животные в зависимости от применяемого судорожного агента были распределены на 4 группы и контрольную группу с введением 0,9% раствора натрия хлорида, по 20 голов в каждой группе. Моделирование судорожного синдрома в первой группе проведено с помощью обратимого ингибитора ацетилхолинэстеразы из группы карбаматов, а именно фенилового эфира карбаминовой кислоты (далее фенилкарбамат) 1 мг/кг м.т. Оригинальное соединение синтезировано в ФГБУ «НКЦТ им. С.Н. Голикова» ФМБА России под руководством Беспалова А.Я. и защищено патентом Российской Федерации на изобретение [13]. Во второй и третьей группах в качестве модельных токсикантов использовали, соответственно: Коразол (Пентилентетразол, 6,7,8,9-тетрагидро-5H-тетразоло(1,5-a)азепина, C6H10N4), производитель Sigma-Aldrich, в дозе 65 мг/кг м.т. и Тиосемикарбазид (амид гидразинотионкарбоновой кислоты, CH5N3S) в дозе 8 мг/кг м.т., ресинтезирован в лаборатории синтеза ФГБУ «НКЦТ им. С.Н. Голикова» ФМБА России [14]. В каждой экспериментальной группе 10 животных было задействовано для изучения двигательной активности, нейромоторных функций, сердечно-сосудистой системы и 10 — для оценки когнитивных функций.
Выраженность судорожного синдрома после введения токсикантов определяли визуально по модернизированной шкале Racine [15].
Оценку двигательной активности, тревожности проводили с помощью компьютеризированного теста «Открытое поле», разработанного C.S. Hall (1936) [16] с помощью системы VideoMot2, TSE (Германия). Оценку поведения проводили через 24, 48 ч. Регистрировали 7 компонентов поведения в течение 2-х мин наблюдения: горизонтальную и вертикальную (стойки) активность, груминг, скорость движения животных и расстояние, пройденное животным в течение эксперимента, общую двигательную активность, количество движений в центре площадки и на периферии.
Изучение нейромоторных функций, клинически выражающихся общей слабостью, астенией, в экспериментальных условиях проводили через 24, 48 ч с помощью анализатора системы хватки «Bioseb GS3», позволяющего автоматически регистрировать силу захвата решетки передними лапами крысы и точный момент отпускания.
Когнитивные функции оценивали с помощью регистрации параметров условной реакции пассивного избегания болевого раздражения (УРПИ) через 2, 24 и 48 ч после обучения в двухкамерной установке PACS-30 (Columbus Instruments, США). Регистрировали следующие параметры: время первого посещения темной камеры (до обучения для оценки наличия у животного норкового рефлекса), латентный период захода в темную наказуемую камеру, время пребывания в светлой и темной камерах. Общее время эксперимента для каждого животного — 120 с. Наряду с временными параметрами УРПИ в каждой группе при повторных тестированиях регистрировали количество обучившихся животных, у которых латентный период захода в темную камеру был более 120 с (продолжительность наблюдения за животными).
Для оценки деятельности сердечно-сосудистой системы проводили электрокардиографическое исследование (ЭКГ) во II отведении на приборе электрокардиограф ветеринарный «Поли-Спектр-8В» («Нейрософт», Россия) через 24, 48 ч. Измеряемые показатели: частота сердечных сокращении (ЧСС), величина зубца R, интервалы PQ и QT, рассчитываемые по II стандартному отведению. На этом же приборе осуществляли оценку ритмограммы сердца с помощью кардиоинтервалографии по Баевскому (КИГ) [17].
У животных, подвергнутых запланированной эвтаназии и некропсии, на первом этапе эксперимента был выполнен гистологический анализ головного мозга. Срезы органов были обезвожены, пропитаны парафином и окрашены гематоксилином и эозином, с последующим исследованием методом световой микроскопии на микроскопе Leica DM1000, Leica Microsystems Wetzlar GmbH (Германия) при 400-кратном увеличении. Для эвтаназии применяли ингаляцию СО2 с использованием оборудования Open Science (Россия).
На втором этапе эксперимента проводили оценку некоторых биохимических показателей, а также ионного состава крови животных. В группе «фенилкарбамат» дополнительно оценивали антиоксидантный статус в сравнении с интактной группой. Для этого была сформирована новая выборка, в которой судорожный синдром моделировали фенилкарбаматом в дозе 1 мг/кг м.т., коразолом в дозе 65 мг/кг м.т., тиосемикарбазидом в дозе 8 мг/кг м.т. В зависимости от времени забора крови (24, 48 ч; 7 и 14 сут) лабораторные животные для контроля исследуемых показателей были разделены на 4 группы, включая интактную группу, по 24 головы в каждой.
Кровь от животных для биохимического анализа забирали в сухой вакутейнер через 24, 48 ч, на 7 и 14 сут. Далее отобранный биологический материал центрифугировали (центрифуга Z 326 K, производства Германии, серия 66110159) при 3000 об/мин, при 4 °С 10 мин. Для дальнейших исследований отбирали надосадочную жидкость — сыворотку. Исследовали прозрачную сыворотку без признаков гемолиза. Определение биохимических показателей (триглицеридов, аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), лактатдегидрогеназы (ЛДГ), щелочной фосфатазы (ЩФ), общего холестерина, мочевины, общего билирубина) проводили на биохимическом анализаторе А-25 фирмы «BioSystems» (Испания) с использованием наборов АО «Вектор-Бест» (Россия). Калибровку анализатора и внутренний контроль качества исследований производили на калибровочных и контрольных материалах АО «Вектор-Бест» (Россия).
Для изучения антиоксидантной системы использовали плазму крови и эритроцитарную взвесь, получаемую центрифугированием цельной крови при 3000 g на протяжении 3 мин с последующей трехкратной отмывкой эритроцитов физиологическим раствором и поэтапным центрифугированием при указанных параметрах. Из отмытых эритроцитов готовили гемолизат соответствующим для каждой методики образом. В гемолизате эритроцитов по методу W.H. Habig и W.B. Jakoby [19] определяли показатели системы антиоксидантной защиты: супероксиддисмутазы (СОД) [18]; глутатионпероксидазы (ГП), глутатионредуктазы (ГР). Для оценки процессов перекисного окисления липидов (ПОЛ) определяли концентрацию восстановленного глутатиона (ВГ) [20], а также стабильного конечного продукта ПОЛ — малонового диальдегида (МДА) [21]. Исследование проведено на биохимическом анализаторе «А-25» (BioSystems SA).
Для изучения механизма действия фенилкарбамата на третьем этапе оценивали активность холинэстеразы в крови и головном мозге. Активность ацетилхолинэстеразы определяли по методу Эллмана [22]. Экспериментальные животные были разделены на две группы: контрольная 30 голов и опытная 30 голов. Крысам-самцам из опытной группы внутрибрюшинно вводили фенилкарбамат в дозе 1 мг/кг м.т. Животным из группы контроля вводили внутрибрюшинно 0,9% раствор натрия хлорида. После декапитации у исследуемых групп проводили забор крови и тканей головного мозга через определенные интервалы времени: 10, 30, 60 мин, 6 и 24 ч. На одну временную точку задействовали 6 животных.
Статистическую обработку полученных экспериментальных данных осуществляли с помощью программного обеспечения для статистического анализа Statistica v.10. Для оценки достоверности различий между группами в функциональных и биохимических исследованиях применяли параметрический дисперсионный анализ (ANOVA). Для оценки достоверности различий в динамике изменения активности ацетилхолинэстеразы в головном мозге и в крови крыс использовали непараметрический критерий Манна — Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Основные характеристики судорожного синдрома, наблюдаемые при введении фенилкарбамата внутрибрюшинно в дозе 1 мг/кг м.т., по сравнению с эффектами, наблюдаемыми при введении коразола и тиосемикарбазида (ТСК), представлены в таблице 1.
Таблица 1. Сравнительная оценка латентного периода и продолжительности судорожного синдрома исследуемых конвульсантов
№ | Показатель | ФК, 1мг/кг м.т. n = 20 | Коразол, 65 мг/кг м.т. n = 20 | ТСК, 8 мг/кг м.т. n = 20 |
1 | Латентный период проявления судорог, мин | 5,33 ± 0,33 | 8,11 ± 0,6 | 106,8 ± 7,34 |
2 | Продолжительность судорожного синдрома при 5-м уровне по Racine, мин | 30 ± 0,6 | 35 ± 1,9 | 129 ± 9,0 |
3 | Продолжительность судорожного синдрома при 6-м уровне по Racine, мин | 13 ± 1,5 | 12 ± 1,0 | 150 ± 7,1 |
Таблица подготовлена авторами по собственным данным
Примечание: данные представлены в формате среднего значения и стандартной ошибки среднего (М ± m).
Время наступления латентного периода судорог у животных из группы, получавшей фенилкарбамат в дозе 1 мг/кг м.т., сопоставимо с аналогичным параметром у крыс-самцов, получавших коразол в дозе 65 мг/кг м.т. (табл. 1). Длительный латентный период появления судорог, проявляющихся не только в виде клонических, но и в виде тонических судорог, а также экстензий, отмечен только у животных из группы, получившей тиосемикарбазид. В группе животных при использовании фенилкарбамата интенсивность судорожного синдрома 5-го уровня по Racine регистрировали у 60% животных, что сопоставимо с животными из групп сравнения (применение коразола и тиосемикарбазида). В то же время интенсивность судорожного синдрома 6-го уровня по Racine регистрировали в большей степени у животных из групп с коразоловой и тиосемикарбазидной моделями. Необходимо отметить, что продолжительность судорожного синдрома при 5-м и 6-м уровне по Racine у животных из группы с фенилкарбаматной моделью была сопоставима с данными у животных из группы с коразоловой моделью судорожного синдрома. При этом у животных из группы с тиосемикарбазидной моделью продолжительность судорожного синдрома как при 5-м, так и 6-м уровне по Racine была гораздо длительнее. При этом летальность в группах «фенилкарбамат» и «коразол» составляла 20%, а в группе тиосемикарбазид — 33%.
При оценке поведения и двигательной активности с помощью многоцелевой системы открытого поля установлено, что у животных, получавших фенилкарбамат, через 24 ч после введения наблюдалось статистически значимое угнетение параметров двигательной активности в 2 раза по сравнению с контрольной группой животных. Кроме того, при введении коразола наблюдалось статистически значимое увеличение общей двигательной активности в 2,4 раза, количества горизонтальных перемещений в 4,3 раза и актов груминга в 2 раза по сравнению с контролем. У крыс, получавших тиосемикарбазид, выявлено статистически значимое возрастание общей двигательной активности в 1,2 раза, количества горизонтальных перемещений в 1,9 раза, количества стоек в 3,1 раза, актов груминга в 1,9 раза, среднего расстояния в 2,5 раза и средней скорости в 2,6 раза, двигательной активности на периферии в 6,6 раза.
Статистически значимых различий между показателями силы хвата у животных, получавших судорожные дозы фенилкарбамата или других токсикантов, по сравнению с контрольной группой не обнаружено.
При оценке когнитивных нарушений в тесте УРПИ установлено, что у животных, получивших фенилкарбамат в судорожной дозе, зарегистрировано увеличение времени первого захода в темный отсек до обучения. Тиосемикарбазид не оказывал статистически достоверного влияния на обучение ни при введении токсиканта за сутки до обучения, ни при введении за сутки после обучения. Коразол, введенный за 24 ч до обучения, согласно полученным результатам, вызывал дозозависимое нарушение краткосрочной памяти по механизму влияния на процессы фиксации информации (след памяти).
При изучении функции сердечно-сосудистой системы зафиксировано достоверное снижение частоты сердечных сокращений (ЧСС) через 48 ч после введения фенилкарбамата (403,0 ± 18,8 против 484,5 ± 8,7 уд. мин в контрольной группе). При оценке индекса напряженности по данным кардиоинтервалографии через 24 ч отмечены достоверные отличия от значений в группе, получавшей фенилкарбамат (47 715,2 ± 10 714,0 против 13 889,6 ± 4623,0 у.е.) и в группе, получавшей тиосемикарбазид (14 814,5 ± 6278,8 против 73 743 ± 16 103,0 у.е.).
При гистологическом исследовании образцов тканей головного мозга у животных, получивших фенилкарбамат, через 24 ч после введения выявлено большое количество темных нейронов коры вытянутой формы без четкой границы ядра, ядрышко не визуализируется по сравнению с группой контроля (рис. 1).
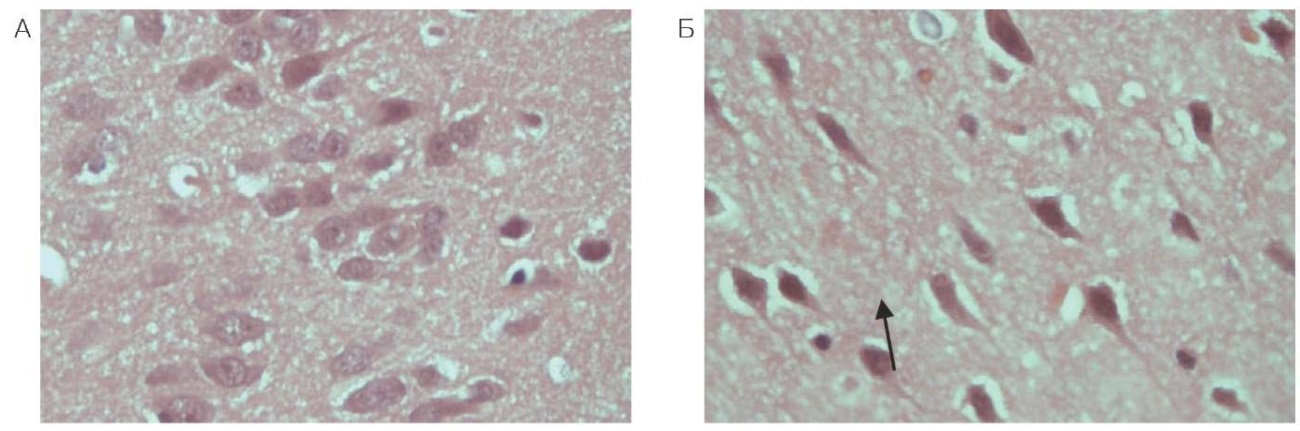
Рисунок подготовлен авторами по собственным данным
Рис. 1. Кора лобной доли головного мозга крысы (увеличение ×400): А — контрольное животное; Б — через 24 часа после введения фенилкарбамата
Примечание: стрелкой указан темный нейрон вытянутой формы без четкой границы ядра.
В белом веществе наблюдали очаговое разрежение нейропиля, преимущественно за счет отростков клеток (астроцитов, олигодендроцитов или нейронов). Вены в белом веществе растянуты, заполнены эритроцитами, плохо воспринимающими эозин, без четких границ. Большинство нейронов ствола темные, сморщенные, но на этом фоне встречаются отдельные клетки в состоянии острого набухания (рис. 2). В тканях мозжечка клетки Пуркинье темные, ядро и ядрышко не определяются, наблюдаются очаги паренхиматозного кровоизлияния, «выпадения» клеток, очаги элективного некроза; соответствующие данные представлены на рисунке 3.
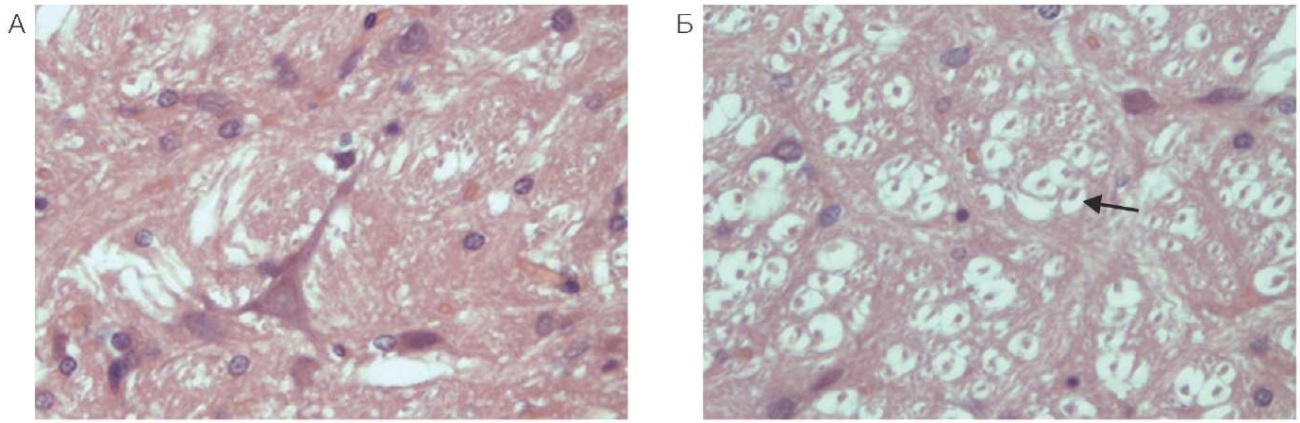
Рисунок подготовлен авторами по собственным данным
Рис. 2. Ствол головного мозга крысы (увеличение ×400): А — контрольное животное; Б — через 24 часа после введения фенилкарбамата
Примечание: стрелкой указаны клетки в состоянии острого набухания.
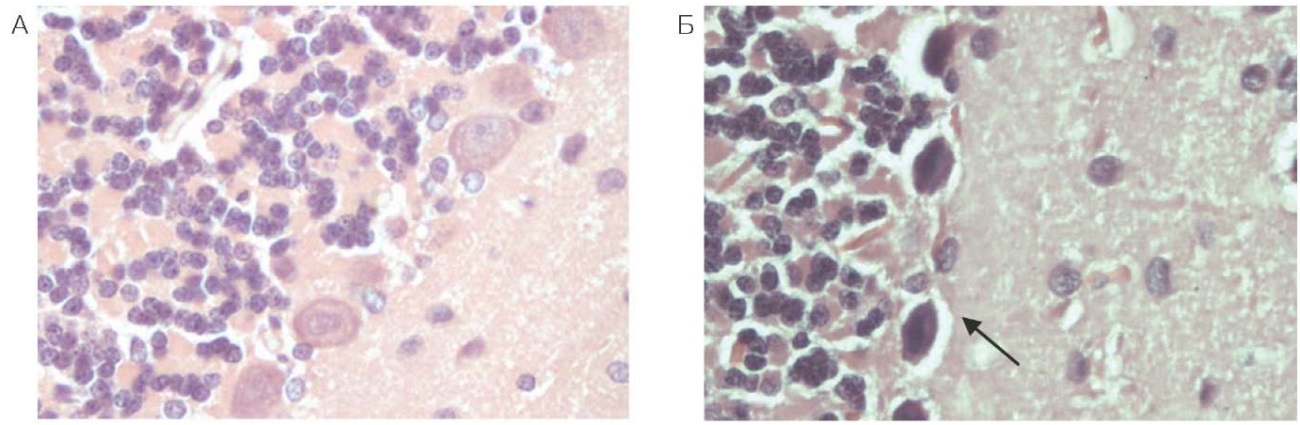
Рисунок подготовлен авторами по собственным данным
Рис. 3. Мозжечок крысы (увеличение ×400): А — контрольное животное; Б — через 24 часа после введения фенилкарбамата
Примечание: стрелкой указаны клетки Пуркинье темные, ядро и ядрышко не определяются.
Обращает на себя внимание, что фенилкарбамат, не приводящий к развитию выраженных нарушений двигательной активности и когнитивных функций в первые 24 ч после введения (в отличие токсикантов групп сравнения: коразола и тиосемикарбазида), при оценке в тестах «открытое поле» и «УРПИ» также негативно влияет на целый ряд биохимических показателей по прошествии двух недель после воздействия. При этом после воздействия коразола наблюдали единичные и менее выраженные сходные изменения.
Данные биохимического состава крови экспериментальных животных в течение 24 часов и в более длительный период представлены в таблице 2.
Таблица 2. Влияние изучаемых судорожных токсикантов на биохимические показатели в крови животных в различные временные периоды
Изучаемые показатели | Период наблюдения | Интактная группа n = 24 | ФК, 1 мг/кг м.т n = 24 | Коразол, 65 мг/кг м.т. n = 24 | ТСК, 8 мг/кг м.т. n = 24 |
Триглицериды, ммоль/л | 24 ч | 0,32 ± 0,03 | 0,52 ± 0,05* | 0,45 ± 0,06 | 0,62 ± 0,04* |
48 ч | 1,07 ± 0,16 | 1,24 ± 0,17 | 0,68 ± 0,06* | 0,96 ± 0,08 | |
7 сут | 1,43 ± 0,26 | 0,87 ± 0,08 | 1,12 ± 0,10 | 1,32 ± 0,20 | |
14 сут | 0,83 ± 0,07 | 1,09 ± 0,14 | 1,32 ± 0,13* | 0,76 ± 0,09 | |
ЛДГ, Ед/л | 24 ч | 1001,3 ± 114,9 | 916,4 ± 112,6 | 870,8 ± 89 | 754,6 ± 32,3 |
48 ч | 909,2 ± 78,6 | 894,2 ± 55,2 | 792,4 ± 52,5 | 867 ± 62,4 | |
7 сут | 894,4 ± 61,2 | 816,1 ± 83,3 | 1046,9 ± 79,9 | 929,9 ± 71,5 | |
14 сут | 935,7 ± 67,3 | 686,8 ± 63,2* | 759,4 ± 81,3 | 783,7 ± 67,4 | |
АЛТ, ЕД/л | 24 ч | 52,8 ± 2,2 | 56,4 ± 5,4 | 56,4 ± 2,3 | 62,5 ± 5,4 |
48 ч | 60,7 ± 3,1 | 62,1 ± 2,7 | 65,0 ± 4,4 | 58,4 ± 2,7 | |
7 сут | 71,4 ± 2,5 | 69,2 ± 3,9 | 79,4 ± 7,1 | 70,8 ± 4,1 | |
14 сут | 55,5 ± 3,2 | 43,6 ± 2,1* | 48,3 ± 1,6 | 53,3 ± 6,2 | |
АСТ, ЕД/л | 24 ч | 132,8 ± 7,6 | 156,6 ± 12,7 | 146,0 ± 5,1 | 146,5 ± 7,7 |
48 ч | 143,5 ± 8,3 | 153,4 ± 5,2 | 150,7 ± 7,9 | 155,2 ± 7,4 | |
7 сут | 169,7 ± 7,9 | 160,9 ± 12,2 | 169,1 ± 10,9 | 170,9 ± 10,7 | |
14 сут | 140,3 ± 7,4 | 142,7 ± 6,7 | 125,7 ± 6,9 | 150,3 ± 14,4 | |
ЩФ, ЕД/л | 24 ч | 215,8 ± 12,5 | 179,6 ± 11* | 198,1 ± 15,3 | 277,3 ± 20,4* |
48 ч | 292,0 ± 22,8 | 328,1 ± 15,9 | 256,2 ± 25,4 | 258 ± 29,3 | |
7 сут | 302,7 ± 27,9 | 269,7 ± 23,2 | 305,3 ± 34,3 | 343 ± 25,8 | |
14 сут | 210,4 ± 18,7 | 306,5 ± 24,7* | 301,9 ± 22* | 295 ± 46,1 | |
Холестерин, ммоль/л | 24 ч | 1,61 ± 0,05 | 1,40 ± 0,08* | 1,22 ± 0,08* | 1,48 ± 0,08 |
48 ч | 1,14 ± 0,05 | 1,15 ± 0,06 | 1,15 ± 0,05 | 1,24 ± 0,05 | |
7 сут | 1,10 ± 0,08 | 1,03 ± 0,04 | 1,24 ± 0,07 | 1,30 ± 0,08 | |
14 сут | 1,61 ± 0,07 | 1,41 ± 0,08* | 1,30 ± 0,07* | 1,45 ± 0,08 | |
Билирубин общий, мкмоль/л | 24 ч | 10,2 ± 0,4 | 12,0 ± 1,0 | 12,1 ± 1,3 | 14,1 ± 1,5* |
48 ч | 18,2 ± 2,8 | 20,2 ± 1,8 | 10,5 ± 1,6* | 17,6 ± 1,3 | |
7 сут | 13,8 ± 2,8 | 14,4 ± 2,3 | 19,6 ± 2,1 | 17,9 ± 2,0 | |
14 сут | 12,2 ± 1 | 17,6 ± 1,8* | 18,2 ± 2,7* | 14,3 ± 1,3 | |
Мочевина, ммоль/л | 24 ч | 4,4 ± 0,2 | 3,6 ± 0,3* | 4,0 ± 0,3 | 4,7 ± 0,3 |
48 ч | 4,5 ± 0,3 | 5,9 ± 0,3* | 4,7 ± 0,6 | 4,2 ± 0,1 | |
7 сут | 5,2 ± 0,5 | 5,4 ± 0,2 | 5,4 ± 0,2 | 6,4 ± 0,4 | |
14 сут | 4,2 ± 0,2 | 5,6 ± 0,3* | 4,9 ± 0,2* | 3,9 ± 0,3 |
Таблица составлена авторами на основании собственных данных
Примечание: данные представлены в формате среднего значения и стандартной ошибки среднего (М ± m). * доверительная вероятность различий относительно контрольной группы (р < 0,05).
После воздействия фенилкарбамата в первые сутки фиксировали повышение триглицеридов, которое нормализовалось к концу экспериментального периода наблюдений. Часть изменений происходила по типу декомпенсации: избыточное повышение концентрации биохимического показателя и последующее его резкое снижение в ответ на воздействие токсиканта. В тоже время на 14-е сутки выявлено снижение средних значений по таким показателям, как АЛТ, ЛДГ. Также на 14-е сутки наблюдали повышение ЩФ, мочевины, билирубина и снижение уровней холестерина.
При оценке ионного состава крови (табл. 3), характеризующего, помимо прочего, функцию почек, установлено, что изменения, вызываемые фенилкарбаматом в первые сутки (снижение концентрации ионов натрия и магния), аналогичны эффектам после воздействия тиосемикарбазида, что может свидетельствовать об избыточной затрате ионов в момент судорожного синдрома.
Таблица 3. Влияние изучаемых судорожных токсикантов на ионный состав крови животных в различные временные периоды судорожного синдрома
Изучаемые показатели | Период наблюдения | Интактная группа n = 24 | Коразол, 65 мг/кг м.т. n = 24 | ТСК, 8 мг/кг м.т. n = 24 | ФК, 1 мг/кг м.т n = 24 |
K+, (ммоль/л) | 24 ч | 4,7 ± 0,1 | 4,5 ± 0,1 | 4,6 ± 0,1 | 4,9 ± 0,1 |
48 ч | 4,6 ± 0,2 | 4,6 ± 0,1 | 4,6 ± 0,1 | 4,8 ± 0,1 | |
7 сут | 4,2 ± 0,1 | 4,1 ± 0,1 | 4,0 ± 0,1 | 4,2 ± 0,1 | |
14 сут | 5,2 ± 0,2 | 5,1 ± 0,1 | 5,1 ± 0,2 | 5,7 ± 0,2 | |
Na+, (ммоль/л) | 24 ч | 160 ± 0,9 | 153,6 ± 1,5* | 157,6 ± 1,4 | 155,4 ± 1,2* |
48 ч | 155,3 ± 1,3 | 157,7 ± 1,7 | 158,6 ± 1,2 | 159,0 ± 1,0* | |
7 сут | 162,1 ± 1,3 | 161,1 ± 1,5 | 163,5 ± 1,0 | 162,7 ± 1,2 | |
14 сут | 145,2 ± 1,6 | 142,9 ± 1,9 | 143 ± 1,7 | 142,9 ± 1,9 | |
CI–, (ммоль/л) | 24 ч | 96,6 ± 1,5 | 95,1 ± 1,1 | 99 ± 1,6 | 99,2 ± 1,1 |
48 ч | 96,9 ± 1,0 | 94,8 ± 1,7 | 96,6 ± 0,7 | 99,2 ± 1,2 | |
7 сут | 93,6 ± 1,5 | 92,6 ± 1,6 | 92,9 ± 1,2 | 94,4 ± 1,1 | |
14 сут | 93,8 ± 0,7 | 92,5 ± 1,4 | 92,3 ± 1,7 | 96,5 ± 1,1* | |
Фосфор (Р), ммоль/л | 24 ч | 2,89 ± 0,07 | 2,82 ± 0,08 | 2,64 ± 0,07* | 2,85 ± 0,08 |
48 ч | 2,65 ± 0,05 | 2,69 ± 0,10 | 2,49 ± 0,03* | 2,94 ± 0,06* | |
7 сут | 2,14 ± 0,07 | 2,12 ± 0,05 | 2,14 ± 0,06 | 2,29 ± 0,07 | |
14 сут | 2,85 ± 0,08 | 2,68 ± 0,06 | 2,65 ± 0,11 | 2,63 ± 0,04* | |
Магний (Mg), ммоль/л | 24 ч | 1,37 ± 0,25 | 0,35 ± 0,07* | 0,94 ± 0,01 | 0,27 ± 0,02* |
48 ч | 1,23 ± 0,19 | 0,89 ± 0,02 | 0,96 ± 0,02 | 0,90 ± 0,02 | |
7 сут | 1,27 ± 0,19 | 0,88 ± 0,03 | 1,19 ± 0,18 | 0,90 ± 0,02 | |
14 сут | 0,56 ± 0,03 | 0,63 ± 0,02 | 0,57 ± 0,05 | 0,67 ± 0,02* |
Таблица составлена авторами на основании собственных данных
Примечание: данные представлены в формате среднего значения и стандартной ошибки среднего (М ± m). * доверительная вероятность различий относительно контрольной группы (р < 0,05).
Поскольку фенилкарбамат является ингибитором ацетилхолинэстеразы (АХЭ), необходимо было оценить степень его влияния на активность АХЭ в разработанной модели судорожного синдрома. В таблице 4 приведены результаты определения уровня АХЭ в цельной крови и процентное соотношение ингибированной АХЭ в крови и головном мозге после введения фенилкарбамата в судорожной дозе.
Таблица 4. Динамика изменений активности ацетилхолинэстеразы в головном мозге и в крови белых крыс после введения фенилкарбамата
Время | ФК (n = 6) | Контроль (n = 6) | % ингибирования, кровь | % ингибирования, мозг | ||
АХЭ, Е/мл крови | АХЭ, Е/мг мозга | АХЭ, Е/мл крови | АХЭ, Е/мг мозга | |||
10 мин | 463,1 [ 365,4; 480,5]* | 35,1 [ 32,7; 38,5]* | 757,4 [ 606,4; 796,4] | 78 [ 70,7; 80,4] | 38,9 [ 36,6; 51,8] | 54,9 [ 50,6; 58,1] |
30 мин | 370,9 [ 328,8; 396,2]* | 66,3 [ 59,9; 79,7]* | 563,7 [ 556,9; 634,9] | 88,4 [ 87; 92,7] | 34,2 [ 29,7; 41,7] | 25,1 [ 9,9; 32,3] |
60 мин | 441,1 [ 292,1; 494,7] | 63,4 [ 51,3; 70,6]* | 690,1 [ 469,2; 700,0] | 92 [ 90,6; 104,5] | 36,1 [ 28,3; 57,7] | 31,0 [ 23,2; 44,2] |
6 ч | 492,4 [ 418,8; 543,8] | 68,1 [ 55,0; 86,2] | 698,7 [ 686,8; 777,6) | 120,3 [ 108; 144,6] | 29,5 [ 22,2; 56,9] | 43,4 [ 28,3; 54,3] |
24 ч | 946,3 [ 398,6; 996,6] | 123,9 [ 111,8; 134,6] | 763,6 [ 629,8; 798,3] | 117,3 [ 109,9; 126,3] | -23,9 [ -30,5; 47,8] | -5,6 [ -14,7; 4,8] |
Таблица составлена авторами на основании собственных данных
Примечание: данные представлены в формате медиана (Me), верхний (UQ) и нижний (LQ) квартили. * доверительная вероятность различий относительно контрольной группы (р < 0,05).
При анализе данных, представленных в таблице 4, выявлено достоверное угнетение АХЭ в головном мозге и в цельной крови белых крыс в течение 6 часов после введения фенилкарбамата. Через 24 ч происходит полное восстановление активности фермента. Важно отметить, что через 6 часов после введения фенилкарбамата при сохраняющейся ингибиции АХЭ на 42,3 и 30,5% в центральной нервной системе и в периферической крови соответственно судороги у крыс полностью прекращались.
Дополнительно изучено состояние отдельных компонентов антиоксидантной системы и маркеров перекисного окисления липидов в разные временные периоды после воздействия фенилкарбамата в дозе 1 мг/кг м.т.
Установлено, что в первые сутки после введения животным фенилкарбамата достоверно изменяются три из четырех изученных показателей. При этом уровень малонового диальдегида в группе «фенилкарбамат» в первые сутки наблюдения снижен по сравнению с контрольной группой почти в 2 раза, но к 14 сут наблюдений его уровень значительно превышал контрольные показатели, в то же время активность глутатионпероксидазы демонстрирует противоположную направленность изменений по сравнению с контролем (табл. 5).
Таблица 5. Влияние фенилкарбамата на уровень малонового диальдегида и показателей антиоксидантной системы в крови лабораторных животных
Экспериментальные группы | Период наблюдения | Изучаемые показатели | |||
ВГ, мкмоль/л | МДА, нмоль/мл | СОД, ЕД/г Hb | ГП, Ед/ г Hb | ||
Контроль | 24 ч | 0,28 ± 0,02 | 142,3 ± 8,3 | 1131,0 ± 51,3 | 34,7 ± 1,3 |
ФК | 0,36 ± 0,02* | 79,6 ± 10,9* | 1331,1 ± 70,8 | 42,5 ± 2,7* | |
Контроль | 48 ч | 0,13 ± 0,04 | 188,3 ± 11,8 | 1274,9 ± 141,2 | 27,7 ± 2,4 |
ФК | 0,21 ± 0,03 | 151,3 ± 4,2* | 1494,5 ± 194,1 | 33,7 ± 3,9 | |
Контроль | 7 сут | 0,41 ± 0,06 | 122,6 ± 3,9 | 1297,9 ± 76,6 | 35,8 ± 1,0 |
ФК | 0,40 ± 0,04 | 153,1 ± 9,7* | 1096,7 ± 81,0 | 32,3 ± 1,6 | |
Контроль | 14 сут | 0,39 ± 0,03 | 164,0 ± 12,2 | 1702,8 ± 66,9 | 35,6 ± 1,1 |
ФК | 0,34 ± 0,07 | 197,6 ± 8,2* | 1504,8 ± 59,7 | 31,6 ± 1,3* | |
Таблица составлена авторами на основании собственных данных
Примечание: данные представлены в формате среднего значения и стандартной ошибки среднего (М ± m); * доверительная вероятность различий относительно контрольной группы (р < 0,05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Модели с применением ингибиторов холинэстеразы на основе ФОС имеют свои особенности, и при разработке антидотов их использование предпочтительнее, чем моделей для тестирования противоэпилептических препаратов [10]. Наши исследования продемонстрировали, что воздействие фенилкарбамата на организм экспериментальных животных также имеет особенности, которые должны учитываться как при изучении патогенеза отравлений, так и при разработке средств лечения. Изучение ключевых характеристик судорожного синдрома при остром отравлении в течение 2 часов продемонстрировало, что в целом модель на основе фенилкарбамата (внутрибрюшинное введение) сопоставима с распространенной в практике доклинических исследований скрининговой судорожной моделью на основе коразола. При использовании фенилкарбамата в качестве модельного токсиканта интенсивность судорог была выражена немного меньше (5-й уровень у >60 % животных), чем в группах сравнения (интенсивность 6-го уровня при введении коразола и тиосемикарбазида). Важно отметить, что степень выраженности судорог 5-го уровня по шкале Racine соответствует генерализованному судорожному синдрому у человека, что позволяет рекомендовать фенилкарбамат в качестве эффективного токсиканта для моделирования тяжелого судорожного синдрома при разработке средств лечения.
Выявленные изменения в частоте сердечных сокращений свидетельствуют о том, что при разработке средств лечения отравлений карбаматами целесообразно уделять внимание препаратам, влияющим на функции сердца и сосудов. При этом модель на основе введения фенилкарбамата может послужить основой для тестирования соответствующих подходов к лечению. В целом зафиксированные изменения показателей ЭКГ совпадают с данными научной литературы, где описано выраженное влияние карбаматов и ФОС на показатели сердечно-сосудистой деятельности [23].
Поскольку стандартные тесты для оценки двигательной активности и когнитивных нарушений низкоинформативны при применении в первые сутки после воздействия фенилкарбаматом, можно предположить, что развивающиеся после подобных отравлений нарушения функции нервной системы имеют длительный и сложный патогенез и требуют либо более продолжительных наблюдений, либо применения альтернативных тестов при экспериментальном моделировании отравлений соединениями группы карбаматов.
Результаты гистологического исследования тканей мозга подтверждают, что, несмотря на отсутствие выраженных отклонений в тестах для оценки когнитивных нарушений у экспериментальных животных в первые 24 ч после воздействия, введение карбаматов приводило к возникновению нарушений в структуре мозга, что также может быть использовано при изучении патогенеза отравлений и в практике доклинических исследований при разработке подходов к лечению отравлений.
Некоторая часть выявленных изменений биохимических показателей может быть связана не только с комплексом патогенетических преобразований при интоксикации, но и с индивидуальной чувствительностью отдельных особей, что (при малом количестве животных в группах) повлияло на среднестатистические значения показателей. Однако результаты нашего исследования подтверждаются научными данными, полученными при оценке влияния на человека иных ингибиторов холинэстераз. Так, в исследовании R. Senarathne et al. предлагалось использовать АСТ и АЛТ в качестве альтернативных маркеров отравлений карбаматами и ФОС [24]. Выявленные изменения активности ферментов печени, холестерина и триглицеридов через 14 сут после воздействия фенилкарбамата свидетельствуют о нарушении функций печени. Повышение концентрации мочевины в крови может быть связано как с нарушениями функции печени, так и с повреждением мышечных тканей, кроме того, в процессе массированного распада белка, сопровождающегося гипераммониемией, токсичный аммиак может стать причиной развития ряда неврологических нарушений.
При воздействии фенилкарбамата, помимо дефицита магния, изменялась частота сердечных сокращений. Можно предположить, что данные изменения вносят свой вклад в не зависящую от взаимодействия с АХЭ судорожную активность, учитывая, что гипомагниемия часто ассоциирована с гипервозбудимостью миокарда, тремором, фасцикуляциями.
Результаты изучения содержания и функции АХЭ при введении фенилкарбамата вполне ожидаемы и подтверждают эффективность использования данного соединения в качестве модельного токсиканта при экспериментальном моделировании судорожного синдрома на фоне отравления ингибиторами холинэстераз.
Результаты исследования маркеров перекисного окисления липидов и системы антиоксидантной защиты подтвердили данные о комплексном механизме развития судорог и последующих неврологических нарушений после отравлений карбаматами. Выявленное ранее изменение уровня малонового диальдегида, образующегося в процессе перекисного окисления липидов и ассоциируемого с изменениями липидограммы [25], соотносится с установленными нами изменениями в концентрациях триглицеридов и холестерина. Были зафиксированы отличия уровня МДА на 1 сут в группе «фенилкарбамат» по сравнению с контрольной группой, но начиная со второго дня и до 14 дня наблюдалось увеличение данного показателя по сравнению с контрольной группой. Повышение уровня содержания ГП и ВГ на 1 и 2 сут экспериментального периода в группе животных, получивших фенилкарбамат, по сравнению с контрольной группой подтверждает нарушение функции печени, сердечно-сосудистой системы и развитие воспалительной реакции на фоне отравления карбаматами, сопровождающегося активацией антиоксидантных механизмов.
Обобщая результаты проведенной разработки экспериментальной модели судорожного синдрома на основе введения фенилкарбамата в организм, можно предложить следующий алгоритм использования модели, представленный в таблице 6.
Таблица 6. Схема для формирования экспериментальной модели судорожного синдрома обратимым ингибитором ацетилхолинэстеразы
Тип животных | Белые беспородные крысы-самцы возрастом 3 месяца, весом 150–250 г |
Количество животных в группе | Не менее 6 |
Модельный токсикант | Фениловый эфир карбаминовой кислоты [13] |
Минимальная судорожная доза | 1 мг/кг (в качестве растворителя — 0,9% раствор натрия хлорида) |
Способ введения токсиканта в организм | Внутрибрюшинно |
Значимые характеристики судорожного синдрома | Клонические судороги в 100% случаев; латентный период проявления судорог 5–6 мин; интенсивность судорог не менее 5 баллов по шкале Racine в течение 30 мин |
При изучении эффективности средств терапии судорожного синдрома (до 24 ч) дополнительно могут учитываться показатели | Повышенные уровни: триглицеридов, восстановленного глутатиона, активности глутатионпероксидазы. Сниженные концентрации: холестерина, щелочной фосфатазы, мочевины, Na+, Mg2+, малонового диальдегида; Снижение частоты сердечных сокращений |
При изучении эффективности средств терапии отдаленных последствий судорожного синдрома (до 14 сут) дополнительно могут учитываться показатели | Повышение: щелочной фосфатазы, мочевины, билирубина, малонового диальдегида. Снижение: холестерина, лактатдегидрогеназы, АЛТ, глутатионпероксидазы |
Таблица составлена авторами на основании собственных данных
ЗАКЛЮЧЕНИЕ
Разработанная экспериментальная модель судорожного синдрома на основе фенилкарбамата в дозе 1 мг/кг м.т. обладает приемлемыми характеристиками по сравнению с существующими моделями и может эффективно применяться в доклинических исследованиях при изучении особенностей патогенеза отравлений карбаматами, при разработке средств купирования судорожного синдрома при остром отравлении и при создании средств профилактики и лечения отдаленных последствий отравлений у выживших.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.С. Мелехова — разработка и тестирование экспериментальной модели, написание разделов статьи; А.В. Бельская — разработка и тестирование экспериментальной модели, написание разделов статьи; В.Н. Зорина — анализ научной литературы, трактовка результатов биохимического анализа, написание статьи; М.В. Мельникова — тестирование экспериментальной модели; Л.Г. Кубарская — определение ацетилхолинэстеразы; О.Н. Гайкова — гистологическое исследование.
Список литературы
1. Ghosh AK, Brindisi M. Urea derivatives in modern drug discovery and medicinal chemistry. J. Med. Chem. 2020;63:2751–88. https://doi.org/10.1021/acs.jmedchem.9b01541
2. Matosevic A, Bosak A. Carbamate Group as Structural Motif in Drugs: a review of carbamate derivatives used as therapeutic agents. Arhiv za higijenu rada i toksikologiju. 2020;71(4):285–99. https://doi.org/10.2478/aiht-2020-71-3466
3. King AM, Aaron CK. Organophosphate and carbamate poisoning. Emerg Med Clin North Am.2015;33(1):133–51. https://doi.org/10.1016/j.emc.2014.09.010
4. Mangaly AJ, Radhakrishnan C. Alternate Biochemical Markers in Organophosphate Poisoning. J Assoc Physicians India. 2023;71(8):11–2. https://doi.org/10.59556/japi.71.0325
5. Morgan JE, Wilson SC, Travis BJ, Bagri KH, Pagarigan KT, Belski HM, et al. Refractory and Super-Refractory Status Epilepticus in Nerve Agent-Poisoned Rats Following Application of Standard Clinical Treatment Guidelines. Front Neurosci.2021;15:732213. https://doi.org/10.3389/fnins.2021.732213
6. Alozi M, Rawas-Qalaji M Treating organophosphates poisoning: management challenges and potential solutions. Crit Rev Toxicol.2020;50(9):764–79. https://doi.org/10.1080/10408444.2020.1837069
7. Leung MCK, Meyer JN. Mitochondria as a target of organophosphate and carbamate pesticides: Revisiting common mechanisms of action with new approach methodologies. Reprod Toxicol. 2019;89:83–92. https://doi.org/10.1016/j.reprotox.2019.07.007
8. Mudyanselage AW, Wijamunige BC, Kocon A, Carter WG. Differentiated Neurons Are More Vulnerable to Organophosphate and Carbamate Neurotoxicity than Undifferentiated Neurons Due to the Induction of Redox Stress and Accumulate Oxidatively-Damaged Proteins. Brain Sci. 2023;13(5):728. https://doi.org/10.3390/brainsci1305072
9. Löscher W. Animal Models of Seizures and Epilepsy: Past, Present, and Future Role for the Discovery of Antiseizure Drugs. Neurochem Res. 2017;42(7):1873–88. https://doi.org/10.1007/s11064-017-2222-z
10. McCarren HS, McDonough JH Jr. Anticonvulsant discovery through animal models of status epilepticus induced by organophosphorus nerve agents and pesticides. Ann N Y Acad Sci. 2016;1374(1):144–50. https://doi.org/10.1111/nyas.13092
11. СанПиН 3.3686-21 Санитарно-эпидемиологические требования по профилактике инфекционных болезней. СанПиН 3.3686-21 Санитарно-эпидемиологические требования по профилактике инфекционных болезней.
12. Обоснование и разработка порядка применения наиболее эффективных препаратов, предлагаемых в качестве средств фармакологической коррекции последствий отравлений веществами судорожного действия. Отчет о НИР (заключительный). ФГБУН ИТ ФМБА России, рук. Петров А.Н., исполн.: Войцехович К.О. и др.СПб.; 2017 г. № 115021340031. Обоснование и разработка порядка применения наиболее эффективных препаратов, предлагаемых в качестве средств фармакологической коррекции последствий отравлений веществами судорожного действия. Отчет о НИР (заключительный). ФГБУН ИТ ФМБА России, рук. Петров А.Н., исполн.: Войцехович К.О. и др.СПб.;2017 г. № 115021340031.
13. Беспалов АЯ, Прокопенко ЛИ, Горчакова ТЛ, Козлов ВК, Петров АН, Зайцева МА и др. Гидрохлориды замещенных 2-[(диметиламино)метил] арилдиметилкарбоматов, обладающие антихолинэстеразной активностью. Патент Российской Федерации № 2754133; 2021/
14. Миронов АН. ред. Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К; 2012.
15. Racine RJ. Modification of seizure activity by electrical stimulation. II. Motor seizure. Electroencephalogr Clin Neurophysiol. 1972;32(3):281–94. https://doi.org/10.1016/0013-4694(72)90177-0
16. Hall CS Emotional behavior in the rat. III. The relationship between emotionality and ambulatory activity. J. comp. physiol. Psychol. 1936;22:345–52. https://doi.org/10.1037/h0059253
17. Струтынский АВ. Электрокардиограмма. Анализ и интерпретация. М.: МЕДпресс-информ; 2013.
18. Батоцыренова ЕГ, Кашуро ВА, Шарабанов АВ. Фармакологическая коррекция отдаленных последствий острого тяжелого отравления тиопенталом натрия в условиях хронического светового десинхроноза. Биомедицина. 2021;17(3):23–8.
19. Habig WH. Assay for differentiation of glutathione S-transferases. Methods in Enzymology. 1981;77:398–405. https://doi.org/10.1016/s0076-6879(81)77053-8
20. Ellman GL. Tissue sulfhydryl groups. Archives of Biochemistry and Biophysics. 1959;82(1):70–7. https://doi.org/10.1016/0003-9861(59)90090-6
21. Uchiyama M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Analytical Biochemistry. 1978;86(1):271–8. https://doi.org/10.1016/0003-2697(78)90342-1
22. Ellmann GL, Courtney KD, Andress V, Fcatherstone RM. A new and rapid Colorimetric determination of activity acetylcholinesterase. Biochem.Pharmacol. 1961;7(2):88–95. https://doi.org/10.1016/0006-2952(61)90145-9
23. Yadav I. Study of Sick Euthyroid Syndrome in Organophosphate Poisoning. J Assoc Physicians India. 2022; 70(4):11–2.
24. Senarathne R, Hettiaratchi U, Athiththan L, Peiris H, Sarathchandra C, Senanayake H, Weerawansa P, Siribaddana S. Selected Liver Markers in Predicting the Severity of Organophosphate and Carbamate Poisoning. J Environ Public Health. 2022:7826396. https://doi.org/10.1155/2022/7826396
25. Булатова ИА, Щекотова АП, Карлышева КН. Особенности окислительного стресса при метаболическом синдроме с жировым поражением печени. Современные проблемы науки и образования. 2014:2. URL: https://science-education.ru/ru/article/view?id=12473 (дата обращения: 26.04.2024).
Об авторах
А. С. МелеховаРоссия
Мелехова Александра Сергеевна
Санкт-Петербург
А. В. Бельская
Россия
Бельская Алиса Владимировна
Санкт-Петербург
В. Н. Зорина
Россия
Зорина Вероника Николаевна, д-р биол. наук
Санкт-Петербург
М. В. Мельникова
Россия
Мельникова Маргарита Викторовна
Санкт-Петербург
Л. Г. Кубарская
Россия
Кубарская Лариса Георгиевна, канд. биол. наук
Санкт-Петербург
О. Н. Гайкова
Россия
Гайкова Ольга Николаевна, д-р биол. наук
Санкт-Петербург
Рецензия
Для цитирования:
Мелехова А.С., Бельская А.В., Зорина В.Н., Мельникова М.В., Кубарская Л.Г., Гайкова О.Н. Экспериментальная модель судорожного синдрома на основе фенилкарбамата. Медицина экстремальных ситуаций. 2024;26(4):38-48. https://doi.org/10.47183/mes.2024-26-4-38-48
For citation:
Melekhova A.S., Belskaya A.V., Zorina V.N., Melnikova M.G., Kubarskaya L.G., Gaikova O.N. Experimental model of convulsive syndrome based on phenylcarbamate. Extreme Medicine. 2024;26(4):38-48. https://doi.org/10.47183/mes.2024-26-4-38-48

















