Перейти к:
Признаки развития окислительного стресса при анализе протеома крови женщин-добровольцев в эксперименте с 5-суточной «сухой» иммерсией
https://doi.org/10.47183/mes.2025-251
Аннотация
Введение. «Сухая» иммерсия, являясь моделью для воспроизведения физиологических эффектов невесомости, позволяет оценить изменения функций сердечно-сосудистой, опорно-двигательной и других систем организма. Исследования протеома крови на основе масс-спектрометрии могут способствовать выявлению механизмов физиологической адаптации к факторам космического полета, моделируемых в «сухой» иммерсии. Цель. Расширение научных представлений о молекулярных участниках острого периода адаптации физиологических систем к условиям моделируемой микрогравитации по данным протеомного анализа сухих пятен крови участниц 5-суточной «сухой» иммерсии.
Материалы и методы. В исследовании приняли участие 8 здоровых женщин-добровольцев (средний возраст 30,0 ± 4,8 года). Белки крови анализировали по методу «сухих пятен крови»; использовали капиллярную кровь, высушенную на специальном бумажном фильтре (Perkin Elmer). Ферментное расщепление белков проводили с использованием трипсина (Thermo Scientific, США). Смеси триптических пептидов анализировали методом жидкостной хромато-масс-спектрометрии на хроматографе нано-ВЭЖХ Dionex Ultimate3000, совмещенном с масс-спектрометром TimsTOF Pro. Масс-спектрометрический анализ проводили с использованием метода параллельного накопления при последовательной фрагментации (PASEF). Полученные данные LC-MS/MS были полуколичественно проанализированы с помощью DIA-NN 1.8.1. Статистический анализ проводили в программе Statistica 12.
Результаты. Обнаружено, что молекулярный ответ на условия иммерсии связан с повышением уровней белков антиоксидантной защиты, активацией процессов катаболизма и пентозофосфатного пути. Уменьшались уровни отрицательных регуляторов эндопептидаз, белков гомеостаза железа. Выявленные повышенные уровни активаторов НАДФH-оксидазы свидетельствуют об активации НАДФН-оксидазы в условиях эксперимента. Эти результаты могут указывать на развитие окислительного стресса во время иммерсии.
Выводы. Выявленные молекулярные участники ответа женского организма на условия иммерсии могут предоставить информацию о сигнальных путях и механизмах, задействованных в ответе на гипокинезию, и в последующем будут способствовать разработке фармакологических мер поддержки здоровья женщин-космонавтов. Эти результаты также могут быть полезны для понимания процессов, приводящих к неблагоприятным последствиям у людей с низким уровнем двигательной активности.
Ключевые слова
Для цитирования:
Каширина Д.Н., Пастушкова Л.Х., Бржозовский А.Г., Кононихин А.С., Николаев Е.Н., Ларина И.М. Признаки развития окислительного стресса при анализе протеома крови женщин-добровольцев в эксперименте с 5-суточной «сухой» иммерсией. Медицина экстремальных ситуаций. 2025;27(2):205-212. https://doi.org/10.47183/mes.2025-251
For citation:
Kashirina D.N., Pastushkova L.Kh., Brzhozovskiy A.G., Kononikhin A.S., Nikolaev E.N., Larina I.M. Oxidative stress signs in blood proteome analysis of female volunteers in five-day dry immersion test. Extreme Medicine. 2025;27(2):205-212. https://doi.org/10.47183/mes.2025-251
ВВЕДЕНИЕ
Эксперимент «Сухая» иммерсия является одной из лучших моделей для исследования влияния начального этапа космического полета (КП) на здоровье космонавтов. По сравнению с другими наземными моделями, такими как антиортостатическая гипокинезия (АНОГ), «сухая» иммерсия (СИ) признана более адекватной, так как вызывает физиологические изменения, сходные с таковыми в начальном периоде космического полета как по характеру, так и по динамике развития [1]. «Сухая» иммерсия имитирует отсутствие опоры, иммобилизацию, гипокинезию и централизацию жидкостей организма, что также наблюдается во время космических полетов [2]. Данная модель позволяет оценить вызванные микрогравитацией изменения функций вестибулярного аппарата, сердечно-сосудистой, опорно-двигательной, соматосенсорной и других систем организма.
Считается, что одной из основных особенностей биологического ответа организма человека на условия космического полета является выраженный окислительный стресс, который может вызывать повреждение всех клеточных структур, включая ДНК. Окислительный стресс возникает, когда продукция свободных радикалов превышает естественные антиоксидантные возможности клетки [3]. Воздействие микрогравитации и космической радиации усиливает выработку клетками активных форм кислорода и азота (АФК, АФА), что нарушает функции сердечно-сосудистой системы и костной ткани [4]. Также было показано повышение уровня 8-оксогуанозина (продукта окисления ДНК) в моче у 59 астронавтов [5]. На физиологическом уровне окислительный стресс и окислительно-восстановительный дисбаланс способствуют связанным с космическим полетом нарушениям регуляции метаболизма сердечно-сосудистой, иммунной и нервной систем [6].
Во время наземных экспериментов также наблюдали увеличение показателей, свидетельствующих о развитии окислительного стресса [7][8] в результате либо повышенного образования активных форм кислорода, либо дисфункции антиоксидантных защитных систем [9]. Так, в АНОГ выявлено увеличение маркера окислительного повреждения ДНК 8-OH-дезоксигуанозина, сопровождающееся увеличением экскреции маркеров резорбции костей [N-телопептида коллагена типа I (NTX), пиридиновых сшивок, дезоксипиридинолина] [8]. Рост запасов железа во время космического полета также связывают с увеличением окислительного повреждения ДНК и потерей костной массы [10]. Во время экспериментов с гипокинезией, помимо влияния на костный метаболизм, также растет выработка АФК в мышцах, что сопровождается изменениями в активности антиоксидантных систем [11].
В настоящее время активно изучаются механизмы действия микрогравитации и гипокинезии на физиологические системы человека, в том числе с помощью постгеномных методов. Исследования протеома на основе масс-спектрометрии, анализирующие динамические изменения белков крови, тканей и т.д., могут способствовать выявлению механизмов физиологической адаптации к факторам космического полета, моделируемым в СИ.
Так, ранее в эксперименте 5-дневной «сухой» иммерсии было выявлено повышение уровня свободного билирубина и миоглобина в сыворотке крови, что указывало на усиление гемолиза и миолиза. Также было показано увеличение уровней гепсидина, ферритина и гаптоглобина, что может быть связано с повышением уровня железа в сыворотке [12]. При сравнении изменений метаболизма железа у мужчин и женщин, подвергшихся 5-дневной СИ, выявлено повышение системной доступности железа и уровня гепсидина в сыворотке, что свидетельствует о неправильном распределении железа в этих условиях вне зависимости от пола испытуемого [13].
Вместе с тем были выявлены белки, уровни которых изменялись и после космических полетов, и в наземных экспериментах в условиях проведения 21-суточных АНОГ и СИ, а именно: A1BG, А2М, SERPINA1, SERPINA3, SERPING1, SERPINC1, HP, CFB, TF. Это указывает на изменения в процессах, затрагиваемых микрогравитацией: гемостаза, дегрануляции тромбоцитов и белкового обмена [14]. В эксперименте 3-суточной иммерсии с участием женщин-добровольцев было установлено существенное изменение транскриптомного профиля в камбаловидной мышце человека, снижение тканевого дыхания, стимулируемого АДФ, однако без изменения содержания митохондриальных белков / дыхательных ферментов, что указывало на нарушение регуляции процессов клеточного дыхания. РНК с пониженной регуляцией были тесно связаны с функцией митохондрий, а также с метаболизмом липидов, гликолизом, передачей сигналов инсулина и различными переносчиками [15]. В этом же эксперименте при протеомном анализе сухих пятен крови выявлены внутриклеточные белки с повышенным уровнем экспрессии, которые включены в процессы пентозофосфатного шунта (PGM2, TKT, BPGM); в то же время понижался уровень внеклеточных белков (ALBU, APOA4, AGT, LUM, HPX, SERPINA7) [16].
Цель исследования — изучение молекулярных маркеров острого периода адаптации физиологических систем здоровых женщин к условиям моделируемой микрогравитации по данным протеомного анализа экстрактов сухих пятен крови участниц 5-суточной «сухой» иммерсии.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн эксперимента 5-суточной «сухой» иммерсии
Эксперимент «Сухая» иммерсия является моделью для наземного воспроизведения физиологических эффектов невесомости; он был организован ГНЦ РФ — ИМБП РАН и проводился на стенде института «Сухая иммерсия». В исследовании приняли участие восемь молодых здоровых женщин-добровольцев (средний возраст 30,0 ± 4,8 года). Каждая участница исследования добровольно подписала информированное согласие после объяснения ей потенциальных рисков, преимуществ и характера предстоящего исследования. Комиссией медицинских экспертов было подтверждено, что все испытуемые имели хорошее здоровье и нормальный индекс массы тела. Во время периода «сухой» иммерсии испытуемые не подвергались никаким дополнительным воздействиям, направленным на коррекцию адаптивных изменений в физиологических системах. В начале испытаний женщины-добровольцы были синхронизированы по фазе менструального цикла (фолликулярная фаза), чтобы избежать различий в гормональных эффектах на исследуемые параметры.
Сбор образцов капиллярной крови
Для анализа белков крови использовали капиллярную кровь, высушенную на специальном бумажном фильтре (Perkin Elmer) (так называемый метод сухих пятен крови). Преимущества данного метода — в его простоте и низкоинвазивности, что позволяет отбирать образцы с высокой скважностью. Образцы капиллярной крови были взяты у добровольцев за 2 сут до начала эксперимента (фон), на 1, 3 и 5-е сут во время эксперимента СИ и через 2 сут после окончания иммерсии (после СИ). Контролем служили образцы, отобранные до иммерсии. Забор капиллярной крови у испытуемых проведен из концевой фаланги безымянного пальца автоматическим скарификатором. С помощью автоматической пипетки отбирали 20 мкл крови и помещали каплю крови на специальную фильтровальную бумагу, сушили в течение 2 ч и хранили при -20 °С.
Сухие пятна крови вырезали и помещали в микроцентрифужные пробирки. Затем белки экстрагировали, восстанавливалии, алкилировали и осаждали, как описано [16]. Ферментное расщепление белков проводили с использованием трипсина (Thermo Scientific, США). Полученные смеси триптических пептидов анализировали методом жидкостной хромато-масс-спектрометрии на хроматографе нано-ВЭЖХ Dionex Ultimate3000 (Thermo Fisher Scientific, США), совмещенным с масс-спектрометром TimsTOF Pro (Bruker Daltonics, США). Пептиды разделяли с помощью насадочной эмиссионной колонки (C18, 25 см × 75 мкм × 1,6 мкм) (Ion Optics, Парквилл, Австралия) при скорости потока 400 нл/мин посредством градиентного элюирования 4–90% фазы B в течение 40 мин. Мобильная фаза А состояла из 0,1% муравьиной кислоты в воде, а мобильная фаза В — из 0,1% муравьиной кислоты в ацетонитриле.
Масс-спектрометрический анализ осуществляли с использованием метода параллельного накопления при последовательной фрагментации (PASEF). Источник электрораспылительной ионизации (ESI) работал при напряжении на капилляре 1500 В, смещении концевой пластины 500 В при температуре 180 °C. Измерения проводились в диапазоне m/z от 100 до 1700 Th. Подвижность ионов находилась в диапазоне от 0,60 до 1,60 В с/см2. Общее время цикла составило 1,88 с, а количество сканирований PASEF MS/MS было установлено на 10.
Полученные данные LC-MS/MS были полуколичественно проанализированы с помощью DIA-NN 1.8.1. Заданные ограничительные параметры были следующими: точность масс фрагментов составляла 1,5e-05 (MS2) и 2e-05 (MS1); фермент — трипсин; максимальное число пропущенных связей — 3; фиксированная модификация — карбамидометил (С). Порог частоты ложных обнаружений (FDR) был установлен на уровне 0,01. Полуколичественный анализ производили с использованием нормализованных интенсивностей пиков в спектрах MS, что отражает относительные уровни белков в образцах.
Статистический анализ проводился в программе Statistica 12 c помощью непараметрического теста Манна — Уитни (p-value < 0,05). Биологические процессы, в которых участвуют выявленные белки, были определены с помощью веб-ресурса STRING1.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В результате анализа протеома образцов сухих пятен крови женщин-добровольцев было идентифицировано 829 различных белков, в среднем в каждом образце выявляли около 700 белков. При сравнении уровня белков в каждой точке эксперимента на 1, 3 и 5-е сут иммерсии и после эксперимента (на 2-е сутки после окончания) относительно фона (за 2 сут до эксперимента) выявлено порядка 214 белков, относительные уровни которых достоверно менялись в те или иные сроки эксперимента, причем с удлинением срока эксперимента происходило статистически значимое возрастание различий в количестве белков, отвечающих за различные патофизиологические процессы в организме.
Так, на 1-е сут иммерсии у женщин выявлено увеличение уровней 4 белков и снижение уровня 1 белка относительно фоновых уровней. На третьи сутки повышались уровни 18 белков и снижались уровни 28 белков относительно фона. На 5-е сутки уровни 43 белков повышались, а 32 белков снижались. В то же время оказалось неожиданным, что в восстановительном периоде было обнаружено наибольшее число белков с изменившимся уровнем — 139: из них 59 белков с повышенным и 80 белков с пониженным относительно фона уровнем.
Для всех белков, относительные уровни которых повышались во время иммерсии, с использованием веб-ресурса String выявлено 9 биологических процессов по базе данных Gene Ontology (GO) (рис. 1А). Наиболее достоверным процессом оказался процесс детоксикации клеточных окислителей, к которым относились белки генов CAT, TXNDC17, PRDX1, TXN, TXNRD1, HBB, HBD. Некоторые из этих же белков участвовали в процессе катаболизма пероксида водорода (CAT, PRDX1, HBB, HBD). Также можно отметить процессы катаболизма и биосинтез глицеральдегид-3-фосфата, который является ключевым интермедиатом метаболизма гексоз во многих биохимических процессах: гликолизе, глюконеогенезе, пентозофосфатном шунте и т.д.
Среди биологических процессов, в которые вовлечены белки со сниженными во время иммерсии уровнями (HRG, F12, PEBP1, SERPINA10, AMBP, CLEC3B, USP9X, FN1, SERPINC1, GSN, PSMC2, SERPINA4), выявлен только один — регуляция протеолиза (рис. 1Б). Среди данных белков, участвующих в регуляции протеолиза, половина белков являлась ингибиторами протеаз (богатый гистидином гликопротеин (HRG); гиппокампа холинергический нейростимулирующий пептид (PEBP1); ингибитор протеазы, зависимой от белка Z (SERPINA10); легкая цепь ингибитора интер-альфа-трипсина (AMBP); антитромбин-III (SERPINC1); каллистатин (SERPINA4). Очевидно, что снижение ингибиторов протеаз будет способствовать усилению протеолиза в условиях иммерсии.
Наиболее статистически значимо изменялся биологический процесс детоксикации клеточных окислителей, который является частью антиоксидантной защиты, что характеризовалось повышением вовлеченных в этот процесс уровней белков. В таблице 1 перечислены белки антиоксидантной защиты, уровни которых изменялись в течение всего периода сухой иммерсии.
На рисунке 2 отображена схема вовлечения белков антиоксидантной защиты в ответ на условия иммерсии. На третьи сутки СИ повышались уровни белка 17, содержащего тиоредоксиновый домен (TXNDC17), пероксиредоксина-1 (PRDX1), каталазы (CAT) и субъединицы модификатора глутамат-цистеиновой лигазы (GCLM), которые имеют пероксидазную активность и могут способствовать удалению клеточного пероксида водорода, являющегося активной формой кислорода и способного повреждать клеточные компоненты. На 5-е сутки к ответу вовлекались тиоредоксин (TXN) и тиоредоксинредуктаза 1 (TXNRD1). Восстановление тиоредоксина осуществляет тиоредоксинредуктаза, которая использует для этого одну молекулу НАДФН. Также в этот период повышались уровни бета- и дельта-субъединиц гемоглобина (HBB, HBD).
Молекулярный ответ на окончание иммерсии и возвращение к привычным условиям жизнедеятельности также ассоциировался с повышением уровней белков данного процесса. Так, повышалась супероксиддисмутаза (SOD1), бета- и тета-1-субъединицы гемоглобина (HBB, HBQ1), а уровни PRDX1, СAT, TXN, TXNDC17 и TXNRD1 восстанавливались до предэкспериментальных значений.
Также были выявлены процессы, ассоциированные с антиоксидантной защитой и окислительным стрессом, такие как пентозофосфатный путь, регуляция НАДФН-оксидазы и гомеостаз железа. Так, отметим достоверное повышение (p-value < 0,05) уровней белков пентозофосфатного пути (транскетолазы (TKT) и фосфоглюкомутазы-2 (PGM2) (рис. 3А), предположительно для образования одного из основных компонентов системы антиоксидантной защиты — НАДФН.
Кроме того, в нашем эксперименте после окончания иммерсии было выявлено достоверное повышение уровня субстрата 1 ботулинического токсина C3, связанного с Ras (RAC1), являющегося регуляторной субъединицей НАДФН-оксидазы и стимулирующего ее активность, относительно уровня до иммерсии (рис. 3Б). Еще одним регулятором НАДФН-оксидазы является CDC42 [17], который, по нашим данным, был повышен на 3-и сут СИ и после окончания иммерсии (рис. 3Б). В данной цепочке взаимодействий важным звеном является адаптерный белок бета-парвин PARVB (уровень был повышен на 3-и сут иммерсии), который играет роль в передаче сигналов интегрина через интегрин-связанную киназу ILK (уровень был повышен только после окончания иммерсии) (рис. 3Б) и активации вышеупомянутых ГТФаз CDC42 и RAC1.
Также важно отметить снижение уровня белков гомеостаза ионов железа (каталитическая субъединица А протонной АТФазы V-типа (ATP6V1A), BolA-подобный белок 2 (BOLA2)), которое мы наблюдали во время «сухой» иммерсии (рис. 3В). Стойкое снижение уровней этих белков начиная с 3-х сут иммерсии может указывать на изменения в метаболизме железа, вызванные условиями эксперимента.
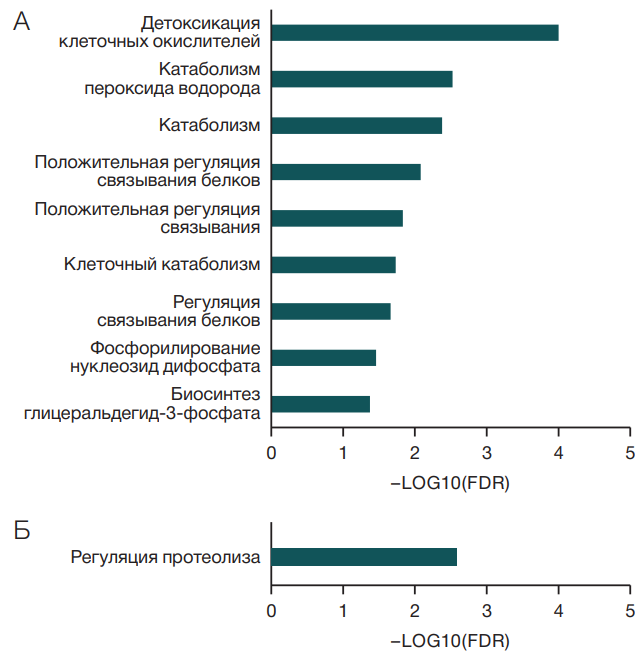
Рисунок подготовлен авторами по собственным данным
Рис. 1. Статистически значимо представленные биологические процессы, в которые вовлечены белки с измененным уровнем, по базе данных Gene Ontology: А — биологические процессы, к которым относятся все белки с достоверно повышенным во время иммерсии уровнем; Б — биологические процессы, к которым относятся все белки с достоверно сниженным во время иммерсии уровнем
Таблица 1. Динамика изменений уровней белков антиоксидантной защиты во время и после сухой иммерсии в процентах относительно фоновых уровней
Названия белков | Гены | Изменения уровней белков относительно фона, % | |||
Время проведения СИ, сут | |||||
1 | 3 | 5 | После окончания | ||
Каталаза | CAT | 109,7 | 119,7* | 125,5* | 114,3 |
Пероксиредоксин-1 | PRDX1 | 113,1 | 119,2* | 113,1* | 101,5 |
Регуляторная субъединица глутамат-цистеиновой лигазы | GCLM | 112,9 | 119,1* | 124,0* | 114,0 |
Белок 17, содержащий домен тиоредоксин | TXNDC17 | 101,4 | 130,7* | 121,7* | 118,5 |
Тиоредоксинредуктаза 1, цитоплазматическая | TXNRD1 | 117,8 | 122,4 | 147,2* | 128,6 |
Тиоредоксин | TXN | 118,1 | 114,7 | 150,6* | 123,8 |
Субъединица гемоглобина дельта | HBD | 118,2 | 109,5 | 126,6* | 108,4 |
Субъединица гемоглобина бета | HBB | 109,6 | 113,3 | 124,4* | 118,1* |
Каталитическая субъединица глутамат-цистеиновой лигазы | GCLC | 108,6 | 112,6 | 111,9 | 125,8* |
Субъединица гемоглобина тета-1 | HBQ1 | 103,5 | 126,7 | 128,4 | 143,7* |
Супероксиддисмутаза | SOD1 | 112,6 | 118,5 | 115,2 | 134,2* |
Таблица подготовлена авторами по собственным данным
Примечание: * достоверные изменения относительно фоновых уровней (p-value < 0,05).
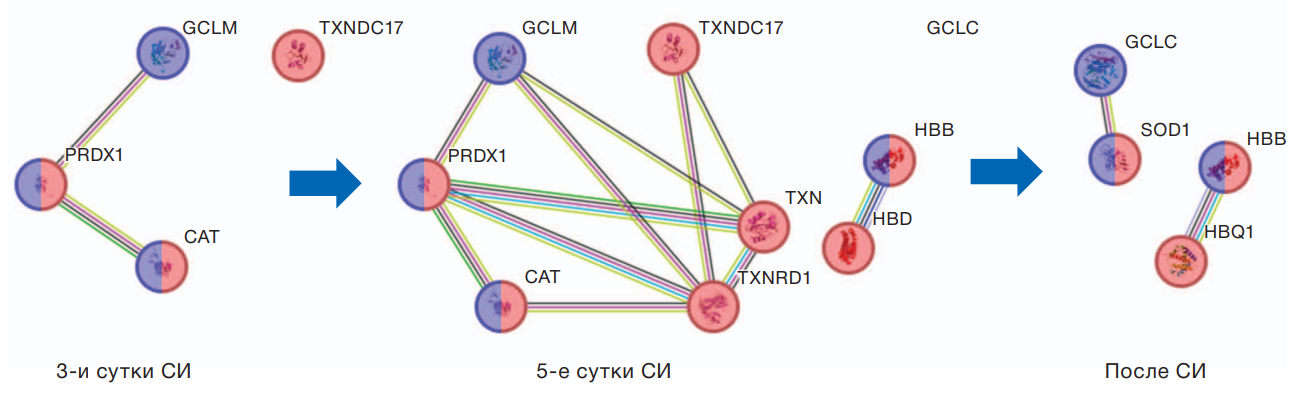
Рисунок подготовлен авторами по собственным данным
Рис. 2. Взаимосвязь белков антиоксидантной защиты
Примечание: красный цвет — белки детоксикации клеточных оксидантов; синий цвет — белки ответа на окислительный стресс; линии межбелковых взаимодействий: салатовый — совместное упоминание в статьях (Co-Mentioned in Pubmed Abstracts); малиновый — взаимодействие белков определено экспериментально; черный — коэкспрессия белков; голубой — взаимодействие указано в проверенных базах данных; зеленый — близкое расположение генов белков; синий — совместная встречаемость генов белков; сиреневый — гомология белков.
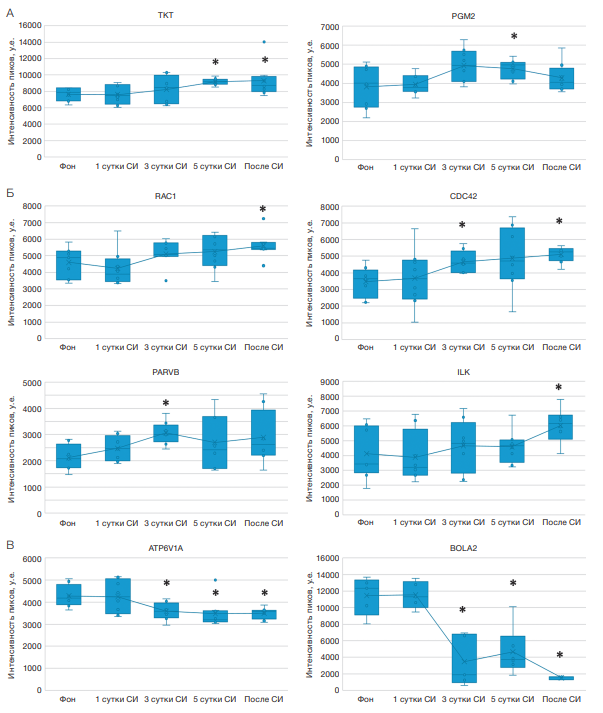
Рисунок подготовлен авторами по собственным данным
Рис. 3. Графики изменений уровней белков в сухих пятнах крови участников 5-суточной СИ
Примечание: А — динамика изменений уровней белков пентозофосфатного пути; Б — динамика изменений уровней регуляторов НАДФН-оксидазы; В — динамика изменений уровней белков метаболизма железа; * статистически значимые изменения p-value < 0,05; у.е. — условные единицы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Молекулярный ответ на условия 5-суточной иммерсии связан в первую очередь с повышением уровней белков антиоксидантной защиты и белков пентозофосфатного пути, важного для образования НАДФН. Интересно, что ранее в 3-суточной иммерсии мы также наблюдали повышение белков пентозофосфатного пути, в том числе вышеупомянутых PGM2 и TKT [18]. Так как материалом для протеомного исследования служили белковые экстракты сухих пятен крови (в которые, кроме белков плазмы, попадали и белки цитозоля разрушенных клеток крови), полагаем, что основной вклад в изменение данных белков внесли эритроциты как наиболее представленные клетки кровотока. В эритроцитах пентозофосфатный путь окисления глюкозы не связан с образованием энергии, но обеспечивает процессы анаболизма. В эритроцитах образуется только НАДФН как продукт пентозофосфатного пути. В этом случае пентоза не является конечным продуктом, а превращается в фосфогексозу, которая замыкает цикл или переходит в гликолиз, завершающий шунт. НАДФН является важным компонентом антиоксидантной защиты и необходим для регенерации глутатиона, который вместе с глутатионпероксидазой разрушает активные формы кислорода (АФК), а также для восстановления тиоредоксина при участии тиоредоксинредуктазы. Поскольку НАДФН образуется в эритроцитах только в реакциях пентозофосфатного шунта, повышение концентрации белков пентозофосфатного шунта может быть реакцией на окислительный стресс. Результаты исследований метаболизма эритроцитов, проводимых до и после КП, показали изменения в метаболическом статусе клеток, выражавшиеся в снижении активности процессов восстановительной системы (снижение восстановленного глутатиона) [19], что подтверждает наше предположение.
Было многократно показано, что отсутствие физической активности увеличивает выработку АФК в мышцах [11], активирует систему глутатиона [11, 20] и влияет на активность антиоксидантных систем [11]. Глутатион является компонентом одной из основных антиоксидантных систем, стимулируемых как в мышцах, так и на системном уровне (в печени и эритроцитах) при активации окислительных процессов [21]. Поэтому клетке важно иметь достаточное количество НАДФН для восстановления глутатиона и защиты от окислительного стресса.
Полагаем, что главной причиной окислительного стресса, наблюдающегося и в КП, и в модельных экспериментах, являются последствия эффектов гиподинамии и гипокинезии в мышечной ткани. В мышечных волокнах имеются два основных источника АФК: митохондрии, образующие АФК при неполном сопряжении окисления и фосфорилирования [22], и НАДФН-оксидаза-2 (NOX-2), локализующаяся в сарколемме и внутренних мембранах [23]. Показано, что разгрузка мышц приводит к снижению дыхания в митохондриях и изменению работы НАДФН-оксидазы-2.
НАДФН-оксидазы являются одним из основных источников активных форм кислорода (АФК) в клетках и до сих пор находятся в центре обширного исследовательского интереса благодаря своей исключительной функции по производству АФК в нормальных физиологических условиях.
Повышение уровней регуляторов НАДФН-оксидазы RAC1_HUMAN, CDC42, а также белков, передающих сигнал на эти ГТФазы, PARVB и ILK во время и после иммерсии, подтверждают роль НАДФН-оксидазы в генерации АФК в условиях гипокинезии и развитии окислительного стресса. Полагают, что окислительный стресс является одним из путей активации сигнальных путей, ответственных за снижение синтеза мышечных белков и активацию протеолиза, что впоследствии приводит к атрофии мышц [24][25].
При современном образе жизни населения в городских агломерациях существует необходимость разработки средств предотвращения развития окислительного стресса и его последствий, вызванных низкой физической активностью. Важность такого заключения определяется тем, что отсутствие физической активности увеличивает выработку АФК клеточными компонентами сосудов и ухудшает эндотелий-зависимую вазорелаксацию, что может способствовать эндотелиальной дисфункции и развитию атеросклероза. Установлено, что статины оказывают благотворное влияние на сердечно-сосудистую систему, предотвращая сердечно-сосудистые заболевания за счет блокировки Rac1 и НАДФН-оксидазы, тем самым снижая генерацию АФК [26]. Стоит отметить, что противодействие окислительному стрессу также может уменьшить потерю мышечной массы при гиподинамии. Так, при моделировании гипокинезии на животных моделях добавление антиоксидантов предотвращало атрофию [27].
Второй причиной повышения уровня белков защиты от окислительного стресса, как и снижения уровня белков гомеостаза ионов железа (ATP6V1A, BOLA2), которые мы наблюдали во время «сухой» иммерсии (рис. 3В), может быть усиление гемолиза. Активация гемолиза была выявлена как в модельных экспериментах, так и во время КП [12][28], хотя причины этого явления до сих пор неизвестны. Тщательную оценку статуса железа, а также гематологических реакций проводили в эксперименте с 5-суточной СИ, в котором участвовали 20 здоровых мужчин [12]. Было обнаружено, что иммерсия увеличивает концентрацию железа в селезенке, тогда как запасы железа в печени не затрагивались. Секвестрации железа в селезенке сопутствовало повышение уровня гепсидина в крови, подавляющего всасывание железа в кишечнике. Увеличение в крови уровня неконъюгированного билирубина, который образуется в норме как результат расщепления белков, содержащих гем (гемоглобина, миоглобина), а также повышение уровня миоглобина подтверждают, что «сухая» иммерсия способствовала гемолизу и миолизу. Эти явления могут объяснять одновременное повышение уровней сывороточного железа и насыщение трансферрина, наблюдавшиеся в исследовании [12].
Метаболизм железа строго контролируется как на системном, так и на клеточном уровне. С одной стороны, железо необходимо для поддержания многих процессов в организме, с другой — перегрузка железом может привести к образованию высокореактивных частиц при взаимодействии лабильного железа с АФК, которые естественным образом производятся во время аэробного дыхания в дыхательной цепи митохондрий. Эти высокореактивные частицы индуцируют окислительный стресс. Предполагается, что перегрузка железом способствует развитию остеопороза и мышечной атрофии по описанному выше механизму [29][30].
ЗАКЛЮЧЕНИЕ
Молекулярный ответ на условия 5-суточной иммерсии, выраженный в изменениях белкового состава экстрактов сухих пятен крови, связан с повышением уровней белков антиоксидантной защиты, процессов катаболизма, связывания белков, фосфорилирования нуклеозид дифосфатов, метаболизма интермедиатов гликолиза и пентозофосфатного пути; уменьшением уровней отрицательных регуляторов эндопептидаз, белков гомеостаза железа. Интересной находкой в данном исследовании явилась активация системы клеточных антиокислителей. Повышенные уровни белков пентозофосфатного пути и антиоксидантной защиты могут указывать на развитие окислительного стресса во время иммерсии. Вклад в генерацию АФК может вносить и измененный метаболизм железа. Выявленные повышенные уровни активаторов НАДФH оксидазы свидетельствуют об активации НАДФН оксидазы в условиях гиподинамии.
Развитию окислительного стресса также может способствовать модификация процессов метаболизма железа и гемолиз, наблюдающиеся при моделировании эффектов микрогравитации и гипокинезии. Эти наблюдения подчеркивают необходимость пристального внимания к оценке метаболизма железа у пациентов с ограниченной подвижностью. Выявленные молекулярные участники ответа организма на условия иммерсии могут предоставить информацию о сигнальных путях и механизмах, задействованных в ответе на гипокинезию или моделируемую микрогравитацию, и в последующем будут способствовать разработке фармакологических мер поддержки здоровья как космонавтов, так и лиц с низким уровнем двигательной активности.
1. Search Tool for the Retrieval of Interacting Genes/Proteins) — база данных и веб-ресурс для поиска информации об известных и предсказанных белок-белковых взаимодействиях https://string-db.org
Список литературы
1. Tomilovskaya E, Shigueva T, Sayenko D, Rukavishnikov I, Kozlovskaya I. Dry immersion as a ground-based model of microgravity physiological effects. Front. Physiol. 2019;10:284. https://doi.org/10.3389/fphys.2019.00284
2. Navasiolava NM, Custaud M-A, Tomilovskaya ES, Larina IM, Mano T, Gauquelin-Koch G, et al. Long-term dry immersion: review and prospects. Eur. J. Appl. Physiol. 2011;111:1235–60. https://doi.org/10.1007/s00421-010-1750-x
3. Spitz DR, Azzam EI, Li JJ, Gius D. Metabolic oxidation/reduction reactions and cellular responses to ionizing radiation: a unifying concept in stress response biology. Cancer and Metastasis Reviews. 2004;23:311–322. https://doi.org/10.1023/B:CANC.0000031769.14728.bc
4. Tahimic CGT, Globus RK. Redox signaling and its impact on skeletal and vascular responses to spaceflight. Int. J. Mol. Sci. 2017;18(10):2153. https://doi.org/10.3390/ijms18102153
5. da Silveira WA, Fazelinia H, Rosenthal SB, Laiakis EC, Kim MS, Meydan C, et al. Comprehensive multi-omics analysis reveals mitochondrial stress as a central biological hub for spaceflight impact. Cell. 2020;183(5):1185–201.e20. https://doi.org/10.1016/j.cell.2020.11.002
6. Afshinnekoo E, Scott RT, MacKay MJ, Pariset E, Cekanaviciute E, Barker R, et al. Fundamental biological features of spaceflight: advancing the field to enable deep-space exploration. Cell. 2020;183(5):1162–84. https://doi.org/10.1016/j.cell.2020.10.050
7. Debevec T, Pialoux V, Ehrstrom S, Ribon A, Eiken O, Mekjavic IB, Millet GP. FemHab: the effects of bed rest and hypoxia on oxidative stress in healthy women. J. Appl. Physiol. 2016;120(8):930–8. https://doi.org/10.1152/japplphysiol.00919.2015
8. Zwart SR, Oliver SA, Fesperman JV, Kala G, Krauhs J, Ericson K, Smith SM. Nutritional status assessment before, during, and after long-duration head-down bed rest. Aviat. Space Environ. Med. 2009;80(Suppl 5):A15–22. https://doi.org/10.3357/asem.br07.2009
9. Wauquier F, Leotoing L, Coxam V, Guicheux J, Wittrant Y. Oxidative stress in bone remodelling and disease. Trends Mol. Med. 2009;15(10):468–77. https://doi.org/10.1016/j.molmed.2009.08.004
10. Zwart SR, Morgan JLL, Smith SM. Iron status and its relations with oxidative damage and bone loss during long-duration space flight on the International Space Station. Am. J. Clin. Nutr. 2013;98(1):217–23. https://doi.org/10.3945/ajcn.112.056465
11. Agostini F, Dalla Libera L, Rittweger J, Mazzucco S, Jurdana M, Mekjavic IB, et al. Effects of inactivity on human muscle glutathione synthesis by a double-tracer and single-biopsy approach. J. Physiol. 2010;588(Pt 24):5089–104. https://doi.org/10.1113/jphysiol.2010.198283
12. Nay K, Koechlin-Ramonatxo C, Rochdi S, Island ML, Orfila L, Treffel L, et al. Simulated microgravity disturbs iron metabolism and distribution in humans: Lessons from dry immersion, an innovative ground-based human model. FASEB J. 2020;34(11):14920–9. https://doi.org/10.1096/fj.202001199RR
13. Horeau M, Navasiolava N, Van Ombergen A, Custaud MA, Robin A, Ropert M, et al. Dry immersion rapidly disturbs iron metabolism in men and women: results from the VIVALDI studies. NPJ Microgravity. 2024;10(1):68. https://doi.org/10.1038/s41526-024-00399-z
14. Brzhozovskiy AG, Kononikhin AS, Pastushkova LC, Kashirina DN, Indeykina MI, Popov IA, et al. The effects of spaceflight factors on the human plasma proteome, including both real space missions and ground-based experiments. Int. J. Mol. Sci. 2019;20(13):3194. https://doi.org/10.3390/ijms20133194
15. Popov DV, Makhnovskii PA, Zgoda VG, Gazizova GR, Vepkhvadze TF, Lednev EM, et al. Rapid changes in transcriptomic profile and mitochondrial function in human soleus muscle after 3-day dry immersion. J. Appl. Physiol (1985). 2023;134(5):1256–64. https://doi.org/10.1152/japplphysiol.00048.2023
16. Kashirinа D, Brzhozovskiy A, Sun W, Pastushkova L, Popova O, Rusanov V, et al. Proteomic characterization of dry blood spots of healthy women during simulation the microgravity effects using dry immersion. Front. Physiol. 2022;12:75329. https://doi.org/10.3389/fphys.2021.753291
17. Wang X, Ke Z, Chen G, Xu M, Bower KA, Frank JA, et al. Cdc42dependent activation of NADPH oxidase is involved in ethanolinduced neuronal oxidative stress. PLoS One. 2012;7(5):e38075. https://doi.org/10.1371/journal.pone.0038075
18. Каширина ДН, Пастушкова ЛХ, Бржозовский АГ, Кононихин АС, Николаев ЕН, Ларина ИМ. Эффекты 3-суточного иммерсионного воздействия на протеом крови женщин добровольцев. Авиакосм. Экол. Мед. 2023;57(2):47–56. https://doi.org/10.21687/0233-528X-2023-57-2-47-56
19. Иванова СМ, Лабецкая ОИ. Метаболизм эритроцитов. В кн. Орбитальная станция «Мир». Т.1. М.: Аником. 2001;612–5.
20. Dalla Libera L, Ravara B, Gobbo V, Tarricone E, Vitadello M, Biolo G, et al. A transient antioxidant stress response accompanies the onset of disuse atrophy in human skeletal muscle. J. Appl. Physiol. (1985). 2009;107(2):549–57. https://doi.org/10.1152/japplphysiol.00280.2009
21. Dobrowolny G, Aucello M, Rizzuto E, Beccafico S, Mammucari C, Boncompagni S, et al. Skeletal muscle is a primary target of SOD1G93A-mediated toxicity. Cell Metab. 2008;8(5):425–36. https://doi.org/10.1016/j.cmet.2008.09.002
22. Hyatt H, Deminice R, Yoshihara T, Powers SK. Mitochondrial dysfunction induces muscle atrophy during prolonged inactivity: A review of the causes and effects. Arch. Biochem. Biophys. 2019;662:49–60. https://doi.org/10.1016/j.abb.2018.11.005
23. Henríquez-Olguín C, Boronat S, Cabello-Verrugio C, Jaimovich E, Hidalgo E, Jensen TE. The emerging roles of nicotinamide adenine dinucleotide phosphate oxidase 2 in skeletal muscle redox signaling and metabolism. Antioxid. Redox Signal. 2019;31:1371–410. https://doi.org/10.1089/ars.2018.7678
24. Shenkman BS. How postural muscle senses disuse? Early signs and signals. Int. J. Mol. Sci. 2020;21(14):5037. https://doi.org/10.3390/ijms21145037
25. Powers SK, Kavazis AN, McClung JM. Oxidative stress and disuse muscle atrophy. J. Appl. Physiol. 2007;102:2389–97. https://doi.org/10.1152/japplphysiol.01202.2006
26. Kwok JM, Ma CC, Ma S. Recent development in the effects of statins on cardiovascular disease through Rac1 and NADPH oxidase. Vascul. Pharmacol. 2013;58(1–2):21–30. https://doi.org/10.1016/j.vph.2012.10.003
27. Momken I, Stevens L, Bergouignan A, Desplanches D, Rudwill F, Chery I, et al. Resveratrol prevents the wasting disorders of mechanical unloading by acting as a physical exercise mimetic in the rat. FASEB J. 2011;25(10):3646–60. https://doi.org/10.1096/fj.10-177295
28. Trudel G, Shahin N, Ramsay T, Laneuville O, Louati H. Hemolysis contributes to anemia during long-duration space flight. Nat. Med. 2022;28(1):59–62. https://doi.org/10.1038/s41591-021-01637-7
29. Reardon TF, Allen DG. Iron injections in mice increase skeletal muscle iron content, induce oxidative stress and reduce exercise performance. Exp. Physiol. 2009;94:720–30. https://doi.org/10.1113/expphysiol.2008.046045
30. Tsay J, Yang Z, Ross FP, Cunningham-Rundles S, Lin H, Coleman R, et al. Bone loss caused by iron overload in a murine model: importance of oxidative stress. Blood. 2010;116(14):2582–9. https://doi.org/10.1182/blood-2009-12-260083
Об авторах
Д. Н. КаширинаРоссия
Каширина Дарья Николаевна, канд. биол. наук
Москва
Л. Х. Пастушкова
Россия
Пастушкова Людмила Ханифовна, д-р биол. наук
Москва
А. Г. Бржозовский
Россия
Бржозовский Александр Геннадьевич, канд. биол. наук
Москва
А. С. Кононихин
Россия
Кононихин Алексей Сергеевич, канд. физ.-мат. наук
Москва
Е. Н. Николаев
Россия
Николаев Евгений Николаевич, д-р физ.-мат. наук
Москва
И. М. Ларина
Россия
Ларина Ирина Михайловна, д-р мед. наук
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Каширина Д.Н., Пастушкова Л.Х., Бржозовский А.Г., Кононихин А.С., Николаев Е.Н., Ларина И.М. Признаки развития окислительного стресса при анализе протеома крови женщин-добровольцев в эксперименте с 5-суточной «сухой» иммерсией. Медицина экстремальных ситуаций. 2025;27(2):205-212. https://doi.org/10.47183/mes.2025-251
For citation:
Kashirina D.N., Pastushkova L.Kh., Brzhozovskiy A.G., Kononikhin A.S., Nikolaev E.N., Larina I.M. Oxidative stress signs in blood proteome analysis of female volunteers in five-day dry immersion test. Extreme Medicine. 2025;27(2):205-212. https://doi.org/10.47183/mes.2025-251

















