Перейти к:
Физико-химические критерии оценки опасности ЦНС-активных ксенобиотиков
https://doi.org/10.47183/mes.2025-265
Аннотация
Введение. Судебно-медицинская экспертиза часто сталкивается с малоизученными, потенциально опасными психоактивными веществами. При этом информация о биологической активности таких веществ отрывочна и противоречива или вообще отсутствует. Поэтому разработка подходов к прогнозированию опасности ксенобиотиков является актуальной задачей медицины экстремальных ситуаций.
Цель. Изучение взаимосвязи физико-химических свойств и степени опасности представителей одного из классов ЦНС-активных веществ с использованием методов математического анализа и последующим научным обоснованием критериев предварительной оценки опасности наркотических средств.
Материалы и методы. В качестве модельных объектов исследования использовали известные структуры наркотических анальгетиков, разделенные на три группы по степени потенциальной опасности. В качестве факторов потенциальной опасности таких веществ рассматривали их физико-химические свойства, такие как: молекулярная масса, полярность, площадь полярной поверхности, коэффициенты распределения и константы основной диссоциации. Для выявления связи физико-химических свойств и степени опасности психоактивных веществ использовали линейный дискриминантный анализ.
Результаты. На примере представителей одного из классов ЦНС-активных веществ показана связь степени их опасности с физико-химическими свойствами, влияющими на перераспределение таких веществ из центрального кровотока в ткани центральной нервной системы. Для прогнозирования степени опасности психоактивных веществ предложены физико-химические критерии — классификационные функции, достаточно хорошо разделяющие группы модельных веществ между собой.
Выводы. Показали, что физико-химические свойства психоактивных веществ определяют особенности их токсического действия в не меньшей степени, чем сила их связывания с целевыми рецепторами. Сформулированные в работе классификационные функции, рассчитываемые на основании физико-химических свойств веществ, могут быть использованы для предварительной оценки степени опасности ксенобиотиков в ходе их выявления в биологических пробах.
Ключевые слова
Для цитирования:
Криворотов Д.В., Николаев А.И., Радилов А.С., Рембовский В.Р., Кузнецов В.А. Физико-химические критерии оценки опасности ЦНС-активных ксенобиотиков. Медицина экстремальных ситуаций. 2025;27(1):15-25. https://doi.org/10.47183/mes.2025-265
For citation:
Krivorotov D.V., Nikolaev A.I., Radilov A.S., Rembovsky V.R., Kuznetsov V.A. Physical and chemical criteria for hazard assessment of CNS-active xenobiotics. Extreme Medicine. 2025;27(1):15-25. https://doi.org/10.47183/mes.2025-265
ВВЕДЕНИЕ
В ходе судебно-медицинской экспертизы случаев отравлений психоактивными веществами используются целевые аналитические методы: ГХ-МС (масс-спектрометрия с газовой хроматографией) и ВЭЖХ-МС/МС (тандемная масс-спектрометрия с жидкостной хроматографией), которые позволяют обнаруживать известные ксенобиотики и их метаболиты [1]. Для идентификации химической структуры новых веществ, появляющихся в незаконном обороте, применяют нецелевое тестирование с помощью технологий ВЭЖХ-HRMS (масс-спектрометрия высокого разрешения с жидкостной хроматографией). Идентифицируемые в биологических пробах вещества могут представлять значительную опасность [2–5]. Если безопасность лекарственного средства может быть измерена путем определения его терапевтического индекса, рассчитываемого как отношение максимальной дозы лекарственного средства, не проявляющей токсичности, к дозе, дающей нужный эффект (LD50/ED50), то для выявляемых в ходе экспертизы веществ такой подход невозможен. При этом информация об опасной фармакологической активности выявляемых ксенобиотиков либо отрывочна и противоречива, либо вообще отсутствует, чему есть ряд существенных причин:
- стремительное появление новых психоактивных химических веществ, которые незаконно поступают в оборот, при отсутствии стандартных образцов и методов их определения в биологических и иных средах [6];
- законодательные ограничения исследования наркотических средств, не имеющих медицинского применения [6];
- недостаточная стандартизация многочисленных методов исследования фармакологических свойств наркотических средств [7][8];
- сложность межвидового переноса результатов доклинических исследований, приводящая к недооценке токсичности наркотических средств [9];
- невозможность сравнения по биологическому действию не стандартизированных по степени чистоты и изомерному составу наркотических средств [3].
Перечисленные причины делают затруднительной медико-биологическую оценку новых психоактивных веществ, рост случаев выявления которых в незаконном обороте в последнее время отмечается в России и в мире [4][8–10]. Для прогнозирования опасности выявляемых веществ целесообразно иметь доступные для простого определения критерии, связанные с токсическим действием ЦНС-активных ксенобиотиков.
Известно, что токсичность многих наркотических анальгетиков связана с опиоид-индуцированной депрессией дыхания, способной привести к гибели пациента при отсутствии надлежащего лечения [11]. Центральным генератором паттернов дыхания в стволе головного мозга являются комплекс пре-Бетцингера (preBötzinger Complex) и ядро Келликера — Фузе (Kolliker–Fuse). В этих областях мозга за реакцию на повышение уровня углекислого газа (рСО2) и снижение оксигенации крови (рО2), необходимой для рефлекторного механизма дыхания, задействовано всего 70–140 нейронов [12]. Соответственно, механизм регуляции дыхательной деятельности крайне уязвим по отношению к веществам, способным селективно воздействовать на данные мишени в головном мозге. Можно предположить, что опасность ЦНС-активных ксенобиотиков, выраженная как их сила и быстродействие, опосредуется, во-первых, факторами, определяющими степень их влияния на целевые рецепторы в нейронах указанных областей головного мозга, и, во-вторых, факторами, определяющими перенос ксенобиотиков из центрального кровотока к их биологическим мишеням в головной мозг.
Силу действия наркотических анальгетиков часто связывают с величинами констант ингибирования опиоидных рецепторов [13]. Но в стандартизированных условиях морфин и фентанил, существенно различающиеся по силе анальгетического действия, имеют сравнимые константы ингибирования (Ki) μ-опиоидных рецепторов (МОР) (табл. 1) [5][7].
Таблица 1. Константы ингибирования μ-опиоидных рецепторов некоторыми наркотическими анальгетиками
Низкоаффинные лиганды, Ki > 100 нМ | Морфиноподобные лиганды, Ki = 1–100 нМ | Высокоаффинные лиганды, Ki < 1 Нм | |||
Препарат | Ki (nM) МОР | Препарат | Ki (nM МОР | Препарат | Ki (nM) МОР |
трамадол | 1248,6 | гидрокодон | 41,58 | буторфанол | 0,76 |
кодеин | 734,2 | оксикодон | 25,87 | леворфанол | 0,41 |
меперидин | 450,1 | дифеноксилат | 12,37 | оксиморфон | 0,40 |
пропоксифен | 120,2 | алфентанил | 7,39 | гидроморфон | 0,36 |
пентазоцин | 117,8 | метадон | 3,37 | бупренорфин | 0,21 |
налбуфин | 2,11 | суфентанил | 0,13 | ||
фентанил | 1,34 | ||||
морфин | 1,16 | ||||
Таблица составлена авторами по данным источника [7]
При более глубоком рассмотрении прямой связи анальгетической активности опиоидов с силой их связывания с рецептором не просматривается, что подтверждается многочисленными примерами [14]. Так, по данным Е. Boström et al., оксикодон, который более чем в 20 раз слабее связывается с опиоидными рецепторами, чем морфин (табл. 1), проявляет в 1,8 раза большую анальгетическую активность. Такой эффект объясняют его большей концентрацией в целевых тканях мозга, чем в крови, тогда как у морфина, напротив, достижимая концентрация в мозге у крыс в несколько раз ниже, чем в крови [15]. Таким образом, связывание «малых молекул» с опиоидными рецепторами в большинстве случаев является определяющим условием проявления анальгетической активности, но не главным фактором силы и скорости ее проявления (аналогично классическим работам Н.В. Лазарева о проявлении наркотических свойств у углеводородов (неэлектролитов)) [16]. К не менее существенным факторам опасного действия опиоидных анальгетиков можно отнести их свойства, обусловливающие особенности поступления в целевые ткани, органы и мишени в центральной нервной системе через гематоэнцефалический барьер.
Гематоэнцефалический барьер (ГЭБ) выполняет функцию фильтра, через который из кровеносного русла в головной мозг поступают питательные вещества, а в обратном направлении выводятся продукты жизнедеятельности нервной ткани. ГЭБ обеспечивает защиту мозга от циркулирующих в крови микроорганизмов, токсинов, клеточных и гуморальных факторов иммунной системы и ксенобиотиков. Препараты, действующие на мишени в ЦНС, должны обладать способностью проникать через такой биологический барьер. В настоящее время рассматриваются три пути переноса малых молекул в ткани мозга: однонаправленное проникновение в мозг посредством пассивной и облегченной диффузии, обусловленное градиентом концентраций веществ и не требующее дополнительной энергии; активный перенос, требующий энергию (АТФ) для транспорта молекул против градиента концентраций; пассивная диффузия для умеренно липофильных препаратов и механизмы активного транспорта для проникновения через ГЭБ преимущественно полярных молекул [17][18].
Каналом для диффузии органических молекул через клеточные слои гематоэнцефалического барьера выступают мембраны, разделяющие клетки слоев ГЭБ. Для движения через такой канал растворенная в крови молекула должна трансформироваться в ходе многоэтапного физико-химического процесса десольватации и потери заряда для нековалентного взаимодействия с фосфолипидным бислоем по аналогии взаимодействия «лиганд–рецептор», но с меньшими стерическими требованиями. Поэтому «малые молекулы» для проникновения в головной мозг должны обладать набором определенных свойств, таких как оптимальный геометрический размер, ионизационные свойства, гибкость и др. Так, первым параметром, хорошо коррелирующим с анальгетической силой анестетиков и анальгетиков, является липофильность, выражаемая в форме LogP [16], которая сейчас рассматривается как композитный дескриптор, описывающий вклад стерических межмолекулярных взаимодействий и вклад образования водородных связей [17]. Дескрипторами образования водородной связи выступают такие свойства молекул, как поляризуемость, площадь ее полярной поверхности, количество доноров и акцепторов водородных связей или гетероатомов, способных к их образованию. Полярные соединения с высоким потенциалом образования водородных связей, такие как пептиды, плохо проникают через гематоэнцефалический барьер. Поляризуемость лежит в основе ряда физических свойств веществ, включая поверхностное натяжение и растворимость, и характеризуется дипольным моментом. Площадь полярной поверхности определяется как сумма поверхностей всех полярных атомов или молекул, в первую очередь кислорода и азота. Препараты, действующие на ЦНС, имеют меньшие площади полярной поверхности (PSA), чем другие классы лекарственных препаратов, как правило, не более 90 А2. Молекулы с площадью полярной поверхности более 140 А2 плохо проникают через клеточные мембраны.
Значение для диффузии через биологические мембраны имеют геометрические и стерические факторы, выражаемые молекулярным весом, молекулярным объемом и гибкостью молекулы. Для эффективного проникновения через ГЭБ молекулярный вес не должен превышать 400 Да. Молекулярный объем как функция молекулярного веса и структуры учитывает все конформации, доступные молекуле. Наличие у структур более десяти способных к вращению связей коррелирует со снижением их биодоступности и ЦНС-активности. Ограниченная гибкость и компактность молекул, имеющих на своей поверхности меньше полярных групп, способных функционировать в качестве доноров и акцепторов водородных связей, является преимуществом для веществ, действующих на центральную нервную систему, поэтому параметры, описывающие данные свойства, являются существенными факторами, связанными с ЦНС-активностью ксенобиотиков.
Большинство ЦНС-активных веществ имеют атом азота, способный к ионизации в плазме крови. Образующийся при этом заряд протонированной молекулы отрицательно сказывается на ее способности к диффузии через диэлектрические слои фосфолипидных мембран, которые лучше пропускают молекулы в нейтральной форме [18]. Но при этом наличие положительного заряда на атоме азота считается важным фактором для электростатического взаимодействия веществ с ключевыми аминокислотами целевых рецепторов [19]. Степень ионизации молекул в буферной системе крови и ликвора является дуалистическим фактором, как имеющим связь со скоростью поступления активных молекул в ткани ЦНС, так и оказывающим влияние на их способность к связыванию с целевыми мишенями в ЦНС [20][21]. Таким образом, выраженность токсического действия ЦНС-активных веществ, обусловленная эффективностью их поступления в головной мозг, определяется суммой физико-химических факторов, связанных с их химическим строением. Эти факторы могут быть экспериментально оценены или рассчитаны.
Цель работы — изучение взаимосвязи физико-химических свойств и степени опасности представителей одного из классов ЦНС-активных веществ с использованием методов математического анализа и последующим научным обоснованием критериев предварительной оценки опасности наркотических средств.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве модельных объектов исследования сформировали выборку из известных структур наркотических анальгетиков, представленных в таблице 2. Рассматриваемые объекты разделяли на три группы.
- Группа 1 включала когда-либо используемые в медицине наркотические анальгетики [14] с учетом возможных побочных эффектов при их медицинском использовании; они рассматривались как вещества с возможным проявлением опасности.
- Группа 2 включала наркотические вещества, не предназначенные для медицинского применения, но целенаправленно создаваемые для незаконного применения человеком, с учетом информации о случаях массовых отравлений такими веществами [22]; их рассматривали как вещества с возможным проявлением высокой опасности.
- Группа 3 включала высокоактивные препараты, использование которых в медицине требует мер осторожности для их контролируемого дозирования, а также ветеринарные и исследовательские препараты, не предназначенные для употребления человеком [3][14]; их рассматривали как вещества с возможным проявлением чрезвычайно высокой опасности.
Таблица 2. Характеристика обучающей выборки модельных веществ
Группа | Модельные объекты | Источник информации | Количество структур | Оценка модельных объектов |
1 | Медицинские наркотические анальгетики | [7] | 17 | Вещества с риском проявления опасности |
2 | Немедицинские наркотические анальгетики | [22] | 18 | Вещества с риском проявления высокой опасности |
3 | Высокоактивные наркотические анальгетики | [3][14] | 18 | Вещества с риском проявления чрезвычайно высокой опасности |
Общее количество структур в обучающей выборке | 53 | |||
Таблица составлена авторами по данным источников [3][7][14][22]
В качестве потенциальных дескрипторов степени опасности ЦНС-активных ксенобиотиков рассматривали физико-химические свойства, которые могут быть измерены без проведения сложного эксперимента и применения стандартных образцов контролируемых веществ; соответствующие данные представлены в таблице 3. Так, молекулярную массу веществ определяли в ходе хромато-масс-спектрометрического анализа, а величины констант распределения «октанол/вода» и кислотно-основной диссоциации коррелировали с величинами времени удерживания при высокоэффективной жидкостной хроматографии [21][23]. В случае нахождения информации о структурной формуле ксенобиотика в масс-спектрометрических базах данных для определения его физико-химических свойств возможно применение методов компьютерного моделирования с использованием доступных и надежных алгоритмов расчета [24].
Таблица 3. Выбранные физико-химические дескрипторы степени опасности ЦНС-активных ксенобиотиков
Обозначение параметра | Описание параметра | Размерность | Возможность определения при идентификации ксенобиотика |
LogP / LogD7,4 | Коэффициент распределения вещества в системе «октанол/вода» отражает липофильность веществ, способность растворяться в жирах, липидах и других средах при рН 7,0 (LogP) или при физиологическом рН (LogD7,4) при распределении веществ в организме | - | ВЭЖХ экспериментально, расчетными методами |
pKb | Константа основной диссоциации определяет липофильность ионизируемых молекул | - | ВЭЖХ экспериментально, расчетными методами |
MW | Молекулярная масса вещества отражает стерические факторы, влияющие на распределение веществ в организме | Да | ВЭЖХ-МС экспериментально, расчетными методами |
TPSA | Топологическая площадь полярной поверхности (topological polar surface area) — расчетный параметр, связываемый со способностью веществ преодолевать биологические мембраны | Å2 (10–16cm2) | расчетными методами |
Polar | Поляризуемость (polarizability) — физическое свойство веществ приобретать электрический или магнитный дипольный момент во внешнем электромагнитном поле и связываемый со способностью веществ образовывать водородные связи и преодолевать биологические мембраны | Å3 (10–24cm3) | расчетными методами |
Таблица составлена авторами
Расчет значений выбранных физико-химических показателей для обучающей выборки веществ проводили с использованием программного обеспечения ACD/Percepta [24]. Для математического анализа данных применяли методы описательной статистики и метод линейного дискриминантного анализа с использованием программы статистического анализа «Statistica» 6.0. Ранее нами была показана эффективность методов многомерной статистики (хемометрии), в частности линейного дискриминантного анализа и множественной регрессии для расчета по физико-химическим параметрам молекул токсических свойств хладонов [25], для оценки степени воздействия ксенобиотиков и неинвазивной диагностики ряда заболеваний по спектральным характеристикам биопроб1 [26].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сформированная выборка содержала 53 обезличенные записи о расчетных значениях физико-химических свойств модельных ЦНС-активных веществ, описанных в литературных источниках, в соответствии с таблицей 2. Структуры модельных препаратов в данной работе имели значение только для расчета выбранных физико-химических величин, результаты которого приведены в таблице 4.
Таблица 4. Результаты расчета физико-химических дескрипторов
№ п/п | Модельный объект | Номер группы | Рассчитанные физико-химические дескрипторы | |||||
LogD7,4 | LogP | MW | TPSA | Polar | pKb | |||
1 | фентанил | 1 | 3,32 | 4,08 | 336,47 | 23,55 | 41,09 | 8,08 |
2 | бупренорфин | 1 | 3,48 | 4,45 | 467,64 | 62,16 | 52,07 | 8,26 |
3 | метадон | 1 | 3,12 | 4,44 | 309,44 | 20,31 | 38,02 | 8,70 |
4 | леворфанол | 1 | 1,94 | 3,21 | 257,37 | 23,47 | 30,49 | 8,61 |
5 | гидрокодон | 1 | 0,57 | 1,31 | 299,36 | 38,77 | 32,32 | 8,06 |
6 | пентазоцин | 1 | 3,05 | 3,79 | 285,42 | 23,47 | 34,96 | 8,04 |
7 | буторфанол | 1 | 1,96 | 3,52 | 327,46 | 43,7 | 37,64 | 8,85 |
8 | пропоксифен | 1 | 3,97 | 4,85 | 339,47 | 29,54 | 40,58 | 8,23 |
9 | меперидин | 1 | 1,22 | 2,44 | 247.33 | 29.54 | 28,25 | 8.60 |
10 | налбуфин | 1 | 0,98 | 2,03 | 357,44 | 73,16 | 38,11 | 8,35 |
11 | трамадол | 1 | 0,71 | 2,54 | 263,37 | 32,7 | 30,90 | 9,24 |
12 | гидроморфон® | 1 | 0,53 | 1,29 | 285,33 | 49,77 | 30,41 | 8,03 |
13 | кодеин | 1 | 0,34 | 1,21 | 299,36 | 41,93 | 32,84 | 8,21 |
14 | морфин | 1 | -0,18 | 0,69 | 285,33 | 52,93 | 30,93 | 8,16 |
15 | оксикодон | 1 | 0,16 | 0,91 | 315,36 | 59,00 | 32,95 | 8,06 |
16 | дифеноксилат | 1 | 5,42 | 5,72 | 452,58 | 53,33 | 52,93 | 7,40 |
17 | оксиморфон | 1 | 0,25 | 1,00 | 301,33 | 70,00 | 31,03 | 8,03 |
18 | 4-фтор-фентанил | 2 | 3,11 | 3,87 | 354,46 | 23,55 | 41,09 | 8,07 |
19 | фуранил-фентанил | 2 | 3,35 | 4,12 | 374,47 | 36,69 | 44,25 | 8,08 |
20 | 3-метил-тиофентанил | 2 | 2,96 | 4,09 | 356,52 | 51,79 | 42,32 | 8,50 |
21 | β-гидрокси-тиофентанил | 2 | 2,38 | 2,77 | 358,49 | 72,02 | 41,06 | 7,58 |
22 | β-гидрокси-фентанил | 2 | 2,87 | 3,07 | 352,47 | 43,78 | 41,70 | 7,15 |
23 | α-метил-тиофентанил | 2 | 3,15 | 4,04 | 356,52 | 51,79 | 42,25 | 8,23 |
24 | α-метил-фентанил | 2 | 2,75 | 4,09 | 350,49 | 23,55 | 42,89 | 8,73 |
25 | асетил-α-метилфентанил | 2 | 2,56 | 3,91 | 336,47 | 23,55 | 41,05 | 8,73 |
26 | 3-метил-бутирилфентанил | 2 | 4,21 | 4,98 | 364,52 | 23,55 | 44,79 | 8,08 |
27 | ремифентанил | 2 | 1,77 | 1,85 | 376,44 | 76,15 | 40,06 | 6,70 |
28 | 4-метокси-бутирилфентанил | 2 | 3,55 | 4,33 | 380,52 | 32,78 | 45,58 | 8,10 |
29 | тиофентанил | 2 | 2,66 | 3,79 | 342,49 | 51,79 | 40,45 | 8,50 |
30 | 4-фтор-бутирилфентанил | 2 | 3,69 | 4,44 | 368,48 | 23,55 | 42,93 | 8,07 |
31 | 3-метилфентаил | 2 | 3,36 | 4,13 | 350,49 | 23,55 | 42,96 | 8,08 |
32 | акрилфентанил | 2 | 2,99 | 3,75 | 334,45 | 23,55 | 40,98 | 8,08 |
33 | ацетилфентанил | 2 | 2,98 | 3,74 | 322,44 | 23,55 | 39,25 | 8,08 |
34 | алфентанил | 2 | 1,99 | 2,04 | 416,51 | 81,05 | 46,25 | 6,53 |
35 | суфентанил (СФ) | 2 | 2,91 | 3,77 | 386,55 | 61,02 | 44,80 | 8,20 |
36 | пиррольный аналог СФ № 1 | 3 | 2,33 | 2,55 | 383,48 | 54,78 | 44,16 | 7,19 |
37 | эторфин | 3 | 2,30 | 3,09 | 411,53 | 62,16 | 45,51 | 8,07 |
38 | гетероцикл, аналог КФ № 1 | 3 | 3,05 | 3,10 | 506,59 | 90,47 | 54,93 | 6,43 |
39 | гетероцикл, аналог СФ № 1 | 3 | 1,80 | 2,67 | 462,58 | 65,45 | 53,43 | 8,20 |
40 | гетероцикл, аналог СФ № 2 | 3 | 3,14 | 3,26 | 449,54 | 70,16 | 49,87 | 6,86 |
41 | гетероцикл, аналог КФ № 2 | 3 | 2,93 | 2,98 | 463,52 | 87,23 | 49,82 | 6,43 |
42 | гетероцикл, аналог СФ № 3 | 3 | 2,59 | 2,81 | 435,55 | 53,09 | 49,82 | 7,23 |
43 | гетероцикл, аналог КФ № 3 | 3 | 2,61 | 2,70 | 449,54 | 70,16 | 49,77 | 6,79 |
44 | гетероцикл, аналог КФ № 4 | 3 | 2,53 | 2,65 | 483,60 | 87,23 | 52,76 | 6,90 |
45 | пиррольный аналог КФ № 1 | 3 | 0,72 | 1,16 | 444,48 | 142,52 | 46,55 | 7,64 |
46 | пиррольный аналог СФ № 2 | 3 | 1,59 | 2,46 | 370,48 | 50,6 | 43,21 | 8,20 |
47 | пиррольный аналог КФ № 2 | 3 | 1,91 | 2,12 | 384,47 | 67,67 | 43,55 | 7,19 |
48 | гетероцикл, аналог КФ № 5 | 3 | 2,26 | 2,86 | 415,55 | 90,98 | 45,91 | 7,86 |
49 | охмефентанил | 3 | 3,04 | 3,24 | 366,49 | 43,78 | 43,57 | 7,15 |
50 | 3-тиофен-КФ | 3 | 3,01 | 3,61 | 400,53 | 78,09 | 44,75 | 7,86 |
51 | винил-КФ | 3 | 3,19 | 3,51 | 392,49 | 49,85 | 45,29 | 7,44 |
52 | лофентанил | 3 | 3,96 | 4,29 | 408,53 | 49,85 | 47,26 | 7,44 |
53 | карфентанил (КФ) | 3 | 3,17 | 3,49 | 394,50 | 49,85 | 45,39 | 7,44 |
Таблица составлена авторами по собственным данным
Средние значения величин физико-химических дескрипторов, использованных для построения регрессионных моделей и определяющих пределы их применимости, приведены в таблице 5.
Таблица 5. Средние значения величин дескрипторов по группам
Группа веществ | Рассчитанные физико-химические дескрипторы | |||||
LogD7,4 | LogP | MW | TPSA | Polar | pKb | |
Группа 1 | 1,46 | 2,49 | 300,7 | 40,79 | 34,04 | 8,35 |
Группа 2 | 3,16 | 4,08 | 355,6 | 33,88 | 42,55 | 8,25 |
Группа 3 | 2,51 | 2,83 | 414,9 | 69,86 | 46,58 | 7,28 |
Все вещества | 2,38 | 3,07 | 365,0 | 51,43 | 41,78 | 7,86 |
Таблица составлена авторами по собственным данным
Средние значения физико-химических величин, представленные в таблице 5, показали, что наибольшей липофильностью (LogP) обладают наркотические вещества группы 2. В то же время соотношение усредненных значений показателей липофильности групп препаратов в воде и плазме крови LogP и LogD7,4 показывает, что липофильность групп 1 и 2 существенно снижается при физиологическом рН. Высокоактивные вещества группы 3, имеющие меньшую величину константы основной ионизации, наоборот, демонстрируют высокую липофильность не только в воде, но и в плазме крови, что подчеркивает связь липофильности со способностью веществ к поступлению в ткани ЦНС при перераспределении в системе «кровь-мозг».
Для поиска физико-химических критериев, позволяющих проводить оценку степени опасности ЦНС-активных веществ, рассматривали коэффициенты парной корреляции между физико-химическими дескрипторами, приведенные в таблице 6. Как следует из таблицы 6, большинство дескрипторов слабо коррелируют друг с другом. Наиболее сильная корреляция наблюдается между величинами LogD7,4 и LogP, поскольку это очень близкие по природе параметры. Различие между ними связано с величинами рН, при которых они определяются, и обусловлено степенью ионизации молекул веществ при этих рН. Об этом говорит очень сильная корреляция (R = 0,97) между вычисленной величиной (LogD7,4 – LogP) и величиной pKb.
Таблица 6. Коэффициенты корреляции между физико-химическими дескрипторами
LogD7,4 | LogP | MW | TPSA | Polar | pKb | LogP — LogD7,4 | |
LogD7,4 | 1,00 | 0,92 | 0,36 | -0,31 | 0,58 | -0,18 | -0,21 |
LogP | 0,92 | 1,00 | 0,10 | -0,52 | 0,35 | 0,20 | 0,18 |
MW | 0,36 | 0,10 | 1,00 | 0,64 | 0,96 | -0,70 | -0,68 |
TPSA | -0,31 | -0,52 | 0,64 | 1,00 | 0,43 | -0,56 | -0,53 |
Polar | 0,58 | 0,35 | 0,96 | 0,43 | 1,00 | -0,60 | -0,59 |
pKb | -0,18 | 0,20 | -0,70 | -0,56 | -0,60 | 1,00 | 0,97 |
LogP – LogD7,4 | -0,21 | 0,18 | -0,68 | -0,53 | -0,59 | 0,97 | 1,00 |
Таблица составлена авторами по собственным данным
Сильная корреляция также наблюдается между величинами MW и Polar, что, вероятно, обусловлено пропорциональным увеличением интегральной поляризуемости молекулы, связанной с ростом числа поляризуемых фрагментов при возрастании массы. Рассмотрение полученных результатов корреляций между физико-химическими свойствами в обучающих группах ЦНС-активных веществ показало, что рассмотренные величины сами по себе и в парах не позволяют однозначно проводить распределение веществ к одной из трех групп опасных веществ.
Для анализа всего сформированного массива данных физико-химических свойств модельных веществ с целью выявления их связи со степенью их опасного действия на организм использовали дискриминантный анализ. Дискриминантный анализ как раздел многомерного статистического анализа включает статистические методы классификации многомерных наблюдений в ситуации, когда исследователь a priori обладает так называемыми обучающими выборками (классификация с обучением). Дискриминантный анализ позволяет на основе измерения различных характеристик (признаков, дескрипторов) объекта классифицировать его, т.е. оптимальным способом отнести к одной из нескольких групп (классов). С помощью дискриминантного анализа определяли отличия совокупностей по среднему какой-либо переменной (или линейной комбинации переменных) для последующего использования этой переменной или линейной комбинации переменных в качестве критерия принадлежности новых их членов к той или иной группе.
Полученный массив данных подвергали процедуре линейного дискриминантного анализа (ЛДА) с пошаговым включением переменных. Как группирующая переменная выступала категория «Группа», а как независимые переменные — все остальные дескрипторы. Предварительно массив данных разбивался на 2 части: одна часть использовалась в качестве «обучающей» для построения математической модели классификации, а вторая часть выступала как контрольная для проверки полученной модели. В качестве контроля использовались последние три соединения в списке каждой группы.
В процессе ЛДА совокупности данных с пошаговым включением переменных определяли дискриминантные функции. На каждом шаге просматривали все переменные и находили ту из них, которая вносила наибольший вклад в различие между совокупностями. Эта переменная включалась в модель на данном шаге, и далее осуществляли переход к следующему шагу. Режим пошагового включения переменных позволял обойтись минимумом вовлеченных в анализ переменных. Дискриминантные функции, выражающие максимальную неоднородность групп между собой, представляли собой линейные комбинации переменных, оптимизированные так, чтобы наиболее эффективно дискриминировать группы между собой. Так как все дискриминантные функции ортогональны, они в совокупности образовывали фазовое пространство дискриминантных функций — n-мерную декартову систему координат, где n — число статистически значимых дискриминантных функций.
Дискриминантные функции являлись едиными для всей совокупности данных, вовлеченных в ЛДА, но значения корней каждой из дискриминантных функций являлись строго специфичными для каждого вещества. Корни дискриминантных функций для каждого вещества рассчитывали путем матричного умножения вектора дескрипторов этого вещества на матрицу коэффициентов дискриминантных функций, и таким образом исходная матрица данных преобразовывалась в матрицу, содержащую вместо дескрипторов значения величин корней дискриминантных функций. Уникальные для каждого соединения значения корней, по сути, представляли собой координаты точек соответствующих соединений в фазовом пространстве дискриминантных функций. Средние значения этих корней для каждой группы определяли координаты центров групп (так называемые центроиды группы). Именно значения величин корней дискриминантных функций или координат объектов (веществ) в фазовом пространстве дискриминантных функций позволили провести классификацию объектов, т.е. соотнести конкретное вещество с какой-либо из групп по близости точки к центроиду группы.
В результате проведенного ЛДА обучающей выборки матрицы данных с дескрипторами для трех групп веществ получены две статистически значимые дискриминантные функции dF1 и dF2, полностью описывающие массив данных, из которых функция dF1 описывает 88% информации, содержащейся в данных, представленных в таблице 7.
Таблица 7. Коэффициенты дискриминантных функций для групп модельных ксенобиотиков
Дескриптор | Нестандартизованные | Стандартизованные | ||
dF1 | dF2 | dF1 | dF2 | |
MW | 0,051 | 0,028 | 1,724 | 0,966 |
LogP | 2,599 | -1,376 | 2,190 | -1,159 |
LogD7,4 | -1,943 | 0,845 | -1,712 | 0,745 |
Polar | -0,643 | -0,359 | -2,329 | -1,300 |
TPSA | -0,032 | 0,000 | -0,611 | -0,005 |
Constant | 6,638 | 7,010 | 0 | 0 |
Eigenval | 4,090 | 0,562 | 4,090 | 0,562 |
Cum Prop | 0,879 | 1,000 | 0,879 | 1,000 |
Таблица составлена авторами по собственным данным
Таким образом, полученные дискриминантные функции представляют собой следующие линейные комбинации значений дескрипторов:
dF1 = 0,051×MW + 2,599×LogP – 1,943×LogD7,4 – 0,643×
Polar – 0,032×TPSA + 6,638
dF2 = 0,028×MW – 1,376×LogP – 0,845×LogD7,4 – 0,359×
Polar +7,010
Относительно близкие друг к другу по абсолютной величине и далекие от нуля стандартизованные коэффициенты для каждого дескриптора для функции dF1 свидетельствуют о важном вкладе всех без исключения рассмотренных физико-химических показателей в дискриминацию, выполняемую этой наиболее статистически значимой дискриминантной функцией. В принципе то же относится и к функции dF2, за исключением оказавшегося малозначимым показателя TPSA (топологическая площадь полярной поверхности).
Для всех модельных веществ из таблицы 4, включая контрольные, были рассчитаны значения корней дискриминантных функций dF1 и dF2. Значения корней, уникальные для каждого соединения, являются координатами точек соответствующих соединений в фазовом пространстве дискриминантных функций, представляющем собой плоскую систему координат с осями dF1 и dF2. На рисунке 1 показано расположение точек, соответствующее конкретным образцам веществ из трех групп, в фазовом пространстве функций dF1 и dF2.
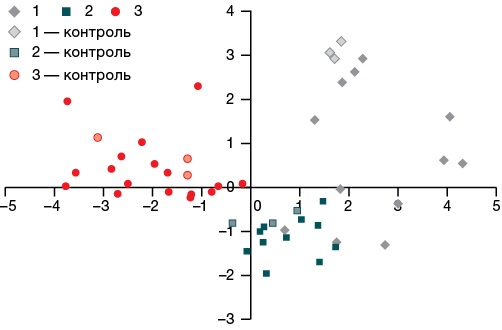
Рисунок подготовлен авторами по собственным данным
Рис. 1. Значения корней дискриминантных функций dF1 и dF2 для групп 1, 2 и 3 модельных химических ксенобиотиков, включая контрольные соединения
Из рисунка 1 видно, что все группы хорошо отделяются друг от друга, все контрольные точки определялись в своих группах.
Для всех трех групп модельных веществ были найдены средние значения корней дискриминантных функций dF1 и dF2, которые являются координатами центроидов групп в фазовом пространстве функций dF1 и dF2 (табл. 8 и 9). Полученные дискриминантные функции, согласно данным классификационной матрицы (табл. 9), обладают высокой дискриминирующей мощностью, позволяя достаточно четко разделить группы рассматриваемых веществ между собой. В таблице 9 приведены результаты классификации методом ЛДА как для веществ обучающей выборки, так и для всех веществ, включая контрольные.
Таблица 8. Средние значения корней дискриминантных функций dF1 и dF2 для групп модельных ксенобиотиков
Группа веществ | dF1 | dF2 |
Группа 1 | 2,485 ± 1,225 | 0,675 ± 1,368 |
Группа 2 | 0,797 ± 0,716 | –1,176 ± 0,485 |
Группа 3 | 0,797 ± 0,716 | 0,255 ± 0,809 |
Таблица подготовлена авторами по собственным данным
Таблица 9. Матрица классификации, полученная для веществ обучающей выборки и для всех веществ, включая контрольные
Только обучающая выборка | Группа | % правильной классификации | Группа 1 | Группа 2 | Группа 3 |
1 | 75 | 9 | 3 | 0 | |
2 | 100 | 0 | 11 | 0 | |
3 | 100 | 0 | 0 | 19 | |
Итого | 92,9 | 9 | 14 | 19 | |
Все вещества | Группа | % правильной классификации | Группа 1 | Группа 2 | Группа 3 |
1 | 80 | 12 | 3 | 0 | |
2 | 100 | 0 | 14 | 0 | |
3 | 100 | 0 | 0 | 22 | |
Итого | 94,1 | 12 | 17 | 22 |
Таблица подготовлена авторами по собственным данным
В целом вещества были классифицированы правильно, за исключением веществ № 1, 2 и 8 из группы 1, которые уже на первых шагах ЛДА были четко отнесены к группе № 2. Это говорит о том, что математическая модель на основе физико-химических свойств, классифицирующая вещества из класса опиоидных анальгетиков по группам, построена удовлетворительно.
Таким образом, для определения принадлежности новых соединений, не входящих в исследовательский список, к одной из трех групп, необходимо:
- определить значения величин всех дескрипторов;
- рассчитать величины корней дискриминантных функций dF1 и dF2, соответствующие координатам точки данного соединения в фазовом пространстве функций dF1 и dF2;
- выбрать наименьшее расстояние от данной точки до центров каждой из групп (расстояние находится по правилам геометрии по формуле Пифагора), которое и будет указывать на принадлежность к этой группе.
Может сложиться так, что точка не будет принадлежать ни к одной из трех групп, если будет находиться относительно далеко от всех центроидов.
Для прямого вычисления показателя классификации с целью отнесения оцениваемых соединений к одной из трех групп можно использовать функции классификации CF1–CF3, предназначенные для определения, к какой группе наиболее вероятно может быть отнесен ксенобиотик. Имеется столько же функций классификации, сколько групп:
СF1 = 0,276×MW + 22,406×LogP – 23,622×LogD7,4 + 0,906×
Polar – 0,160×TPSA – 66,585
СF2 = 0,137×MW + 20,566×LogP – 21,906× LogD7,4 + 2,657×
Polar – 0,105×TPSA – 88,554
СF3 = 0,034×MW + 11,248×LogP – 15,200×LogD7,4 + 3,963×
Polar + 0,013×TPSA – 97,835
Для каждого нового либо известного соединения рассчитываются все три функции, и соединение относят к той группе, для которой классификационная функция имеет наибольшее значение.
При выявлении новых ЦНС-активных веществ и ксенобиотиков на основании предложенных физико-химических критериев они могут быть отнесены к одной из трех групп: вещества с риском проявления опасности, вещества с риском проявления высокой опасности и вещества с риском проявления чрезвычайно высокой опасности.
Оценку работоспособности созданной математической модели проводили с помощью классификации веществ обучающей выборки. Полученные результаты классификации веществ, отличные от изначального отнесения к группам в обучающей выборке, приведены в таблице 10.
Таблица 10. Результаты классификации веществ, отличные от обучающей выборки
№ п/п | Модельный объект | Изначальная группа | Результат расчета классификационных функций | Определенная группа | ||
СF1 | СF2 | СF3 | ||||
1 | фентанил | 1 | 72,67 | 75,38 | 72,13 | 2 |
2 | бупренорфин | 1 | 117,08 | 122,51 | 122,32 | 2 |
3 | пропоксифен | 1 | 74,24 | 75,65 | 69,24 | 2 |
4 | дифеноксилат | 1 | 97,91 | 107,42 | 109,98 | 3 |
5 | β-гидрокси-тиофентанил | 2 | 64,01 | 67,06 | 73,06 | 3 |
6 | β-гидрокси-фентанил | 2 | 62,37 | 66,13 | 70,84 | 3 |
7 | ремифентанил | 2 | 61,15 | 60,83 | 68,69 | 3 |
8 | алфентанил | 2 | 76,10 | 81,34 | 93,42 | 3 |
9 | суфентанил | 2 | 86,61 | 90,79 | 91,79 | 3 |
Таблица подготовлена авторами по собственным данным
По результатам проведенной классификации для девяти из пятидесяти трех модельных веществ была спрогнозирована потенциально бóльшая опасность, чем предполагалось изначально. Работоспособность предложенной модели оценки потенциальной опасности ЦНС-активных веществ продемонстрировал пример лекарственного препарата пропоксифен: изначально его отнесли к группе 1, но в результате анализа он был четко распределен в группу 2 — веществ с риском проявления высокой опасности. И действительно, данный препарат начиная с 2009 года в ряде стран обозначен как опасный и снят с производства из-за высокого риска наступления смертельных передозировок и сердечных аритмий2. Приведенные в таблице 10 результаты также показывают, что отдельные лекарственные препараты и выявляемые в незаконном обороте вещества могут нести в себе определенные риски при неконтролируемом применении, что согласуется с литературными данными об их токсическом действии [22].
Лекарственные препараты дифеноксилат и бупренорфин, отнесенные по итогу классификации в группы 2 и 3 соответственно, могут рассматриваться как фармакологические исключения. Дифеноксилат используют при желудочно-кишечных расстройствах, и его действие направлено на опиоидные рецепторы, расположенные в кишечнике. Поэтому чрезмерно высокая липофильность дифеноксилата препятствует его действию на ЦНС [23]. Бупренорфин, относящийся к семейству высокоактивных «соединений Бентли», — мощное лекарственное средство, которое могло быть так же опасно, как и родственный ему эторфин. Но фармакологически он проявляет свойства агониста-антагониста опиоидных рецепторов и не представляет выраженной опасности для жизни человека. Полученные результаты подчеркивают, что разработанная модель, основанная на физико-химических свойствах веществ, не может учитывать особенности их влияния на целевые мишени в центральной нервной системе, такие как рецепторы, ферменты, и в получаемых решениях возможны ложноположительные и ложноотрицательные результаты. В то же время верное отнесение большинства модельных соединений к группам по степени их опасности показывает определяющее влияние физико-химических свойств на токсическое действие наркотических анальгетиков.
ЗАКЛЮЧЕНИЕ
На примере представителей одного из классов ЦНС-активных веществ показана связь потенциальной опасности наркотических анальгетиков и их физико-химических свойств, определяющих перераспределение таких веществ из центрального кровотока в ткани центральной нервной системы. Молекулярная масса, липофильность, способность к кислотно-основной диссоциации, полярность и поляризуемость ЦНС-активных веществ влияют на особенности их токсического действия в не меньшей степени, чем способность к связыванию с целевыми рецепторами. Поэтому такие физико-химические свойства могут выступать критериями, обусловливающими степень опасности ЦНС-активных ксенобиотиков.
Методом линейного дискриминантного анализа с пошаговым включением переменных обучающей выборки представителей одного из классов ЦНС-активных веществ — опиоидных анальгетиков, разделенных на три группы по степени опасности, построена математическая модель классификации психоактивных веществ на основании их физико-химических свойств. Модель включала в себя две дискриминантные функции dF1 и dF2 как линейные комбинации значений физико-химических дескрипторов и позволила достаточно полно разделить рассмотренные группы наркотических анальгетиков между собой по критерию потенциальной опасности. Для отнесения новых соединений к той или иной группе вычислены функции классификации CF1–CF3.
Работоспособность предложенной математической модели оценки степени опасности ЦНС-активных ксенобиотиков продемонстрирована на примере классификации обучающей выборки веществ. Результат показал правильное отнесение для сорока четырех веществ из пятидесяти трех, для семи веществ отнесение к группам было уточнено по итогам классификации, и два вещества оказались фармакологическими исключениями.
Вычисленные классификационные функции можно легко встроить в виде формул в табличные редакторы или специализированное программное обеспечение и базы данных для автоматической классификации новых и известных соединений. При условии определения количественного выражения силы и быстроты действия на организм опиоидных анальгетиков и других параметров молекул вполне возможно проведение математического анализа с целью установления количественной связи характеристик их биологической активности и структуры QSAR (quantitative structure-activity relationship — количественных соотношений «структура-активность»). Существенный интерес представляет применимость полученных в исследовании результатов к другим классам ЦНС-активных веществ.
Без сомнения, при всем совершенстве любых предиктивных методов их результаты требуют подтверждения традиционными токсикологическими методами, но показанная возможность оперативного выявления потенциально опасных ксенобиотиков будет полезна для профилактики массовых отравлений при попадании таких ЦНС-активных веществ в незаконный оборот.
1. Рембовский ВР, Радилов АС, Дулов СА, Николаев АИ. Оценка степени воздействия ксенобиотиков по спектральным характеристикам водно-белковых комплексов плазмы крови. Методические рекомендации 12.11. М.: ФМБА; 2012.
2. Gandey A. Physicians Say Good Riddance to Worst Drug in History. 2011. https://www.medscape.com/viewarticle/736718?src=mp&spon=25&form=fpf (дата обращения: 16.01.2024).
Список литературы
1. Заикина ОЛ, Лодягин АН, Шилов ВВ. Гамма-оксибутират и производные фентанила: химико-токсикологическое подтверждение отравлений. Судебная медицина. 2016;2(2):112–3. EDN: YHZMBF
2. Stanley TH, Egan TD, Aken HVan. A. Tribute to Dr. Paul A. J. Janssen: Entrepreneur Extraordinaire, Innovative Scientist, and Significant Contributor to Anesthesiology. Anesth. Analg. 2008;106(2):451–62.https://doi.org/10.1213/ane.0b013e3181605add
3. Lindsay CD, Riches JR, Timperley CM. Chemical Warfare Toxicology. Management of Poisoning Chemical Defence Against Fentanyls. The Royal Society of Chemistry. 2016;259–313. https://doi.org/10.1039/9781782628071-00259
4. Соснов АВ, Семченко ФМ, Тохмахчи ВН, Соснова АА и др. Критерии выбора соединений для разработки сильнодействующих анальгетиков и других лекарств центрального действия. Разработка и регистрация лекарственных средств. 2018;3(24):42–56. EDN: OYVYND
5. Kelly E, Sutcliffe K., Cavallo D, Ramos-Gonzalez N, Alhosan N, et al. The anomalous pharmacology of fentanyl. Br J Pharmacol. 2023;180(7):797–812. https://doi.org/10.1111/bph.15573
6. Соснов АВ, Голубев СС, Пункевич БС, Садовников СВ, Загребин ЕМ и др. Стандартные образцы контролируемых сильнодействующих компонентов препаратов анальгетиков. Разработка и регистрация лекарственных средств. 2016;1(14):216–23. EDN: WBODLX
7. Volpe DA, McMahon Tobin GA, Mellon RD et al. Uniform assessment and ranking of opioid μ receptor binding constants for selected opioid drugs. Regul Toxicol Pharmacol. 2011;59(3):385–90. https://doi.org/10.1016/j.yrtph.2010.12.007
8. Уйба ВВ, Криворотов ДВ, Забелин МВ, Радилов АС, Рембовский ВР и др. Антагонисты опиоидных рецепторов. От настоящего к будущему. Медицина экстремальных ситуаций. 2018;20(3):356–70. EDN: YPHKPZ
9. Skolnick P. Treatment of overdose in the synthetic opioid era. Pharmacol. Ther. 2022;233:108019. https://doi.org/10.1016/j.pharmthera.2021.108019
10. Головко АИ, Ивницкий ЮЮ, Рейнюк ВЛ и др. Причины высокой летальности при передозировках наркотических средств из группы синтетических опиоидов Medline.ru. Российский биомедицинский журнал. 2020;21:141–56. EDN: CMQERC
11. Hill R, Santhakumar R, Dewey W, Kelly E, Henderson G. Fentanyl depression of respiration: Comparison with heroin and morphine. Br J Pharmacol. 2020;177(2):254–66. https://doi.org/10.1111/bph.14860
12. Bachmutsky I, Wei XP, Kish E, Yackle K. Opioids depress breathing through two small brainstem sites. Elife. 2020;19;9:e52694. https://doi.org/10.7554/eLife.52694
13. Vardanyan RS, Hruby VJ. Vardanyan RS, Hruby VJ. Fentanyl-related compounds and derivatives: current status and future prospects for pharmaceutical applications. Future Med Chem. 2014;6(4):385–412. https://doi.org/10.4155/fmc.13.215
14. Bagley JR, Thomas SA, Rudo FG, Spencer HK, Doorley BM et al. New 1-(heterocyclylalkyl)-4-(propionanilido)-4-piperidinyl methyl ester and methylene methyl ether analgesics. J Med Chem. 1991;34(2):827–41. https://doi.org/10.1021/jm00106a051
15. Boström E, Hammarlund-Udenaes M, Simonsson US. Blood-brain barrier transport helps to explain discrepancies in in vivo potency between oxycodone and morphine. Anesthesiology. 2008;108(3):495–505. https://doi.org/10.1097/ALN.0b013e318164cf9e
16. Лазарев НВ. Наркотики. Л.: Ин-т гигиены труда и профзаболеваний Ленгорздравотдела. 1940.
17. Раевский ОА, Солодова СЛ, Раевская ОЕ, Манхольд Р. Количественная взаимосвязь структуры органических соединений и их способности проникать через гематоэнцефалический барьер. Химико-фармацевтический журнал. 2012;46(3):3–8. https://doi.org/10.30906/0023-1134-2012-46-3-3-8
18. Pajouhesh H, Lenz GR. Medicinal chemical properties of successful central nervous system drugs. NeuroRx. 2005;2(4):541–53. https://doi.org/10.1602/neurorx.2.4.541
19. Noha SM, Schmidhammer H, Spetea M. Molecular docking, molecular dynamics, and structure-activity relationship explorations of 14-oxygenated N-methylmorphinan-6-ones as potent μ-opioid receptor agonists. ACS Chem Neurosci. 2017;8(6):1327–37. https://doi.org/10.1021/acschemneuro.6b00460
20. Sugano K, Kansy M, Artursson P, Avdeef A, Bendels S, et al. Coexistence of passive and carrier-mediated processes in drug transport. Nat Rev Drug Discov. 2010;9(8):597–614. https://doi.org/10.1038/nrd3187
21. Šegan S, Jevtić I, Tosti T, Penjišević J, Šukalović V et al. Determination of lipophilicity and ionization of fentanyl and its 3-substituted analogs by reversed-phase thin-layer chromatography. J Chromatogr B Analyt Technol Biomed Life Sci. 2022;1211:123481. https://doi.org/10.1016/j.jchromb.2022.12348
22. Suzuki J, El-Haddad S. A review: Fentanyl and non-pharmaceutical fentanyls. Drug Alcohol Depend. 2017;171:107–16. https://doi.org/10.1016/j.drugalcdep.2016.11.033
23. Криворотов ДВ, Кочура ДМ, Дулов СА, Радилов АС. Экспериментальное сравнение липофильности антагонистов опиоидов. Токсикологический вестник. 2022;30(3):149–57. https://doi.org/10.47470/0869-7922-2022-30-3-149-157
24. Janicka M, Janicka M, Sztanke M, Sztanke K. Reversed-phase liquid chromatography with octadecylsilyl, immobilized artificial membrane and cholesterol columns in correlation studies with in silico biological descriptors of newly synthesized antiproliferative and analgesic active compounds. J Chromatogr A. 2013;1318:92–101. https://doi.org/10.1016/j.chroma.2013.09.060
25. Николаев АИ, Шкаева ИЕ, Солнцева СА, Никулина ОС. Расчет токсических свойств галогензамещенных углеводородов нормального строения по физико-химическим параметрам молекулы. Химическая промышленность. 2019;96(4):205–11. EDN: TOOJXY
26. Николаев АИ, Антонова ИН, Донская ОС, Владимирова ЛГ. Алгоритм анализа ЛК-спектров для неинвазивной диагностики заболеваний по образцам ротоглоточного смыва. Медицинский алфавит. 2019;4(35):23–7. https://doi.org/10.33667/2078-5631-2019-4-35(410)-23-27
Об авторах
Д. В. КриворотовРоссия
Криворотов Денис Викторович - канд. хим. наук.
Ленинградская область
А. И. Николаев
Россия
Николаев Анатолий Иванович - канд. хим. наук.
Ленинградская область
А. С. Радилов
Россия
Радилов Андрей Станиславович - д-р мед. наук, профессор.
Ленинградская область
В. Р. Рембовский
Россия
Рембовский Владимир Романович - д-р мед. наук, профессор
Ленинградская область
В. А. Кузнецов
Россия
Кузнецов Виктор Анатольевич - канд. хим. наук.
Ленинградская область
Дополнительные файлы
Рецензия
Для цитирования:
Криворотов Д.В., Николаев А.И., Радилов А.С., Рембовский В.Р., Кузнецов В.А. Физико-химические критерии оценки опасности ЦНС-активных ксенобиотиков. Медицина экстремальных ситуаций. 2025;27(1):15-25. https://doi.org/10.47183/mes.2025-265
For citation:
Krivorotov D.V., Nikolaev A.I., Radilov A.S., Rembovsky V.R., Kuznetsov V.A. Physical and chemical criteria for hazard assessment of CNS-active xenobiotics. Extreme Medicine. 2025;27(1):15-25. https://doi.org/10.47183/mes.2025-265

















