Перейти к:
Функциональная электрическая стимуляция при ходьбе в раннем восстановительном периоде ишемического инсульта
https://doi.org/10.47183/mes.2025-268
Аннотация
Введение. Одним из осложнений острых нарушений мозгового кровообращения является нарушение функции ходьбы, которое биомеханически характеризуется снижением скорости и асимметрией пространственно-временных и кинематических параметров. Для коррекции данных изменений возможно применение функциональной электростимуляции мышц (ФЭС), однако в имеющейся литературе данный метод применяется преимущественно в позднем восстановительном периоде инсульта.
Цель. Оценка возможности применения многоканальной ФЭС у пациентов в раннем восстановительном периоде инсульта для восстановления функции ходьбы.
Материалы и методы. В исследовании приняли участие 11 пациентов (2 женщины и 9 мужчин) в возрасте от 46 до 66 лет в раннем восстановительном периоде ишемического инсульта (количество дней после инсульта составило 69,1 ± 52,0 дня) и 34 здоровых испытуемых (18 женщин и 16 мужчин) — контрольная группа. Изучали: мышечную силу нижних конечностей по Medical Research Council Weakness Scale, мышечный тонус нижних конечностей по модифицированной шкале Ашфорт; функцию ходьбы оценивали по индексу динамической походки, индексу Хаузера, тестам «Встань и иди» и десятиметровой ходьбы; а также исследовали функцию стереотипа походки (d770), преодоление препятствий (d4551) и ходьбу на короткие расстояния (d4500). Всем пациентам проведен курс ФЭС (среднее количество — 10,8 процедуры). Клиническое и биомеханическое исследования выполнены до и по окончании курса ФЭС. Биомеханическое исследование ходьбы проведено с помощью комплекса программного обеспечения «Стэдис» («Нейрософт»). Статистическая обработка данных выполнена в программе Statistica 12.0.
Результаты. Клиническая оценка показала незначительное, но достоверное функциональное улучшение по результатам тестирования после проведенного лечения. Отмечено увеличение значений индекса динамической походки и теста 10-метровой ходьбы, уменьшение индекса Хаузера и времени выполнения теста «Встань и иди», а также по доменам (d770) и (d4500). Функция ходьбы улучшилась. Возросли значения скорости ходьбы (p < 0,05), увеличился период двойной опоры на паретичной стороне (p < 0,05), возросла активность m. gastrocnemius на паретичной и здоровой сторонах (p < 0,05).
Выводы. Обнаруженные изменения функции ходьбы были типичны для гемипареза. В ходе проведения курса ФЭС у пациентов не было выявлено негативных реакций на проводимую стимуляцию. Клинические и биомеханические функции ходьбы пациентов за время курса ФЭС изменилась незначительно, но динамика их положительная. Из биомеханических параметров достоверно возросла амплитуда икроножной мышцы на стороне пареза, что является одним из целевых параметров ФЭС. Проведение коротких курсов многоканальной ФЭС данной категории больных возможно, но недостаточно эффективно. Повышение эффективности ФЭС требует дальнейшего изучения.
Ключевые слова
Для цитирования:
Скворцов Д.В., Гребенкина Н.В., Климов Л.В., Кауркин С.Н., Булатова М.А., Иванова Г.Е. Функциональная электрическая стимуляция при ходьбе в раннем восстановительном периоде ишемического инсульта. Медицина экстремальных ситуаций. 2025;27(3):417-428. https://doi.org/10.47183/mes.2025-268
For citation:
Skvortsov D.V., Grebenkina N.V., Klimov L.V., Kaurkin S.N., Bulatova M.A., Ivanova G.E. Functional electrical stimulation for gait correction in the early recovery phase after ischemic stroke. Extreme Medicine. 2025;27(3):417-428. https://doi.org/10.47183/mes.2025-268
ВВЕДЕНИЕ
Острое нарушение мозгового кровообращения (ОНМК) является второй по значимости причиной смерти и одной из основных причин инвалидности в мире [1, 2]. Во всем мире отмечено как увеличение частоты инсультов, так и расходов, связанных с необходимыми реабилитационными мероприятиями, а также в связи с тем, что значительная часть перенесших ОНМК имеет стойкую утрату здоровья [3].
Выделяют следующие осложнения ОНМК: двигательные [4], когнитивные [5] и сенсорные нарушения [6]. Одним из серьезных осложнений двигательных нарушений является увеличение риска падений [7] вследствие слабости мышц, производящих тыльное сгибание стопы, и появление симптома отвисающей стопы в паретичной нижней конечности [8]. Часто наблюдается медленная скорость ходьбы и асимметрия движений нижних конечностей, связанная с уменьшением амплитуды движений в суставах и необходимостью осуществлять перенос ноги через сторону [9–12]. В частности, пространственная асимметрия связана с изменением длины шага [13][14].
Учитывая актуальность задачи быстрого восстановления двигательных функций у пациентов с ОНМК, рассматриваются варианты применения новых методов реабилитации. Одним из таких направлений является функциональная электростимуляция мышц (ФЭС).
Moe et al. описали методику ФЭС преимущественно в контексте выполнения определенной функциональной задачи [15], в частности ходьбы [16]. Ряд исследований описывает эффективность использования методики ФЭС в контексте коррекции имеющихся типичных изменений ходьбы при гемипарезе. Однако механизм этого воздействия и система оценки полученных результатов до сих пор вызывают вопросы. В большинстве исследований применения ФЭС принято использовать критерий изменения скорости ходьбы и силы мышц [17][18]. Данный критерий представляет клиническую значимость, но не обеспечивает детального биомеханического понимания.
Также оказывается важным анализ движений не только поврежденной, но и неповрежденной конечности, что было отмечено авторами исследования, где целью являлось изучение непосредственного влияния ФЭС на среднюю ягодичную мышцу и переднюю большеберцовую у пациентов, перенесших инсульт, включая тех, кто использовал вспомогательные устройства для ходьбы. Несмотря на полученные данные, исследователи не смогли прояснить этиологию увеличения длины шага для интактной конечности [19]. В исследовании [20] была получена коррекция гиперэкстензии колена и отвисающей стопы при использовании ФЭС, но авторы отмечают необходимость дополнительных методических разработок для применения данного метода. При этом имеющиеся в литературе источники не касаются применения метода ФЭС у пациентов в раннем восстановительном периоде инсульта.
Цель — определить возможность и оценить результат применения многоканальной ФЭС у пациентов в раннем восстановительном периоде инсульта для коррекции функции ходьбы.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на базе Научно-исследовательского центра медицинской реабилитации ФГБУ ФЦМН ФМБА России в период с апреля по декабрь 2024 года.
В него были включены пациенты с гемипарезом в раннем восстановительном периоде впервые возникшего ишемического инсульта (<180 дней) в бассейне средней мозговой артерии, в возрасте до 75 лет, способные к передвижению (ходьбе) без посторонней помощи, в том числе с использованием дополнительных средств опоры (трость).
Критерии исключения пациентов: когнитивные нарушения, препятствующие пониманию пациентом инструкций; сенсомоторная афазия; декомпенсированная соматическая патология, заболевания центральной и периферической нервной системы (кроме инсульта), сопровождающиеся неврологическим дефицитом (последствия травм, опухолей, полинейропатии и др.); ортопедическая патология (суставные деформации, контрактуры, ампутации и др.); эпилептическая активность в анамнезе; кожные заболевания, сопровождающиеся высыпаниями в местах крепления электродов; отказ пациента от участия в исследовании.
В результате отбора в исследовании приняли участие 11 пациентов (2 женщины и 9 мужчин) в возрасте от 46 до 66 лет (средний возраст 57,6 ± 8,0 года). У 4 человек наблюдался правосторонний гемипарез. Количество дней после инсульта составило в среднем 69,1 ± 52,0 дня. Индекс массы тела в группе составил в среднем 24,9 кг/м2.
Также в исследование были включены 34 здоровых участника (18 женщин и 16 мужчин), составивших контрольную группу. Средний возраст испытуемых — 29,8 года, средний индекс массы тела — 20,6 кг/м2.
Методика оценки клинического статуса
Для оценки клинического состояния пациента использовали следующие шкалы и балльные оценки: мышечную силу нижних конечностей оценивали по Medical Research Council Weakness Scale [21]; мышечный тонус нижних конечностей — по модифицированной шкале Ашфорт (Modified Ashworth Scale, mAS) [22].
Для оценки функции ходьбы применяли следующие инструменты: индекс динамической походки (Dynamic Gait Index, DGI) [23], индекс Хаузера (Hauser Ambulation Index) [24], тест «Встань и иди» (Timed Up and Go Test, TUG) [25], тест десятиметровой ходьбы (10 Meter Walk Test — 10MWT) [26].
Оценка нарушений здоровья и возможностей пациента изучена в доменах Международной классификации функционирования ограничений жизнедеятельности и здоровья [27][28] «Активность и участие»: функция стереотипа походки (d770), преодоление препятствий (d4551) и ходьба на короткие расстояния (d4500).
Методика оценки функции ходьбы
Методика исследования. Всем пациентам проводили предварительное биомеханическое исследование ходьбы с использованием комплекса программного обеспечения «Стэдис» («Нейрософт», г. Иваново). Регистрацию пространственно-временных и кинематических параметров ходьбы выполняли с помощью инерционных сенсоров, зафиксированных эластичными манжетами на уровне крестца и на обеих нижних конечностях: на латеральной поверхности средней трети бедра, на уровне латеральной лодыжки голеностопного сустава и на тыльной поверхности стоп. Одновременно регистрировали электромиографическую активность мышц с помощью электродов, которые помещали на средней трети длины мышц нижних конечностей: m. quadriceps femoris, hamstring (m. biceps femoris, m. semitendinosus, m. semimembranosus), m. tibialis anterior и m. gastrocnemius (обе головки). Во время исследования пациенты ходили в произвольном темпе по прямой (8,5 м) с разворотами в конце дистанции. Биомеханические данные регистрировались до достижения 30 циклов шага. Программное обеспечение позволяло учитывать качественно зарегистрированные шаги, исключая данные с неустойчивой ходьбой (развороты, спотыкания, ускорение или замедление скорости ходьбы и др.). Как результат биомеханического исследования получали отчет с пространственно-временными параметрами цикла шага, кинематическими данными в виде гониограмм движений (флексия и экстензия за цикл шага) тазобедренного, коленного и голеностопного суставов, а также профилями биоэлектрической активности мышц.
Первое биомеханическое исследование ходьбы проводилось как группе пациентов, так и группе здоровых испытуемых (диагностика); второе — только группе пациентов после курса ФЭС.
Регистрируемые параметры
Временные: цикл шага (ЦШ) в секундах, остальные в процентах от ЦШ: период опоры (ПО), период одиночной опоры (ПОО), период двойной опоры (ПДО), начало второй двойной опоры (НВДО).
Пространственные: высота подъема стопы (см), циркумдукция (см) и скорость ходьбы (км/ч).
Кинематические: амплитуда сгибания и разгибания, а также ее фаза (момент наступления в ЦШ) в процентах ЦШ.
Тазобедренный сустав (ТБС): амплитуда и фаза сгибания в начале ЦШ (Тa1 и Тx1 соответственно), разгибание в конце ПО (Тa2 и Тx2) и сгибания в периоде переноса (Тa3 и Тx3).
Коленный сустав (КС): амплитуда в начале ЦШ (К0), амплитуда и фаза первого сгибания (Ka1 и Kx1), первого разгибания (Ka2 и Kx2) и второго сгибания (Ka3 и Kx3).
Голеностопный сустав (ГСС): амплитуда в начале ЦШ (ГС0), амплитуда и фаза первого разгибания (Гa1 и Гx1), первого сгибания (ГСa2 и ГСx2), второго разгибания (ГСa3 и ГСx3) и второго сгибания (ГСa4 и ГСx4).
Биоэлектрическую активность мышц регистрировали для максимальной амплитуды (в микровольтах, мВ) и ее фазы (в процентах ЦШ). Профиль m. tibialis anterior (ТА) имел два пика ЭМГ-активности (TAa1 и TAa2) и соответствующие значения фаз (TAx1 и TAx2). Профиль m. gastrocnemius (GC) имел один пик активности (GCa) и одну фазу (GCx). Профиль m. quadriceps femoris (QF) был представлен двумя пиками (QFa1 и QFa2) и соответствующими значениями фаз (QFx1 и QFx2). Профиль hamstring (НМ) имел один пик (HMa) и одну фазу (HMx).
Регистрируемые амплитуды и фазы гониограмм (изменения амплитуды движений в цикле шага) и электромиограмм (профиль биоэлектрической активности мышцы в цикле шага) представлены на рисунке 1.
Методика проведения функциональной электростимуляции
Для проведения процедуры ФЭС использовали стимуляционные устройства комплекса «Стэдис» («Нейрософт», г. Иваново) и электроды для электростимуляции FIAB (Florence, Italy). Устройства фиксировались такими же эластичными манжетами, как и для проведения биомеханического исследования ходьбы. Они располагались на крестце, бедрах и наружных лодыжках. На мышцы паретичной ноги производили аппликацию стимуляционных электродов: на верхнюю и нижнюю трети mm. quadriceps femoris, hamstring, tibialis anterior и gastrocnemius (рис. 2).
На следующем этапе проводили настройку силы тока, основываясь на двух критериях: на пробную стимуляцию должно быть видимое сокращение мышцы, ощущения пациента должны находиться до его болевого порога. Настройку силы тока (интенсивности стимуляции) выполняли в начале каждой сессии для каждой стимулируемой мышцы. Параметры частоты тока и длительности импульса оставляли неизменными — 50 Гц и 200 мс соответственно. После определения силы тока производили калибровку системы и приступали к тренировке. Пациенты ходили по прямой в произвольном темпе, делая развороты в конце дистанции и продолжая ходьбу. Электрические импульсы подавались на мышцы в определенный момент цикла шага, соответствующий физиологическому максимуму биоэлектрической активности мышц во время ходьбы у здорового человека. Так, для m. quadriceps femoris импульс подавался в начале периода опоры и в начале периода переноса, для hamstring — в начале периода опоры, для m. tibialis anterior — в начале периода опоры и в середине периода переноса, для m. gastrocnemius — в середине цикла шага. Пациент продолжал ходьбу в течение 30 минут, после чего тренировка завершалась. Процедуру останавливали ранее в случае появления субъективных жалоб (головокружение, утомление) или по просьбе пациента. Процедуры проводились пациентам ежедневно 5 раз в неделю. Длительность курса определялась временем пребывания пациентов в стационаре и составляла в среднем 10,8 процедуры. Средняя длительность процедур составила 25,5 минуты.
Статистическая обработка результатов
Для статистической обработки данных использовали программное обеспечение Statistica 12.0 (StatSoft, Талса, США). Нормальность распределения количественных параметров определяли с помощью теста Шапиро — Уилка, по результатам которого распределение оказалось отличным от нормального (p < 0,05), следовательно, все данные были представлены в виде медианы и первого и третьего квартилей Ме [Q1; Q3]. Для сравнения параметров ходьбы у пациентов, полученных до и после курса ФЭС, применяли критерий Вилкоксона; для сравнения параметров ходьбы группы пациентов с испытуемыми из группы контроля применяли U-критерий Манна – Уитни. Статистически значимым считали значение p < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Клинические показатели
При сравнении клинических характеристик группы пациентов до и после курса ФЭС выявлены статистически достоверные изменения, характеризующие улучшение функции ходьбы. Индекс динамической походки увеличился на 3 единицы. Индекс Хаузера уменьшился на единицу. Значение теста «Встань и иди» уменьшилось на 7 секунд. Значение скорости в тесте 10-метровой ходьбы увеличилось на 0,15 м/с. Домены МКФ: функция стереотипа походки (b770) и ходьбы на короткие расстояния (d4500) уменьшили значение на единицу (табл. 1).
Пространственно-временные параметры
При сравнении параметров, полученных до и после курса ФЭС, обнаружены следующие статистически значимые изменения: увеличение двойной опоры на паретичной стороне, уменьшение двойной опоры на интактной стороне и увеличение скорости ходьбы (табл. 2).
Сравнение параметров до и после курса ФЭС с аналогичными параметрами группы контроля обнаружило следующие статистически достоверные отличия: увеличение ЦШ, увеличение ПО на интактной стороне, увеличение ОО на паретичной стороне, увеличение ДО на обеих сторонах, более раннее НВДО на паретичной стороне и более позднее НВДО на интактной стороне, снижение высоты подъема стопы на паретичной стороне, увеличение циркумдукции на паретичной стороне, а также значимое снижение скорости ходьбы в группе пациентов относительно группы здоровых испытуемых.
Кинематические параметры
При сравнении параметров, полученных до и после курса ФЭС, обнаружены следующие статистически значимые изменения: более раннее Tx3 на паретичной стороне, увеличение Ta2 на интактной стороне, более позднее Kx1 на интактной стороне, более позднее ГСx1 на интактной стороне, увеличение ГСa3 на интактной стороне (табл. 3).
При оценке параметров группы пациентов, полученных до курса ФЭС, с аналогичными параметрами группы здоровых испытуемых выявлены следующие статистически значимые отличия: у пациентов отмечали снижение амплитуды первого сгибания в ТБС на паретичной стороне; более раннее начало этого сгибания (Tx1) на интактной стороне; снижение амплитуды разгибания (Ta2) на обеих сторонах и более раннее начало ее фазы (Tx2) на паретичной, при этом более позднее начало на интактной стороне; снижение амплитуды сгибания в периоде переноса (Ta3) на паретичной и увеличение на интактной стороне; более позднее начало фазы этого сгибания (Tx3) на интактной стороне.
В коленном суставе: снижение амплитуды первого сгибания (Ka1) на паретичной стороне с более ранним началом ее фазы (Kx1) на обеих сторонах, уменьшенная амплитуда разгибания (Ka2) на паретичной стороне и более раннее начало ее фазы (Kx2) на паретичной стороне; снижение амплитуды сгибания (Ka3) на паретичной стороне и более позднее начало ее фазы (Kx3) на интактной стороне.
В голеностопном суставе: более раннее начало фазы первого экстремума (ГСx1) на обеих сторонах и более позднее начало полного сгибания (ГСx2) на интактной стороне; снижение амплитуды (ГСa3) на обеих сторонах и более позднее начало ее фазы (ГСx3) на обеих сторонах; увеличенная амплитуда (ГСa4) на обеих сторонах и более позднее начало ее фазы (ГСx4) на паретичной стороне.
При сравнительной оценке кинематических параметров у пациентов после курса ФЭС с аналогичными параметрами у здоровых испытуемых отмечены следующие статистически значимые изменения: в тазобедренном суставе — снижение амплитуды первого сгибания (Ta1) на паретичной стороне, снижение амплитуды разгибания (Ta2) на обеих сторонах, более раннее его начало (Tx2) на паретичной стороне и более позднее начало на интактной стороне, снижение амплитуды (Ta3) на паретичной стороне и увеличение ее на интактной. В коленном суставе — снижение амплитуды первого сгибания (Ka1) на паретичной стороне, более раннее ее начало (Kx1) на паретичной стороне, сниженные амплитуды (Ka2 и Ka3) на паретичной стороне, более позднее окончание второго сгибания (Kx3) на интактной стороне. В голеностопном суставе — увеличение первой амплитуды (ГСa1) на паретичной стороне, более раннее ее начало (ГСx1) на паретичной стороне, снижение второй амплитуды (ГСa2) на паретичной стороне, более позднее ее начало (ГСx2) на интактной стороне, уменьшение амплитуды (ГСa3) на обеих сторонах, более позднее ее начало (ГСx3) на обеих сторонах, увеличение амплитуды ГСa4 на обеих сторонах и более позднее ее начало (ГСx4) на паретичной стороне.
Электромиографические параметры
При сравнении профилей биоэлектрической активности мышц, полученных до и после курса ФЭС, обнаружено два статистически значимых изменения: увеличение максимума активности икроножной мышцы как для паретичной, так и для интактной стороны (табл. 4).
При сравнении электромиографических параметров у пациентов до курса ФЭС с аналогичными параметрами у здоровых испытуемых выявлены следующие статистически значимые отличия: в профиле m. tibialis anterior — снижение TAa1 на паретичной стороне, более позднее начало TAx1 на обеих сторонах, сниженное TAa2 на паретичной стороне и более раннее начало TAx2 на паретичной стороне; в профиле m. gastrocnemius — сниженное GCa на паретичной стороне, более раннее начало GCx на паретичной и более позднее начало GCx на интактной стороне; в профиле m. quadriceps femoris — увеличенное QFa1 на интактной стороне, более позднее начало QFx1 на обеих сторонах, увеличенное QFa2 на интактной стороне; в профиле hamstring — сниженное HMa на паретичной стороне и более раннее начало HMx на паретичной стороне.
При сравнении электромиографических профилей мышц у пациентов после курса ФЭС с аналогичными профилями у здоровых испытуемых обнаружены следующие статистически значимые изменения: в профиле m. tibialis anterior — снижение TAa1 на паретичной стороне и увеличение TAa1 на интактной стороне, более позднее начало TAx1 на обеих сторонах, сниженное TAa2 на паретичной стороне и более раннее начало TAx2 на паретичной стороне; в профиле m. gastrocnemius — сниженное GCa на паретичной стороне; в профиле m. quadriceps femoris — более позднее начало QFx1 на интактной стороне; в профиле hamstring — сниженное HMa на паретичной стороне и увеличенное HMa на интактной стороне.
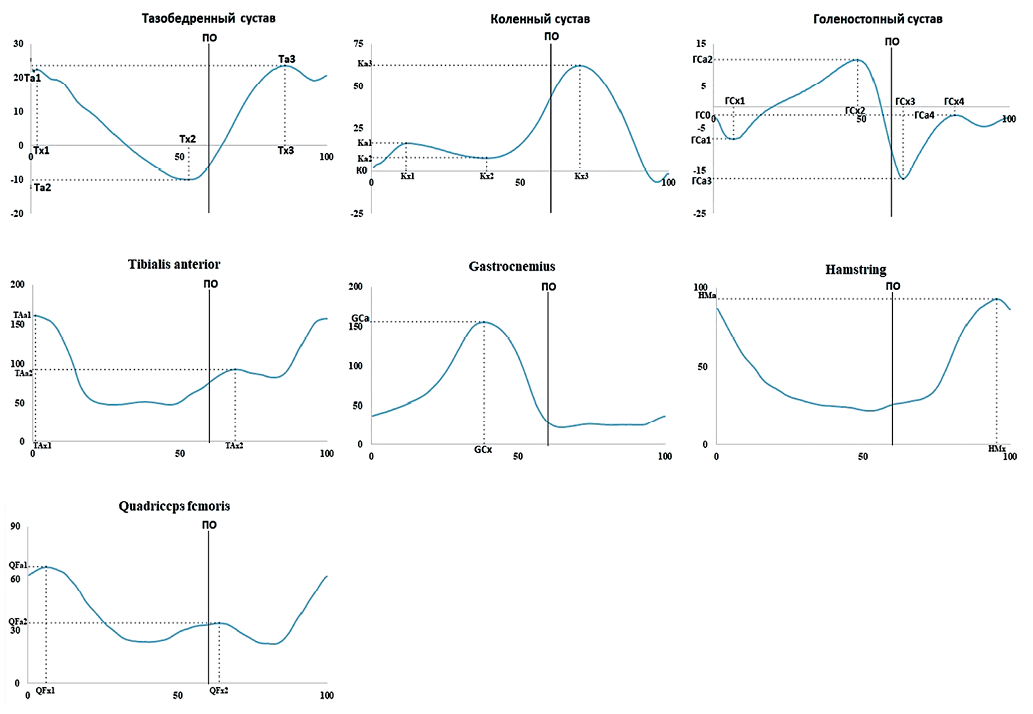
Рисунок подготовлен авторами по собственным данным
Рис. 1. Анализируемые параметры для гониограмм и профилей биоэлектрической активности мышц: вертикальная шкала для гониограмм тазобедренного, коленного и голеностопного суставов в градусах, для профилей мышц m. tibialis anterior, m. gastrocnemius, m. quadriceps femoris, hamstring в микровольтах, горизонтальная — в процентах цикла шага

Рисунок подготовлен авторами по собственным данным
Рис. 2. Расположение стимулирующих электродов и устройств на нижней конечности пациента: электроды располагали на стороне гемипареза, устройства на обеих ногах для регистрации биомеханических параметров во время проведения стимуляции
Таблица 1. Клинические показатели до и после проведения курса функциональной электрической стимуляции (ФЭС)
Клинический показатель | До ФЭС | После ФЭС |
Мышечная сила нижних конечностей, баллов | 3 | 3 |
Клинические шкалы и тесты | ||
Мышечный тонус нижних конечностей | 1–2 | 1–2 |
Индекс динамической походки | 16 [ 14; 17] | 19* [ 18; 20] |
Индекс Хаузера | 4 [ 3; 4] | 3* [ 3; 4] |
Тест «Встань и иди», с | 32 [ 25; 36] | 25* [ 19; 30] |
Тест 10-метровой ходьбы, м/с | 0,75 [ 0,7; 0,8] | 0,9* [ 0,85; 1,0] |
Категории МКФ | ||
d770 — функция стереотипа походки | 2 [ 2; 3] | 1* [ 1; 2] |
d4551 — преодоление препятствий | 2 [ 1; 2] | 1 [ 1; 2] |
d4500 — ходьба на короткие расстояния | 2 [ 1; 2] | 1* [ 0; 1] |
Таблица составлена авторами по собственным данным
Примечание: * статистически значимые изменения, p < 0,05.
Таблица 2. Пространственно-временные параметры до и после курса функциональной электрической стимуляции (ФЭС)
Параметр | До курса ФЭС | После курса ФЭС | Контрольная группа | ||
Паретичная сторона | Интактная сторона | Паретичная сторона | Интактная сторона | ||
ЦШ, с | 1,6 [ 1,5; 2,0]* | 1,6 [ 1,4; 1,9]* | 1,5 [ 1,4; 2,0]* | 1,5 [ 1,4; 2,0]* | 1,1 [ 1,1; 1,2] |
ПО, % | 63,3 [ 60,8; 64,5] | 74,2 [ 69,1; 78]* | 62,1 [ 59,9; 65,0] | 71,8 [ 67,9; 78,2]* | 63,1 [ 62,4; 64,4] |
ОО, % | 26,3 [ 22,2; 31,2]* | 36,9 [ 35,9; 39,5] | 27,6 [ 21,5; 31,7]* | 37,8 [ 35,2; 39,7] | 36,9 [ 35,7; 37,9] |
ДО, % | 34,5 [ 30,6; 43,0]* | 34,8 [ 30,7; 42,8]* | 35,0 [ 27,6; 40,8]* # | 34,4 [ 28,2; 41,4]* # | 26,1 [ 24,6; 28,1] |
НВДО, % | 41,6 [ 40,8; 45,8]* | 57,1 [ 53,5; 60,0]* | 42,8 [ 40,0; 45,6]* | 56,4 [ 54,1; 60,1]* | 49,9 [ 49,6; 50,3] |
Высота подъема стопы, см | 8 [ 7; 12]* | 13 [ 11; 15] | 9 [ 7; 12]* | 14 [ 11; 14] | 13,5 [ 12; 15] |
Циркумдукция, см | 4 [ 3; 6]* | 2 [ 2; 4] | 4 [ 3; 6]* | 2 [ 2; 3] | 3 [ 2; 4] |
Скорость, км/ч | 1,7 [ 1,2; 2,5]* | 2,2 [ 1,3; 2,4]*# | 4,3 [ 4; 5] | ||
Таблица составлена авторами по собственным данным
Примечание: * статистически значимые изменения по сравнению с контрольной группой, p < 0,05; # статистически значимые изменения по сравнению с одноименным параметром той же стороны после курса ФЭС, p < 0,05; ЦШ — цикл шага; ПО — период опоры; ПОО — период одиночной опоры; ПДО — период двойной опоры; НВДО — начало второй двойной опоры.
Таблица 3. Кинематические параметры до и после курса функциональной электрической стимуляции (ФЭС)
Локализация | Параметр | До курса ФЭС | После курса ФЭС | Контрольная группа | ||
Паретичная сторона | Интактная сторона | Паретичная сторона | Интактная сторона | |||
ТБС | Ta1 | 15* [ 9; 16] | 23 [ 19; 30] | 15* [ 10; 17] | 24 [ 20; 28] | 23 [ 20; 25] |
Tx1 | 2 [ 1; 5] | 1* [ 1; 2] | 3 [ 1; 7] | 2 [ 1; 5] | 2 [ 2; 3] | |
Ta2 | -6* [ -9; 1] | -6* [ -10; -3] | -8* [ -11; -2] | -7*# [ -11; -3] | -11 [ -12; -9] | |
Tx2 | 50* [ 47; 55] | 59* [ 56; 64] | 50* [ 47; 52] | 61* [ 57; 66] | 53 [ 51; 55] | |
Ta3 | 16* [ 11; 28] | 31* [ 26; 34] | 17* [ 16; 27] | 31* [ 25; 32] | 24 [ 22; 27] | |
Tx3 | 90 [ 84; 92] | 90* [ 86; 93] | 88# [ 83; 91] | 89 [ 87; 93] | 87 [ 84; 89] | |
КС | K0 | 2 [ 0; 4] | 12* [ 8; 15] | 1 [ -3; 5] | 10* [ 7; 13] | 3 [ -1; 5] |
Ka1 | 10* [ 4; 12] | 14 [ 14; 20] | 10* [ 3; 11] | 16 [ 13; 19] | 17 [ 14; 19] | |
Kx1 | 8* [ 7; 10] | 9* [ 7; 12] | 11* [ 8; 13] | 10# [ 7; 15] | 12 [ 12; 14] | |
Ka2 | 2* [ -4; 9] | 6 [ 4; 9] | -1* [ -4; 2] | 5 [ 2; 11] | 6 [ 4; 9] | |
Kx2 | 33* [ 31; 37] | 38 [ 34; 43] | 37 [ 32; 42] | 38 [ 35; 40] | 37 [ 34; 41] | |
Ka3 | 35* [ 27; 52] | 61 [ 56; 62] | 37* [ 30; 47] | 61 [ 59; 64] | 63 [ 60; 67] | |
Kx3 | 70 [ 66; 73] | 79 [ 74; 83]* | 71 [ 64; 73] | 77* [ 74; 81] | 70 [ 69; 71] | |
ГСС | ГС0 | -9* [ -12; -2] | -4 [ -5; -3] | -10* [ -15; -6] | -3 [ -4; -1] | -3 [ -5; 0] |
ГСa1 | -11 [ -14; -5] | -7 [ -9; -4] | -14* [ -15; -13] | -7 [ -10; -5] | -8 [ -10; -6] | |
ГСx1 | 4* [ 1; 5] | 4* [ 3; 7] | 3* [ 1; 6] | 6# [ 3; 8] | 7 [ 6; 8] | |
ГСa2 | 9 [ 5; 14] | 10 [ 9; 12] | 8 [ 5; 12]* | 13 [ 10; 14] | 12 [ 10; 15] | |
ГСx2 | 49 [ 47; 51] | 58* [ 56; 60] | 48,75 [ 48; 50] | 57* [ 56; 59] | 48 [ 46; 50] | |
ГСa3 | -5* [ -11; -3] | -9* [ -18; -7] | -10* [ -13; -7] | -15* # [ -17; -12] | -19 [ -22; -15] | |
ГСx3 | 74* [ 66; 79] | 74* [ 71; 80] | 67* [ 65; 76] | 73* [ 70; 77] | 64 [ 63; 65] | |
ГСa4 | -9* [ -11; -3] | -4* [ -10; -4] | -9* [ -14; -5] | -6* [ -9; -3] | -1 [ -3; 1] | |
ГСx4 | 94* [ 93; 98] | 82 [ 81; 98] | 99* [ 95; 100] | 81 [ 81; 97] | 86 [ 81; 97] | |
Таблица составлена авторами по собственным данным
Примечание: * статистически значимые изменения в сравнении с контрольной группой, p < 0,05; # статистически значимые изменения по сравнению с одноименным параметром той же стороны после курса ФЭС, p < 0,05; Та1 и Та2 — амплитуда и фаза сгибания тазобедренного сустава в начале ходьбы; ТБС — тазобедренный сустав; Та2 и Тх2 — полное разгибание тазобедренного сустава в период переноса; Та3 и Тх3 — сгибание тазобедренного сустава в период переноса; КС — коленный сустав; К0 — начальная амплитуда коленного сустава; Ка1 и Кх1 — амплитуда и фаза первого сгибания коленного сустава; Ка2 и Кх2 — амплитуда и фаза первого разгибания коленного сустава; Ка3 и Кх3 — амплитуда и фаза второго сгибания коленного сустава; ГСС — голеностопный сустав; ГС0 — начальная амплитуда голеностопного сустава; ГСа1 и ГСх1 — амплитуда и фаза первого разгибания голеностопного сустава; ГСа2 и ГСх2 — амплитуда и фаза первого сгибания голеностопного сустава; ГСа3 и ГСх3 — амплитуда и фаза второго разгибания голеностопного сустава; ГСа4 и ГСх4 — амплитуда и фаза второго сгибания голеностопного сустава.
Таблица 4. Электромиографические параметры до и после функциональной электрической стимуляции (ФЭС)
Мышца | Параметр | До курса ФЭС | После курса ФЭС | Контрольная группа | ||
Паретичная сторона | Интактная сторона | Паретичная сторона | Интактная сторона | |||
ТА | TAa1 | 72* [ 33; 95] | 163 [ 134; 230] | 69* [ 58; 135] | 208* [ 178; 278] | 159 [ 118; 186] |
TAx1 | 58* [ 4; 60] | 10* [ 9; 28] | 60* [ 12; 60] | 20* [ 9; 26] | 1 [ 1; 2] | |
TAa2 | 70* [ 58; 104] | 143 [ 118; 215] | 71* [ 60; 139] | 180 [ 136; 222] | 154 [ 116; 185] | |
TAx2 | 68* [ 62; 97] | 100 [ 84; 100] | 66* [ 64; 100] | 100 [ 84; 100] | 99 [ 98; 100] | |
GС | GСa | 50* [ 27; 81] | 145 [ 133; 163] | 70* # [ 54; 96] | 171# [ 164; 208] | 154 [ 113; 202] |
GСx | 31* [ 28; 39] | 44* [ 35; 47] | 37 [ 32; 40] | 39 [ 35; 47] | 39 [ 37; 40] | |
QF | QFa1 | 62 [ 41; 67] | 92* [ 72; 109] | 62 [ 52; 84] | 89 [ 67; 174] | 63 [ 41; 86] |
QFx1 | 13* [ 10; 17] | 21* [ 6; 24] | 14 [ 6; 16] | 12* [ 9; 23] | 7 [ 5; 9] | |
QFa2 | 40 [ 31; 58] | 75 [ 60; 126] | 48* [ 40; 81] | 82 [ 60; 116] | 57 [ 39; 81] | |
QFx2 | 100 [ 51; 100] | 97 [ 51; 100] | 100 [ 99; 100] | 95 [ 52; 100] | 100 [ 99; 100] | |
HM | HMa1 | 53* [ 43; 71] | 108 [ 83; 146] | 59* [ 40; 79] | 129* [ 115; 146] | 83 [ 62; 123] |
HMx1 | 13* [ 10; 19] | 26 [ 12; 56] | 14 [ 11; 25] | 45 [ 31; 65] | 92 [ 43; 95] | |
Таблица составлена авторами по собственным данным
Примечание: * статистически значимые изменения в сравнении с контрольной группой, p < 0,05; # статистически значимые изменения по сравнению с одноименным параметром той же стороны после курса ФЭС, p < 0,05; TA — m. tibalis anterior; GC — m. gastrocnemius; QF — m. quadriceps femoris; HM — hamstring.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты, полученные в данном исследовании, продемонстрировали незначительные, но типичные для пациентов с инсульт-ассоциированным гемипарезом изменения в ходьбе.
После проведенного курса ФЭС отмечено увеличение значений индекса динамической походки и теста 10-метровой ходьбы, уменьшение индекса Хаузера и времени выполнения теста «Встань и иди». Наиболее часто в литературе можно встретить оценку эффектов ФЭС с помощью теста 10-метровой ходьбы и теста «Встань и иди» [29–31], изменения которых аналогичны полученным в данном исследовании. Кроме того, некоторые исследования включали и другие клинические показатели, изменения которых носили неоднозначный характер. Так, в систематическом обзоре Wang et al., включающем 14 исследований с участием 945 пациентов с гемипарезом, было продемонстрировано положительное влияние курса ФЭС на показатели шкалы Фугл-Мейера, шкалы равновесия Берг, теста 10-минутной ходьбы, модифицированного индекса Бартела и функционального теста ходьбы [30]. В то же время в исследовании Matsumoto et al. [32] по результатам проведенного 8-недельного курса ФЭС (40 минут, 1 раз в день, 5 дней в неделю) с участием 92 пациентов не было определено достоверных отличий в клинических показателях теста 10-метровой ходьбы, шкалы Фугл-Мейера и теста «Встань и иди».
Полученные нами результаты изменений пространственно-временных параметров ходьбы пациентов до проведения курса ФЭС продемонстрировали изменения, характерные для данного периода инсульта. К ним относятся увеличение продолжительности ЦШ, нормальная длительность ПО на паретичной и его увеличение на здоровой стороне, снижение ПОО на паретичной и его увеличение на здоровой стороне, увеличение суммарного ПДО, асимметрия НВДО с его сокращением на паретичной и увеличением на здоровой стороне, снижение клиренса стопы на паретичной стороне. Все перечисленные изменения биомеханики описаны ранее [9–12] и представляют собой типичную функциональную картину гемипареза.
По окончании курса ФЭС отмечено незначительное, но достоверное возрастание времени двойной опоры как на паретичной, так и на интактной стороне. Это одна из компенсаторных реакций для улучшения баланса тела. Устойчивость выше, если обе ноги на опоре. Другим результатом явилось увеличение скорости ходьбы, что коррелирует с результатами, полученными в других исследованиях [33][34].
Для пациентов с гемипарезом также типичны изменения кинематики: снижение амплитуд движений в тазобедренном, коленном и голеностопном суставах паретичной стороны. При этом голеностопный сустав находится в незначительном разгибании, что снижает клиренс и приводит (наряду с другими изменениями) к увеличению циркумдукции. Для паретичной стороны характерно снижение амплитуд движений в суставах. При этом здоровая сторона вынуждена компенсировать меньшую активность паретичной. Таким образом, при низкой скорости ходьбы пациентов даже нормативные кинематические параметры интактной стороны уже являются гиперфункцией. Более поздние максимумы ряда амплитуд на интактной стороне — результат увеличения ПО. Увеличивается общее время периода опоры, и таким образом максимумы амплитуд тоже смещаются и происходят позже по времени.
По результатам курса ФЭС со стороны кинематики движений в суставах регистрируются небольшие изменения, преимущественно для интактной стороны. В существующих в литературе источниках ФЭС наиболее часто используется у пациентов после инсульта при отвисающей стопе, следовательно, изменения кинематики ограничиваются голеностопным суставом. Так, Güzel et al. описали положительное влияние 4-недельного курса ФЭС на амплитуду движений голеностопного сустава у пациентов в раннем восстановительном периоде ишемического инсульта [34].
Анализ ЭМГ показал характерные изменения для гемипареза: снижение амплитуд активности на стороне пареза для всех анализируемых мышц. Однако отмечены менее выраженные изменения в QF по сравнению с другими группами мышц и по амплитуде, и по профилю активности [12][35]. Именно эта мышца обеспечивает стабильность коленного сустава, при существенном изменении ее активности невозможна опора на паретичную конечность.
В результате курса реабилитации у пациентов отмечали только достоверное увеличение амплитуды GC с обеих сторон. При этом активность GC на паретичной стороне оставалась более чем в два раза ниже, чем таковая на интактной, как до, так и после проведения ФЭС.
Полученные результаты показывают, что в раннем восстановительном периоде церебрального инсульта курс реабилитации длительностью 3 недели в целом и с использованием ФЭС в частности объективно приводил к незначительному функциональному улучшению. При этом тренировки с ФЭС проводились ежедневно, а пациенты ходили максимальное количество времени до утомления. Интенсивность стимуляции также поддерживали на максимальном уровне для каждого пациента. По данным зарубежных исследователей, курс ФЭС проводится более длительные сроки [36]. Однако в текущих условиях проведения описанного исследования выйти за рамки 10 процедур весьма сложно. Этот фактор отмечался нами в предшествующих работах, где применялся метод восстановления функции ходьбы с помощью биологической обратной связи [11][37].
При этом длительность реабилитационных мероприятий для пациентов с нарушением функции ЦНС зависит от оценки пациента по шкале реабилитационной маршрутизации (ШРМ), то есть определяется степенью функциональных ограничений и зависимостью от окружающих в самообслуживании. В соответствии с Программой государственных гарантий бесплатного оказания гражданам медицинской помощи для пациентов с оценкой по ШРМ 4 — длительность реабилитационного курса составляет 14 дней, при оценке ШРМ 5 — 20 дней. Как правило, формирование навыка ходьбы начинается у пациентов с уровнем функциональных ограничений ШРМ 4, а значит, фактическое количество дней реабилитации будет варьировать от 10 до 12. Объективная оценка функции ходьбы проводится в первый день поступления пациента на медицинскую реабилитацию и перед выпиской.
Результаты данного исследования косвенно подтверждают недостаточную длительность курса медицинской реабилитации для пациентов с заболеваниями ЦНС, предоставляемой текущей системой медицинской реабилитации, и необходимость дальнейшего изучения.
ВЫВОДЫ
Все пациенты представленного исследования имели типичные изменения функции ходьбы, связанные с гемипарезом в раннем восстановительном периоде инсульта. Проведенный курс многоканальной ФЭС не обнаружил негативных реакций. Клиническая и биомеханическая динамика состояния пациентов за время курса ФЭС изменилась незначительно, но достоверно возросла амплитуда икроножной мышцы на стороне пареза.
Таким образом, в раннем восстановительном периоде инсульта возможно проведение многоканальной ФЭС для коррекции ходьбы. При этом короткие ежедневные курсы в 10 процедур не приводят к существенным изменениям функции стимулируемых мышц.
Дальнейшие исследования могут быть направлены на определение методики настройки параметров ФЭС в соответствии с обнаруженными биомеханическими нарушениями с целью получения более значимого терапевтического эффекта в восстановлении функции ходьбы у пациентов в раннем восстановительном периоде ишемического инсульта.
Список литературы
1. Katan M, Luft A. Global Burden of Stroke. Seminars in Neurology. 2018;38:208–11. https://doi.org/10.1055/s-0038-1649503
2. Tsao CW, Aday AW, Almarzooq ZI, Anderson CAM, Arora P, Avery CL, et al. Heart Disease and Stroke Statistics-2023 Update: A Report from the American Heart Association. Circulation. 2023;147:e93–621. https://doi.org/10.1161/CIR.0000000000001123
3. Donkor ES. Stroke in the 21st Century: A Snapshot of the Burden, Epidemiology, and Quality of Life. Stroke Research and Treatment. 2018.27;2018:3238165. https://doi.org/10.1155/2018/3238165
4. Hendricks HT, Van Limbeek J, Geurts AC, Zwarts MJ. Motor recovery after stroke: A systematic review of the literature. Archives of Physical Medicine and Rehabilitation. 2002;83:1629–37. https://doi.org/10.1053/apmr.2002.35473
5. Levine DA, Galecki AT, Langa KM, Unverzagt FW, Kabeto MU, Giordani B, et al. Trajectory of Cognitive Decline After Incident Stroke. JAMA. 2015;314:41–51. https://doi.org/10.1001/jama.2015.6968
6. Lima DHF, Queiroz AP, Salvo G, Yoneyama SM, Oberg TD, Lima NMFV. Brazilian version of the Nottingham Sensory Assessment: validity, agreement and rehability. Brasilian Journal of Physical Therapy. 2010;14:166–75. https://doi.org/10.1590/S1413-35552010005000006
7. Schmid AA, Wells CK, Concato J, Dallas MI, Lo AC, Nadeau SE, et al. Prevalence, predictors, and outcomes of poststroke falls in acute hospital setting. Journal of Rehabilitation Research and Development. 2010;47:553–62.
8. Sacco RL, Kasner SE, Broderick JP, Caplan LR, Connors JJ, Culebras A, et al. An Updated Definition of Stroke for the 21st Century. Stroke. 2013;44:2064–89. https://doi.org/10.1161/STR.0b013e318296aeca
9. Perry J, Burnfield JM. Gait Analysis: Normal and Pathological Function (2 nd ed.). CRC Press; 2010. https://doi.org/10.1201/9781003525592
10. Wang Y, Mukaino M, Ohtsuka K, Otaka Y, Tanikawa H, Matsuda F, et al. Gait characteristics of post-stroke hemiparetic patients with different walking speeds. International Journal of Rehabilitation Research. 2020;43(1):69–75. https://doi.org/10.1097/MRR.0000000000000391
11. Skvortsov DV, Kaurkin SN, Ivanova GE. Targeted Biofeedback Training to Improve Gait Parameters in Subacute Stroke Patients: A Single-Blind Randomized Controlled Trial. Sensors. 2024; 24(22):7212. https://doi.org/10.3390/s24227212
12. Скворцов ДВ, Гребенкина НВ, Кауркин СН, Иванова ГЕ. Характеристика функции ходьбы у больных с гемипарезом в раннем восстановительном периоде ишемического инсульта: одноцентровое ретроспективное исследование. Физическая и Реабилитационная Медицина, Медицинская Реабилитация. 2024;6(3):208–19. https://doi.org/10.36425/rehab634515
13. Balasubramanian CK, Bowden MG, Neptune RR, Kautz SA. Relationship between step length asymmetry and walking performance in subjects with chronic hemiparesis. Archives of Physycal Medicine and Rehabilitation. 2007;88:43–9. https://doi.org/10.1016/j.apmr.2006.10.004
14. Kim CM, Eng JJ. Symmetry in vertical ground reaction force is accompanied by symmetry in temporal but not distance variables of gait in persons with stroke. Gait and Posture. 2003;18:23–8. https://doi.org/10.1016/S0966-6362(02)00122-4
15. Moe JH, Post HW. Functional electrical stimulation for ambulation in hemiplegia. The Lancet. 1962;82:285–8.
16. Kesar TM, Perumal R, Jancosko A, Reisman DS, Rudolph KS, Higginson JS, et al. Novel patterns of functional electrical stimulation have an immediate effect on dorsiflexor muscle function during gait for people poststroke. Physical Therapy. 2010;90(1):55–66. https://doi.org/10.2522/ptj.20090140
17. Burridge JH, Taylor PN, Hagan SA, Wood DE, Swain ID. The effects of common peroneal stimulation on the effort and speed of walking: a randomized controlled trial with chronic hemiplegic patients. Clinical Rehabilitation. 1997;11(3):201–10. https://doi.org/10.1177/026921559701100303
18. Robbins SM, Houghton PE, Woodbury MG, Brown JL. The therapeutic effect of functional and transcutaneous electric stimulation on improving gait speed in stroke patients: a meta-analysis. Archives of Physical Medicine and Rehabilitation. 2006;87(6):853–9. https://doi.org/10.1016/j.apmr.2006.02.026
19. Araki S, Kawada M, Miyazaki T, Nakai Y, Takeshita Y, Matsuzawa Y, et al. Effect of Functional Electrical Stimulation of the Gluteus Medius during Gait in Patients following a Stroke. Biomed Research International. 2020;2020:8659845. https://doi.org/10.1155/2020/8659845
20. Santos GF, Jakubowitz E, Pronost N, Bonis T, Hurschler C. Predictive simulation of post-stroke gait with functional electrical stimulation. Scientific Reports. 2021;11(1):21351. https://doi.org/10.1038/s41598-021-00658-z
21. Paternostro-Sluga T, Grim-Stieger M, Posch M, Schuhfried O, Vacariu G, Mittermaier C, et al. Reliability and validity of the Medical Research Council (MRC) scale and a modified scale for testing muscle strength in patients with radial palsy. Journal of Rehabilitation Medicine. 2008;40(8):665–71. https://doi.org/10.2340/16501977-0235
22. Супонева НА, Юсупова ДГ, Ильина КА, Мельченко ДА, Бутковская АА, Жирова ЕС и др. Валидация Модифицированной шкалы Эшворта (Modified Ashworth Scale) в России. Анналы Клинической и Экспериментальной Неврологии. 2020;14(1):89–96. https://doi.org/10.25692/ACEN.2020.1.10
23. Jonsdottir J, Cattaneo D. Reliability and validity of the dynamic gait index in persons with chronic stroke. Archives of Physical Medicine and Rehabilitation. 2007;88(11):1410–5. https://doi.org/10.1016/j.apmr.2007.08.109
24. Hauser SL, Dawson DM, Lehrich JR, Beal MF, Kevy SV, Propper RD, et al. Intensive immunosuppression in progressive multiple sclerosis. A randomized, threearm study of high-dose intravenous cyclophosphamide, plasma exchange, and ACTH. The New England Journal of Medicine. 1983;308(4):173–80. https://doi.org/10.1056/NEJM198301273080401
25. Chan PP, Tou JI, Tse MM, Ng SS. Reliability and Validity of the Timed Up and Go Test with a Motor Task in People with Chronic Stroke. Archives of Physical Medicine and Rehabilitation. 2017;98(11):2213–20. https://doi.org/10.1016/j.apmr.2017.03.008
26. Watson MJ. Refining the ten-metre walking test for use with neurologically impaired people. Physiotherapy. 2002;88(7):386–97.
27. Мельникова ЕВ, Буйлова ТВ, Бодрова РА, Шмонин АА, Мальцева МН, Иванова ГЕ. Использование международной классификации функционирования (МКФ) в амбулаторной и стационарной медицинской реабилитации: инструкция для специалистов. Вестник Восстановительной Медицины. 2017;6(82):7–20. EDN: ZVGCHN
28. Иванова ГЕ, Мельникова ЕВ, Шмонин АА, Вербицкая ЕВ, Аронов ДМ, Белкин АА и др. Применения международной классификации функционирования в процессе медицинской реабилитации. Вестник Восстановительной Медицины. 2018;(88):2–77. EDN: YOTJKP
29. Mitsutake T, Sakamoto M, Horikawa E. The effects of electromyography-triggered neuromuscular electrical stimulation plus tilt sensor functional electrical stimulation training on gait performance in patients with subacute stroke: a randomized controlled pilot trial. International Journal of Rehabilitation Research. 2019;42(4):358–64. https://doi.org/10.1097/MRR.0000000000000371
30. Wang J, Zhao L, Gao Y, Liu C, Dong X, He X. The difference between the effectiveness of body-weight-supported tread-mill training combined with functional electrical stimulation and sole body-weight-supported treadmill training for improving gait parameters in stroke patients: A systematic review and meta-analysis. Frontiers in Neurology. 2022;13:1003723. https://doi.org/10.3389/fneur.2022.1003723
31. Dujović SD, Malešević J, Malešević N, Vidaković AS, Bijelić G, Keller T, et al. Novel multi-pad functional electrical stimulation in stroke patients: A single-blind randomized study. NeuroRehabilitation. 2017;41(4):791–800.
32. Matsumoto S, Shimodozono M, Noma T, Miyara K, Onoda T, Ijichi R, et al. Effect of Functional Electrical Stimulation in Convalescent Stroke Patients: A Multicenter, Randomized Controlled Trial. Journal of Clinical Medicine. 2023;12(7):2638. https://doi.org/10.3390/jcm12072638
33. Wonsetler EC, Bowden MG. A systematic review of mechanisms of gait speed change post-stroke. Part 1: spatiotemporal parameters and asymmetry ratios. Topics in Stroke Rehabilitation. 2017;24(6):435–46. https://doi.org/10.1080/10749357.2017.1285746
34. Güzel S, Karaca Umay E, Öztürk EA, Çakci A. The efficiency of functional electrical stimulation and balance-weighted rehabilitation therapy in stroke patients with-foot-drop: a pilot study. Journal of Physical Medicine and Rehabilitation Sciences. 2022;25(1):1–10. https://doi.org/10.31609/jpmrs.2021-82149
35. Almeida ASSC, Viana da Cruz AT, Candeira SRA, Cardozo do Nascimento NI, Santar de Castro KJ, Costa de Lima R, et al. Late physiotherapy rehabilitation changes gait patterns in post-stroke patients. Biomedical Human Kinetics. 2017;9(1):14–8. https://doi.org/10.1515/bhk-2017-0003
36. Skvortsov DV, Kaurkin SN, Ivanova GE. A Study of Biofeedback Gait Training in Cerebral Stroke Patients in the Early Recovery Phase with Stance Phase as Target Parameter. Sensors. 2021;21:7217. https://doi.org/10.3390/s21217217
37. Скворцов ДВ, Климов ЛВ, Гребенкина НВ. Метод функциональной электрической стимуляции: рекомендуемые параметры применения. Физическая и Реабилитационная Медицина, Медицинская Реабилитация. 2024;6(3):263–79. https://doi.org/10.36425/rehab635187
Об авторах
Д. В. СкворцовРоссия
Скворцов Дмитрий Владимирович, д-р мед. наук, профессор
Москва
Н. В. Гребенкина
Россия
Гребенкина Наталья Вячеславовна
Москва
Л. В. Климов
Россия
Климов Леонид Владимирович, канд. мед. наук
Москва
С. Н. Кауркин
Россия
Кауркин Сергей Николаевич, канд. мед. наук, доцент
Москва
М. А. Булатова
Россия
Булатова Мария Анатольевна, канд. мед. наук
Москва
Г. Е. Иванова
Россия
Иванова Галина Евгеньевна, д-р мед. наук, профессор
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Скворцов Д.В., Гребенкина Н.В., Климов Л.В., Кауркин С.Н., Булатова М.А., Иванова Г.Е. Функциональная электрическая стимуляция при ходьбе в раннем восстановительном периоде ишемического инсульта. Медицина экстремальных ситуаций. 2025;27(3):417-428. https://doi.org/10.47183/mes.2025-268
For citation:
Skvortsov D.V., Grebenkina N.V., Klimov L.V., Kaurkin S.N., Bulatova M.A., Ivanova G.E. Functional electrical stimulation for gait correction in the early recovery phase after ischemic stroke. Extreme Medicine. 2025;27(3):417-428. https://doi.org/10.47183/mes.2025-268

















