Перейти к:
Оценка устойчивости Acinetobacter baumannii in vitro к тигециклину в Иране: систематический обзор и метаанализ
https://doi.org/10.47183/mes.2025-318
Аннотация
Введение. Acinetobacter baumannii (A. baumannii) — это распространенный и исключительно госпитальный микроорганизм, новая мутация которого устойчива к большинству доступных антибиотиков, за исключением тигециклина. Клиницисты выражают озабоченность в связи с недавними данными о резистентности к этому антибиотику, зафиксированными в Иране.
Цель. Оценить устойчивость Acinetobacter baumannii (A. baumannii) к тигециклину в Иране, учитывая его клиническое значение в лечении инфекций с множественной лекарственной устойчивостью.
Материалы и методы. В базах данных MEDLINE, PubMed, Web of Science (WOS), Scopus проведен поиск исследований, опубликованных за все время до января 2024 г. Выполнен расширенный поиск с использованием медицинских тематических рубрик (MeSH) по таким терминам, как «Acinetobacter baumannii», «тигециклин». В соответствии с критериями приемлемости были отобраны название, аннотация и полный текст статей. Также были включены перекрестные исследования, в которых сообщалось об устойчивости к тигециклину у последовательных изолятов A. baumannii среди госпитализированных пациентов иранских клиник.
Результаты. В метаанализ было включено в общей сложности 16 исследований. Общая распространенность штаммов A. baumannii, устойчивых к тигециклину, составила 18,1%. Выявлены отчетливые различия в устойчивости. Несмотря на то, что исследования проводились в ограниченном количестве регионов, сообщалось о широком диапазоне резистентности: от минимальной в исследовании в Тегеране (0%) до максимальной в исследовании в Тебризе (100%).
Заключение. В результате проведенного исследования установлено, что, несмотря на высокий уровень резистентности в некоторых городах Ирана, тигециклин по-прежнему остается одним из наиболее эффективных антибиотиков для лечения инфекции A. baumannii. Существует вероятность, что, улучшив контроль за применением антибиотиков, можно замедлить или остановить распространение устойчивости к ним.
Ключевые слова
Для цитирования:
Рахманян М., Варжови М.Н., Дерави Н., Нариман З., Голамзад А., Кайлани К., Ализаде А., Мусави-ан-фард С.Р. Оценка устойчивости Acinetobacter baumannii in vitro к тигециклину в Иране: систематический обзор и метаанализ. Медицина экстремальных ситуаций. 2025;27(2):257-266. https://doi.org/10.47183/mes.2025-318
For citation:
Rahmanian M., Varjovi M.N., Deravi N., Nariman Z., Gholamzad A., Keylani K., Alizadeh A., Mousavianfard S.R. In vitro evaluation of Acinetobacter baumannii resistance to tigecycline in Iran: a systematic review and meta-analysis. Extreme Medicine. 2025;27(2):257-266. https://doi.org/10.47183/mes.2025-318
ВВЕДЕНИЕ
Acinetobacter baumannii (A. baumannii) — это повсеместно встречающаяся аэробная грамотрицательная коккобацилла, широко распространенная в воде, почве, больничной среде и способная выживать в течение длительного времени [1][2]. Кроме того, A. baumannii является наиболее распространенным патогеном, высеваемым с поверхности кожи, из крови, мочи, плевральной жидкости и мокроты [3]. Миграция патогена из окружающей среды, способность длительно сохранять свою патогенность, в том числе в больничных условиях, а также сложности его эрадикации привели к увеличению частоты встречаемости данной бактериальной инфекции и к росту госпитальной инфекции [4]. Более того, ситуация осложнилась появлением, размножением и распространением нового лекарственно-устойчивого вида A. baumannii, способного к передаче наследуемой генетической информации относительно устойчивости к различным антибиотикам [5]. В опубликованных исследованиях сообщалось о резистентности A. baumannii к самым разным классам противомикробных препаратов: аминогликозидам, β-лактамам, хинолонам, а также карбапенемам. Таким образом, для лечения лекарственно-устойчивых инфекций, вызываемых A. baumannii, одним из потенциальных лекарственных препаратов можно рассматривать тигециклин [2][6].
Тигециклин — бактериостатическое средство с более высокой аффинностью и структурой, сходной с другими тетрациклинами. Его механизм действия аналогичен иным препаратам тетрациклинового ряда, в том числе препарат препятствует трансляции бактериального белка посредством гибкого связывания со спиральным участком (H34) на 30S-субъединице рибосомы. Фактически тигециклин препятствует интеграции аминокислотных остатков для расширения пептидных последовательностей и вызывает нарушение конфигурации пептидов и деления бактериальных клеток [7]. Механизм резистентности к тетрациклинам, как правило, опосредован получением генетических участков, передающих гены резистентности, особенно к тетрациклинам, мутациями внутри области прикрепления рибосом и/или мутациями в хромосомах, приводящих к усиленной экспрессии основных механизмов резистентности [8].
Тигециклин — это полусинтетическое средство, известное как основной антибиотик класса глицилциклинов. Тигециклин, антибиотик, созданный на основе миноциклина, обладает широким спектром действия и способен преодолевать основные механизмы устойчивости бактерий к тетрациклинам, такие как эффлюкс и защита рибосом. Это достигается благодаря добавлению глицикламидного фрагмента к молекуле миноциклина [7]. Это доступный препарат для борьбы с инфекцией A. baumannii с множественной лекарственной устойчивостью (МЛУ) [9]. Он проявляет активность в отношении многих патогенов с множественной лекарственной устойчивостью, таких как энтеробактерии, золотистый стафилококк и ацинетобактерии [10]. Управление по контролю за качеством продуктов питания и лекарственных средств США (FDA) в 2005 г. одобрило этот препарат для лечения внебольничной пневмонии, неосложненных и осложненных кожных инфекций, за исключением инфекции диабетической стопы, и осложненных абдоминальных инфекций [11].
Тигециклин обладает заметной активностью в от-ношении грамотрицательных бактерий с широкой лекарственной устойчивостью (ШЛУ) и МЛУ, в частности A. baumannii, но недавно появились сообщения об устойчивости к нему [12–14]. Некоторые механизмы, такие как хромосомный или дополнительный кодирующий процесс генов, также ответственны за устойчивость к тигециклину [7]. Поскольку этот препарат является одним из немногих оставшихся средств для лечения инфекции, вызываемой A. baumannii с МЛУ, необходимо своевременно определить его потенциальную резистентность. Поскольку эффективность превентивных мер в области здравоохранения в развитых странах значительно выше, в развивающихся странах, таких как Иран, необходимо внедрение надлежащих мер по контролю назначения лекарств, распространения информации об антибиотикорезистентности среди пациентов, механизмов регулирования правильного применения лекарственных препаратов [15]. Таким образом, исследование устойчивости A. baumannii к тигециклину у пациентов в Иране является важной и актуальной задачей.
Цель работы — оценка устойчивости Acinetobacter baumannii (A. baumannii) к тигециклину в Иране с учетом его клинического значения в лечении инфекций с множественной лекарственной устойчивостью.
МАТЕРИАЛЫ И МЕТОДЫ
Это исследование было проведено на основе стандартной методологии Кокрейновского руководства по систематическим обзорам вмешательств на основе чек-листа PRISMA (Предпочтительные элементы отчетности для систематических обзоров и метаанализов).
Систематический поиск опубликованных исследований проводили в базах данных Google Scholar, PubMed, Web of Science и Scopus для выявления всех доступных публикаций за все время до января 2024 г. Для поиска мы использовали ключевые слова и их комбинации, соответствующие предметным рубрикам: Acinetobacter baumannii, Тигацил®, тигециклин. Кроме того, для повышения результативности мы провели поиск научной литературы на основе цитирования (CoCites), который более эффективен, чем традиционные методы поиска по ключевым словам.
Критерии включения и исключения в исследование
Записи, полученные в результате поиска в базах данных, были объединены в библиотеке Endnote 20 (Thomson Reuters, Торонто, Онтарио, Канада), а дублирующие материалы были удалены.
Для анализа были отобраны материалы поперечных исследований in vitro, в которых изучали устойчивость A. baumannii к тигециклину, при этом возбудитель был получен из биологических сред, взятых у пациентов, поступивших в стационары Ирана, с использованием различных методов, включая микродилюцию в бульоне, дисковую диффузию и E-тест [16]. Более того, в это исследование были включены только пациенты с МЛУ, которую определяли как невосприимчивость по крайней мере к одному антибиотику из трех классов антимикробных препаратов, признанных в качестве вариантов лечения заболеваний, связанных с A. baumannii [17]. Были исключены биологические и биомедицинские исследования на животных моделях, а также отчеты о случаях, серии случаев, контрольные случаи и исследования, в которых оценивались переменные, не имеющие отношения к уровню резистентности.
Статистический анализ
Статистический анализ проводили с использованием комплексного программного обеспечения для метаанализа версии 3.0 (Biostat Inc., Энглвуд, Нью-Джерси, США). Были рассчитаны 95% доверительные интервалы (CIs) и точечные оценки уровня резистентности к тигециклину.
Степень существующей неоднородности между различными метаисследованиями оценивали с помощью значения I2 (количественного показателя неоднородности, который показывает меру степени несогласованности результатов исследований; величина, которую мы называем I2, описывает процент общего разброса между исследованиями, который обусловлен скорее неоднородностью, чем случайностью) и p-критерия.
Показатель I2 вычисляется на основе базовых результатов, полученных в результате типичного метаанализа, по формуле:
I2 = 100% × (Q – df) / Q, (1)
где Q — статистика неоднородности Кокрана, а df — степени свободы.
Отрицательные значения I2 приравнивали к нулю, так что I2 находился в диапазоне 0–100%. Значение 0% указывает на отсутствие наблюдаемой неоднородности, а большие значения указывают на увеличение неоднородности. Для оценки неоднородности между исследованиями использовали статистику I2 и Q-критерий Кокрана. Из-за высокого уровня гетерогенности между исследованиями (I2 > 50% или p < 0,1) мы использовали модель случайных эффектов. Также для оценки достоверности публикации мы использовали критерий Эггера. Соответственно значение p < 0,05 считалось статистически значимым показателем достоверности публикации.
ОБСУЖДЕНИЕ
Выбор исследования
На основе систематического поиска было выявлено 365 соответствующих цели исследования публикаций, в которых оценивалась распространенность резистентного A. baumannii к тигециклину у пациентов в Иране. В ходе первого скрининга было отобрано 190 статей по названию и аннотации, а во время второго — 53 статьи, основанных на полнотекстовой оценке. В соответствии с критериями включения и исключения 16 научных статей были признаны удовлетворяющими и включены в текущий систематический обзор и метаанализ (рис. 1).
Характеристики включенных исследований
Все отобранные статьи с данными о проведенных одномоментных углубленных исследованиях были опубликованы в период 2014–2022 гг. и охватывали разные области страны: столицу (n = 10), северный регион (n = 2), южный регион (n = 3) и юго-западный регион (n = 1) Ирана. Были взяты различные типы биологических сред/образцов у пациентов, включая содержимое ожоговых ран, мочу, мокроту, кровь и другие биологические жидкости организма (табл. 1).
Количество госпитальных изолятов МЛУ колеблется от 26 до 200. В 9 исследованиях проводили определение чувствительности A. baumannii к противомикробным препаратам с использованием метода дисковой диффузии, в четырех — метода микроразведения в бульоне, в трех исследованиях применяли Е-тест и в одном — комбинацию методов дисковой диффузии и микроразведения в бульоне (табл. 2).
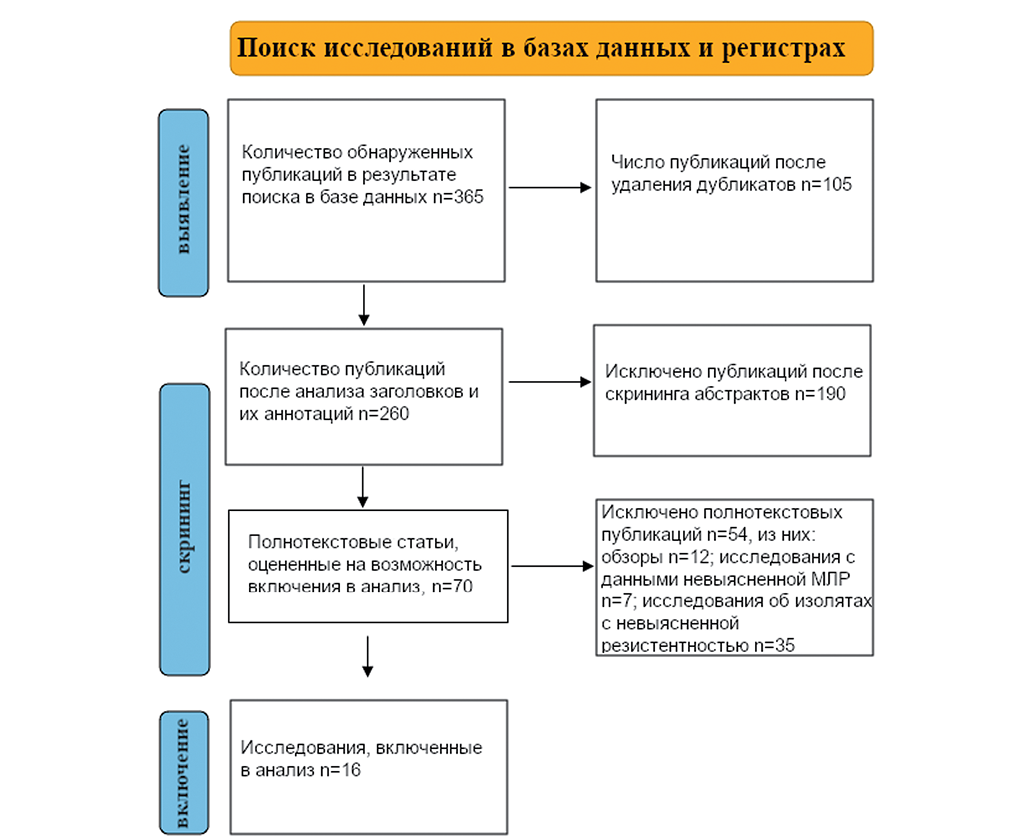
Рисунок подготовлен авторами
Рис. 1. Блок-схема исследований, включенных в систематический обзор
Таблица 1. Краткое описание включенных исследований
Исследование | Год публикации | Даты исследования | Тип исследований | Город | Популяция | |
1 | Sepahvand et al. [18] | 2022 | н.д. | Одномоментное | Шираз | ГП |
2 | Saadati et al. [13] | 2021 | 08.2017–02.2018 | Одномоментное | Тебриз | ГП |
3 | Alavi-Moghaddam et al. [19] | 2020 | 01.2016–11.2018 | Одномоментное | Тегеран | ГП |
4 | Salehi et al. 2019 [20] | 2019 | 08.2016–02.2017 | Одномоментное | Тегеран | ГП |
5 | Tafreshi et al. [21] | 2019 | 2016–2018 | Одномоментное | Тегеран | ГП |
6 | Yazdansetad et al. [22] | 2019 | 2013 | Одномоментное | Тегеран | ГП ожоговые |
7 | Salehi et al. 2018 [23] | 2018 | н.д. | Одномоментное | Тегеран | Пациенты, персонал и внешние объекты университетской клиники |
8 | Zafari et al. [24] | 2017 | 09.2015–06.2016 | Одномоментное | Тегеран | ГП |
9 | Sarhaddi et al. [25] | 2017 | 01.2014–12.2014 | Одномоментное | Мешхед | ГП |
10 | Ansari et al. [26] | 2017 | 09.2015–04.2016 | Одномоментное | Шехре-Корд | ГП |
11 | Alaei et al. [27] | 2016 | 02.2010–03.2011 | Одномоментное | Шираз | Пациенты ОРИТ/ПИТ |
12 | Pourhajibagher et al. [28] | 2016 | н.д. | Одномоментное | Тегеран | ГП |
13 | Jasemi et al. [29] | 2016 | 08.2011–12.2013 | Одномоментное | Тегеран | ГП |
14 | Kooti et al. [30] | 2015 | 12.2012–05.2013 | Одномоментное | Шираз | ГП |
15 | Bahador et al 2015 [31] | 2015 | 2012 | Одномоментное | Тегеран | Ожоговые пациенты |
16 | Bahador et al. 2014 [32] | 2014 | 2011 | Одномоментное | Тегеран | Пациенты ОРИТ/ПИТ |
17 | Bahador et al. 2014 [32] | 2014 | 2006 | Одномоментное | Тегеран | Пациенты ОРИТ/ПИТ |
Таблица составлена авторами по данным источников [13][18–32]
Примечание: ГП — госпитальные пациенты; ОРИТ — отделение реанимации и интенсивной терапии, ПИТ — палата интенсивной терапии; н.д. — нет данных.
Таблица 2. Перечень отобранных проб и методов исследования
№ п/п | Исследование | Биологический субстрат | МЛУ изоляты | TGC/МЛУ | Диагностический тест |
1 | Sepahvand et al. [18] | Кровь, отделяемое ран, моча и мокрота | 100 | 22 | Дискодиффузионный метод |
2 | Saadati et al. [13] | Трахеальный секрет, кровь, отделяемое раны, катетер, смывы бронхов, СМЖ, моча, мокрота, асцитическая жидкость | 100 | 100 | Дискодиффузионный метод |
3 | Alavi-Moghaddam et al. [19] | Кровь, трахеальный секрет, моча, СМЖ, катетер, плевральная жидкость | 109 | 35 | Дискодиффузионный метод |
4 | Salehi et al. 2019 [20] | Различные образцы, в основном мокрота | 180 | 152 | Дискодиффузионный метод |
5 | Tafreshi et al. [21] | Инфицированная ожоговая рана | 84 | 28 | Метод микроразведения в бульоне |
6 | Yazdansetad et al. [22] | Ожоговая рана | 63 | 22 | Метод микроразведения в бульоне |
7 | Salehi et al. 2018 [23] | Смывы с одежды и рук персонала, медицинского оборудования и стационарной обстановки | 125 | 2 | Дискодиффузионный метод |
8 | Zafari et al. [24] | Кровь, отделяемое раны, моча, мокрота, слизь из дыхательных путей | 100 | 2 | Дискодиффузионный метод |
9 | Sarhaddi et al. [25] | Ожоговая рана | 54 | 2 | E-тест |
10 | Ansari et al. [26] | Клинические образцы | 30 | 18 | Дискодиффузионный метод |
11 | Alaei et al [27] | Моча, мокрота, кровь, отделяемое послеоперационных ран, СМЖ, назальный секрет, слезная жидкость | 45 | 4 | Метод микроразведения в бульоне |
12 | Pourhajibagher et al. [28] | Ожоговая рана | 33 | 2 | Дискодиффузионный метод и метод микроразведения в бульоне |
13 | Jasemi et al. [29] | Клинические образцы | 26 | 8 | Дискодиффузионный метод |
14 | Kooti et al. [30] | Моча, отделяемое ран, кровь, мокрота, ЭТТ, биологические жидкости, отделяемое из носовой полости, глотки, глаз | 200 | 4 | Дискодиффузионный метод |
15 | Bahador et al. 2015 [31] | Клинические образцы | 62 | 11 | Метод микроразведения в бульоне |
16 | Bahador et al. 2014 [32] | Отделяемое ран, секрет дыхательных путей, моча, кровь, СМЖ | 50 | 4 | E-тест |
17 | Bahador et al. 2014 [32] | Отделяемое ран, секрет дыхательных путей, моча, кровь, СМЖ | 50 | 0 | E-тест |
Таблица составлена авторами по данным источников [13][18–32]
Примечание: TGC — тигециклин; СМЖ — спинномозговая жидкость; ЭТТ — эндотрахеальная трубка; МЛУ — множественная лекарственная устойчивость.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В исследованиях были отмечены различия в степени распространенности резистентных штаммов A. baumannii. Так, в исследовании Saadati et al. [13] было обнаружено, что все изоляты являются МЛУ (100 из 100), и авторы сообщили о самом высоком уровне резистентности (100%) к тигециклину на северо-западе Ирана. В своем исследовании Salehi et al. [18, 33] выявили, что на севере Ирана к тигециклину устойчивы были 1,6% клинических изолятов с МЛУ (2 из 125). В опубликованном исследовании Bahador et al. [31] описано, что на севере Ирана в течение пяти лет наблюдался заметный рост резистентности к тигециклину, причем в 2006 г. все изоляты продемонстрировали восприимчивость к тигециклину, тогда как уже в 2011 г. резистентность была установлена у 8% госпитальных изолятов. Исследование Kooti et al., проведенного в 2015 г. в госпиталях южных регионов Ирана [30], показало, что резистентность к тигециклину была выявлена у 2% (4 из 200) изолятов с МЛУ. Авторами Alaei et al. в 2016 г. [27] опубликованы данные о предполагаемом уровне резистентности в 8,8% (4 из 45) в том же регионе. В ходе эпидемиологических расследований, проведенных в столице Ирана в 2016–2018 гг., был зафиксирован широкий диапазон результатов о развитии резистентности к тигециклину — 1,6–84%. В исследовании Jasemi et al. [29] в нескольких больницах была проведена оценка распространенности и динамики фенотипов лекарственной устойчивости Acinetobacter baumannii в 2011–2013 гг. в Тегеране. Авторами отмечено значительное снижение резистентности к тигециклину.
Механизм резистентности к этому антибиотику, вероятно, связан с генотипическими особенностями изолятов Acinetobacter baumannii с множественной лекарственной устойчивостью (MDR-AB) и генами, участвующими в процессе формирования резистентности.
В исследовании Kooti et al. [30] с использованием мультиплексной ПЦР (полимеразной цепной реакции) выявлено 0,5, 7 и 40% изолятов, обладающих генами, подобными blaOXA-58-like, blaOXA-24-like и blaOXA-23-like соответственно.
В исследовании Bahador et al. [31] инсерционные последовательности ISAba1 и ISAba4 (семейство транспозазы) были идентифицированы выше blaOXA-23-like гена у 45,1 и 12,9% изолятов соответственно. Sarhaddi et al. [25] оценили частоту встречаемости blaTEM (семейство бета лактамазы класс А), blaOXA-23-like, blaOXA-24-like, blaVIM и blaIMP (семейство металл-бета-лактамаз подкласса В1) в 64,8, 66,7, 68,5, 70,4 и 70,4% соответственно. Наличие этих генов может свидетельствовать о корреляции с приобретением устойчивости к противомикробным препаратам.
Форест-диаграмма на основе данных, полученных в результате метаанализа, продемонстрировала, что устойчивость A. baumannii с МЛУ к тигециклину наблюдалась в 18,1% случаев (рис. 2). Что касается теста на гетерогенность, то для выбранных исследований были получены следующие результаты: Q = 305,71; df (Q) = 16; p = 0,000; I2 = 94,766. Во включенных исследованиях наблюдалась предвзятость публикаций, основанная на значимых результатах теста Эггера (p < 0,05), а воронкообразная диаграмма была асимметрична (рис. 3).
Анализ подгрупп
Общая частота резистентности A. baumannii из образцов от пациентов в палатах и отделениях интенсивной терапии (ПИТ/ОРИТ) и в других отделениях составила 0,072 и 0,222% соответственно (рис. 4). Подгруппа образцов от пациентов ПИТ/ОРИТ имела более низкую гетерогенность (I2 = 14,18%), в то время как у других пациентов ПИТ/ОРИТ, наблюдалась высокая гетерогенность (I2 = 95,28%).
Общая частота резистентности A. baumannii к тигециклину в Ширазе и Тегеране составила 0,079 и 0,161% соответственно (рис. 5). Значения I2 для этих исследований составили 91,31% для Шираза и 95,14% для Тегерана.
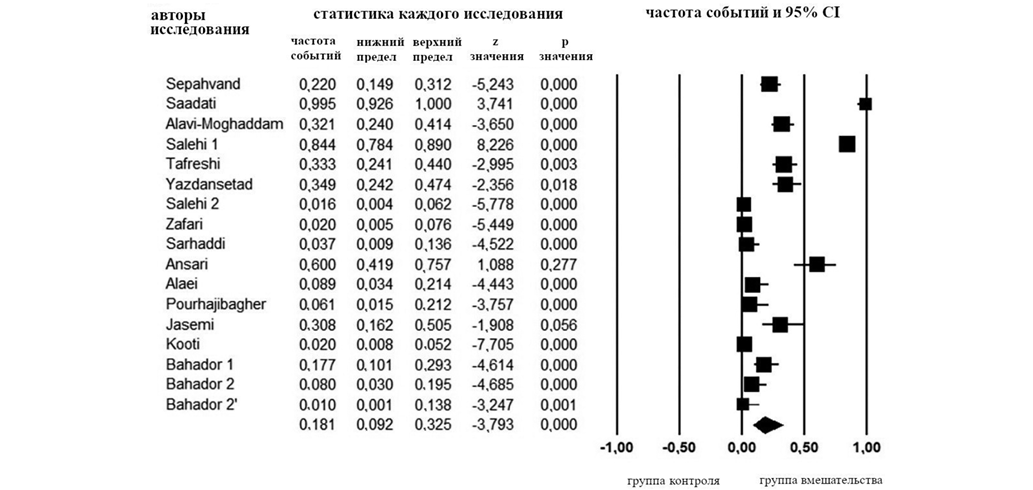
Рисунок подготовлен авторами
Рис. 2. Результаты метаанализа, оценивающего устойчивость к тигециклину среди различных изолятов A. baumannii в Иране
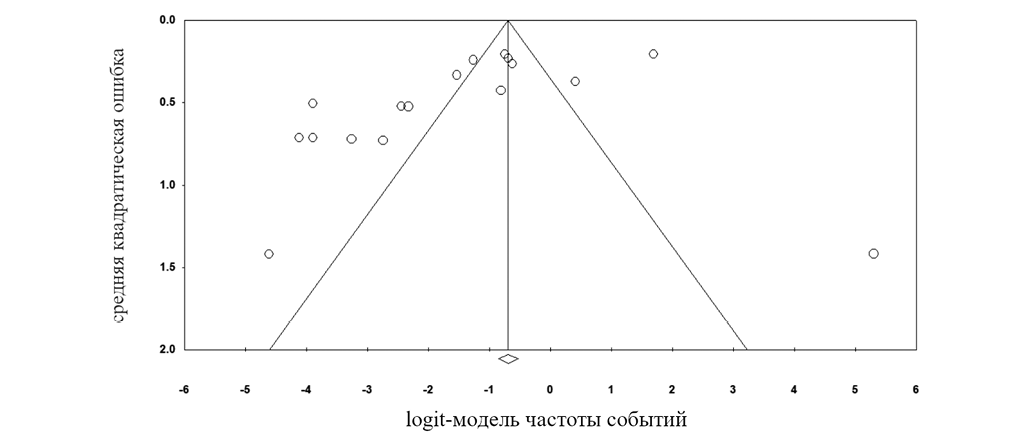
Рисунок подготовлен авторами
Рис. 3. Воронкообразная диаграмма средней квадратической ошибки с использованием logit-модели частоты событий

Рисунок подготовлен авторами
Рис. 4. Анализ исследований образцов пациентов ПИТ/ОРИТ
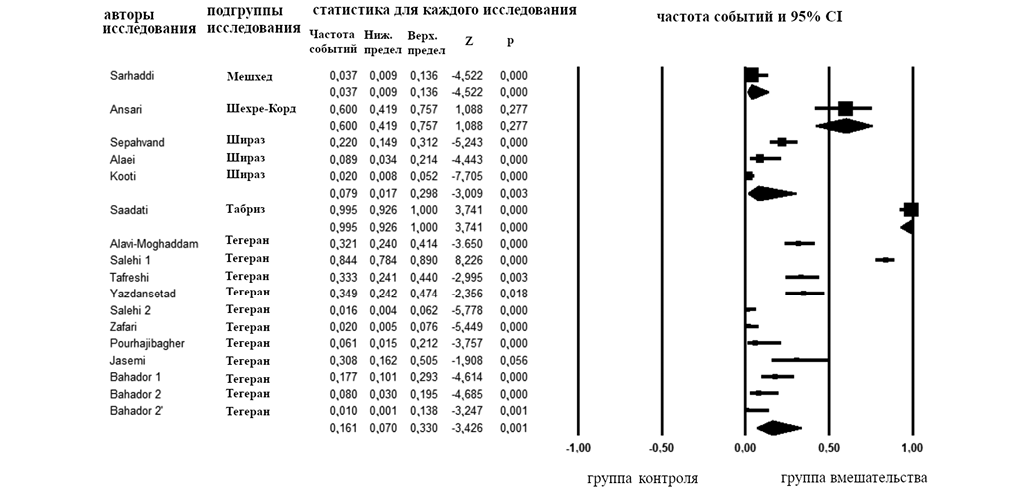
Рисунок подготовлен авторами
Рис. 5. Анализ подгрупп в зависимости от местоположения
ОБСУЖДЕНИЕ
A. baumannii играет ключевую роль в распространении внутрибольничной инфекций из-за своей устойчивости к различным классам антибиотиков [34][35]. На основании этого применение эффективных антибиотиков и постоянный мониторинг устойчивости к противомикробным препаратам могут помочь снизить темпы распространения A. baumannii.
Тигециклин — мощное полусинтетическое производное тетрациклина, признан основным препаратом среди новых лекарственных препаратов для лечения инфекций, вызываемых МЛУ штаммами Acinetobacter spp. и устойчивыми к карбапенемам A. baumannii [7][36]. Отличающиеся показатели степени резистентности могут быть объяснены различными способами применения препарата, применяемыми дозами и методами идентификации колоний согласно требованиям региональных отделов эпидемиологии. С 2005 г. уровень резистентности к тигециклину значительно возрос в результате длительного применения этого препарата в качестве монотерапии и одобрения этих протоколов лечения FDA.
В 2006 г. тигециклин был одобрен Европейским агентством по лекарственным средствам (EMA), в 2011 г. был представлен в Китае, а начиная с 2007 г. во всем мире появились сообщения о резистентности возбудителей к тигециклину. О резистентных штаммах Acinetobacter сообщалось вплоть до 2011 г. [37]. Было установлено, что чрезмерное/неконтролируемое применение антибиотиков этой группы связано с более высоким уровнем резистентности микроорганизмов [38]. Вероятно, существует косвенная корреляция между предшествующим применением антибиотиков других классов и резистентностью к тигециклину из-за транспорта аналогичной эффлюксной помпы [39]. Кроме того, лечение антибиотиками широкого спектра действия вместо применения антибиотиков узкого спектра действия из-за неточного дифференцирования/диагностики инфекции, неправильных доз и схемы применения лекарственного препарата, ошибок при микробиологическом контроле биологического материала, а также самолечения приводили к развитию лекарственной устойчивости [40].
Механизм резистентности к тигециклину опосредован эффлюксными помпами, такими как AdeABC. Другими возможными механизмами являются сверхэкспрессия AdeABC, вызванная аминокислотными и нуклеотидными изменениями в двухкомпонентной системе AdeRS и модифицированная системой BaeSR экспрессии AdeA и AdeB. Кроме того, мутация в генах, кодирующих 1-ацил-sn-глицерол-3-фосфатацилтрансферазу и S-аденозил-L-метионин (SAM)-зависимую метилтрансферазу, приводит к снижению восприимчивости [7].
Несмотря на наши выводы, аналогичные обзорные исследования показали противоречивые результаты. Так, в опубликованном исследовании Ni et al. авторами не рекомендовано назначать тигециклин, основываясь на оценке когортных и рандомизированных контролируемых исследований (РКИ-исследований). В этом исследовании был продемонстрирован более высокий уровень госпитальной смертности и низкая скорость эрадикации бактерий с неэффективностью комбинированной терапии у пациентов в группах обследования по сравнению с контрольными группами [17]. В исследовании Sodeifian et al. был проведен анализ результатов обсервационных исследований аналогично нашему исследованию. На основании этого анализа авторы не рекомендовали применять тигециклин в принятых схемах лечения. Они пришли к выводу, что общая эффективность тигециклина при лечении пациентов аналогична и не превышает эффективность противомикробных препаратов других групп. Кроме того, авторы сообщили о высоком уровне смертности пациентов и более низкой скорости уничтожения бактерий при применении тигециклина по сравнению с аналогичными показателями при применении колистина в рамках включенных исследований [41].
Следует проявлять осторожность при интерпретации результатов из-за ограниченности данных. Исследования по изучению частоты распространения A. baumannii с МЛУ в Иране немногочисленны, и большинство из них сосредоточены в крупных городах, в частности в Тегеране. Поэтому для обобщения результатов исследований, а также возможности их анализа применительно ко всей территории Ирана необходимо больше информации о частоте распространения A. baumannii в других городах. Следует учитывать небольшой размер выборок для подгруппового анализа статистического теста. Существует высокая вероятность предвзятости при оценке результатов исследований на основе контрольного списка The Joanna Briggs Institute (JBI), так как ни в одном из исследований не упоминались ограничивающие факторы и подходы к их устранению, а также в некоторых исследованиях не были точно описаны применяемые статистические методы. Применяемые критерии надежности оценки результатов и их достоверность также оставались неясными, что делало интерпретацию данных исследования ненадежной. Кроме того, многие клинические образцы были получены от пациентов ПИТ/ОРИТ наряду с отдельными лицами, госпитализированными в другие отделения, включая ожоговое, при этом имелись различия в методах выделения изолятов, условиях пребывания больных, в которых находятся пациенты ПИТ/ОРИТ, что может потенциально повлиять на результаты тестирования и чувствительность микроорганизмов к противомикробным препаратам. Кроме того, различный выбор методов тестирования на чувствительность к противомикробным препаратам, таких как дисковая диффузия, Е-тест или микроразведение в бульоне, также может привести к расхождениям в результатах. Такая изменчивость создает трудности при составлении окончательных выводов. Всестороннее исследование чувствительности различных изолятов A. baumannii к тигециклину позволит получить более полные сведения о возможности использования антибактериальной терапии для лечения инфекций, вызванных штаммами A. baumannii с МЛУ. Однако необходимы дальнейшие исследования, чтобы получить более достоверные данные об уровне резистентности.
ЗАКЛЮЧЕНИЕ
В настоящей работе мы оценили уровень резистентности A. baumannii у пациентов из некоторых городов Ирана. Согласно нашим выводам уровень резистентности штаммов A. baumannii к тигециклину высок, однако тигециклин по-прежнему считается эффективным препаратом против МЛУ-бактерий. Результаты метаанализа показали, что общее влияние тигециклина на частоту встречаемости резистентных штаммов в проанализированных исследованиях не связано с его более высокой степенью резистентности. Другими словами, рост резистентности A. baumannii к этому препарату не является статистически значимым, что подтверждено результатами других исследований, проведенных ранее в Иране.
Повышенная устойчивость A. baumannii к большинству антибиотиков, установленная в настоящем исследовании, возможно, связана с неправильным использованием или неоправданно высоким потреблением противомикробных препаратов широкого спектра действия, отсутствием доступа к чистой воде, нарушением алгоритмов санитарно-гигиенических и дезинфекционных мероприятий, назначением комбинаций противомикробных препаратов в фиксированных дозах, даже без знания доказанных преимуществ по сравнению с отдельными составами лекарственных средств, а также социальными факторами, такими как самолечение, использование противомикробных препаратов без рецепта, неадекватная профилактика инфекций и заболеваний, ограниченный доступ к качественным, недорогостоящим лекарствам, вакцинам и диагностическим средствам. Учитывая сложившуюся ситуацию с распространением резистентных изолятов, необходимо внедрение комплексных программ инфекционного контроля, направленных на локализацию и ограничение распространения штаммов A. baumannii в медицинских учреждениях.
Список литературы
1. Jung J, Park W. Acinetobacter species as model microorganisms in environmental microbiology: current state and perspectives. Appl Microbiol Biotechnol. 2015;99(6):2533–48. https://doi.org/10.1007/s00253-015-6439-y
2. Ahuatzin-Flores OE, Torres E, Chávez-Bravo E. Acinetobacter baumannii, a Multidrug-Resistant Opportunistic Pathogen in New Habitats: A Systematic Review. Microorganisms. 2024;12(4):644. https://doi.org/10.3390/microorganisms12040644
3. Shelburne SA, Singh KV, White AC, et al. Sequential outbreaks of infections by distinct Acinetobacter baumannii strains in a public teaching hospital in Houston, Texas. J Clin Microbiol. 2008;46(1):198–205. https://doi.org/10.1128/jcm.01459-07
4. Vijayakumar S, Rajenderan S, Laishram S, et al. Biofilm Formation and Motility Depend on the Nature of the Acinetobacter baumannii Clinical Isolates. Frontiers in Public Health. 2016;24(4):105. https://doi.org/10.3389/fpubh.2016.00105
5. Sayehmiri F, Alikhani MY, Sayehmiri K, et al. The Prevalence of Antibiotic Resistance to Polymyxins in Clinical Isolates of Acinetobacter baumannii in Iran and the World: A Systematic Review and Meta-Analysis. Shiraz E-Med J. 2017;18(12):e57580. https://doi.org/10.5812/semj.57580
6. Lima WG, Silva Alves GC, Sanches C, et al. Carbapenem-resistant Acinetobacter baumannii in patients with burn injury: A systematic review and meta-analysis. Burns. 2019;45(7):1495–508. https://doi.org/10.1016/j.burns.2019.07.006
7. Yaghoubi S, Zekiy AO, Krutova M, et al. Tigecycline antibacterial activity, clinical effectiveness, and mechanisms and epidemiology of resistance: narrative review. European Journal of Clinical Microbiology & Infectious Diseases. 2022:1–20. https://doi.org/10.1007/s10096-020-04121-1
8. Grossman TH. Tetracycline antibiotics and resistance. Cold Spring Harbor perspectives in medicine. 2016;6(4):a025387. https://doi.org/10.1101/cshperspect.a025387
9. Zhou Y, Chen X, Xu P, et al. Clinical experience with tigecycline in the treatment of hospital-acquired pneumonia caused by multidrug resistant Acinetobacter baumannii. BMC Pharmacology and Toxicology. 2019;20(1):19. https://doi.org/10.1186/s40360-019-0300-3
10. Yaghoubi S, Zekiy AO, Krutova M, et al. Tigecycline antibacterial activity, clinical effectiveness, and mechanisms and epidemiology of resistance: narrative review. Eur J Clin Microbiol Infect Dis. 2022;41(7):1003–22. https://doi.org/10.1007/s10096-020-04121-1
11. Townsend ML, Pound MW, Drew RH. Tigecycline in the treatment of complicated intra-abdominal and complicated skin and skin structure infections. Ther Clin Risk Manag. 2007;3(6):1059–70. PMID: 18516315
12. Navon-Venezia S, Leavitt A, Carmeli Y. High tigecycline resistance in multidrug-resistant Acinetobacter baumannii. J Antimicrob Chemother. 2007;59(4):772–4. https://doi.org/10.1093/jac/dkm018
13. Saadati M, Rahbarnia L, Farajnia S, et al. The prevalence of biofilm encoding genes in multidrug-resistant Acinetobacter baumannii isolates. Gene Reports. 2021;23:101094. https://doi.org/10.1016/j.genrep.2021.101094
14. Salehi B, Ghalavand Z, Mohammadzadeh M, et al. Clonal relatedness and resistance characteristics of OXA-24 and-58 producing carbapenem-resistant Acinetobacter baumannii isolates in Tehran, Iran. Journal of applied microbiology. 2019;127(5):1421–9. https://doi.org/10.1111/jam.14409
15. Ayukekbong JA, Ntemgwa M, Atabe AN. The threat of antimicrobial resistance in developing countries: causes and control strategies. Antimicrobial Resistance & Infection Control. 2017;6:1–8. https://doi.org/10.1186/s13756-017-0208-x
16. Kaprou GD, Bergšpica I, Alexa EA, et al. Rapid Methods for Antimicrobial Resistance Diagnostics. Antibiotics (Basel). 2021;10(2). https://doi.org/10.3390/antibiotics10020209
17. Ni W, Han Y, Zhao J, et al. Tigecycline treatment experience against multidrug-resistant Acinetobacter baumannii infections: a systematic review and meta-analysis. Int J Antimicrob Agents. 2016;47(2):107–16. https://doi.org/10.1016/j.ijantimicag.2015.11.011
18. Sepahvand S, Darvishi M, Mokhtari M, et al. Evaluation of genetic diversity of colistin-resistant Acinetobacter baumannii by BOX-PCR and ERIC-PCR: the first report. Future Microbiol. 2022;17:917–30. https://doi.org/10.2217/fmb-2021-0225
19. Alavi-Moghaddam M, Dolati M, Javadi A, et al. Molecular detection of oxacillinase genes and typing of clinical isolates of Acinetobacter baumannii in Tehran, Iran. Journal of Acute Disease. 2020;9(1):33–9. https://doi.org/10.4103/2221-6189.274016
20. Salehi B, Ghalavand Z, Mohammadzadeh M, et al. Clonal relatedness and resistance characteristics of OXA-24 and -58 producing carbapenem-resistant Acinetobacter baumannii isolates in Tehran, Iran. J Appl Microbiol. 2019;127(5):1421–9. https://doi.org/10.1111/jam.14409
21. Tafreshi N, Babaeekhou L, Ghane M. Antibiotic resistance pattern of Acinetobacter baumannii from burns patients: increase in prevalence of blaOXA-24-like and blaOXA-58-like genes. Iranian Journal of Microbiology. 2019;11(6):502. https://doi.org/10.18502/ijm.v11i6.2222
22. Yazdansetad S, Najari E, Ghaemi EA, et al. Carbapenemresistant Acinetobacter baumannii isolates carrying blaOXA genes with upstream ISAba1: First report of a novel OXA subclass from Iran. Journal of Global Antimicrobial Resistance. 2019;18:95–9. https://doi.org/10.1016/j.jgar.2018.12.011
23. Salehi B, Goudarzi H, Nikmanesh B, et al. Emergence and characterization of nosocomial multidrug-resistant and extensively drug-resistant Acinetobacter baumannii isolates in Tehran, Iran. Journal of infection and chemotherapy. 2018;24(7):515–23. https://doi.org/10.1016/j.jiac.2018.02.009
24. Zafari M, Feizabadi MM, Jafari S, et al. High prevalence of OXA-type carbapenemases among Acinetobacter baumannii strains in a teaching hospital of Tehran. Acta microbiologica et immunologica Hungarica. 2017;64(4):385–94. https://doi.org/10.1556/030.64.2017.031
25. Sarhaddi N, Soleimanpour S, Farsiani H, et al. Elevated prevalence of multidrug-resistant Acinetobacter baumannii with extensive genetic diversity in the largest burn centre of northeast Iran. Journal of global antimicrobial resistance. 2017;8:60–6. https://doi.org/10.1016/j.jgar.2016.10.009
26. Ansari H, Doosti A, Kargar M, et al. Antimicrobial resistant determination and prokaryotic expression of smpA gene of Acinetobacter baumannii isolated from admitted patients. Jundishapur Journal of Microbiology. 2017;10(11):e59370. https://doi.org/10.5812/jjm.59370
27. Alaei N, Aziemzadeh M, Bahador A. Antimicrobial resistance profiles and genetic elements involved in carbapenem resistance in Acinetobacter baumannii isolates from a referral hospital in Southern Iran. Journal of Global Antimicrobial Resistance. 2016;5:75–9. https://doi.org/10.1016/j.jgar.2015.12.005
28. Pourhajibagher M, Mokhtaran M, Esmaeili D, et al. Antibiotic resistance patterns among Acinetobacter baumannii strains isolated from burned patients. Der Pharmacia Lettre. 2016;8(8):347–51.
29. Jasemi S, Douraghi M, Adibhesami H, et al. Trend of extensively drug-resistant Acinetobacter baumannii and the remaining therapeutic options: a multicenter study in Tehran, Iran over a 3-year period. Letters in applied microbiology. 2016;63(6):466–72. https://doi.org/10.1111/lam.12669
30. Kooti S, Motamedifar M, Sarvari J. Antibiotic resistance profile and distribution of oxacillinase genes among clinical isolates of Acinetobacter baumannii in Shiraz teaching hospitals, 2012– 2013. Jundishapur journal of microbiology. 2015;8(8):e20215. https://doi.org/10.5812/jjm.20215v2
31. Bahador A, Raoofian R, Farshadzadeh Z, et al. The prevalence of ISAba1 and ISAba4 in Acinetobacter baumannii species of different international clone lineages among patients with burning in Tehran, Iran. Jundishapur journal of microbiology. 2015;8(7):e17167. https://doi.org/10.5812/jjm.17167v2
32. Bahador A, Raoofian R, Taheri M, et al. Multidrug resistance among Acinetobacter baumannii isolates from Iran: changes in antimicrobial susceptibility patterns and genotypic profile. Microbial Drug Resistance. 2014;20(6):632–40 https://doi.org/10.1089/mdr.2013.0146
33. Salehi B, Goudarzi H, Nikmanesh B, et al. Emergence and characterization of nosocomial multidrug-resistant and extensively drug-resistant Acinetobacter baumannii isolates in Tehran, Iran. Journal of infection and chemotherapy: official journal of the Japan Society of Chemotherapy. 2018;24(7):515–23 https://doi.org/10.1016/j.jiac.2018.02.009
34. Mulani MS, Kamble EE, Kumkar SN, et al. Emerging Strategies to Combat ESKAPE Pathogens in the Era of Antimicrobial Resistance: A Review. Front Microbiol. 2019;10:539. https://doi.org/10.3389/fmicb.2019.00539
35. Antunes LC, Visca P, Towner KJ. Acinetobacter baumannii: evolution of a global pathogen. Pathog Dis. 2014;71(3):292–301. https://doi.org/10.1111/2049-632x.12125
36. Büyük A, Yilmaz FF, Gül Yurtsever S, et al. Antibiotic Resistance Profiles and Genotypes of Acinetobacter baumannii Isolates and In Vitro Interactions of Various Antibiotics in Combination with Tigecycline and Colistin. Turk J Pharm Sci. 2017;14(1):13–8.
37. Korczak L, Majewski P, Iwaniuk D, et al. Molecular mechanisms of tigecycline-resistance among Enterobacterales. Frontiers in Cellular and Infection Microbiology. 2024;14:1289396. https://doi.org/10.3389/fcimb.2024.1289396
38. Llor C, Bjerrum L. Antimicrobial resistance: risk associated with antibiotic overuse and initiatives to reduce the problem. Therapeutic advances in drug safety. 2014;5(6):229–41. https://doi.org/10.1177/2042098614554919
39. Zhong X, Xu H, Chen D, et al. First emergence of acrAB and oqxAB mediated tigecycline resistance in clinical isolates of Klebsiella pneumoniae pre-dating the use of tigecycline in a Chinese hospital. PloS one. 2014;9(12):e115185. https://doi.org/10.1371/journal.pone.0115185
40. Uddin TM, Chakraborty AJ, Khusro A, et al. Antibiotic resistance in microbes: History, mechanisms, therapeutic strategies and future prospects. Journal of infection and public health. 2021;14(12):1750–66. https://doi.org/10.1016/j.jiph.2021.10.020
41. Sodeifian F, Zangiabadian M, Arabpour E, et al. Tigecyclinecontaining regimens and multi drug-resistant Acinetobacter baumannii: a systematic review and meta-analysis. Microbial Drug Resistance. 2023;29(8):344–59. https://doi.org/10.1089/mdr.2022.0248
Об авторах
М. РахманянИран
Мохаммад Рахманян
Тегеран
М. Н. Варжови
Иран
Махдия Нозад Варжови
Тебриз
Н. Дерави
Россия
Нилуфар Дерави
Тегеран
З. Нариман
Иран
Зара Нариман
Тегеран
А. Голамзад
Иран
Амир Голамзад
Тегеран
К. Кайлани
Иран
Кимия Кайлани
Тегеран
А. Ализаде
Иран
Алалех Ализаде
Мешхед
С. Р. Мусави-ан-фард
Иран
Сейед Реза Мусави-ан-фард
Тегеран
Дополнительные файлы
Рецензия
Для цитирования:
Рахманян М., Варжови М.Н., Дерави Н., Нариман З., Голамзад А., Кайлани К., Ализаде А., Мусави-ан-фард С.Р. Оценка устойчивости Acinetobacter baumannii in vitro к тигециклину в Иране: систематический обзор и метаанализ. Медицина экстремальных ситуаций. 2025;27(2):257-266. https://doi.org/10.47183/mes.2025-318
For citation:
Rahmanian M., Varjovi M.N., Deravi N., Nariman Z., Gholamzad A., Keylani K., Alizadeh A., Mousavianfard S.R. In vitro evaluation of Acinetobacter baumannii resistance to tigecycline in Iran: a systematic review and meta-analysis. Extreme Medicine. 2025;27(2):257-266. https://doi.org/10.47183/mes.2025-318
















