Перейти к:
Изучение антимикробного действия низкотемпературной аргоновой плазмы на хирургическую инфекцию в эксперименте in vitro
https://doi.org/10.47183/mes.2025-332
Аннотация
Введение. Применение метода на основе низкотемпературной аргоновой плазмы (НТАП) широко изучается в качестве альтернативного подхода к профилактике развития гнойных инфекций в случаях, когда эффективность антимикробных препаратов и антисептиков снижена из-за сформированной к ним устойчивости патогенов.
Цель. Оценка выживаемости условно-патогенных микроорганизмов, обладающих патогенным потенциалом, после воздействия факторов НТАП на модели in vitro.
Материалы и методы. Исследование выполнено с использованием клинических штаммов из группы ESKAPE-патогенов (группа супер-микроорганизмов с высоким эпидемическим потенциалом формирования госпитальных штаммов) и эталонных музейных культур, а также смеси штаммов. В качестве источника НТАП использовали плазменно-дуговую установку «ПЛАЗМОРАН» (Россия). В работе использовали один режим плазмогенерации, три варианта расстояния от среза сопла плазмотрона до плоскости расположения культуры в чашке Петри (10, 15 и 20 см), четыре варианта экспозиции действия факторов НТАП на культуры (15, 30, 45 с для бактерий и 30, 45 и 60 с для грибов). Оценку выживаемости патогенных микроорганизмов in vitro после воздействия НТАП определяли по задержке бактериального роста.
Результаты. Выявлено выраженное противомикробное действие в отношении клинических штаммов грамотрицательных бактерий из группы ESKAPE-патогенов K. pneumoniae, Р. aeruginosa, A. baumanii, E. coli, грамположительных бактерий MRSA и дрожжеподобных грибов С. albicans при времени воздействия 30–45 с для бактерий (необходимая при этом доза излучения УФ-А 37,8 Дж/м2, УФ-В 15,9 Дж/м2, УФ-С 34,2 Дж/м2) и расстоянии от сопла прибора 10–15 см. Противомикробное действие НТАП заключается в отсутствии роста микроорганизмов на питательных средах в месте воздействия НТАП при определенных дозе воздействия, времени экспозиции и расстоянии, обеспечивающих снижение титра жизнеспособных микроорганизмов не только монокультур, но и в ассоциации бактерий, как в отношении музейных эталонных культур, так и в отношении клинических штаммов из группы ESKAPE-патогенов.
Выводы. Факторы НТАП, формируемые плазменно-дуговой установкой «ПЛАЗМОРАН», обладают выраженным антибактериальным и противогрибковым действием как в отношении музейных эталонных культур, так и в отношении клинических штаммов рабочей коллекции группы ESKAPE-патогенов. Эффективность воздействия факторов НТАП обеспечивает снижение титра жизнеспособных микроорганизмов с 10 8 –10 9 до единичных КОЕ. Факторы воздействия НТАП (доза излучения УФ-А 37,8 Дж/м2; УФ-В 15,9 Дж/м2; УФ-С 34,2 Дж/м2) имеют наибольший эффект при обработке бактериальных культур на расстоянии 10–15 см с экспозицией 30–45 с; для грибов (доза излучения УФ-А 168,6 Дж/м2; УФ-В 68,4 Дж/м2; УФ-С 159 Дж/м2) при расстоянии 10 см и времени воздействия 60 с. A. baumannii и E. faecium более устойчивы к факторам воздействия НТАП, чем другие исследованные бактерии при стандартных дозе, времени воздействия и расстоянии. C. albicans более устойчива к факторам воздействия НТАП по сравнению с бактериями, и их уничтожение требует большей экспозиции воздействия и меньшего расстояния от сопла плазмотрона до обрабатываемой поверхности. Полученные результаты требуют дальнейшего изучения.
Ключевые слова
Для цитирования:
Загайнова А.В., Сухина М.А., Земляной А.Б., Зеленина Т.А., Маркевич П.С., Новожилов К.А., Федец З.Е., Панькова М.Н., Мания Т.Р., Грицюк О.В. Изучение антимикробного действия низкотемпературной аргоновой плазмы на хирургическую инфекцию в эксперименте in vitro. Медицина экстремальных ситуаций. 2025;27(3):351-366. https://doi.org/10.47183/mes.2025-332
For citation:
Zagainova A.V., Sukhina M.A., Zemlianoi A.B., Zelenina T.A., Markevich P.S., Novozhilov K.A., Fedets Z.E., Pankova M.N., Maniya T.R., Gritsyuk O.V. Antimicrobial effect of low-temperature argon plasma on surgical infection in vitro. Extreme Medicine. 2025;27(3):351-366. https://doi.org/10.47183/mes.2025-332
ВВЕДЕНИЕ
Бактерии являются повсеместными обитателями окружающей среды и организма человека и играют жизненно важную роль в поддержании экологического баланса. Среди всех известных бактерий, которые даже не являются патогенами, только около 1% могут вызывать инфекции у пациентов с ослабленным иммунитетом. И.И. Мечников первым указал на возможность проявления патогенных свойств у нормальной микрофлоры человека. При возникновении повреждения кожных покровов на раневую поверхность может попадать как транзиторная, так и резидентная условно-патогенная микрофлора; такие условно-патогенные бактерии, как Staphylococcus aureus, Streptococcus sp. и Pseudomonas aeruginosa, являются распространенными возбудителями кожных и раневых инфекций [1].
Антибактериальная терапия часто не позволяет преодолеть инфекции, вызванные потенциально патогенной микрофлорой, из-за широко распространенной устойчивости их к антибиотикам [2–6]. Биопленки, образованные прикрепившимися бактериями, еще больше усложняют уничтожение бактерий [7–10]. Помимо увеличения количества резистентных к антибиотикам микроорганизмов, антибактериальная терапия зачастую невозможна для пациентов с все чаще наблюдаемыми аллергическими и токсическими реакциями на лекарственные препараты [11].
Растущая антибиотикорезистентность и ее быстрое распространение представляют собой серьезную угрозу для здоровья человека. В последние десятилетия наблюдается увеличение количества выделяемых из окружающей среды и биоматериала грамотрицательных бактерий с множественной лекарственной устойчивостью, таких как Escherichia coli, Serratia coli, Proteus mirabilis, Pneumocystis pneumoniae, Pseudomonas aeruginosa и грамположительный метициллин-резистентный золотистый стафилококк Staphylococcus aureus (MRSA) [12].
До настоящего времени большинство исследований, направленных на борьбу с инфекциями, вызванными потенциально патогенной микрофлорой, сосредоточены на поиске химических средств, эффективных в отношении бактерий.
Альтернативные подходы к профилактике и лечению гнойных инфекций, основанные на использовании физических факторов, становятся все более актуальными в условиях снижения эффективности антимикробных препаратов из-за развития устойчивости микроорганизмов. Одним из перспективных методов местного лечения с выраженным бактерицидным действием является применение низкотемпературной аргоновой плазмы (НТАП) [13–16]. НТАП представляет собой поток частично ионизированного нейтрального газа макроскопической температуры, получаемый при атмосферном давлении [17]. Поток плазмы несет электроны, ионы, свободные радикалы, возбужденные молекулы и ультрафиолетовое излучение [18][19].
Бактерицидное воздействие плазмы обусловлено синергетическим действием ионизированных элементов и ультрафиолетового излучения, что приводит к формированию окислительного стресса и повреждению ДНК бактерий [20–23]. НТАП обладает выраженным антимикробным эффектом.
Медицинские изделия и оборудование обрабатываются в три этапа: дезинфекция, предстерилизационная очистка, стерилизация. Многоразовые инструменты, аппараты, оборудование и системы после каждого пациента обрабатывают механическим, физическим (термическим), химическим или комбинированным методом. Механический метод обработки заключается в протирании систем, крупногабаритных аппаратов и инструментов, не контактирующих с кровью, салфетками с дезинфицирующим средством. Физический (термический) способ заключается в нагреве в воде температурой 70–80 °С, обработке паром или горячим воздухом (например, паром под давлением обрабатывают постельные принадлежности, воздухом 120 °С дезинфицируют не загрязненные выделениями медицинские изделия из стекла, металлов, силиконовой резины). Химический способ заключается в погружении инструментария в емкости с дезинфектантом. В качестве комбинированного метода используют сочетание физического и химического способов обеззараживания, например обработка инструментов в чистящем растворе одновременно с нагревом. Нетепловая плазма может быть эффективной для стерилизации медицинского оборудования, когда не подходит термическая или химическая обработка [13][24][25].
Сообщается о применении низкотемпературной плазмы для улучшения регенерации кожи в косметологии [26][27]. Показано, что применение НТАП эффективно для заживления ран и снижения болевого синдрома после геморроидэктомии, в том числе за счет выраженного бактерицидного действия [28]. Обработка НТАП ускоряла регенеративные процессы и очищение раны при коррекции поздних гнойно-воспалительных осложнений контурной пластики с применением полиакриламидного геля [29].
Авторами Pierdzioch et al.; Herbst et al. впервые при воздействии НТАП на загрязненные срезы дентина выявлен бактерицидный эффект [30][31].
Благодаря неспецифическому и проникающему действию НТАП может использоваться для снижения микробной контаминации тканей, для локального бактерицидного воздействия на инфицированные раны и снижения интенсивности воспаления в месте ранения.
НТАП обладает рядом ключевых преимуществ, включая высокую неспецифическую бактерицидную активность, низкий потенциал формирования устойчивых форм микроорганизмов. Кроме того, НТАП представляет собой перспективный метод лечения острых и хронических ран благодаря своей относительной простоте, низкой стоимости и отсутствию особых требований к обработке раневых поверхностей.
Цель исследования — оценка выживаемости условно-патогенных микроорганизмов после воздействия факторов НТАП на модели in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено с использованием клинических штаммов из группы ESKAPE-патогенов: Klebsiella pneumoniae, Pseudomonas aeruginosa, Acinetobacter baumannii, Escherichia coli, грамположительных бактерий MRSA Staphylococcus aureus, Enterococcus faecalis, Enterococcus faecium, обладающих множественной устойчивостью к антибактериальным препаратам по системе EUCAST, дрожжеподобных грибов Сandida albicans и эталонных музейных культур E. coli АТСС 10536, K. pneumoniae subsp. pneumoniae АТСС 700603, Staphylococcus aureus 906, Pseudomonas aeruginosa ATCC 10145, Enterococcus faecalis АТСС 29212, Enterococcus faecium 9/63, грибов Candida albicans АТСС 24433.
Штаммы микроорганизмов, использованные в работе, были взяты из рабочей коллекции лаборатории микробиологии и паразитологии ФГБУ «ЦСП» ФМБА России. Исследование проведено с использованием паспортизированных музейных культур с подтвержденными биохимическими свойствами, выращенных на плотных агаризованных средах (контроль качества). Эталонные музейные культуры приобретены из национальных и государственных коллекций. Культуры хранили в рабочей коллекции в криозащитной среде в низкотемпературных морозильных камерах при температуре минус 70 °С.
Для выращивания микроорганизмов использовали следующие плотные агаризованные питательные среды: среда Эндо для культивирования E. coli, K. pneumoniae, P. aeruginosa; желточно-солевой агар для культивирования S. aureus; энтерококк-агар для культивирования E. faecalis и E. faecium; среда Сабуро для культивирования C. albicans.
В ходе исследования проводили оценку динамического диапазона действия факторов НТАП на выживаемость как отдельных штаммов микроорганизмов из группы ESKAPE-патогенов, так и смеси культур микроорганизмов.
Методика проведения исследования заключалась в следующем. Суточные культуры штаммов микроорганизмов наносили капельным методом на поверхность агаризованной среды чашек Петри (d = 90 мм) для образования сплошного газона из расчета 100 мкл на чашку. В наносимой на поверхность агаризованной среды суспензии содержание каждого микроорганизма составляло 4,5 McFarland Standard No, что соответствует 9,0×108–1,2×109 КОЕ/мл. Суспензию микроорганизмов тщательно растирали шпателем по всей поверхности агара. Затем каждую чашку с внесенным микроорганизмом подвергали обработке с применением плазменно-дуговой хирургической установки для лечения ран «Плазморан» (ТУ 9444-001-43009282-2015, производства ООО «Плазмопром», Россия) в заданном режиме с учетом расстояния 10, 15 и 20 см (Фактор L) и времени воздействия 15, 30, 45 с для бактерий и 30, 45 и 60 с для грибов (Фактор T). В процессе проведения исследования использовали один режим плазмогенерации, три варианта расстояния от среза сопла плазмотрона до плоскости расположения культуры в чашке Петри, четыре варианта экспозиции действия факторов НТАП на культуры. В качестве установления титра микроорганизмов, используемого для посевов в инокуляте бактериальной взвеси, применяли способ разведения с посевом на чашке Петри с последующим учетом роста КОЕ на поверхности агаризованных сред.
Обработке подлежали секторы посева бактериальных культур, попадающие в область воздействия прибора, которую контролировали по зоне освещенности на питательной среде. В качестве контроля использовали посевы микроорганизмов без обработки НТАП.
После обработки НТАП чашки с культурами помещали в термостат для культивирования. Контрольная группа с посевами микроорганизмов также помещались в термостат для дальнейшего инкубирования.
Оценку эффективности влияния НТАП на задержку роста микроорганизмов определяли по наличию или отсутствию зоны лизиса на питательной среде. Оценку результатов проводили путем замера диаметра задержки зоны лизиса и подсчета в зоне лизиса числа выросших клонов микроорганизмов.
Чашки с посевами инкубировали в инкубаторе «BD240» (Binder, Германия) в течение 24–48 ч при температуре 37 ± 1 °С для бактерий и при двух температурных режимах, 37 ± 1 и 26 ± 1 °С, для грибов. После инкубации проводили подсчет выросших колоний, осуществляемый двумя способами: вручную и с помощью автоматического счетчика колоний Scan 1200 (Франция). Чистоту каждой культуры и идентификацию проводили методом масс-спектрометрии на масс-спектрометре Microflex c программным обеспечением (Bruker Daltonik GmbH, Германия). Затем биомассу выросших колоний бактерий, находящихся в экспоненциальной фазе роста, снимали с поверхности двух чашек плотной среды.
Оценку влияния НТАП на выживаемость микроорганизмов из группы ESKAPE-патогенов проводили через 24 ± 2 ч для бактерий и через 48 ± 2 ч и 7 сут для грибов.
Рабочими факторами, формируемыми плазмогенератором, были: газодинамический поток рабочего газа; рекомбинационное излучение с широким спектром — от области вакуумного ультрафиолета до ближнего инфракрасного диапазона; газ аргон с выраженными каталитическими свойствами в реакциях с участием кислорода, азота и их соединений; озон, образующийся в результате воздействия рекомбинационного излучения на кислород воздуха.
При обработке чашек излучением НТАП чашки основной группы располагали так, чтобы пятно освещенности излучения НТАП краевой области охватывало центральную зону посева (рис. 1). В контрольных группах всех исследованных тест-микроорганизмов чашки с культурой не подвергали воздействию излучения НТАП.
При обработке использовали режим прибора В2 при значениях фактора времени (Т) 15, 30, 45 с и фактора расстояния (L) 10, 15, 20 см. Энергетические характеристики, используемые для обработки чашек, указаны в таблице 1. В связи с тем что прибор измеряет энергетическую освещенность (она же интенсивность излучения) в Вт/м2, характер накопления энергии выражается в Дж/м2, который равен Вт/м2 × время излучения (в секундах). Энергетические характеристики излучения НТАП измерены производителем с использованием оборудования «ТКА-ПКМ 13». Прибор имеет три датчика: УФ-А (400–315 нм), УФ-В (315–280 нм), УФ-С (280–200 нм).
Оценку результатов исследования эффективности обработки НТАП проводили на основании подсчета процента отмирания бактерий и грибов на поверхности контрольных и опытных образцов по формуле:
Эффективность (%) = 100 – ( (ΣT × 100)/Сср), (1)
где Сср — среднее значение количества бактерий в исходной суспензии, равное отношению ∑С/N;
∑С — сумма всех колоний, выросших на чашках во всех повторностях;
N — количество повторностей;
Тср — среднее значение количества бактерий, выросших на чашках после 24–48 ч инкубации посевов, равное отношению ∑Т/n;
∑Т — сумма всех колоний, выросших на чашках после 24–48 ч инкубации посевов во всех повторностях;
n — количество чашек (не менее 5 для каждого исследуемого тест-микроорганизма или смеси тест-микроорганизмов в соответствии с ЕН ИСО 11737-11),
используемых для исследования (одинаковое для контроля и обработанной НТАП чашки Петри с тест-микроорганизмами).
Критерием антимикробной активности в отношении тест-микроорганизмов или смеси тест-микроорганизмов считали снижение роста колоний не менее чем на 99,99% или полное отсутствие роста тест-микроорганизмов. Определение жизнеспособных колоний проводили путем подсчета выросших колоний каждого вида микроорганизмов на поверхности питательных сред в чашках Петри (с использованием микроскопа биологического Leica DM6B-Z, ин/н-243302670221503917, з/н-503838 со встроенной камерой; увеличение ×100).
Статистическая обработка результатов исследования проведена с использованием пакета программ Statistica 10.0 (StatSoft Inc., США). Подсчитывали стандартное отклонение и ошибку после учета результатов на каждой из 5 чашек, применяли t-критерий Стьюдента с поправкой Бонферрони, считая распределение нормальным. Различия считали статистически значимыми при p < 0,05.
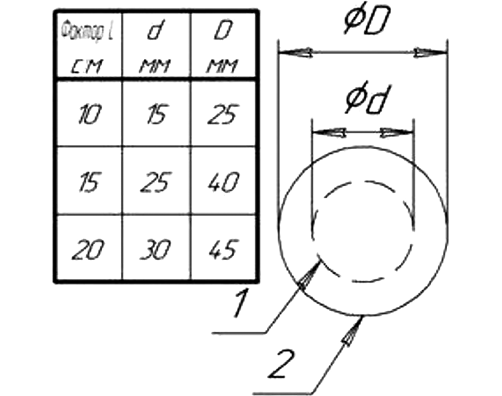
Рисунок подготовлен авторами
Рис. 1. Геометрия пятна освещенности на обрабатываемой поверхности, формируемого рекомбинационным излучением НТАП, в зависимости от значения Фактора L: 1 — граница центральной и краевой областей; 2 — внешняя граница краевой области
Таблица 1. Характеристики плазменно-дуговой хирургической установки «Плазморан», используемые для обработки
Тип УФ | Фактор T, с | |||
15 | 30 | 45 | 60 | |
Фактор L = 10 см | ||||
УФ-А | 42,15 | 84,3 | 126,45 | 168,6 |
УФ-В | 17,1 | 34,2 | 51,3 | 68,4 |
УФ-С | 39,75 | 79,5 | 119,25 | 159,0 |
Фактор L = 15 см | ||||
УФ-А | 18,9 | 37,8 | 56,7 | 75,6 |
УФ-В | 7,95 | 15,9 | 23,85 | 31,8 |
УФ-С | 17,1 | 34,2 | 51,3 | 68,4 |
Фактор L = 20 см | ||||
УФ-А | 12,15 | 24,3 | 36,45 | 48,6 |
УФ-В | 4,68 | 9,36 | 14,04 | 18,72 |
УФ-С | 10,2 | 20,4 | 30,6 | 40,8 |
Таблица составлена авторами по собственным данным
Примечание: измерения интенсивности излучения выражали в Дж/м2 ± 10 %.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Первый этап исследования проводили с музейными культурами в трех повторностях для каждой комбинации, включающей расстояние и время воздействия НТАП.
В результате исследований, проведенных на эталонных музейных культурах при воздействии НТАП (при различном расстоянии и времени обработки), достигнуто угнетение бактериального роста (эффективность 99,999–100%) в отношении E. faecalis АТСС 29212, E. Faecium 9/63, K. pneumoniae subsp. pneumoniae АТСС 700603, E. coli АТСС 10536, P. aeruginosa ATCC 10145, S. Aureus 906; соответствующие данные представлены в таблице 2.
Эффективность угнетения бактериального роста на уровне 100% достигнута для Enterococcus faecalis на расстоянии 10 см через 15 с при воздействии дозы УФ-А 42,15 Дж/м2, дозы УФ-В 17,1 Дж/м2 и дозы УФ-С 39,75 Дж/м2. В то же время угнетение бактериального роста при воздействии доз на уровне УФ-А 84,3 Дж/м2, УФ-В 34,2 Дж/м2 и УФ-С 79,5 Дж/м2 было достигнуто при экспозиции 30 с, а при воздействии УФ-А 126,45 Дж/м2, УФ-В 51,3 Дж/м2 и УФ-С 119,25 Дж/м2 через 45 с; при обработке на расстоянии 15 см угнетение бактериального роста было достигнуто через 45 с при воздействии УФ-А 56,7 Дж/м2, УФ-В 23,85 Дж/м2 и УФ-С 51,3 Дж/м2.
В результате воздействия НТАП в течение 45 с на музейные штаммы Klebsiela pneumoniae subsp.
pneumoniae АТСС 700603, E. coli АТСС 10536, Enterococcus faecalis АТСС 29212, Enterococcus faecium 9/63, Pseudomonas aeruginosa ATCC 10145 дозой УФ-В 15,9 Дж/м2 и в течение 60 с на Candida albicans 24433 АТСС дозой УФ-В 68,4 Дж/м2 на расстояния 10 см в зоне направленного воздействия НТАП было обнаружено отсутствие роста всех указанных микроорганизмов; соответствующие данные приведены на рисунке 2.
В ходе исследования проводили изучение воздействия НТАП на чашки с посевами микроорганизмов из группы ESKAPE-патогенов: грамположительные бактерии MRSA S. aureus, E. faecalis, E. faecium; грамотрицательные бактерии K. pneumoniae, P. aeruginosa, A. baumannii, E. coli, а также на дрожжеподобные грибы C. albicans, используя разные расстояние среза сопла плазмотрона до плоскости расположения культуры в чашке Петри и время воздействия; полученные результаты представлены на рисунке 3.
В результате исследований установлено, что с применением переменных параметров (расстояния и времени) при обработке НТАП культур получена эффективность 99,999–100% угнетения бактериального роста (табл. 3).
Исследования воздействия НТАП проводили в 5 повторностях в отношении клинических штаммов микроорганизмов из группы ESKAPE-патогенов K. pneumoniae, P. aeruginosa, A. baumannii, E. coli, грамположительных бактерий MRSA S. aureus, E. faecalis, E. faecium, обладающих множественной устойчивостью к антибактериальным препаратам по системе EUCAST, и в 3 повторностях для каждой комбинации воздействия на смесь музейных эталонных культур E. coli АТСС 10536, K. pneumoniae subsp. pneumoniae АТСС 700603, S. aureus 906, P. aeruginosa ATCC 10145, E. faecalis АТСС 29212, E. Faecium 9/63.
При исследовании, проведенном на смеси музейных культур, установлена 99,999% эффективность влияния НТАП при использовании переменных параметров расстояния и времени обработки. Выживаемость наблюдалась в основном штаммов K. pneumoniae subsp. pneumoniae АТСС 700603; жизнеспособных колоний P. aeruginosa ATCC 10145, музейных штаммов E. coli АТСС 10536, S. aureus 906, E. faecalis АТСС 29212, E. Faecium 9/63 не обнаружено (табл. 4).
При оценке эффективности воздействия НТАП на выживаемость смеси клинических штаммов микроорганизмов установлена 99,997–99,999% эффективность влияния НТАП по сравнению с исходным внесенным уровнем микроорганизмов. После воздействия НТАП на чашках после инкубации обнаружены единичные колонии клинических штаммов K. pneumoniae и A. Baumannii, при этом жизнеспособные колонии штаммов P. aeruginosa, E. coli, S. aureus, E. faecalis, E. faecium, Candida albicans не обнаружены. Результаты исследования представлены в таблице 5.
Антимикробное действие НТАП заключается в гибели бактериальных культур (грамположительных и грамотрицательных потенциально патогенных клинических штаммов микроорганизмов, обладающих множественной антибиотикорезистентностью) и дрожжевых грибов.
Результаты проведенного исследования показали, что в 99,999% гибель микроорганизмов происходит при достижении уже самой минимальной дозы воздействия УФ-А 12,05 Дж/м2, УФ-В 4,68 Дж/м2, УФ-С 10,2 Дж/м2 совокупности факторов НТАП, указанных в таблице 5.
С увеличением значения расстояния действие НТАП становится слабее, а с увеличением значения времени действие НТАП усиливается. Таким образом, комбинация факторов расстояния и времени определяет общую энергию НТАП, передаваемую микроорганизму.
Это подтвердили данные исследований in vitro на культурах микроорганизмов, таких как K. pneumoniae, A. Baumannii, и грибов C. albicans. Воздействие на больших расстояниях (15–20 см) в течение определенных периодов времени (15 с для бактерий и 30 с для грибов) не оказывало никакого эффекта на вышеуказанные выбранные культуры.
Параметры воздействия НТАП, которые приводили к гибели микроорганизмов, зависели от вида микроорганизма, времени и расстояния воздействия. Обнаружена экспоненциальная зависимость количества жизнеспособных бактерий A. baumannii, K. pneumoniae и грибов C. albicans после воздействия НТАП от значения энергетической освещенности за счет расстояния и времени воздействия, при достижении которой происходила гибель бактерий.
Важно отметить, что при воздействии на МRSА S. aureus и Р. Аeruginоsа жизнеспособность микроорганизмов полностью нарушалась, что происходило при всех значениях параметров расстояния и времени.
В результате проведения исследования выживаемости микроорганизмов и их ассоциаций при воздействии НТАП in vitro — эталонных музейных культур E. coli АТСС 10536, K. pneumoniae subsp. pneumoniae АТСС 700603, S. Aureus 906, P. aeruginosa ATCC 10145, E. faecalis АТСС 29212, E. Faecium 9/63, грибов C. albicans АТСС 24433 и штаммов из группы ESKAPE-патогенов K. pneumoniae, P. aeruginosa, A. baumannii, E. coli, грамположительных бактерий MRSA S. aureus, E. faecalis, E. faecium, обладающих множественной устойчивостью к антибактериальным препаратам по системе EUCAST, дрожжеподобных грибов C. albicans установлено, что эффективность воздействия факторов НТАП, формируемых плазменно-дуговым оборудованием установки «ПЛАЗМОРАН», обеспечивает снижение титра жизнеспособных микроорганизмов с 108–109 до единичных КОЕ/мл, т.е. на 8–9 порядков, как для музейных штаммов, так и для клинических бактериальных штаммов, и составляет 99,99–100%.
В научной литературе уже признается большой потенциал антибактериального воздействия низкотемпературной плазмы на патогены ESKAPE [31]. В целом полное подавление роста неприкрепленных микроорганизмов из группы ESKAPE при воздействии низкотемпературной плазмы достигается за период от 1 мин до 3 часов в зависимости от устройства, типа разряда, выходного напряжения и других факторов [31]. Наиболее быстрое подавление роста ESKAPE-патогенов было описано в работе Flynn et al. (2015) [32]. При использовании нетермической плазмы атмосферного давления было обнаружено быстрое антибактериальное действие в отношении всех патогенов ESKAPE в неприкрепленной (планктонной) форме роста. Полное уничтожение Enterobacter cloacae достигалось за 45 с, P. aeruginosa — за 60 с, E. faecium, K. pneumoniae и A. baumannii были полностью инактивированы в течение 120 с. S. aureus был наиболее устойчивым, для его инактивации потребовалось 240 с воздействия низкотемпературной плазмы.
В результате проведенной работы получена высокая эффективность применения НТАП в экспериментальных условиях с определением процента гибели жизнеспособных бактериальных и грибковых культур. В настоящем исследовании практически полное уничтожение жизнеспособных клеток тест-культур ESKAPE-патогенов происходило за время экспозиции НТАП, составляющее 15 с при дозе УФ-А 12,15 Дж/м2, УФ-В 4,68 Дж/м2 и УФ-С 10,2 Дж/м2 на расстояния 20 см.
Установлено, что дрожжеподобные грибы C. albicans более устойчивы к факторам воздействия НТАП по сравнению с бактериями, и их уничтожение требует большей экспозиции воздействия и меньшего расстояния от сопла плазмотрона до обрабатываемой поверхности, при этом эффективность воздействия составляет так же, как и для бактерий, от 99,99 до 100%.
Рядом исследований показано, что грибы менее чувствительны к низкотемпературной плазме, чем бактерии [33]. Однако эффективность низкотемпературной плазмы в отношении инактивации грибов зависит от вида гриба, подаваемых газов, расстояния между плазменным устройством и образцом, а также времени обработки [34][35]. В большинстве исследований сообщалось, что нетермическая и низкотемпературная плазма может эффективно инактивировать дрожжевые клетки Candida albicans [34].
Некоторые исследователи подчеркивают, что обработка штаммов низкотемпературной плазмой связана с проблемами безопасности, а именно: микроорганизмы, выжившие после воздействия плазмы, генетически и фенотипически модифицируются, и эти измененные штаммы могут быть опасны для окружающей среды. Так, было показано, что C. albicans, выжившие после обработки плазмой, демонстрировали генетическую изменчивость, но не показывали каких-либо значительных изменений в метаболизме и восприимчивости к лекарственным препаратам [35]. С одной стороны, это свидетельствует о том, что обработка низкотемпературной плазмой связана с небольшой вероятностью образования генетически и фенотипически неблагоприятных штаммов [34][35], а с другой стороны, для решения проблемы безопасности необходимо больше экспериментальных данных. Дальнейшие исследования в этом направлении следует провести по оценке безопасности воздействия НТАП и вклада основных факторов в антибактериальный и пролиферативный эффект для лечения послеоперационных ран на модели in vivo.
Таблица 2. Результаты оценки эффективности влияния низкотемпературной аргоновой плазмы на выживаемость музейных штаммов
№ п/п | Наименование микроорганизма | Время обработки НТАП, с | Расстояние от среза сопла плазмотрона до плоскости расположения культуры в чашке Петри, см | Контроль, КОЕ/мл | ||
10 | 15 | 20 | ||||
Оценка эффективности (%) | ||||||
1 | Enterococcus faecalis АТСС 29212 | 15 | 100 | 99,999 | 99,999 | 2×107 |
30 | 100 | 99,999 | 99,999 | |||
45 | 100 | 100 | 99,999 | |||
2 | Enterococcus faecium 9/63 | 15 | 99,999 | 99,999 | 99,999 | 1,5×107 |
30 | 99,999 | 99,999 | 99,999 | |||
45 | 99,999 | 99,999 | 99,999 | |||
3 | Klebsiela pneumoniae subsp. pneumoniae АТСС 700603 | 15 | 99,999 | 99,999 | 99,999 | 3,5×109 |
30 | 99,999 | 99,999 | 99,999 | |||
45 | 99,999 | 99,999 | 99,999 | |||
4 | Escherichia coli АТСС 10536 | 15 | 99,999 | 99,999 | 99,999 | 3,0×109 |
30 | 99,999 | 99,999 | 99,999 | |||
45 | 99,999 | 99,999 | 99,999 | |||
5 | Pseudomonas aeruginosa ATCC 10145 | 15 | 99,999 | 99,999 | 99,999 | 2,5×109 |
30 | 99,999 | 99,999 | 99,999 | |||
45 | 99,999 | 99,999 | 99,999 | |||
6 | Candida albicans 24433 АТСС | 15 | 99,999 | 99,995 | 99,95 | 1,2×107 |
30 | 99,999 | 99,995 | 99,995 | |||
45 | 99,999 | 99,995 | 99,995 | |||
7 | Staphylococcus aureus 906 | 15 | 99,999 | 99,999 | 99,999 | 1×109 |
30 | 99,999 | 99,999 | 99,999 | |||
45 | 99,999 | 99,999 | 99,999 | |||
Таблица подготовлена авторами по собственным данным

Фотографии выполнены авторами
Рис. 2. Результаты оценки эффективности влияния низкотемпературной аргоновой плазмы на выживаемость музейных культур микроорганизмов: расстояние от среза сопла плазмотрона до плоскости расположения культуры в чашке Петри — 10 см, время воздействия НТАП — 45 с (60 с для Candida albicans АТСС 24433); стрелкой указана зона задержки роста бактерий



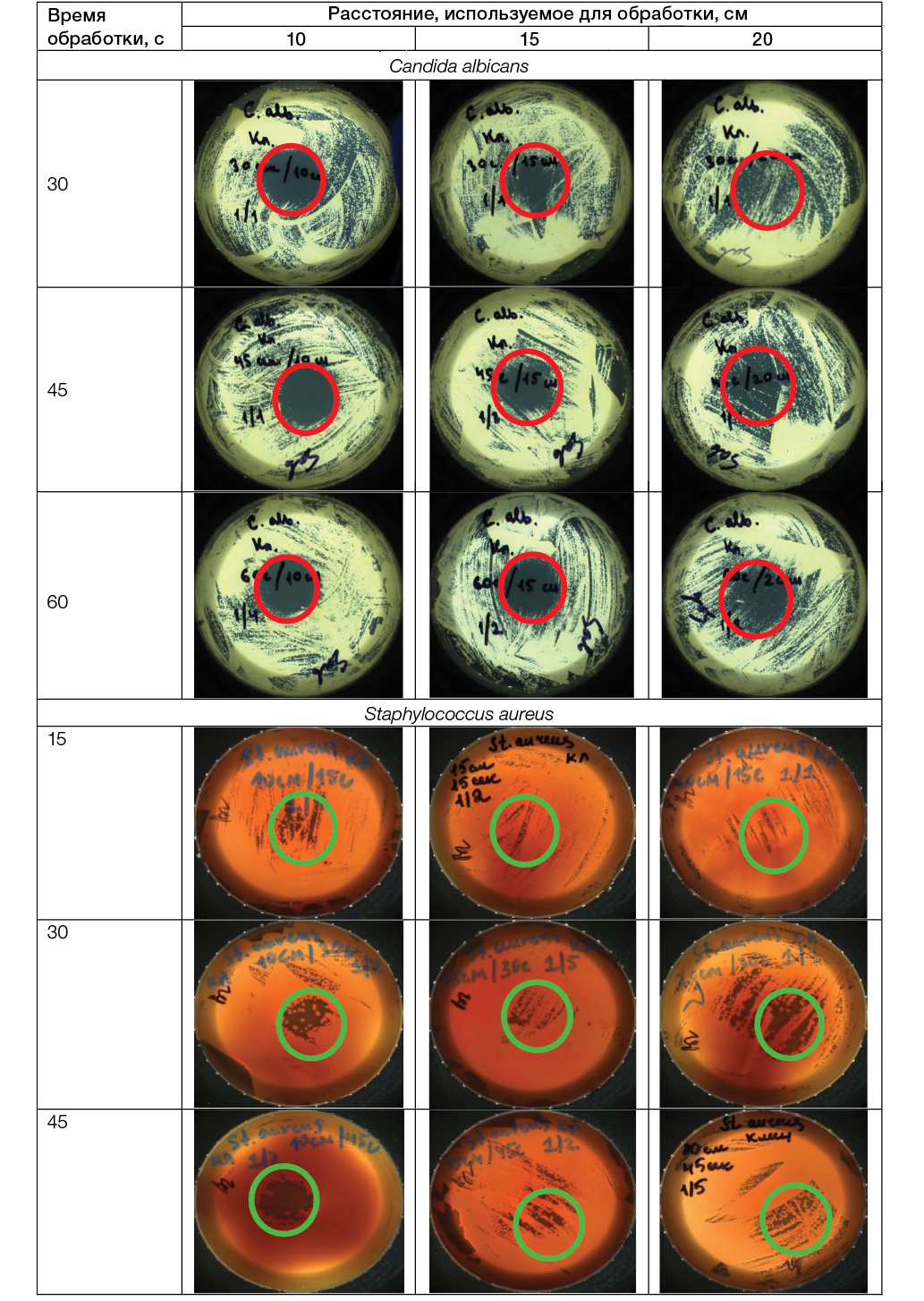
Фотографии выполнены авторами
Рис. 3. Результаты оценки влияния НТАП на выживаемость клинических штаммов из группы ESKAPE-патогенов: указана зона ингибирования бактериального роста; увеличение ×100
Таблица 3. Результаты оценки эффективности влияния низкотемпературной аргоновой плазмы на выживаемость штаммов микроорганизмов
№ п/п | Наименование микроорганизма | Время обработки НТАП, с | Расстояние от среза сопла плазмотрона до плоскости расположения культуры в чашке Петри, см | Контроль, КОЕ/мл | ||
10 | 15 | 20 | ||||
Оценка эффективности (%) | ||||||
1 | Enterococcus faecalis | 15 | 99,999 | 99,999 | 99,999 | 1,4×108 |
30 | 99,999 | 99,999 | 99,999 | |||
45 | 99,999 | 99,999 | 99,999 | |||
2 | Enterococcus faecium | 15 | 99,999 | 99,999 | 99,99 | 4,0×108 |
30 | 99,999 | 99,999 | 99,99 | |||
45 | 99,999 | 99,999 | 99,999 | |||
3 | Klebsiela pneumoniae | 15 | 99,999 | 99,999 | 99,999 | 5,4×108 |
30 | 99,999 | 99,999 | 99,999 | |||
45 | 99,999 | 99,999 | 99,999 | |||
4 | Escherichia coli | 15 | 99,999 | 99,999 | 99,999 | 4,0×108 |
30 | 99,999 | 99,999 | 99,999 | |||
45 | 99,999 | 99,999 | 99,999 | |||
5 | Pseudomonas aeruginosa | 15 | 99,999 | 99,999 | 99,999 | 3,3×108 |
30 | 99,999 | 99,999 | 99,999 | |||
45 | 99,999 | 99,999 | 99,999 | |||
6 | Acinetobacter baumanii | 15 | 99,999 | 99,99 | 99,99 | 1,5×108 |
30 | 99,999 | 99,999 | 99,99 | |||
45 | 99,999 | 99,995 | 99,99 | |||
7 | Candida albicans Staphylococcus aureus | 15 | 100 | 99,99 | 99,99 | 1,0×107 |
30 | 99,999 | 99,999 | 99,99 | |||
45 | 99,999 | 99,999 | 99,99 | |||
8 | Staphylococcus aureus | 15 | 99,999 | 99,998 | – | 2,1×108 |
30 | 99,999 | 99,998 | – | |||
45 | 99,999 | 99,998 | – | |||
Таблица подготовлена авторами по собственным данным
Таблица 4. Результаты оценки эффективности влияния низкотемпературной аргоновой плазмы на выживаемость смеси музейных штаммов микроорганизмов
№ п/п | Время | Расстояние обработки, см | Контроль, | ||
10 | 15 | 20 | |||
Эффективность, % | |||||
1 | 15 | 99,999 | 99,999 | 99,999 | 1×109 |
30 | 99,999 | 99,999 | 99,999 | ||
45 | 99,999 | 99,999 | 99,999 | ||
Таблица подготовлена авторами по собственным данным
Таблица 5. Результаты оценки эффективности влияния низкотемпературной аргоновой плазмы на выживаемость смеси штаммов микроорганизмов
Время | Расстояние обработки, см | Контроль, | ||
10 | 15 | 20 | ||
Эффективность (%) | ||||
15 | 99,999 | 99,997 | 99,997 | 4×108 |
30 | 99,999 | 99,997 | 99,997 | |
45 | 99,999 | 99,997 | 99,997 | |
Таблица подготовлена авторами по собственным данным
ВЫВОДЫ
- Установлено, что факторы НТАП, формируемые плазменно-дуговым оборудованием установки «ПЛАЗМОРАН», обладают выраженным антибактериальным и противогрибковым действием как в отношении музейных эталонных культур, так и в отношении клинических штаммов группы ESKAPE-патогенов: K.pneumoniae, Р.aeruginosa, A. baumannii, E. coli, грамположительных бактерий MRSA S. aureus и E. faecalis, обладающих множественной устойчивостью к антибактериальным препаратам по системе EUCAST, и дрожжеподобных грибов С. albicans. Эффективность воздействия факторов НТАП обеспечивает снижение титра жизнеспособных микроорганизмов с 108–109 до единичных КОЕ, т.е. на 8–9 порядков для бактерий, что составляет 99,999–100%.
- A.baumannii и E. faecium более устойчивы к факторам воздействия НТАП, чем другие исследованные бактерии.
- C. albicansболее устойчива к факторам воздействия НТАП по сравнению с бактериями, и их уничтожение требует большей экспозиции воздействия и меньшего расстояния от сопла плазмотрона до обрабатываемой поверхности, при этом эффективность воздействия составляет 99,99–100%.
- Факторы воздействия НТАП имеют наибольший эффект при обработке потенциально патогенных микроорганизмов при значениях расстояния 10–15см и времени воздействия 30-45с для бактерий (необходимая при этом доза излучения УФ-А 37,8 Дж/м2, УФ-В 15,9 Дж/м2, УФ-С 34,2 Дж/м2) и при значениях расстояния 10 см и времени воздействия 60 сек для грибов (необходимая при этом доза излучения УФ-А 168,6 Дж/м2, УФ-В 68,4 Дж/м2, УФ-С 159 Дж/м2).
- Установлено, что эффективность применения НТАП, формируемых плазменно-дуговым оборудованием — установкой «ПЛАЗМОРАН», обеспечивает снижение титра жизнеспособных микроорганизмов не только монокультур, но и ассоциации бактерий как в отношении музейных эталонных культур, так и в отношении клинических штаммов из группы ESKAPE-патогенов K.pneumoniae, Р.aeruginosa, A. baumannii, E. coli, грамположительных бактерий MRSA S. aureus и E. faecalis, обладающих множественной устойчивостью к антибактериальным препаратам.
- Применение НТАП для обработки раневых поверхностей имеет большую актуальность для профилактики гнойных осложнений в хирургических отделениях, особенно на этапах эвакуации раненых в зоне СВО.
1 ГОСТ ISO 11737-1-2012 ««Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продукции».
Список литературы
1. Brook I. Secondary bacterial infections complicating skin lesions. Journal of Medical Microbiology. 2002;51(10): 808–12. https://doi.org/10.1099/0022-1317-51-10-808
2. Mancuso G, Midiri A, Gerace E, Biondo C. Bacterial antibiotic resistance: the most critical pathogens. Pathogens. 2021;10(10):1310. https://doi.org/10.3390/pathogens10101310
3. Odonkor S, Addo K. Bacteria resistance to antibiotics: recent trends and challenges. International Journal of Biological & Medical Research. 2011;2(4):1204–10.
4. Brooks B, Brooks A. Therapeutic strategies to combat antibiotic resistance. Advanced Drug Delivery Reviews. 2014;78:14–27. https://doi.org/10.1016/j.addr.2014.10.027
5. Fair R, Tor Y. Antibiotics and bacterial resistance in the 21st century. Perspectives in Medicinal Chemistry. 2014;6:S14459. https://doi.org/10.4137/PMC.S14459
6. Strateva T, Yordanov D. Pseudomonas aeruginosa–a phenomenon of bacterial resistance. Journal of Medical Microbiology. 2009; 58(9):1133–48. https://doi.org/10.1099/jmm.0.009142-0
7. Vestby L, Gronseth T, Simm R, Nesse L. Bacterial biofilm and its role in the pathogenesis of disease. Antibiotics. 2020;9(2):59. https://doi.org/10.3390/antibiotics9020059
8. Prakash B, Veeregowda B, Krishnappa G. Biofilms: a survival strategy of bacteria. Current science. 2003;85:1299–307.
9. Bi Y, Xia G, Shi C, Wan J, Liu L, Chen Y, et al. Therapeutic strategies against bacterial biofilms. Fundamental Research. 2021;1(2):193–212. https://doi.org/10.1016/j.fmre.2021.02.003
10. Singh B, Ghosh S, Chauhan A. Development, dynamics and control of antimicrobial-resistant bacterial biofilms: a review. Environmental Chemistry Letters. 2021;19:1983–93. https://doi.org/10.1007/s10311-020-01169-5
11. Geisinger E, Isberg R. Interplay Between Antibiotic Resistance and Virulence During Disease Promoted by Multidrug-Resistant Bacteria. Journal of Infectious Diseases. 2017;215(1):9–17. https://doi.org/10.1093/infdis/jiw402
12. Пай ГВ, Ракитина ДВ, Сухина МА, Юдин СМ, Макаров ВВ, Мания ТР и др. Изучение связи маркеров антибиотикорезистентности с маркерами вирулентности у ndm-положительных штаммов Klebsiella pneumoniae, циркулирующих в различных водах и локусах человека. Гигиена и Санитария. 2021;100(12):1366–71.
13. Venezia R, Orrico M, Houston E, Yin S, Naumova Y. Lethal activity of nonthermal plasma sterilization against microorganisms. Infection Control & Hospital Epidemiology. 2008;29(5):430–6. https://doi.org/10.1086/588003
14. Laroussi M. Cold plasma in medicine and healthcare: The new frontier in low temperature plasma applications. Frontiers in Physics. 2020;8:74. https://doi.org/10.3389/fphy.2020.00074
15. Karthik C, Sarngadharan S, Thomas V. Low-Temperature Plasma Techniques in Biomedical Applications and Therapeutics: An Overview. International Journal of Molecular Sciences. 2023;25(1):524. https://doi.org/10.3390/ijms25010524
16. Mohamed H, Nayak G, Rendine N, Wigdahl B, Krebs F, Bruggeman P, et al. Non-thermal plasma as a novel strategy for treating or preventing viral infection and associated disease. Frontiers in Physics. 2021;9:683118. https://doi.org/10.3389/fphy.2021.683118
17. Perucca M. Introduction to plasma and plasma technology. Plasma Technology for Hyperfunctional Surfaces: Food, Biomedical, and Textile Applications. Wiley-VCH Verlag GmbH & Co;2010:1–32. https://doi.org/10.1002/9783527630455.ch1
18. Hury S, Vidal D, Desor F, Pelletier J, Lagarde T. A parametric study of the destruction efficiency of Bacillus spores in low pressure oxygen-based plasmas. Letters in Applied Microbiology.1998;26(6):417–21. https://doi.org/10.1046/j.1472-765x.1998.00365.x
19. Lassen K, Nordby B, Grün R. The dependence of the sporicidal effects on the power and pressure of RF-generated plasma processes. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 2005;74(1):553–9. https://doi.org/10.1002/jbm.b.30239
20. Shimizu T, Steffes B, Pompl R, Jamitzky F, Bunk W, Ramrath K, et al. Characterization of microwave plasma torch for decontamination. Plasma Processes and Polymers. 2008;5(6):577–82.
21. Yan D, Malyavko A, Wang Q, Ostrikov K, Sherman J, Keidar M. Multi-modal biological destruction by cold atmospheric plasma: capability and mechanism. Biomedicines. 2021;9(9):1259. https://doi.org/10.3390/biomedicines9091259
22. Lackmann J, Bandow J. Inactivation of microbes and macromolecules by atmospheric-pressure plasma jets. Applied Microbiology and Biotechnology.2014;98:6205–13. https://doi.org/10.1007/s00253-014-5781-9
23. Raji A, Vasu D, Pandiyaraj K, Ghobeira R, De Geyter N, Morent R, et al. Combinatorial effects of non-thermal plasma oxidation processes and photocatalytic activity on the inactivation of bacteria and degradation of toxic compounds in wastewater. RSC Advances. 2022;12(22):14246–59. https://doi.org/10.1039/d1ra09337a
24. Moreau M, Orange N, Feuilloley M. Non-thermal plasma technologies: new tools for bio-decontamination. Biotechnology Advances. 2008;26(6):610–7. https://doi.org/10.1016/j.biotechadv.2008.08.001
25. Sung S, Huh J, Yun M, Chang B, Jeong C, Jeon Y. Sterilization effect of atmospheric pressure non-thermal air plasma on dental instruments. The Journal of Advanced Prosthodontics. 2013;5(1):2–8. https://doi.org/10.4047/jap.2013.5.1.2
26. Busco G, Robert E, Chettouh-Hammas N, Pouvesle J, Grillon C. The emerging potential of cold atmospheric plasma in skin biology. Free Radical Biology and Medicine. 2020;161:290–304. https://doi.org/10.1016/j.freeradbiomed.2020.10.004
27. Lotfi M, Khani M, Shokri B. A review of cold atmospheric plasma applications in dermatology and aesthetics. Plasma Medicine. 2023;13:1. https://doi.org/10.1615/PlasmaMed.2023049359
28. Фролов СА, Кузьминов АМ, Вышегородцев ДВ, Королик ВЮ, Туктагулов НВ, Жарков ЕЕ и др. Применение низкотемпературной аргоновой плазмы в лечении ран после открытой геморроидэктомии. Колопроктология. 2021;20(3):51–61. https://doi.org/10.33878/2073-7556-2021-20-3-51-61
29. Шулутко АМ, Османов ЭГ, Новикова ИВ, Чочия СЛ, Середин ВП, Мачарадзе АД. Плазменная обработка при лечении поздних воспалительно-гнойных осложнений инъекционной контурной пластики полиакриламидным гелем. Хирургия. Журнал им. Н.И. Пирогова. 2017;9:59–63. https://doi.org/10.17116/hirurgia2017959-63
30. Pierdzioch P, Hartwig S, Herbst S, Raguse J, Dommisch H, Abu-Sirhan S, et al. Cold plasma: a novel approach to treat infected dentin–a combined ex vivo and in vitro study. Clinical Oral Investigations. 2016;20:2429–35. https://doi.org/10.1007/s00784-016-1723-5
31. Herbst S, Hertel M, Ballout H, Pierdzioch P, Weltmann K, Wirtz H, et al. Bactericidal efficacy of cold plasma at different depths of infected root canals in vitro. The Open Dentistry Journal. 2015;9:486. https://doi.org/10.2174/1874210601509010486
32. Scholtz V, Vaňková E, Kašparová P, Premanath R, Karunasagar I, Julák J. Non-thermal plasma treatment of ESKAPE pathogens: a review. Frontiers in Microbiology. 2021;12:737635. https://doi.org/10.3389/fmicb.2021.737635
33. Flynn P, Higginbotham S, Alshraiedeh N, Gorman S, Graham W, Gilmore B. Bactericidal efficacy of atmospheric pressure non-thermal plasma (APNTP) against the ESKAPE pathogens. International Journal of Antimicrobial Agents. 2015;46:101–7. https://doi.org/10.1016/j.ijantimicag.2015.02.026
34. Soušková H, Scholtz V, Julák J, Kommová L, Savická D, Pazlarová J. The survival of micromycetes and yeasts under the low-temperature plasma generated in electrical discharge. Folia Microbiologica. 2011;56:77–9. https://doi.org/10.1007/s12223-011-0005-5
35. Veerana M, Ketya W, Park G. Application of non-thermal plasma to fungal resources. Journal of Fungi. 2022,8(2):102. https://doi.org/10.3390/jof8020102
36. Tyczkowska-Sieroń E, Kałużewski T, Grabiec M, Kałużewski B, Tyczkowski J. Genotypic and phenotypic changes in Candida albicans as a result of cold plasma treatment. International Journal of Molecule Science. 2020;21:8100. https://doi.org/10.3390/ijms21218100
Об авторах
А. В. ЗагайноваРоссия
Загайнова Анжелика Владимировна, канд. биол. наук
Москва
М. А. Сухина
Россия
Сухина Марина Алексеевна, канд. биол. наук
Москва
А. Б. Земляной
Россия
Земляной Александр Борисович, д-р мед. наук
Красногорск
Москва
Т. А. Зеленина
Россия
Зеленина Татьяна Александровна, канд. мед. наук
Санкт-Петербург
П. С. Маркевич
Россия
Маркевич Павел Сергеевич, канд. мед. наук
Красногорск
К. А. Новожилов
Россия
Новожилов Константин Андреевич, канд. мед. наук
Москва
З. Е. Федец
Россия
Федец Злата Евгеньевна
Москва
М. Н. Панькова
Россия
Панькова Марина Николаевна
Москва
Т. Р. Мания
Россия
Тамари Р. Мания
Москва
О. В. Грицюк
Россия
Грицюк Ольга Вячеславовна, канд. биол. наук
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Загайнова А.В., Сухина М.А., Земляной А.Б., Зеленина Т.А., Маркевич П.С., Новожилов К.А., Федец З.Е., Панькова М.Н., Мания Т.Р., Грицюк О.В. Изучение антимикробного действия низкотемпературной аргоновой плазмы на хирургическую инфекцию в эксперименте in vitro. Медицина экстремальных ситуаций. 2025;27(3):351-366. https://doi.org/10.47183/mes.2025-332
For citation:
Zagainova A.V., Sukhina M.A., Zemlianoi A.B., Zelenina T.A., Markevich P.S., Novozhilov K.A., Fedets Z.E., Pankova M.N., Maniya T.R., Gritsyuk O.V. Antimicrobial effect of low-temperature argon plasma on surgical infection in vitro. Extreme Medicine. 2025;27(3):351-366. https://doi.org/10.47183/mes.2025-332

















