Scroll to:
Application of modified packing in the combination treatment of extensive traumatic liver injuries
https://doi.org/10.47183/mes.2025-337
Abstract
Introduction. Traumatic liver injuries are a significant challenge in modern emergency surgery. Developing new methods for surgical hemostasis of traumatic liver injuries is an extremely relevant task in urgent surgery.
Objective. Development and testing of surgical hemostasis for traumatic liver injuries using a modified packing technique.
Materials and methods. A new method of surgical hemostasis for traumatic liver injuries was developed using cadaveric material. The clinical trial included 27 patients with severe traumatic liver injuries (AAST Grade IV). Patients were divided into the main (n = 14) and control (n = 13) groups. Patients in the main group were treated using a new method of surgical hemostasis for traumatic liver injuries, involving tamponade of the liver wounds with Surgitamp hemostatic gauze impregnated with Molselect G-50 granular sorbent, followed by modified liver packing with strips of polypropylene mesh implant. In the control group, surgical hemostasis was performed by tamponading the liver wound with hemostatic sponges followed by suturing. The effectiveness of the proposed method was evaluated based on the following parameters: definitive hemostasis, number of recurrent hemorrhages, number of reсurrent operations, mortality, hospital stay duration, intensive care unit stay duration. Statistical analysis of the study results was performed using the Statistica 10 software.
Results. The application of modified packing in the combination treatment of patients with severe traumatic liver injuries increased the reliability of definitive hemostasis from 46.2% to 92.8% (p = 0.0391), reduced the number of re-bleeding episodes and re-operations from 38.4% to 7.1% (p = 0.0391), and decreased the mortality rate from 38.4% to 14.2% (p > 0.05).
Conclusions. The application of the new combined method of surgical hemostasis improved the treatment outcomes for patients with severe traumatic liver injuries by increasing the reliability of definitive hemostasis, reducing re-bleeding and re-operations, and lowering mortality.
Keywords
For citations:
Vorontsov A.K., Parhisenko Yu.A., Cherednikov E.F., Barannikov S.V., Bezaltynnykh A.A. Application of modified packing in the combination treatment of extensive traumatic liver injuries. Extreme Medicine. 2025;27(4):490-499. https://doi.org/10.47183/mes.2025-337
ВВЕДЕНИЕ
Травматические повреждения органов брюшной полости представляют собой серьезную проблему современной ургентной хирургии. По статистике травмы живота составляют от 1,5 до 36,5% из числа всех травматических повреждений. Однако частота летальных исходов при повреждениях органов брюшной полости достигает крайне высоких цифр — порядка 60%. При этом бóльшая часть пострадавших находится в молодом и трудоспособном возрасте, что определяет большую медико-социальную значимость проблемы травматических повреждений органов брюшной полости [1][2].
Особую группу повреждений при абдоминальной травме составляют повреждения паренхиматозных органов. Наиболее часто в клинической практике встречаются повреждения селезенки. Травмы печени в структуре повреждений паренхиматозных органов брюшной полости находятся на втором месте, однако представляют собой крайне сложную проблему для мировой хирургии. Тяжелые повреждения печени зачастую сопровождаются развитием трудноконтролируемого внутрибрюшного кровотечения и развитием печеночно-клеточной недостаточности в послеоперационном периоде при массивном размозжении печени, что является основными причинами неудовлетворительных результатов лечения пострадавших с травмой печени и высоких показателей летальности (до 50% и более) при данных повреждениях [3–5].
Большинство исследований последнего времени, касающихся проблемы травматических повреждений печени, направлены на совершенствование тактических подходов лечения травмы печени, применение технологий эндоваскулярного гемостаза и улучшение методов хирургического гемостаза повреждений печени [6].
Среди тактических подходов лечения тяжелых сочетанных повреждений все большее распространение получает стратегия этапного хирургического лечения «damage control surgery», направленная на сокращение первой фазы оперативного лечения с последующей стабилизацией состояния больного и проведением основного этапа хирургического лечения в более благоприятных условиях. Применение стратегии «damage control surgery» в настоящее время показывает хорошие результаты, однако не решает все проблемы хирургического лечения тяжелых травматических повреждений печени из-за развития ранних рецидивных кровотечений у пациентов с массивным повреждением печеночной паренхимы [7–9].
Важным современным достижением в лечении абдоминальной травмы, и прежде всего внутрибрюшных кровотечений, стало применение тактики консервативного лечения (Non-Operative Managementеt, NOM) [10][11]. Тактика NOM подразумевает проведение строгого отбора пациентов, оснащение стационаров рентген-эндоваскулярными операционными с обязательной системой динамического мониторинга за состоянием пациентов [12]. Однако большинство российских стационаров, оказывающих экстренную помощь пациентам с абдоминальной травмой, не имеют соответствующего оснащения, что ограничивает возможности применения тактики NOM в лечении пациентов с повреждениями печени [13].
На сегодняшний день основным методом лечения тяжелых травматических повреждений печени у пациентов с нестабильной гемодинамикой является экстренное оперативное вмешательство — срединная лапаротомия, главной задачей которой является надежная остановка внутрибрюшного кровотечения [14][15]. Разработаны и применяются в клинической практике множество способов гемостаза повреждений печени, как временных, так и окончательных, но ни один из них в настоящее время в полной мере не удовлетворяет хирургов из-за высокой частоты повторных кровотечений в послеоперационном периоде [16][17]. Разработка новых методов хирургического гемостаза травматических повреждений печени является крайне актуальной задачей современной ургентной хирургии [18].
Цель исследования — разработка и апробация хирургического гемостаза при травматических повреждениях печени путем применения модифицированного пакетирования.
МАТЕРИАЛЫ И МЕТОДЫ
Предварительно нами были проведены экспериментальные исследования по изучению возможности применения технологии хирургического гемостаза модифицированным пакетированием у лабораторных животных [19].
Также предварительно выполнены исследования на кадаверном материале с целью разработки методики оперативного вмешательства по применению модифицированного пакетирования. Исследования проведены на 7 нефиксированных трупах мужчин в возрасте 34,5 ± 3,2 года, умерших от причин, не связанных с травматическими повреждениями и заболеваниями органов брюшной полости, предоставленных бюджетным учреждением здравоохранения Воронежской области «Воронежское областное патологоанатомическое бюро». Разрешение на предоставление кадаверного материала соответствовало положениям действующего законодательства1. Временной промежуток от момента смерти до проведения исследования составил не более 24 ч.
На каждом объекте исследования моделировали травматическое повреждение печени. Для этого после проведения тотальной лапаротомии в рану выводили правую долю печени, которую помещали на подставку-столик.
На расстоянии 40 см от поверхности печени с помощью нити к лабораторному штативу крепили стальной груз массой 250 г. По готовности нить, фиксирующая груз, пережигалась пламенем газовой горелки, груз падал в вертикальном направлении и ударялся о диафрагмальную поверхность правой доли печени, что приводило к формированию раны печени (рис. 1А). Моделированную рану печени туго тампонировали гемостатической марлей «Сургитамп» (рис. 1Б), пропитанной гранулированным сорбентом «Молселект G-50» (рис. 1В), затем сдавливали правую долю печени марлевыми салфетками.
С целью проведения модифицированного пакетирования проводили мобилизацию правой доли печени. Для этого ножницами пересекали правую треугольную, венечную, серповидную и круглую связки печени, после чего правую долю печени выводили в рану. Затем полоску (шириной 4,0 см и длиной 30,0 см) из сетчатого полипропиленового импланта, используемого для пластики грыж, фиксировали в сагиттальной плоскости. Для этого край полоски сетчатого импланта подшивали к диафрагме тремя отдельными узловыми швами полипропиленовой мононитью (рис. 1Г). Далее обертывали диафрагмальную поверхность печени с переходом на висцеральную поверхность, сетчатый имплант натягивали для обеспечения компрессии и его нижний край фиксировали узловыми швами к краю начала полоски, создавая компрессию и натяжение. Важно проводить модифицированное пакетирование, отступив от краев желчного пузыря на 1,0–1,5 см, в дальнейшем его окутывали большим сальником (рис. 1Д).
С целью обеспечения дополнительной компрессии в поперечном направлении относительно правой доли печени подшивали три дополнительные полипропиленовые сетчатые полоски (рис. 1Е). Полоски окутывали большим сальником, фиксировали его отдельными узловыми швами к капсуле печени для профилактики возникновения кишечных свищей.
Следующим этапом исследования была клиническая апробация применения технологии модифицированного пакетирования у пострадавших с повреждениями печени. Пилотное рандомизированное контролируемое клиническое исследование проведено на базе Брянской городской больницы № 1, Воронежской областной клинической больницы № 1, Воронежской городской клинической больницы скорой медицинской помощи № 1, Воронежской городской клинической больницы скорой медицинской помощи № 10. В исследовании приняли участие 27 пострадавших с травматическим повреждением печени. Дизайн клинического исследования представлен на рисунке 2.
Критерии включения пациентов в исследование: закрытая травма живота; возраст пострадавших 18–80 лет; подписанное информированное согласие на участие в клиническом исследовании; степень повреждения печени согласно классификации американского общества хирургов и травматологов (American Association for the Surgery of Trauma, AAST) — IV [19]. Критерии невключения пациентов в исследование: отказ от участия в клиническом исследовании; агональное состояние пациента; аллергические реакции на «Молселект G-50», «Сургитамп» и полипропиленовый сетчатый имплант. Критерии исключения пациентов из исследования: отказ от продолжения участия в клиническом исследовании; повреждение полых органов, перитонит; повреждение печени I–III степени по AAST; множественные повреждения органов брюшной полости; макроскопические признаки цирроза печени; количество баллов по шкале военно-полевой хирургии для определения хирургической тактики > 13 баллов.
В зависимости от целей и задач исследования пациенты были разделены на две группы: основную (14 пациентов) и контрольную (13 пациентов). Распределение больных производили методом случайной выборки с использованием генератора случайных чисел. Больные были сопоставимы по полу, возрасту, характеру травматического повреждения печени, структуре сочетанных повреждений и тяжести кровопотери.
В основной группе пациентов для хирургического гемостаза травматических повреждений печени применяли метод, представленный в патенте [20]. В контрольной группе применялся метод хирургического гемостаза ран печени путем тампонирования ран печени гемостатическими коллагеновыми губками с последующим ушиванием раны печени мононитью ПГА 2,0.
В комплексном лечении больные обеих групп в послеоперационном периоде использовали стандартное консервативное лечение, включающее гемостатическую и инфузионную терапии, гемотрансфузии по показаниям, антибактериальную терапию, анальгетики и перевязки.
Результаты исследования оценивали по показателям окончательного гемостаза, количеству повторных кровотечений и повторных операций, времени оперативного вмешательства, длительности пребывания в отделении реанимации и интенсивной терапии, длительности стационарного лечения, летальности, наличию и характеру осложнений в послеоперационном периоде.
Статистическую обработку результатов исследования проводили в программе Statistica 10. Вычисляли стандартные описательные статистики (среднее значение (M), стандартную ошибку среднего значения (m), медиану (Me), нижний (Q1) и верхний (Q3) квартили). Для оценки нормальности распределения количественных показателей использовали критерий Шапиро – Уилка. Значимость различий количественных признаков в независимых группах определяли с использованием t-критерия Стьюдента (при нормальном распределении признака) и U-критерия Манна – Уитни (при распределении отличном от нормального). Анализ качественных признаков проводили с использованием критериев Фишера и Z-критерия с поправкой Йейтса. Различия признаков считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
Общая характеристика пациентов, принявших участие в исследовании, представлена в таблице 1.
В таблице 1 представлены сводные данные о группах пациентов. Так, наиболее часто травматические повреждения печени встречались у мужчин трудоспособного возраста (20 (74,1%)). У женщин травматические повреждения встречались значительно реже: у 7 (25,9%) пострадавших. Средний возраст пациентов с травматическими повреждениями печени составил 36 [ 30; 43] лет. Анализируя механизм абдоминальной травмы, следует отметить, что среди причин травматических повреждений печени преобладали дорожно-транспортные происшествия (12 (44,5%) пациентов), реже встречалась кататравма (падение с высоты) (9 (22,2%) пациентов) и бытовая травма (6 (22,2%) пациентов).
Среди сочетанных повреждений наиболее часто встречались повреждения грудной клетки 17 (32,5%), реже — скелетная травма 9 (8,5%), черепно-мозговая травма 8 (59,0%) и повреждение таза 5 (18,5%).
При анализе сопутствующей патологии установлено, что пациенты с абдоминальной травмой и повреждениями печени были практически соматически здоровы. Лишь у 4 (14,8%) пациентов была выявлена сопутствующая патология: у 1 (3,7%) пациента — ишемическая болезнь сердца, у 3 (11,1%) пострадавших — хронический панкреатит.
В комплексном лечении пациентов основной группы был применен новый комбинированный метод хирургического гемостаза травматических повреждений печени, заключающейся в тампонировании ран печени гемостатической марлей «Сургитамп», пропитанной гранулированным сорбентом «Молселект G-50», с последующим модифицированным пакетированием печени полосками полипропиленового сетчатого импланта [20] (рис. 3А–Е).
В работе установлено, что сразу после тампонирования раны печени гемостатической марлей «Сургитамп», пропитанной гранулированным сорбентом «Молселект G-50», набухающим при контакте с кровью и увеличивающимся в объеме, он превращался в пропитанный кровью гидрогель. Гемостатическая марля «Сургитамп» обеспечивала компрессию и усиление гемостатического эффекта. Сдавление печени руками приводило к временному гемостазу. Однако при ослаблении компрессии кровотечение возобновлялось.
С целью достижения окончательного гемостаза применяли метод модифицированного пакетирования полосками полипропиленового сетчатого импланта (технология фиксации сетчатого импланта описана выше), что приводило к окончательной остановке кровотечения. Окончательный гемостаз в основной группе был достигнут у 13 (92,8%) пациентов. У 1 (7,14%) пациента основной группы на 2 сут после операции наблюдали признаки возобновления кровотечения. Пациент в экстренном порядке был оперирован. При ревизии органов брюшной полости установлен источник кровотечения — диффузное подтекание крови из раны печени за счет недостаточной компрессии при натяжении полосок полипропиленового сетчатого импланта. Дополнительное натяжение полосок привело к остановке кровотечения и окончательному гемостазу.
В основной группе умерло 2 (14,3%) пациента. Причиной летальных исходов явилась тяжелая сочетанная травма. По данным судебно-медицинского вскрытия, признаков повторного внутрибрюшного кровотечения в обоих случаях не наблюдалось.
В контрольной группе с целью достижения окончательного гемостаза повреждений печени рана тампонировалась гемостатическими коллагеновыми губками. Губки активно пропитывались кровью, однако диффузное кровотечение из ран печени сохранялось. Для достижения окончательного гемостаза раны печени ушивались П-образным швом (мононитью ПГА 2.0) до сближения краев раны. При прошивании ран печени наблюдали диффузное подтекание крови из мест вколов иглы, паренхима печени прорезалась шовным материалом, что затрудняло достижение окончательного гемостаза и удлиняло время проведения оперативного вмешательства. У 5 (38,4%) пациентов контрольной группы на 2–3 сут после операции наблюдали признаки повторного кровотечения. Больные были оперированы в экстренном порядке. Источником кровотечения во всех случаях было подтекание крови из разрывов печени. В контрольной группе умерли 5 (38,4%) пациентов на фоне острой кровопотери, постгеморрагической анемии, а также сочетанных повреждений.
Сравнительная эффективность применения модифицированного пакетирования в лечении травматических повреждений печени представлена в таблице 2.
Применение модифицированного пакетирования в комплексном лечении пациентов с тяжелыми травматическими повреждениями печени (класс IV по AAST) позволило повысить надежность окончательного гемостаза с 46,2 до 92,8% (p = 0,0391), снизить количество повторных кровотечений и операций с 38,4 до 7,1% (p = 0,0391) и уменьшить летальность с 38,4 до 14,2% (p > 0,05).
Анализ послеоперационных хирургических осложнений в группах исследования показал, что в послеоперационном периоде у 1 пациента основной группы было повторное кровотечение. Пациент в экстренном порядке был оперирован. При ревизии органов брюшной полости источником кровотечения оказалось диффузное подтекание крови из раны печени за счет недостаточной компрессии при натяжении полосок полипропиленового сетчатого импланта. Дополнительное натяжение полосок привело к остановке кровотечения и окончательному гемостазу.
В контрольной группе у 5 пациентов в послеоперационном периоде отмечали признаки повторного кровотечения. Пациенты были повторно оперированы. Интраоперационно выявлено прорезывание швов паренхимы печени, выполнен дополнительный гемостаз в объеме электрокоагуляции, нанесением на место диффузного подтекания крови пластины Тахокомба или дополнительным прошиванием мест разрывов. У одного пациента контрольной группы в послеоперационном периоде появились жалобы на боли в правом подреберье, слабость, было выполнено УЗИ брюшной полости, выявлена билома брюшной полости. Последнее осложнение потребовало пункционного дренирующего вмешательства под контролем УЗИ. Исход — полное разрешение, пациент выписан в удовлетворительном состоянии на амбулаторный этап на 18 сутки. У одного пациента в послеоперационном периоде на фоне острой массивной кровопотери развился ДВС-синдром, который потребовал интенсивной терапии в условиях ОРИТ; данное осложнение разрешилось.
Фотографии предоставлены авторами
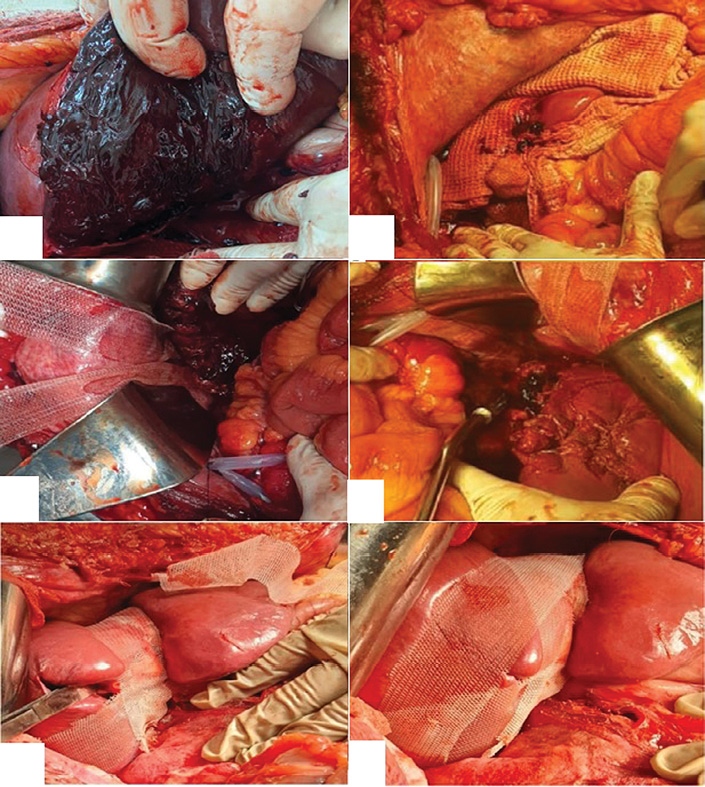
Рис. 1. Этапы модифицированного пакетирования печени на кадаверном материале: А — моделированная ушибленная рана правой доли печени; Б — тампонирование раны печени гемостатическим материалом «Сургитамп»; В — нанесение гранулированного сорбента «Молселект G-50»; Г — фиксация полосок полипропиленового сетчатого импланта к диафрагме; Д — фиксация полосок сетчатого импланта по висцеральной поверхности печени; Е — окончательный вид печени после модифицированного пакетирования
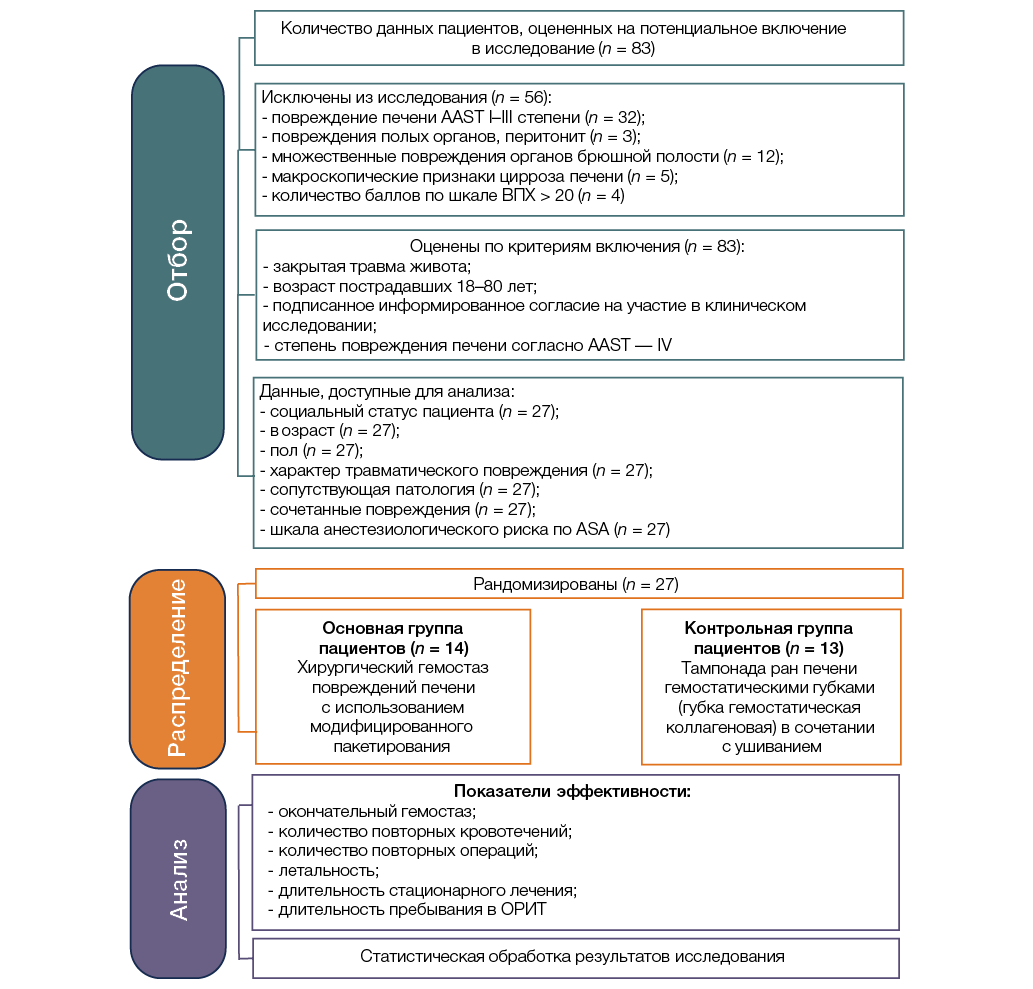
Рисунок подготовлен авторами
Рис. 2. Дизайн клинического исследования: ASA — Американское общество анестезиологов; ВПХ-шкала — шкалы объективной оценки тяжести повреждений, разработанные на кафедре военно-полевой хирургии Военно-медицинской академии; ОРИТ — отделение реанимации и интенсивной терапии,AAST — Американское общество хирургов и травматологов
Таблица 1. Характеристика групп исследования
|
Показатель |
Основная группа (n = 14) |
Контрольная группа (n = 13) |
Уровень статистической значимости, p |
|
Работающие, n (%) |
3 (21,4%) |
5 (38,5%) |
>0,05 |
|
Неработающие, n (%) |
8 (57,2%) |
8 (61,5%) |
>0,05 |
|
Пенсионеры, n (%) |
3 (21,4%) |
0 |
нд |
|
Возраст, годы Me [Q1; Q3] |
40 [ 54,0; 79.0] |
36,7 [ 37,0; 61,0] |
>0,05 |
|
Мужчины, n (%) |
10 (58,7%) |
10 (78,2%) |
>0,05 |
|
Женщины, n (%) |
4 (41,3%) |
3 (21,8%) |
>0,05 |
|
Автодорожная травма, n (%) |
5 (35,7%) |
7 (53,8%) |
>0,05 |
|
Падение с высоты, n (%) |
5 (21,4%) |
4 (23,1%) |
>0,05 |
|
Бытовая травма, n (%) |
4 (28,6%) |
2 (15,4%) |
>0,05 |
|
Ишемическая болезнь сердца, n (%) |
1 (83,2%) |
0 |
нд |
|
Хронический панкреатит, n (%) |
1 (8,4%) |
2 (9,0%) |
>0,05 |
|
Черепно-мозговая травма, n (%) |
4 (60,5%) |
4 (50,0%) |
>0,05 |
|
Повреждения грудной клетки, n (%) |
9 (30,9%) |
8 (41,6%) |
>0,05 |
|
Скелетная травма, n (%) |
5 (8,6%) |
4 (8,4%) |
>0,05 |
|
Повреждение костей таза, n (%) |
3 (21,4%) |
2 (15,3%) |
>0,05 |
|
II, n (%) |
5 (35,7%) |
4 (30,8%) |
>0,05 |
|
III, n (%) |
7 (50%) |
8 (61,5%) |
>0,05 |
|
IV, n (%) |
2 (14,3%) |
1 (7,7%) |
>0,05 |
|
III, n (%) |
4 (28,6%) |
3 (23,2%) |
>0,05 |
|
IV, n (%) |
6 (42,8%) |
5 (38,4%) |
>0,05 |
|
V, n (%) |
4 (28,6%) |
5 (38,4%) |
>0,05 |
Таблица составлена авторами по собственным данным
Примечание: нд — недостаточно данных; n — количество пациентов в группе.
Фотографии предоставлены авторами
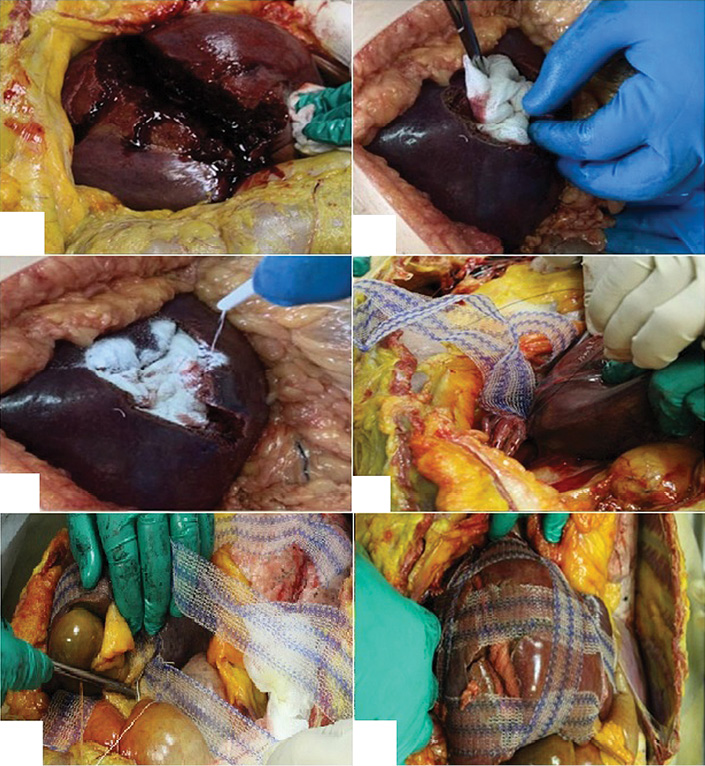
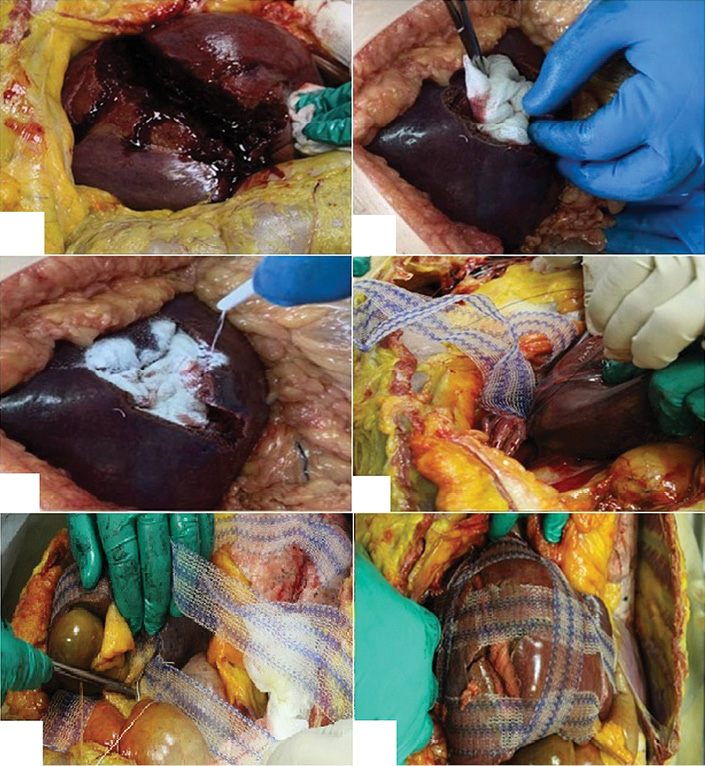
Рис. 3. Этапы выполнения модифицированного пакетирования у пациента с повреждением печени: А — внешний вид травматического разрыва V, VI, VII сегментов правой доли печени (AAST IV); Б — тампонирование раны гемостатическим материалом «Сургитамп», пропитанного гранулированным cорбентом «Молселект G-50», временная тампонада марлевым полотенцем; В — фиксация полосок полипропиленового импланта к диафрагме; Г, Д — фиксация полосок сетчатого импланта в поперечном направлении; Е — окончательный вид операционной раны
Таблица 2. Сравнительная эффективность лечения пациентов с травматическими повреждениями печени
|
Показатель |
Основная группа (n = 14) |
Контрольная группа (n = 13) |
Уровень статистической значимости, p |
|
Окончательный гемостаз, n (%) |
13 (92,8%) |
6 (46,2%) |
0,0391 |
|
Повторные кровотечения, n (%) |
1 (7,1%) |
5 (38,4%) |
0,0391 |
|
Повторные операции, n (%) |
1 (7,1%) |
5 (38,4%) |
0,0391 |
|
Летальность, n (%) |
2 (14,2%) |
5 (38,4%) |
>0,05 |
|
Медиана длительности стационарного лечения, койко-дни |
10,0 [ 9,0; 14,0] |
16,0 [ 10,0; 18,0] |
>0,05 |
|
Медиана времени оперативного вмешательства, мин |
100,0 [ 85,0; 120,0] |
130,0 [ 120,0; 150,0] |
0,0022 |
|
Медиана длительности пребывания в ОРИТ, койко-дни |
3,0 [ 1,0; 4,0] |
5,0 [ 3,0; 6,0] |
0,011 |
|
Медиана объема трансфузии эритроцитарной взвеси, мл |
1140 [ 1100; 1200] |
1230 [ 1150; 1900] |
0,0272 |
|
Медиана объема трансфузии СЗП, мл |
1175 [ 1100; 1250] |
1430 [ 1350; 2100] |
0,0001 |
|
Послеоперационные осложнения (по Clavien–Dindo) |
|||
|
III, n (%) |
1 (7,1%) |
5 (38,4%) |
>0,05 |
|
IIIa, n (%) |
– |
1 (7,7%) |
нд |
|
IV, n (%) |
– |
1 (7,7%) |
нд |
|
V, n (%) |
2 (14,2%) |
5 (38,4%) |
>0,05 |
Таблица составлена авторами по собственным данным
Примечание: нд — недостаточно данных; n — количество пациентов в группе.
ОБСУЖДЕНИЕ
Повреждения органов брюшной полости представляют собой одну из наиболее сложных и во многом не решенных проблем неотложной хирургии [5][9]. В структуре травматизма при абдоминальной травме повреждения печени находятся на втором месте, уступая лишь повреждениям селезенки. Однако наиболее высокие показатели летальности (14–58%) у пациентов с закрытой травмой живота приходятся именно на тяжелые повреждения печени, что обусловлено массивным внутрибрюшным трудноконтролируемым кровотечением и развитием печеночно-клеточной недостаточности в послеоперационном периоде [13][18].
Самой частой причиной летальных исходов при абдоминальной травме являются травматические разрывы печени, осложненные массивным кровотечением. В таких случаях основное значение имеют два фактора: своевременность и быстрота проведения оперативного вмешательства и применение надежного эффективного способа хирургического гемостаза [6].
Большинство хирургов в экстренных случаях применяют ушивание ран, электрокоагуляцию, тампонирование. Существенным недостатком при этом считается появление ишемических зон некроза между швами. При глубоких повреждениях используют тампонирование ран сальником, различными гемостатическими губками, пленками, порошкообразными гемостатиками. Но, как показывает практика, они оказываются малоэффективными. Тампонада глубоких ран полотенцем, салфеткой или любым нерассасывающимся материалом вызывает необходимость проведения повторных операций [3].
При обширных травматических повреждениях печени эффективным способом остановки кровотечения является пакетирование разрывов печени полипропиленовым сетчатым имплантом. При этом производится мобилизация печени от всех связок с обязательным сохранением оттока крови по венам. Но в послеоперационном периоде после стабилизации состояния всех пациентов необходимо повторно оперировать для проведения окончательного хирургического пособия [1].
Приведенные данные свидетельствуют, что существует множество способов гемостаза при повреждениях печени, но ни один из них не удовлетворяет хирургов. В этой связи разработка новых способов хирургического гемостаза травматических повреждений печени является актуальной проблемой ургентной хирургии.
Перед началом клинического исследования нами были проведены многофункциональные интегрированные морфологические, морфометрические, иммуногистохимические исследования на лабораторных животных по разработке нового способа хирургического гемостаза [3]. В серии экспериментов in vivo изначально было показано, что применение гемостатика «Сургитамп» и сорбента «Молселект G-50» эффективно останавливает умеренное паренхиматозное кровотечение на моделях кровоточащих ран печени, а в эксперименте на моделях с активным кровотечением из ран печени разработанная методика комбинированного хирургического гемостаза с применением гемостатических средств и модифицированного пакетирования показала высокую эффективность местного гемостаза [19].
В соответствии с целью нашего клинического исследования разработанный новый способ хирургического гемостаза с модифицированным пакетированием [20] был применен у самой тяжелой категории пациентов с травматическим повреждением печени, осложненным активным кровотечением (IV степени по AAST).
ЗАКЛЮЧЕНИЕ
Разработан и внедрен в клиническую практику новый метод хирургического гемостаза, реализующийся путем тампонирования ран печени гемостатической марлей «Сургитамп», пропитанной гранулированным сорбентом «Молселект G-50», с последующим модифицированным пакетированием печени полосками полипропиленового сетчатого эндопротеза. Это позволило улучшить результаты лечения пациентов с тяжелыми травматическими повреждениями печени за счет повышения надежности окончательного гемостаза, уменьшения повторных кровотечений и операций, снижения уровня летальности.
1 Постановление Правительства Российской Федерации № 750 «Об утверждении Правил передачи невостребованного тела, органов и тканей умершего человека для использования в медицинских, научных и учебных целях, а также использования невостребованного тела, органов и тканей умершего человека в указанных целях» (с изменениями и дополнениями) от 21.07.2012.
INTRODUCTION
Traumatic injuries to the abdominal organs represent a serious problem in modern emergency surgery. According to statistics, abdominal trauma accounts for 1.5–36.5% of all traumatic injuries. However, the mortality rate for injuries to the abdominal organs reaches extremely high figures — approximately 60%. Furthermore, the majority of the victims are of young and working age, which underscores the significant medical and social importance of this problem [1][2].
A distinct category of injuries in abdominal trauma comprises those to the parenchymal organs. Damage to the spleen is most frequently encountered in clinical practice. Liver injuries rank second in the structure of abdominal parenchymal organ injuries, yet they represent a considerable challenge for global surgery. Severe liver injuries are often accompanied by the development of difficult-to-control intra-abdominal hemorrhage and the onset of hepatocellular insufficiency in the postoperative period in cases of massive liver crush injury, which are the primary causes of unsatisfactory treatment outcomes for victims with liver trauma and high mortality rates (up to 50% or more) in such injuries [3–5].
Most recent studies concerning the problem of traumatic liver injuries have been focused on refining tactical approaches to the management of liver trauma, the application of endovascular hemostasis technologies, and the improvement of methods for surgical hemostasis of liver injuries [6]. Among the tactical approaches for the management of severe combined injuries, the strategy of staged surgical treatment, so called “damage control surgery,” is gaining increasing adoption. This strategy aims to shorten the initial phase of operative intervention, followed by stabilization of the patient’s condition and performance of the definitive surgical stage under more favorable circumstances. The strategy of damage control surgery currently demonstrates favorable outcomes; however, it does not address all aspects of the surgical management of severe traumatic liver injuries due to the development of early recurrent hemorrhages in patients with massive hepatic parenchymal damage [7–9].
An important modern achievement in the management of abdominal trauma, and primarily intra-abdominal hemorrhages, has been the adoption of the Non-Operative Management (NOM) strategy [10, 11]. The NOM strategy implies conducting a strict patient selection process and equipping hospitals with angiographic suites, coupled with a mandatory system for dynamic monitoring of patient condition [12]. However, most Russian hospitals providing emergency care to patients with abdominal trauma lack the appropriate facilities, which limits the applicability of the NOM strategy in the treatment of patients with liver injuries [13].
The primary current method for the management of severe traumatic liver injuries in patients with unstable hemodynamics is emergency operative intervention — midline laparotomy. Its main objective is to achieve reliable hemostasis of intra-abdominal hemorrhage [14][15]. A multitude of methods for hemostasis of liver injuries, both temporary and definitive, have been developed and are used in clinical practice; however, none of them can be considered fully satisfactory due to the high incidence of recurrent hemorrhage in the postoperative period [16][17]. The development of new methods for surgical hemostasis of traumatic liver injuries remains an extremely urgent task in modern emergency surgery [18].
In this study, we set out to develop and test a surgical hemostasis method for traumatic liver injuries through the application of modified perihepatic packing.
MATERIALS AND METHODS
Earlier, we conducted preliminary experimental studies to investigate the feasibility of a modified perihepatic packing technique for surgical hemostasis in laboratory animals [19].
In addition, we conducted preliminary studies on cadaveric material to develop a surgical technique for the application of modified perihepatic packing. The studies were carried out on seven unfixed male cadavers with a mean age of 34.5 ± 3.2 years, who had died from causes unrelated to traumatic injuries or diseases of the abdominal organs. The cadavers were provided by the Voronezh Regional Pathological Anatomy Bureau. The authorization for the provision of the cadaveric material complied with the provisions of the current legislation.1 The time interval from death to the study procedure did not exceed 24 h.
In each research subject, a traumatic liver injury was simulated. To that end, following a total laparotomy, the right lobe of the liver was exteriorized into the surgical wound and placed on a supporting platform/table.
At a distance of 40 cm from the liver surface, a 250 g steel weight was suspended from a laboratory stand using a thread. Upon readiness, the thread securing the weight was burned through with a gas burner flame, causing the weight to fall vertically and impact the diaphragmatic surface of the right liver lobe, resulting in the formation of a liver wound (Fig. 1A). The simulated liver wound was tightly packed with Surgitamp hemostatic gauze (Fig. 1B), which had been impregnated with Molselect G-50 granular sorbent (Fig. 1C), after which the right liver lobe was compressed with gauze pads.
To perform the procedure of modified perihepatic packing, mobilization of the right liver lobe was carried out. To that end, the right triangular, coronary, falciform, and round ligaments of the liver were transected with scissors, after which the right liver lobe was exteriorized into the surgical wound. Subsequently, a strip (width 4.0 cm and length 30.0 cm) of a mesh polypropylene implant used for hernia repair was positioned in the sagittal plane. For this purpose, the edge of the mesh implant strip was sutured to the diaphragm with three separate interrupted sutures using polypropylene monofilament (Fig. 1D). Next, the diaphragmatic surface of the liver was wrapped, extending onto the visceral surface; the mesh implant was tensioned to provide compression, and its lower edge was fixed with interrupted sutures to the starting edge of the strip, creating compression and tension. It is important to perform the modified perihepatic packing by maintaining a distance of 1.0–1.5 cm from the edges of the gallbladder; thereafter, it was enveloped with the greater omentum (Fig. 1E).
To provide additional compression in the transverse direction relative to the right liver lobe, three additional polypropylene mesh strips were sutured in place (Fig. 1F). The strips were enveloped with the greater omentum, which was then fixed to the liver capsule with interrupted sutures to prevent the occurrence of intestinal fistulas.
The subsequent phase of the study comprised the clinical evaluation of the modified perihepatic packing technique in patients with liver injuries. A pilot randomized controlled clinical trial was conducted at Bryansk City Hospital No. 1, Voronezh Regional Clinical Hospital No. 1, Voronezh City Emergency Clinical Hospital No. 1, and Voronezh City Emergency Clinical Hospital No. 10. In total, 27 patients with traumatic liver injury were enrolled in the study. The clinical trial design is summarized in Figure 2.
The inclusion criteria for the study were blunt abdominal trauma; patient age 18–80 years; signed informed consent for participation in the clinical trial; Grade IV liver injury according to the American Association for the Surgery of Trauma (AAST) classification [19].
The exclusion criteria for the study were refusal to participate in the clinical trial; moribund state of the patient; allergic reactions to Molselect G-50, Surgitamp, or the polypropylene mesh implant.
The discontinuation criteria for the study were withdrawal of consent for continued participation in the clinical trial; injury to hollow organs, peritonitis; Grade I–III liver injury according to the AAST classification; multiple injuries to abdominal organs; macroscopic signs of liver cirrhosis; a score of > 13 points on the Military Field Surgery scale for determining surgical tactics.
According to the formulated objectives, the patients were divided into two groups: the main group (14 patients) and the control group (13 patients). Patient allocation was performed by random sampling using a random number generator. The patients were comparable in terms of sex, age, nature of traumatic liver injury, structure of associated injuries, and severity of blood loss.
In the main group, the method for surgical hemostasis of traumatic liver injuries, as described in the patent [20], was applied. In the control group, the method for surgical hemostasis of liver wounds involved tamponade of the liver wounds with hemostatic collagen sponges, followed by suturing of the liver wound with 2-0 PGA monofilament.
As part of combined management, patients in both groups received standard conservative treatment in the postoperative period, which included hemostatic and infusion therapy, blood transfusions as indicated, antibiotic therapy, analgesics, and wound dressings.
The study outcomes were assessed based on the following parameters: achievement of definitive hemostasis, number of recurrent hemorrhages and reoperations, operative time, length of stay in the intensive care unit, duration of hospital stay, mortality rate, and the incidence and nature of postoperative complications.
Statistical analysis of the study results was performed using the Statistica 10 software. Standard descriptive statistics were calculated (mean (M), standard error of the mean (m), median (Me), lower (Q1) and upper (Q3) quartiles). The Shapiro–Wilk test was used to assess the normality of distribution for quantitative variables. The significance of differences for quantitative variables between independent groups was determined using Student’s t-test (for normally distributed variables) and the Mann–Whitney U-test (for non-normally distributed variables). Analysis of qualitative variables was conducted using Fisher’s exact test and the Z-test with Yates’ correction. Differences were considered statistically significant at p < 0.05.
RESULTS
The general characteristics of the patients enrolled in the study are presented in Table 1.
Table 1 summarized data on the patient groups. Traumatic liver injuries were most frequently encountered in males of working age — 20 (74.1%). These injuries were significantly less common in females — 7 (25.9%) patients. The median age of patients with traumatic liver injuries was 36.0 [30.0; 43.0] years. Analyzing the mechanism of abdominal trauma, it should be noted that road traffic accidents were the predominant cause of traumatic liver injuries (12 (44.5%) patients), followed by catatrauma (fall from height) (9 (33.3%) patients) and domestic injury (6 (22.2%) patients).
Among the associated injuries, chest injuries were the most frequent — 17 (32.5%), followed by skeletal trauma — 9 (16.7%), traumatic brain injury — 8 (29.6%), and pelvic injury — 5 (18.5%).
An analysis of comorbidities revealed that patients with abdominal trauma and liver injuries were largely somatically healthy. Comorbid conditions were identified in only 4 (14.8%) patients: coronary artery disease was present in 1 (3.7%) patient, and chronic pancreatitis was found in 3 (11.1%) patients.
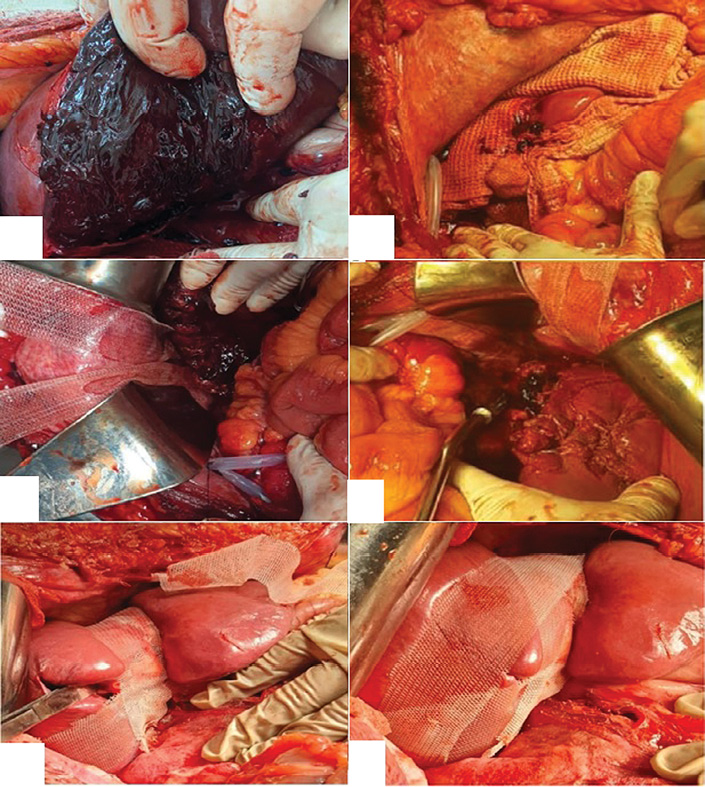
As part of combined management of patients in the main group, a new method for surgical hemostasis of traumatic liver injuries was applied. This method involved tamponade of the liver wounds with Surgitamp hemostatic gauze impregnated with Molselect G-50 granular sorbent, followed by modified perihepatic packing using strips of a polypropylene mesh implant [20] (Fig. 3A–F).
We established that immediately after tamponade of the liver wound with Surgitamp hemostatic gauze impregnated with Molselect G-50 granular sorbent, which swells upon contact with blood and increases in volume, the sorbent transformed into a blood-soaked hydrogel. The Surgitamp hemostatic gauze provided compression and enhanced the hemostatic effect. Manual compression of the liver achieved temporary hemostasis; however, upon release of compression, the bleeding recurred.
To achieve definitive hemostasis, the method of modified perihepatic packing with strips of polypropylene mesh implant was employed (the fixation technique is described above), which resulted in the final cessation of bleeding. Definitive hemostasis was achieved in 13 (92.8%) patients in the main group. In one (7.14%) patient from the main group, signs of recurrent hemorrhage were observed on postoperative day 2. The patient underwent emergency reoperation. During the abdominal cavity revision, the source of bleeding was identified as diffuse oozing from the liver wound due to insufficient compression from the tension of the polypropylene mesh implant strips. Additional tightening of the strips led to hemostasis and achievement of definitive control.
In the main group, two (14.3%) patients died. The cause of death was severe polytrauma. According to forensic autopsy findings, no signs of recurrent intra-abdominal hemorrhage were observed in either case.
In the control group, to achieve definitive hemostasis of the liver injuries, the wounds were packed with hemostatic collagen sponges. The sponges became saturated with blood; however, diffuse bleeding from the liver wounds persisted. To achieve definitive hemostasis, the liver wounds were sutured with U-shaped stitches (using 2-0 PGA monofilament) to approximate the wound edges. During suturing of the liver wounds, diffuse oozing from the needle puncture sites was observed, and the liver parenchyma was lacerated by the suture material, which complicated the achievement of definitive hemostasis and prolonged the operative time. In five (38.4%) patients in the control group, signs of recurrent bleeding were observed on postoperative days 2–3. These patients underwent emergency reoperation. The source of bleeding in all cases was oozing from the liver ruptures. In the control group, five (38.4%) patients died due to acute blood loss, posthemorrhagic anemia, and associated injuries.
The comparative effectiveness of modified perihepatic packing in the management of traumatic liver injuries is presented in Table 2.
The application of modified perihepatic packing in the combination management of patients with severe traumatic liver injuries (AAST Grade IV) resulted in an increase in the reliability of definitive hemostasis from 46.2% to 92.8% (p = 0.0391), a reduction in the rate of recurrent hemorrhages and reoperations from 38.4% to 7.1% (p = 0.0391), and a decrease in mortality from 38.4% to 14.2% (p > 0.05).
The conducted analysis of postoperative surgical complications in the study groups showed that in the postoperative period, one patient in the main group experienced recurrent hemorrhage. The patient underwent emergency reoperation. During the abdominal cavity revision, the source of bleeding was identified as diffuse oozing from the liver wound due to insufficient compression from the tension of the polypropylene mesh implant strips. Additional tightening of the strips led to the cessation of bleeding and the achievement of definitive hemostasis.
In the control group, five patients exhibited signs of recurrent bleeding in the postoperative period. These patients underwent reoperation. Intraoperatively, laceration of the liver parenchyma by the sutures was identified; additional hemostasis was performed, comprising electrocautery, application of a Tachocomb® patch to the site of diffuse oozing, or additional suturing of the rupture sites. One patient in the control group developed complaints of right upper quadrant pain and weakness in the postoperative period; an abdominal ultrasound was performed, revealing a biloma in the abdominal cavity. The latter complication required ultrasound-guided percutaneous drainage. The outcome was complete resolution, and the patient was discharged in satisfactory condition for outpatient follow-up on day 18. One patient developed disseminated intravascular coagulation (DIC) syndrome in the postoperative period following acute massive blood loss, which required intensive care in the ICU; this complication resolved.
Photographs taken by the authors
Fig. 1. Stages of modified perihepatic packing on a cadaveric model: A — simulated contused wound of the right liver lobe; B — tamponade of the liver wound with Surgitamp hemostatic material; C — application of Molselect G-50 granular sorbent; D — fixation of the polypropylene mesh implant strips to the diaphragm; E — fixation of the mesh implant strips along the visceral surface of the liver; F — final appearance of the liver after modified perihepatic packing
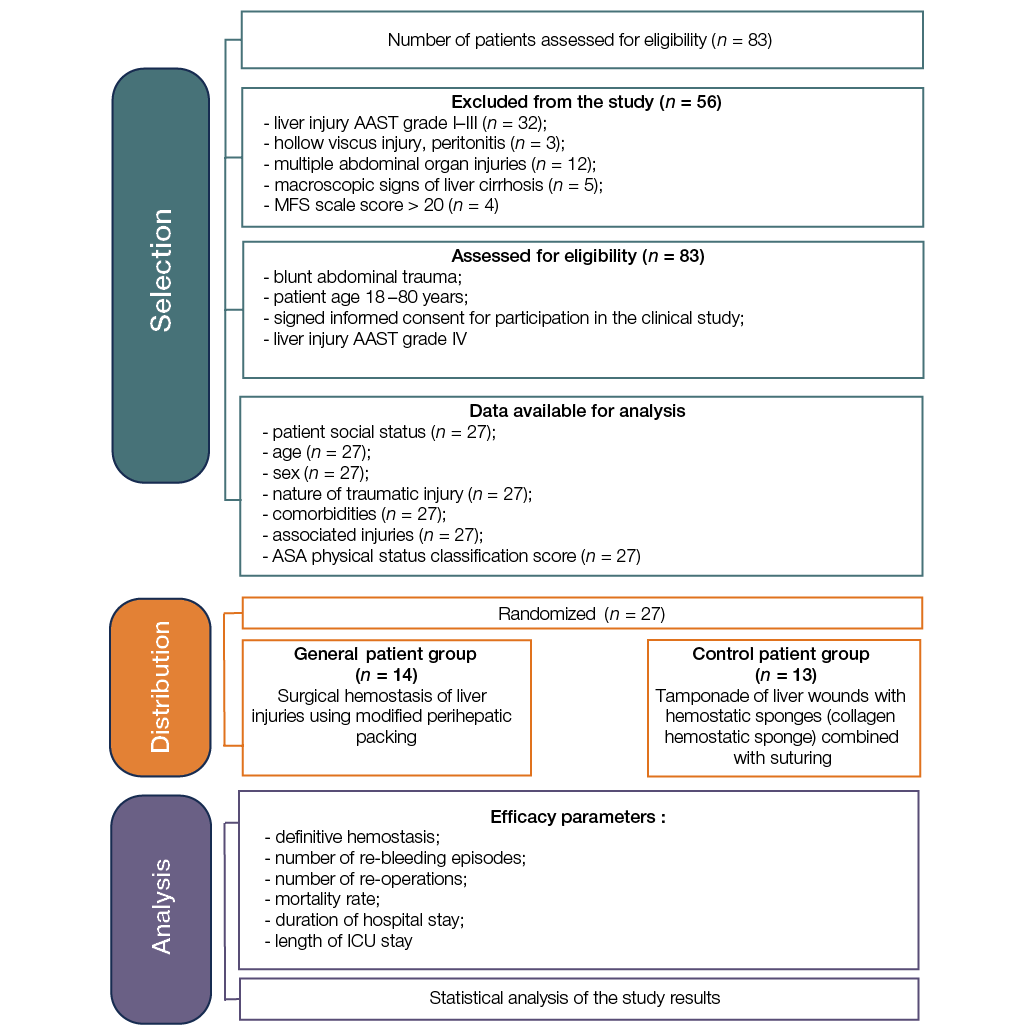
Figure prepared by the authors
Fig. 2. Clinical study design: MFS — Military Field Surgery; ICU — Intensive Care Unit; ASA — American Society of Anesthesiologists; AAST — American Association for the Surgery of Trauma
Table 1. Сharacteristics of the study groups
|
Parameter |
Main group (n = 14) |
Control group (n = 13) |
Statistical significance level, p |
|
Currently employed, n (%) |
3 (21.4%) |
5 (38.5%) |
p > 0.05 |
|
Unemployed, n (%) |
8 (57.2%) |
8 (61.5%) |
p > 0.05 |
|
Retirees, n (%) |
3 (21.4%) |
0 |
id |
|
Age, years Me [Q1; Q3] |
40 [ 54.0; 79.0] |
36.7 [ 37.0; 61.0] |
p > 0.05 |
|
Males, n (%) |
10 (58.7%) |
10 (78.2%) |
p > 0.05 |
|
Females, n (%) |
4 (41.3%) |
3 (21.8%) |
p > 0.05 |
|
Road traffic injury, n (%) |
5 (35.7%) |
7 (53.8%) |
p > 0.05 |
|
Fall from height, n (%) |
5 (21.4%) |
4 (23.1%) |
p > 0.05 |
|
Domestic injury, n (%) |
4 (28.6%) |
2 (15.4%) |
p > 0.05 |
|
Coronary artery disease, n (%) |
1 (83.2%) |
0 |
id |
|
Chronic pancreatitis, n (%) |
1 (8.4%) |
2 (9.0%) |
p > 0.05 |
|
Traumatic brain injury, n (%) |
4 (60.5%) |
4 (50.0%) |
p > 0.05 |
|
Chest injuries, n (%) |
9 (30.9%) |
8 (41.6%) |
p > 0.05 |
|
Skeletal trauma, n (%) |
5 (8.6%) |
4 (8.4%) |
p > 0.05 |
|
Pelvic bone injury, n (%) |
3 (21.4%) |
2 (15.3%) |
p > 0.05 |
|
II, n (%) |
5 (35.7%) |
4 (30.8%) |
p > 0.05 |
|
III, n (%) |
7 (50%) |
8 (61.5%) |
p > 0.05 |
|
IV, n (%) |
2 (14.3%) |
1 (7.7%) |
p > 0.05 |
|
III, n (%) |
4 (28.6%) |
3 (23.2%) |
p > 0.05 |
|
IV, n (%) |
6 (42.8%) |
5 (38.4%) |
p > 0.05 |
|
V, n (%) |
4 (28.6%) |
5 (38.4%) |
p > 0.05 |
Table compiled by the authors based on original data
Note: id — insufficient data; n — patient number in the group.
Photographs taken by the authors
Fig. 3. Stages of modified perihepatic packing in a patient with liver injury: A — gross appearance of a traumatic rupture of segments V, VI, and VII of the right liver lobe (AAST Grade IV); B — tamponade of the wound with Surgitamp hemostatic material impregnated with Molselect G-50 granular sorbent, and temporary packing with a gauze towel; C — fixation of the polypropylene mesh implant strips to the diaphragm; D, E — fixation of the mesh implant strips in the transverse direction; F — final appearance of the surgical wound
Table 2. Comparative effectiveness of management for patients with traumatic liver injuries
|
Parameter |
Main group (n = 14) |
Control group (n = 13) |
Statistical significance level, p |
|
Definitive hemostasis, n (%) |
13 (92.8%) |
6 (46.2%) |
p = 0.0391 |
|
Recurrent hemorrhages, n (%) |
1 (7.1%) |
5 (38.4%) |
p = 0.0391 |
|
Reoperations, n (%) |
1 (7.1%) |
5 (38.4%) |
p = 0.0391 |
|
Mortality, n (%) |
2 (14.2%) |
5 (38.4%) |
p > 0.05 |
|
Median duration of hospital stay, bed days |
10.0 [ 9.0; 14.0] |
16.0 [ 10.0; 18.0] |
p > 0.05 |
|
Median operative time, min |
100.0 [ 85.0; 120.0] |
130.0 [ 120.0; 150.0] |
p = 0.0022 |
|
Median ICU length of stay, bed-days |
3.0 [ 1.0; 4.0] |
5.0 [ 3.0; 6.0] |
p = 0.011 |
|
Median volume of red blood cell transfusion, mL |
1140 [ 1100; 1200] |
1230 [ 1150; 1900] |
p = 0.0272 |
|
Median volume of FFP transfusion, mL |
1175 [ 1100; 1250] |
1430 [ 1350; 2100] |
p = 0.0001 |
|
Postoperative complications (according to the Clavien–Dindo classification) |
|||
|
III, n (%) |
1 (7.1%) |
5 (38.4%) |
p > 0.05 |
|
IIIa, n (%) |
– |
1 (7.7%) |
id |
|
IV, n (%) |
– |
1 (7.7%) |
id |
|
V, n (%) |
2 (14.2%) |
5 (38.4%) |
p > 0.05 |
Table compiled by the authors based on original data
Note: ICU — Intensive Care Unit; FFP — Fresh Frozen Plasma; id — insufficient data; n — patient number.
DISCUSSION
Injuries to the abdominal organs represent one of the most challenging and largely unresolved problems in emergency surgery [5][9]. In the spectrum of abdominal trauma, liver injuries rank second, surpassed only by splenic injuries. However, the highest mortality rates (14–58%) in patients with blunt abdominal trauma are associated precisely with severe liver injuries, which is attributable to massive, difficult-to-control intra-abdominal hemorrhage and the development of hepatocellular insufficiency in the postoperative period [13][18].
The most frequent cause of mortality in abdominal trauma is traumatic liver rupture complicated by massive hemorrhage. In such cases, two factors are of paramount importance: the promptness and rapidity of surgical intervention and the application of a reliable and effective method for surgical hemostasis [6].
Most surgeons in emergency settings employ wound suturing, electrocautery, and packing. A significant drawback of these methods is the development of ischemic necrotic areas between the sutures. For deep injuries, packing the wounds with omentum, various hemostatic sponges, films, or powdered hemostatic agents is used. However, as practice shows, these often prove to be ineffective. Tamponade of deep wounds with a towel, gauze pad, or any non-resorbable material necessitates reoperation [3].
In cases of extensive traumatic liver injuries, an effective method for hemorrhage control is perihepatic packing of the liver ruptures with a polypropylene mesh implant. This procedure involves mobilization of the liver from all its ligaments while mandatorily preserving venous outflow. However, in the postoperative period, after stabilization of all patients, reoperation is required to perform definitive surgical repair [1].
The presented data indicate that while numerous methods for hemostasis in liver injuries exist, none of them is fully satisfactory. In this context, the development of new methods for surgical hemostasis of traumatic liver injuries remains a relevant problem in emergency surgery.
Prior to the initiation of the clinical trial, we conducted multifunctional integrated morphological, morphometric, and immunohistochemical studies in laboratory animals to develop a new method for surgical hemostasis [3]. In a series of in vivo experiments, it was initially demonstrated that the application of Surgitamp hemostatic agent and Molselect G-50 sorbent effectively controls moderate parenchymal bleeding in models of bleeding liver wounds. Furthermore, in experiments using models with active hemorrhage from liver wounds, the developed technique of combined surgical hemostasis — utilizing hemostatic agents and modified perihepatic packing — demonstrated high efficacy in achieving local hemostasis [19].
In accordance with the aim of our clinical study, the newly developed method of surgical hemostasis with modified perihepatic packing [20] was applied to the most severely affected category of patients with traumatic liver injury complicated by active hemorrhage (AAST Grade IV).
CONCLUSION
A new method for surgical hemostasis has been developed and introduced into clinical practice. This method involves tamponade of liver wounds with Surgitamp hemostatic gauze impregnated with Molselect G-50 granular sorbent, followed by modified perihepatic packing using strips of a polypropylene mesh endoprosthesis. This approach has improved treatment outcomes for patients with severe traumatic liver injuries by enhancing the reliability of definitive hemostasis, reducing the incidence of recurrent hemorrhages and reoperations, and lowering the mortality rate.
1. Decree of the Government of the Russian Federation No. 750 “On the Approval of the Rules for the Transfer of Unclaimed Bodies, Organs, and Tissues of a Deceased Person for Use in Medical, Scientific, and Educational Purposes, as well as the Use of Unclaimed Bodies, Organs, and Tissues of a Deceased Person for the Said Purposes” (as amended) of 21.07.2012.
References
1. García IC, Villalba JS, Iovino D, Franchi C, Iori V, Pettinato G, et al. Liver Trauma: Until When We Have to Delay Surgery? A Review. Life. 2022;12(5):694. https://doi.org/10.3390/life12050694
2. Corvino F, Giurazza F, Marra P, Ierardi AM, Corvino A, Basile A, et al. Damage Control Interventional Radiology in Liver Trauma: A Comprehensive Review. Journal of Personalized Medicine. 2024;14(4):365. https://doi.org/10.3390/jpm14040365
3. Vorontsov AK, Parkhisenko YuA, Cherednikov EF, Barannikov SV, Chernykh AV, Bezaltynnykh AA, et al. Experimental justification for the use of a new method of surgical hemostasis of extensive traumatic liver injuries. Volgograd Scientific Medical Journal. 2023;20(2):45–50 (In Russ.). EDN: HSJMKR
4. Evtikhov AV, Lyubivy ED, Kim VL. Clinical observations of severe traumatic liver injuries. Pirogov Russian Journal of Surgery. 2020;7:89–92 (In Russ.). https://doi.org/10.17116/hirurgia202007189
5. Aleksandrov VV, Maskin SS, Alimov MN, Biryulev DS, Matyukhin VV, Rashid A, et al. Closed liver injury. A systematic review. Russian Sklifosovsky Journal “Emergency Medical Care”. 2025;14(1):141–54 (In Russ.).https://doi.org/10.23934/2223-9022-2025-14-1-141-154
6. Coccolini F, Coimbra R, Ordonez C, Kluger Y, Vega F, Moore EE, et al. Liver trauma: WSES 2020 guidelines. World Journal of Emergency Surgery. 2020;15(1):24. https://doi.org/10.1186/s13017-020-00302-7
7. Benz D, Balogh ZJ. Damage control surgery: current state and future directions. Current Opinion in Critical Care. 2017;23(6):491–7. https://doi.org/10.1097/mcc.0000000000000465
8. Ordoñez CA, Parra MW, Millán M, Caicedo Y, GuzmanRodriguez M, Padilla N, et al. Damage Control in Penetrating Liver Trauma: Fear of the Unknown. Colombia Médica. 2020;51(4):e4134365.
9. Chubaryan KA, Groshilin YuV, Lukash VS. Possibilities of improving thе results of surgical treatment of patients with severe liver injuries. Polytrauma. 2024;3:19–27 (In Russ.). https://doi.org/10.24412/1819-1495-2024-3-19-27
10. Brooks A, Reilly JJ, Hope C, Navarro A, Naess PA, Gaarder C. Evolution of non-operative management of liver trauma. Trauma Surgery and Acute Care Open. 2020;5(1):e000551. https://doi.org/10.1136/tsaco-2020-000551
11. Iacobellis F, Di Serafino M, Caruso M, Dell’Aversano Orabona G, Rinaldo C, Grimaldi D, et al. Non-Operative Management of Polytraumatized Patients: Body Imaging beyond CT. Diagnostics. 2023;13(7):1347. https://doi.org/10.3390/diagnostics13071347
12. Aleksandrov VV, Maskin SS, Ermolaeva NK, Matyukhin VV. Conservative management of patients with closed trauma of parenchymal organs of the abdominal cavity and retroperitoneal space, with retroperitoneal hemorrhages — indications, methodology and feasibility. Russian Sklifosovsky Journal “Emergency Medical Care”. 2021;3:540–7 (In Russ.). https://doi.org/10.23934/2223-9022-2021-10-3-540-548
13. Gavrishchuk YaV, Manukovsky VA, Tulupov AN, Demko AE, Kolchanov EA, Savello VE, et al. Diagnostics and treatment of liver injuries in blunt abdominal trauma using minimally invasive technologies. Grekov’s Bulletin of Surgery. 2022;181(3):28–36 (In Russ.). https://doi.org/10.24884/0042-4625-2022-181-3-28-36
14. Podoluzhny VI, Radionov IA, Pelts VA, Startsev AB, Krasnov KA, Shatalin VA. Traumatic liver injury. Polytrauma. 2023;1:34–8 (In Russ.). https://doi.org/10.24412/1819-1495-2023-1-34-38
15. Lipatov VA, Lazarenko SV, Severinov DA, Denisov AA, Chupakhin EG, Aniskina EN. Comparative analysis of the effectiveness of new samples of local hemostatic agents. Extreme Medicine. 2023;25(4):131–6 (In Russ.). https://doi.org/10.47183/mes.2023.063
16. Barannikov SV, Cherednikov EF, Polubkova GV, Banin IN, Bolkhovitinov AE, Berezhnoy SI, et al. Use of alginate polymer polysaccharide hemostatic hydrogel in ongoing arterial bleeding from a peptic ulcer of a gastroenteroanastomosis (clinical case). Extreme Medicine. 2025;27(2):235–42 (In Russ.). https://doi.org/10.47183/mes.2025-243
17. Gavrishchuk YaV, Manukovsky VA, Tulupov AN, Demko AE, Kolchanov EA, Kisilev M, et al. Treatment of a victim with closed liver injury using interventional methods. Bulletin of Experimental and Clinical Surgery. 2023;16(4):316–20 (In Russ.). https://doi.org/10.18499/2070-478X-2023-16-4-316-320
18. Tinkoff G, Esposito TJ, Reed J, Kilgo P, Fildes J, Pasquale M, et al. American Association for the Surgery of Trauma Organ Injury Scale I: spleen, liver, and kidney, validation based on the National Trauma Data Bank. Journal of the American College of Surgeons. 2008;207(5):646–55. https://doi.org/10.1016/j.jamcollsurg.2008.06.342
19. Vorontsov AK, Parkhisenko YuA, Cherednikov EF, Barannikov SV, Bezaltynnykh AA, Chernykh AV. Hemostatic Gauze Surgitamp and Granular Sorbent Molselect G-50 Application in the Treatment of Simulated Bleeding Liver Wounds. Journal of Experimental and Clinical Surgery. 2023;1(16):52–9 (In Russ.). https://doi.org/10.18499/2070-478X-2023-16-1-52-59
20. Vorontsov AK, Parkhisenko YuA, Vorontsov KE, Bezaltynnykh AA. A method of surgical treatment for patients with severe liver injuries. Patent of Russian Federation № 2674874 С1; 2018 (In Russ.). EDN: ZECXBR
About the Authors
A. K. VorontsovRussian Federation
Aleksey K. Vorontsov - Cand. Sci. (Med.)
Smolensk
Yu. A. Parhisenko
Russian Federation
Yurij A. Parhisenko - Dr. Sci. (Med.)
Voronezh
E. F. Cherednikov
Russian Federation
Evgeniy F. Cherednikov - Dr. Sci. (Med.)
Voronezh
S. V. Barannikov
Russian Federation
Sergey V. Barannikov - Cand. Sci. (Med.)
Voronezh
A. A. Bezaltynnykh
Russian Federation
Aleksandr A. Bezaltynnykh - Dr. Sci. (Med.)
Smolensk
Supplementary files
Review
For citations:
Vorontsov A.K., Parhisenko Yu.A., Cherednikov E.F., Barannikov S.V., Bezaltynnykh A.A. Application of modified packing in the combination treatment of extensive traumatic liver injuries. Extreme Medicine. 2025;27(4):490-499. https://doi.org/10.47183/mes.2025-337

















