Перейти к:
Экспрессия генов SPI1 и GATA3 и субпопуляционный состав Т-хелперов у хронически облученных людей
https://doi.org/10.47183/mes.2024-26-3-15-21
Аннотация
Введение. Влияние неблагоприятных факторов, в том числе ионизирующего излучения, приводит к нарушению экспрессии ключевых транскрипционных факторов и соотношения основных типов Т-хелперных клеток, что, в свою очередь, инициирует широкий спектр иммунопатологических расстройств.
Цель. Изучение экспрессии мРНК генов SPI1 и GATA3, а также субпопуляционного состава Т-хелперов 1-го и 2-го типов у хронически облученных людей в период реализации отдаленных последствий радиационного воздействия.
Материалы и методы. Объектом изучения служили мононуклеарные клетки периферической крови, полученные от 98 жителей прибрежных сел реки Течи, среди которых были выделены группа облученных лиц (средняя накопленная доза облучения красного костного мозга составила 706,8 ± 62,7 мГр) и группа сравнения (доза облучения не превышала 70 мГр). Средний возраст людей на время проведения обследования составлял 71,1 ± 0,9 года (58–87 лет). Оценка относительного содержания мРНК исследуемых генов осуществлялась с использованием метода ПЦР-РВ. Исследование количества Т-хелперов 1-го и 2-го типов проводилось методом проточной цитометрии в составе популяций Т-хелперов центральной и эффекторной памяти.
Результаты. Отмечено снижение абсолютного и относительного количества Т-хелперов 2-го типа, входящих в состав Т-хелперов центральной памяти у хронически облученных лиц. У людей с накопленными дозами более 1000 мГр зафиксированы увеличение соотношения Th1/Th2 в популяции Т-хелперов центральной памяти по отношению к необлученным лицам (p = 0,01), а также положительная корреляционная связь между относительным содержанием Т-хелперов 2-го типа эффекторной памяти и экспрессией гена GATA3.
Выводы. Результаты исследования показывают, что изменения в субпопуляционном составе Т-хелперных клеток в отдаленные сроки у хронически облученных людей носят невыраженный характер. Однако эти изменения могут напрямую зависеть от суммарной поглощенной дозы облучения, что определяет перспективы для дальнейшего анализа состояния здоровья людей, подвергшихся хроническому облучению в высоких дозах.
Ключевые слова
Для цитирования:
Никифоров В.С., Котикова А.И., Аклеев А.В. Экспрессия генов SPI1 и GATA3 и субпопуляционный состав Т-хелперов у хронически облученных людей. Медицина экстремальных ситуаций. 2024;26(3):15-21. https://doi.org/10.47183/mes.2024-26-3-15-21
For citation:
Nikiforov V.S., Kotikova A.I., Akleyev A.V. Expression of genes SPI1 and GATA3 and Т-helpers subpopulation combination in chronically exposed people. Extreme Medicine. 2024;26(3):15-21. https://doi.org/10.47183/mes.2024-26-3-15-21
ВВЕДЕНИЕ
Иммунная система человека отличается чрезвычайно высокой радиочувствительностью, а пострадиационные изменения в системе иммунитета у облученных лиц способны длительно сохраняться [1][2]. Наиболее отчетливо это прослеживается у людей, которые подверглись внутреннему облучению в результате депонирования в организме остеотропных радионуклидов, в частности стронция-90 (90Sr). Накапливаясь в костной ткани, 90Sr продолжительно облучал красный костный мозг (ККМ), который отвечает за образование и развитие клеток крови, включая иммунокомпетентные клетки.
Отдаленные изменения в иммунной системе у хронически облученных жителей прибрежных сел реки Течи включали снижение экспрессии дифференцировочных антигенов Т-лимфоцитов, угнетение функциональной активности Т-клеток, снижение в сыворотке крови содержания ИЛ-4, повышение ФНО-α и ИФН-γ. В совокупности эти изменения характеризуют иммунный ответ, связанный с выраженными воспалительными реакциями [3].
Одним из механизмов, вовлеченным в процесс иммуносупрессии, который обнаружен у облученных лиц, является смещение равновесия между клеточно-опосредованным звеном иммунитета (Th1-ответом) и гуморальным иммунитетом (Th2-ответом) [4]. Т-хелперы 1-го типа (Th1) ответственны за устранение внутриклеточных патогенов и ассоциируются с органоспецифическими аутоиммунными заболеваниями, в то время как Т-хелперы 2-го типа (Th2) инициируют иммунный ответ на внеклеточных паразитов, таких как гельминты, и играют ключевую роль в развитии астмы и других аллергических заболеваний [5]. Баланс между Т-хелперами 1 и Т-хелперами 2 играет ключевую роль в иммунном ответе. В норме цитокины, вырабатываемые клетками Th2, подавляют продукцию цитокинов Th1 и активность естественных киллеров. В свою очередь, клетки Th1 могут препятствовать дифференцировке и пролиферации базофилов и эозинофилов, функции которых регулируются цитокинами Th2 [6]. Однако при воздействии высоких доз ионизирующего излучения запускаются более выраженные иммуносупрессивные реакции со стороны продукции Тh2-опосредованных цитокинов, в то время как влияние малых доз радиации на баланс Т-хелперных клеток остается спорным [7][8].
Механизмы, контролирующие широкий спектр фенотипов Т-хелперов, особенно в условиях действия неблагоприятных факторов, остаются малоизученными. Тем не менее на сегодняшний день известны несколько ключевых генов, играющих важную роль в регуляции дифференцировки Th1 и Th2 [9].
Транскрипционный фактор PU.1, кодируемый протоонкогеном SPI1, и белок GATA-3, кодируемый одноименным геном GATA-3, участвуют в разнообразных процессах кроветворения и функционирования иммунной системы. В иммунокомпетентных клетках системы они способны запускать активацию ряда факторов, таких как хемокины, цитокины и рецепторы цитокинов, которые регулируют процессы дифференцировки и функционирования Т-хелперных клеток. Взаимодействие PU.1 и GATA-3 способно контролировать иммунное развитие и гомеостаз путем регуляции экспрессии генов, специфичных для субпопуляций Тh1 и Th2 [10].
Принимая во внимание вышесказанное, цель настоящей работы заключалась в изучении экспрессии мРНК генов SPI1 и GATA3, а также субпопуляционного состава Т-хелперов 1-го и 2-го типов у хронически облученных людей в период реализации отдаленных последствий радиационного воздействия.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось спустя более 65 лет после начала хронического облучения. В качестве объекта исследования выступали мононуклеарные клетки периферической крови, полученные от 98 человек — жителей прибрежных сел реки Течи. Облучение данных людей отличалось низкой интенсивностью, со значением поглощенных доз преимущественно в диапазоне малых и средних, низкой интенсивностью и многолетним облучением красного костного мозга (ККМ) с ярко выраженными компенсаторными механизмами в системе кроветворения. Внутреннее облучение происходило из-за накопления радионуклидов в организме при употреблении речной воды и местных продуктов. Внешнее гамма-излучение было вызвано загрязнением донных отложений и пойменных почв радионуклидами [11].
Участники исследования проходили медицинский осмотр в клиническом отделении Уральского научно-практического центра радиационной медицины Федерального медико-биологического агентства. Биологический материал был получен с согласия пациентов (основание — добровольное информированное согласие в соответствии с Хельсинкской декларацией).
Из исследования были исключены пациенты, находившиеся в период острых или обострения хронических воспалительных заболеваний; имеющие онкологические и аутоиммунные заболевания; принимающие во время обследования антибиотики, гормональные и цитостатические препараты; имевшие контакт с генотоксичными агентами в процессе профессиональной деятельности.
В качестве основных дозиметрических величин, определяющих меры воздействия ионизирующего излучения (ИИ) на организм обследованных лиц, являлись персонализированные дозы облучения ККМ, тимуса и периферических лимфоидных органов, рассчитанные специалистами биофизической лаборатории ФГБУН УНПЦ РМ ФМБА России с использованием дозиметрической системы TRDS-2016 [12].
В соответствии с величиной накопленной дозы облучения ККМ пациенты были разделены условно на две группы: группу сравнения — 45 человек, накопление дозы у которых происходило в течение жизни преимущественно за счет естественного радиоактивного фона, а также медицинских диагностических процедур (накопленные дозы не превышали 55 мГр) и группу хронически облученных лиц — 53 человека, средняя доза облучения красного костного мозга которых составила 782,0 ± 82,3 мГр.
Пациентов, подвергшихся хроническому облучению, разделили на три подгруппы в зависимости от величины накопленной дозы облучения ККМ.
Подгруппа 1. Облученные лица с накопленными дозами на ККМ, не превышающими 500 мГр (n = 20).
Подгруппа 2. Облученные лица с накопленными дозами на ККМ от 500 до 1000 мГр (n = 20).
Подгруппа 3. Облученные лица с накопленными дозами на ККМ более 1000 мГр (n = 13).
Возраст людей из всех подгрупп статистически значимо не различался. В таблице 1 представлена характеристика исследуемых групп, в том числе средний возраст испытуемых и средние дозы облучения, рассчитанные на ККМ, тимус и периферические лимфоидные органы. Обследование проходили лица славянского и тюркского происхождения (татары и башкиры).
Забор крови для оценки относительного содержания мРНК метилтрансфераз был проведен из локтевой вены в объеме 3 мл в стерильные вакуумные пробирки Tempus Blood RNA Collection Tubes (Thermo Scientific™, США). Выделение РНК осуществлялось колоночным методом при помощи коммерческого набора GeneJET Stabilized and Fresh Whole Blood RNA Kit (Thermo Scientific™, США). Количественные и качественные характеристики выделенных образцов общей РНК оценивали при помощи спектрофотометра NanoDrop 2000С (Thermo Scientific™, США). Чистоту препарата определяли по значениям поглощения на длинах волн, равных 260 и 280 нм (А260/280). Реакция обратной транскрипции проводилась отдельным этапом с использованием коммерческого набора реактивов MMLV RT kit («Евроген», Россия). Относительное количественное содержание мРНК определяли с помощью ПЦР в режиме реального времени с использованием амплификатора CFX96 Touch (Bio-Rad Laboratories, США). Олигонуклеотидные последовательности праймеров и зондов были разработаны коммерческой компанией ООО «ДНК-СИНТЕЗ». Относительную продукцию генов рассчитывали по методу 2–ΔΔCt, основанному на расчете количественной оценки экспрессии интересующих генов по отношению к гену «домашнего хозяйства» на основании ПЦР-анализа, проводимого в режиме реального времени [13]. В качестве эндогенного контроля и нормализации данных был использован ген «домашнего хозяйства» ACTB (Actin Beta). Расчет проводился с помощью программного обеспечения прибора Real-Time CFX96 Touch (BioRad, США).
Подробное описание методики исследования субпопуляций Т-хелперов периферической крови методом проточной цитофлюориметрии было представлено в работе [14]. Для данного исследования были отобраны следующие клеточные популяции: Т-хелперы 1-го типа в популяции Т-хелперов центральной памяти (фенотип CD3+CD4+CD45RA-CD62L+CXCR5–CXCR3+CCR6–CCR4–), Т-хелперы 1-го типа в популяции Т-хелперов эффекторной памяти (фенотип CD3+CD4+CD45RA-CD62L-CXCR5–CXCR3+CCR6–CCR4–), Т-хелперы 2-го типа в популяции Т-хелперов центральной памяти (фенотип CD3+CD4+CD45RA-CD62L+CXCR5–CXCR3–CCR6–CCR4+) и Т-хелперы 2-го типа в популяции Т-хелперов эффекторной памяти (фенотип CD3+CD4+CD45RA-CD62L-CXCR5–CXCR3–CCR6–CCR4+).
Статистическую обработку результатов осуществляли с использованием программного комплекса SPSS Statistics 17.0 и Graph Pad Prism 8.4.3. Проверку нормальности распределения количественных показателей проводили с помощью критерия согласия типа Колмогорова — Смирнова. При описании полученных показателей, распределение которых отличалось от нормального, использовали медиану (Ме) и 25–75-й процентили (Q1–Q3). Сравнение выборок данных проводили с использованием U-критерия Манна — Уитни, поскольку распределение большинства значений не соответствовало закону нормального распределения. Для многомерного сравнения использовали критерий Краскела — Уоллиса. Для всех критериев и тестов различия признавали статистически значимыми при p < 0,05.
Таблица 1. Характеристика обследуемых лиц
|
Показатель |
Группа сравнения |
Дозовые подгруппы облученных лиц, доза облучения ККМ, мГр |
Общая группа облученных |
||
|
Подгруппа 1 |
Подгруппа 2 |
Подгруппа 3 |
|||
|
Количество пациентов, n |
45 |
20 |
20 |
13 |
53 |
|
Возраст пациентов, лет |
68,2 ± 1,0 |
70,5 ± 1,1 |
72,5 ± 0,8 |
72,5 ± 0,6 |
71,7 ± 1,0 |
|
Накопленная доза облучения ККМ, мГр |
17,3 ± 2,3 (0–55,0) |
286,5 ± 27,8 (73,4–485,1) |
695,1 ± 34,8 (509,6–968,6) |
1371,5 ± 71,8 (1032,0–1867,6) |
706,8 ± 62,7 (73,4–1867,6) |
|
Накопленная доза облучения тимуса и периферических лимфоидных органов, мГр |
7,17 ± 1,30 (0–39,52) |
46,4 ± 7,4 (4,6–160,9) |
86,2 ± 16,4 (25,5–354,6) |
165,5 ± 17,7 (103,6–357,9) |
90,6 ± 10,2 (4,6–357,9) |
Таблица подготовлена авторами по собственным данным
Примечание: ККМ — красный костный мозг; n — количество исследуемых лиц; данные представлены в виде среднего значения и стандартной ошибки среднего (M ± SE) и (max–min).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
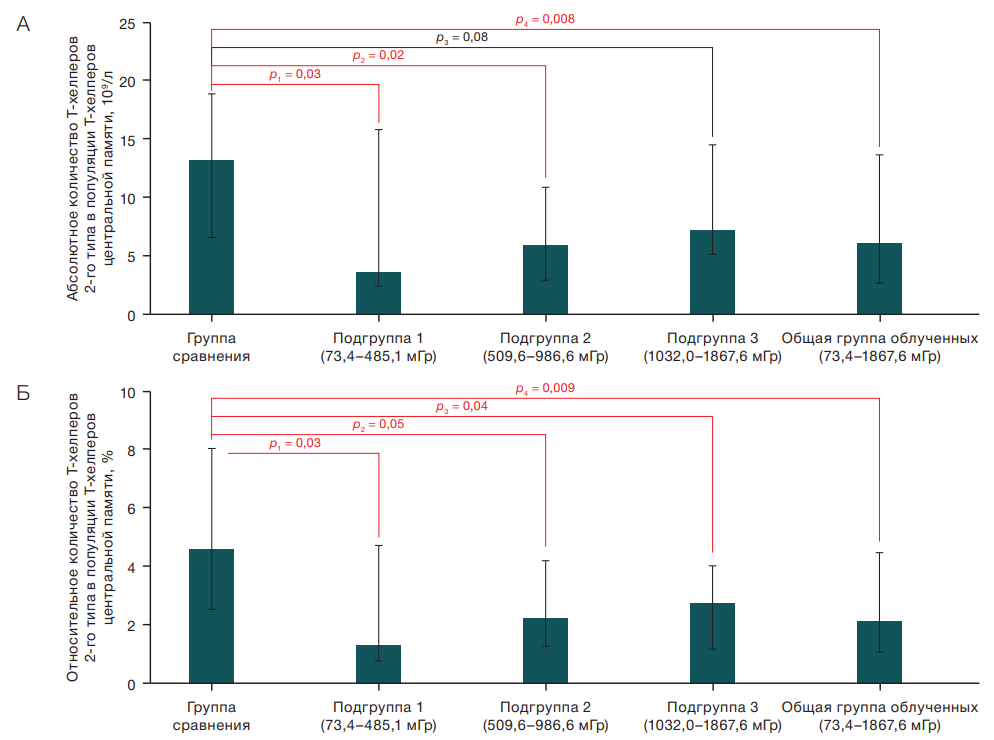
В ходе исследования получены статистически значимые различия в содержании Т-хелперов 2-го типа, входящих в состав Т-хелперов центральной памяти, в периферической крови у облученных лиц и испытуемых из группы сравнения. Соответствующие данные представлены на рисунках 1А и Б.
Так, у лиц из подгрупп с различной дозой облучения ККМ отмечено статистически значимое снижение абсолютного количества Т-хелперов 2-го типа по сравнению с результатами испытуемых из группы сравнения, а именно: в общей группе облученных лиц — 6,00×109/л (p = 0,03), у лиц из первой подгруппы — 3,63×109/л (p = 0,03), у испытуемых из второй подгруппы — 5,88×109/л (p = 0,02) против 13,14×109/л у испытуемых из группы сравнения. У облученных лиц из подгрупп с различной дозой облучения ККМ также обнаружено статистически значимое снижение относительного количества Т-хелперов 2-го типа по сравнению с аналогичным показателем у лиц из группы сравнения (рис. 1Б).
Вместе с тем обнаружено статистически значимое увеличение соотношения Th1/Th2 в популяции Т-хелперов центральной памяти у лиц из третьей подгруппы — 14,26%, облученных лиц из общей группы — 12,54% относительно показателя у испытуемых из группы сравнения — 7,25% (рис. 2). В то же время в первой и второй подгруппах облученных лиц данный показатель был увеличен относительно испытуемых из группы сравнения лишь на уровне тенденции (p = 0,06 и p = 0,07 соответственно). Для других исследуемых показателей Т-хелперного звена не выявлено статистически значимых межгрупповых различий.
Для установления степени связи между концентрацией Т-хелперов, воздействием радиационных факторов (накопленные дозы облучения ККМ, тимуса и периферических лимфоидных органов), а также возрастом пациентов на время обследования был проведен корреляционный анализ.
В ходе проведенного анализа не было выявлено статистически значимой корреляционной взаимосвязи между абсолютным и относительным количеством Т-хелперов 2-го типа в популяции Т-хелперов центральной памяти и соотношением Th1/Th2 в популяции Т-хелперов центральной памяти с накопленными дозами облучения ККМ, тимуса и периферических лимфоидных органов в объединенной группе исследования. Не было также отмечено статистически значимых корреляционных взаимосвязей между выбранными показателями Т-хелперов и возрастом исследуемых лиц ни в группе сравнения, ни в группе облученных лиц.
Результаты исследования относительной экспрессии генов SPI1 и GATA-3 у обследованных пациентов представлены в таблице 2. Приведенные в таблице 2 данные свидетельствуют о том, что статистически значимых различий в относительном содержании мРНК генов SPI1 и GATA3 у лиц из основной группы и группы сравнения выявлено не было даже по мере увеличения значений накопленной дозы облучения ККМ.
Не выявлено статистически значимых корреляционных связей между относительным содержанием мРНК генов SPI и GATA3 c поглощенными дозами облучения ККМ, тимуса и периферических лимфоидных органов и факторами нерадиационной природы (достигнутого возраста, пола и этнической принадлежности).
У всех хронически облученных лиц не обнаружено статистически значимых корреляционных связей между относительным содержанием мРНК гена SPI1 и абсолютным количеством и частотой Т-хелперных клеток 1-го и 2-го типа в отдаленные сроки после начала радиационного воздействия. При этом в группе облученных людей, чьи накопленные дозы облучения ККМ находились в диапазоне высоких значений (превышали 1000 мГр), обнаружена положительная корреляционная связь между экспрессией гена GATA3 и относительным содержанием Т-хелперов 2-го типа эффекторной памяти (Rs = 0,70; р = 0,02).
Рисунки подготовлены авторами по собственным данным
Рис. 1. Абсолютное (А) и относительное (Б) количество Т-хелперов 2-го типа в популяции Т-хелперов центральной памяти в периферической крови, данные представлены в виде Мe (Q1–Q3)
Примечание: р — доверительная вероятность различий относительно группы сравнения (U-критерий Манна — Уитни)
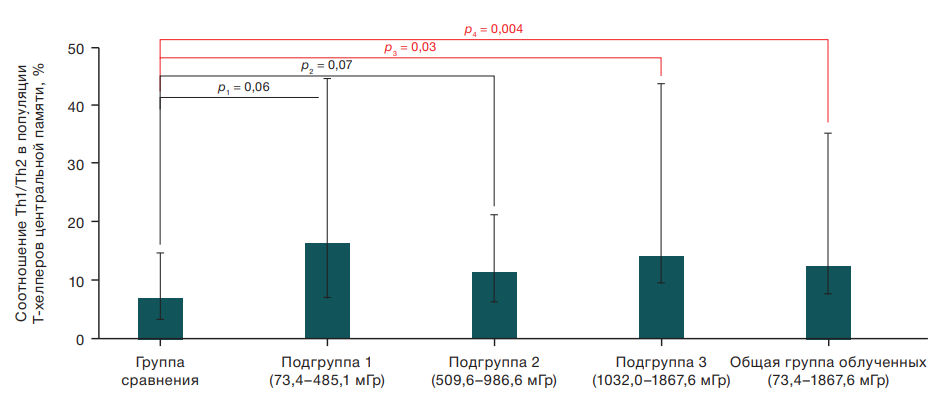
Рисунок подготовлен авторами по собственным данным
Рис. 2. Различие в соотношении Th1/Th2 популяции Т-хелперов центральной памяти между группой сравнения и облученными лицами в широком диапазоне доз, данные представлены в виде Мe (Q1–Q3)
Примечание: р — доверительная вероятность различий относительно группы сравнения (U-критерий Манна — Уитни).
Таблица 2. Относительное содержание мРНК генов SPI1 и GATA3 в исследуемых группах
|
Относительный уровень мРНК гена |
Группа сравнения, n = 45 |
Хронически облученные лица, дозы облучения мГр |
|||
|
Подгруппа 1, n = 20 |
Подгруппа 2, n = 20 |
Подгруппа 3, n = 13 |
Общая группа облученных, n = 53 |
||
|
SPI1, rel. un. |
1,09 (0,30–2,69) |
1,09 (0,33–3,11) |
1,00 (0,24–2,71) |
0,96 (0,28–2,66) |
1,03 (0,29–2,71) |
|
GATA3, rel. un. |
1,10 (0,05–5,62) |
0,84 (0,01–7,37) |
1,10 (0,19–3,16) |
0,83 (0,02–4,06) |
0,85 (0,02–4,06) |
Таблица подготовлена авторами по собственным данным
Примечание: данные представлены в формате Me (Q1–Q3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно ранее полученным данным, длительное воздействие ионизирующей радиации, даже в диапазоне низких доз, может вызывать снижение клеточного иммунитета на фоне изменений в составе циркулирующих клеток иммунной системы [15].
Т-хелперы относятся к субпопуляциям Т-лимфоцитов и выполняют важную роль в регуляции иммунитета. Опосредуя взаимодействие между иммунокомпетентными клетками, они определяют тип иммунного ответа (клеточный или гуморальный) [16]. В современной литературе появляется все больше данных в пользу индуцированных радиацией изменений в составе и функции субпопуляций Т-клеток, что детерминирует формирование специфического воспалительного профиля иммунной системы, нарушение баланса между субпопуляциями Th1 и Th2, а также изменения уровня экспрессии факторов транскрипции [17].
В результате исследования было выявлено статистически значимое снижение количества T-хелперов 2-го типа в составе популяции Т-хелперов центральной памяти у облученных людей. Наиболее низкие показатели клеточности наблюдались среди лиц, чьи поглощенные дозы находились в диапазоне от 73,4 до 485,1 мГр. В связи с этим у облученных людей было зафиксировано увеличение соотношения Th1/Th2 в популяции Т-хелперов центральной памяти относительно лиц из группы сравнения. Однако данные изменения не были связаны с возрастом или дозой облучения ККМ, тимуса и периферических лимфоидных органов. Аналогичное угнетение Th2-ответа у мышей было продемонстрировано в эксперименте в условиях воздействия низкодозовой радиации [18]. Кроме того, Г. Карими и др., проводившие наблюдение за врачами-радиологами с уровнем облучения менее 50 мГр, отмечали у них сдвиг иммунного ответа в сторону продукции Т-хелперов 1-го типа [19]. Ранее нами также описано снижение количества Т-хелперов 2-го типа, входящих в состав Т-хелперов центральной памяти у лиц, подвергшихся хроническому низкоинтенсивному радиационному воздействию [20].
В рамках настоящей работы нами установлено, что в отдаленные сроки после воздействия ИИ у жителей прибрежных сел реки Течи, подвергшихся хроническому облучению, отсутствуют изменения со стороны экспрессии мРНК генов транскрипционных факторов SPI и GATA3. Обращает на себя внимание тот факт, что для лиц, чьи поглощенные дозы облучения ККМ находились в диапазоне высоких значений (более 1000 мГр), характерна статистически значимая положительная корреляционная связь между относительным содержанием мРНК гена GATA3 и Т-хелперами 2-го типа эффекторной памяти. Действительно, белок GATA3 играет важную роль в развитии Th2-фенотипа, активируя секрецию цитокинов IL-4, IL-5 и IL-13 в Th2-клетках, а также ингибируя специфические транскрипционные факторы Th1, такие как T-bet, NF-AT1, FOXP3 и другие [21].
Результаты, полученные в ходе исследования, не противоречат современным научным данным и показывают, что изменения в иммунной системе у людей, подвергшихся хроническому низкоинтенсивному радиационному воздействию, в отдаленные сроки носят невыраженный характер. Необходимо продолжить работу по изучению ключевых факторов транскрипции, участвующих в дифференцировке иммунокомпетентных клеток и обеспечивающих их функционирование у людей, облученных в диапазоне высоких доз.
ЗАКЛЮЧЕНИЕ
Результаты исследования зафиксировали снижение абсолютного количества Т-хелперов 2-го типа, входящих в состав Т-хелперов центральной памяти, в отдаленные сроки у лиц, подвергшихся хроническому радиационному воздействию. У людей с накопленными дозами более 1000 мГр наблюдается увеличение соотношения Th1/Th2 в популяции Т-хелперов центральной памяти по отношению к необлученным лицам и положительная корреляционная связь между экспрессией гена GATA3 и относительным количеством Т-хелперов 2-го типа эффекторной памяти.
Полученные результаты подтверждают факт, что радиационно-индуцированные иммунные изменения могут напрямую зависеть от суммарной поглощенной дозы облучения, что определяет перспективы для дальнейшего анализа состояния здоровья людей, подвергшихся хроническому облучению в высоких дозах.
Список литературы
1. UNSCEAR Biological mechanisms relevant for the inference of cancer risks from low-dose and low-dose-rate radiation. United Nations Scientific Committee on the Effects of Atomic Radiation. United Nations. New York. 2021.
2. Стюарт ФА, Аклеев АВ, Хауэр-Дженсен М. Труды МКРЗ. Публикация 118. Отчет МКРЗ по тканевым реакциям, ранним и отдаленным эффектам в нормальных тканях и органах — пороговые дозы для тканевых реакций в контексте радиационной защиты. Челябинск: Книга; 2012.
3. Аклеев АА. Иммунный статус человека в отдаленном периоде хронического радиационного воздействия. Медицинская радиология и радиационная безопасность. 2020;65(4):29–35. https://doi.org/10.12737/1024-6177-2020-65-4-29-35
4. Chalmin F, Humblin E, Ghiringhelli F, Vegran F. Transcriptional programs underlying Cd4 T cell differentiation and functions. International Review of Cell and Molecular Biology. 2018;(341):1–61. https://doi.org/10.1016/bs.ircmb.2018.07.002
5. Luckheeram RV, Zhou R, Verma AD, Xia B. CD4+T cells: differentiation and functions. Clin Dev Immunol. 2012;(2012):925135. https://doi.org/10.1155/2012/925135
6. Mazzarella G, Bianco A, Catena E, De Palma R, Abbate GF. Th1/ Th2 lymphocyte polarization in asthma. Allergy. 2000;55(61):6–9. https://doi.org/10.1034/j.13989995.2000.00511.x
7. Han SK, Song JY, Yun YS and Yi SY. Effect of gamma radiation on cytokine expression and cytokine-receptor mediated STAT activation. International Journal of Radiation Biology. 2006;(82):686–97. https://doi.org/10.1080/09553000600930699
8. Gao H, Dong Z, Gong X, Dong J, Zhang Y, Wei W. et al. Effects of various radiation doses on induced T-helper cell differentiation and related cytokine secretion. Journal of Radiation Research. 2018;(59):395–403. https://doi.org/10.1093/jrr/rry011
9. Nikiforov VS., Akleyev AV. mRNA Expression of GATA3, FOXP3, TBX21, STAT3, NFKB1, and MAPK8 Transcription Factors in Humans and Their Cooperative Interactions LongTerm after Exposure to Chronic Radiation. Biology Bulletin. 2022;49(6):588–95. https://doi.org/10.1134/S1062359022060103
10. Rothenberg EV, Hosokawa H, Ungerback J. Mechanisms of action of hematopoietic transcription factor PU.1 in initiation of T-cell development. Frontiers in Immunology. 2019;(10):228. https://doi.org/10.3389/fimmu.2019.00228
11. Аклеев АВ, ред. Последствия радиоактивного загрязнения реки Теча. Челябинск: Книга; 2016. EDN: VYWFDT
12. Дегтева МО, Напье БА, Толстых ЕИ, Шишкина ЕА, Бугров НГ, Крестинина ЛЮ и др. Распределение индивидуальных доз в когорте людей, облученных в результате радиоактивного загрязнения реки Течи. Медицинская радиология и радиационная безопасность. 2019;64(3):46–53. https://doi.org/10.12737/article_5cf2364cb49523.98590475
13. Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)). Methods. 2001;25(4):402–8. https://doi.org/10.1006/meth.2001.1262
14. Котикова АИ, Блинова ЕА, Аклеев АВ. Субпопуляционный состав Т-хелперов в периферической крови хронически облученных лиц в отдаленном периоде. Медицина экстремальных ситуаций. 2022;24(2):65–73. https://doi.org/10.47183/mes.2022.018
15. Кодинцева ЕА, Аклеев АА. Корреляции показателей адаптивного и врожденного иммунитета у хронически облученных людей в отдаленные сроки. Российский иммунологический журнал. 2020;23(2):225–230 https://doi.org/10.46235/1028-7221-399-DCP
16. Alberts B, Johnson A, Lewis J et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science; 2002. Helper T Cells and Lymphocyte Activation. Available from: https://www.ncbi.nlm.nih.gov/books/NBK26827.
17. McKelvey KJ, Hudson AL, Back M, Eade T, Diakos CI. Radiation, inflammation and the immune response in cancer. Mammalian Genome. 2018;29(11):843–65. https://doi.org/10.1007/s00335-018-9777-0
18. Gao H, Dong Z, Gong X, Dong J, Zhang Y, Wei W,et al. Effects of various radiation doses on induced T-helper cell differentiation and related cytokine secretion. Journal of radiation research. 2018;59(4):395–403. https://doi.org/10.1093/jrr/rry011
19. Karimi G, Balali-Mood M, Alamdaran SA, Badie-Bostan H, Mohammadi E, Ghorani-Azam A, Sadeghi M, & Riahi-Zanjani B. Increase in the Th1-Cell-Based Immune Response in Healthy Workers Exposed to Low-Dose Radiation — Immune System Status of Radiology Staff. Journal of pharmacopuncture. 2017;20(2):107–11. https://doi.org/10.3831/KPI.2017.20.014
20. Nikiforov VS, Kotikova AI, Blinova EA, Akleyev AV. Transcriptional Activity of Genes Regulating T-Helper Differentiation in the Accidentally Exposed Population of the Southern Urals. Dokl Biochem Biophys. 2024. https://doi.org/10.1134/S1607672924701114
21. Shih H-Y, Sciume` G, Poholek AC, Vahedi G, Hirahara K, Villarino AV et al. Transcriptional and epigenetic networks that drive helper T cell identities. Immunological Reviews. 2014;261(1):23–49. https://doi.org/10.1111/imr.12208
Об авторах
В. С. НикифоровРоссия
Никифоров Владислав Сергеевич, канд. биол. наук, доцент
Челябинск
А. И. Котикова
Россия
Котикова Алиса Игоревна
Челябинск
А. В. Аклеев
Россия
Аклеев Александр Васильевич, д-р мед. наук, профессор
Челябинск
Дополнительные файлы
Рецензия
Для цитирования:
Никифоров В.С., Котикова А.И., Аклеев А.В. Экспрессия генов SPI1 и GATA3 и субпопуляционный состав Т-хелперов у хронически облученных людей. Медицина экстремальных ситуаций. 2024;26(3):15-21. https://doi.org/10.47183/mes.2024-26-3-15-21
For citation:
Nikiforov V.S., Kotikova A.I., Akleyev A.V. Expression of genes SPI1 and GATA3 and Т-helpers subpopulation combination in chronically exposed people. Extreme Medicine. 2024;26(3):15-21. https://doi.org/10.47183/mes.2024-26-3-15-21

















