Перейти к:
Влияние экстракта простаты быка на сократительную активность лимфатических сосудов крысы
https://doi.org/10.47183/mes.2024-26-3-87-91
Аннотация
Введение. Хронический простатит — распространенное и плохо поддающееся терапии заболевание, комплексный подход к лечению которого включает применение антибактериальных, противовоспалительных средств и др. Перспективным подходом в лечении хронического простатита является использование биорегуляторных пептидов, выделенных из ткани предстательной железы крупного рогатого скота.
Цель. Изучить влияние экстракта простаты крупного рогатого скота, содержащей биорегуляторные пептиды, на функциональную активность лимфатических сосудов.
Материалы и методы. Работа выполнена на изолированных лимфатических сосудах крыс. Диапазон изучаемых концентраций субстанции — 2–10 мкг/мл (в пересчете на водорастворимые пептиды).
Результаты. Биорегуляторные пептиды, входящие в состав экстракта простаты, обладают вазомоторной активностью в отношении лимфатических сосудов. В диапазоне концентраций 2–10 мкг/мл изучаемая субстанция оказывает стимулирующее влияние на моторику лимфангионов, которое реализуется за счет увеличения частоты сокращений лимфатических сосудов, наиболее выраженное в концентрации 5 мкг/мл на уровне 37,6% (p ≤ 0,05) от фона. Полученный стимулирующий эффект устойчив в течение 30-минутного «отмывания» лимфатических сосудов физиологическим раствором.
Выводы. Водорастворимые биорегуляторные пептиды, входящие в состав экстракта простаты КРС и обладающие органотропным действием на предстательную железу, могут способствовать снижению отека ткани путем активации моторики лимфатических сосудов органов малого таза.
Для цитирования:
Нечайкина О.В., Лаптев Д.С., Петунов С.Г., Бобков Д.В., Кудрявцева Т.А. Влияние экстракта простаты быка на сократительную активность лимфатических сосудов крысы. Медицина экстремальных ситуаций. 2024;26(3):87-91. https://doi.org/10.47183/mes.2024-26-3-87-91
For citation:
Nechaykina O.V., Laptev D.S., Petunov S.G., Bobkov D.V., Kudryavtseva T.A. Effect of bovine prostate extract on the contractile activity of lymphatic vessels in rats. Extreme Medicine. 2024;26(3):87-91. https://doi.org/10.47183/mes.2024-26-3-87-91
ВВЕДЕНИЕ
Хронический простатит является одним из наиболее распространенных и в то же время недостаточно изученным и плохо поддающимся лечению заболеванием. При этом эпидемиология заболевания такова, что основной целевой популяцией пациентов являются преимущественно лица репродуктивного возраста. Течение хронического простатита нередко осложняется нарушением копулятивной и генеративной функций [1]. В последнее время заболевание все чаще выявляется у пожилых мужчин, иногда в сочетании с доброкачественной гиперплазией простаты [2]. Так, у мужчин в возрасте до 50 лет частота подтвержденного простатита только лишь в 2 раза больше, чем у пациентов старше 50 лет [3].
Предстательная железа имеет хорошо развитое внутриорганное сосудистое русло, включающее в себя кровеносные и лимфатические капилляры и посткапилляры. Сети кровеносных и лимфатических микрососудов образуют микрососудисто-мышечные комплексы с пучками гладких миоцитов в передних отделах предстательной железы и микрососудисто-железистые комплексы с простатическими железами в заднем и латеральном отделах предстательной железы [4]. Нарушение лимфатического оттока в сосудистое русло и застойные явления в железистых структурах занимают ведущее место в патогенезе хронического простатита.
Ввиду полиэтиологичности и многофакторности патогенеза лечение хронического простатита подразумевает комплексный подход, включающий антибактериальную, противовоспалительную терапию, физиотерапевтические процедуры и другие воздействия. Перспективным подходом в лечении хронического простатита является использование биорегуляторных пептидов, выделенных из ткани предстательной железы крупного рогатого скота (КРС) [2]. Впервые биологический эффект простатических пептидов, выделенных из предстательной железы быка, был выявлен в середине 1980-х годов. В экспериментальных условиях было выявлено, что полипептиды из предстательной железы, обладая тропностью к сосудам, повышают антиагрегационную активность сосудистых стенок [5]. Простатические пептиды, как и другие регуляторные пептиды, характеризуются отсутствием видоспецифичности, при этом обладают выраженной тропностью к тканям простаты, что позволяет рассматривать ее в качестве органа-мишени.
На фармацевтическом рынке представлено большое количество лекарственных средств, действующим веществом которых является экстракт простаты быка. Для производства этих лекарственных препаратов используются активные фармацевтические субстанции, внесенные в Государственный реестр лекарственных средств. Технология их производства существенно различается, что в значительной степени определяет особенности их состава и выраженность биологического эффекта [6]. Субстанция-смесь «Простатилен®» производства AO МБНПК «Цитомед», полученная по технологии тангенциальной ультрафильтрации, является активной фармацевтической субстанцией, используемой при изготовлении лекарственного средства (ЛС) «Простатилен®».
Простатилен® — это пептидный препарат, одной из форм выпуска которого являются ректальные свечи. Действующим веществом ЛС «Простатилен®» является комплекс водорастворимых пептидов, полученный из ткани предстательной железы половозрелых быков, с добавлением глицина. Способность ЛС «Простатилен®» восстанавливать реологические свойства крови и улучшать микроциркуляцию в органах-мишенях приводят к нормализации гемодинамики и обеспечивают лечение воспалительных заболеваний предстательной железы [7]. Высокая биодоступность ЛС «Простатилен®» обеспечивается низкой молекулярной массой компонентов пептидной фракции и реализуется пассивным транспортом ЛС через энтероциты слизистой прямой кишки. Пептиды абсорбируются сосудами прямой кишки и оказывают влияние через систему анастомозов на органы малого таза, в том числе на предстательную железу, располагающуюся в анатомической близости от места введения [8]. Отток интерстициальной жидкости, содержащей регуляторные пептиды, обеспечивается адекватной сократительной активностью лимфатических сосудов, чувствительных к действию различных вазоактивных веществ, в том числе эндогенных модуляторов функционального состояния [9–11].
Одну из доступных и информативных экспериментальных моделей, используемых для изучения влияния вазоактивных субстанций на транспортную функцию лимфатической системы, представляют изолированные лимфатические сосуды, обладающие спонтанной ритмической сократительной активностью. В связи с этим оценка влияния комплекса пептидов, являющихся действующим веществом ЛС «Простатилен®», на сократительную активность лимфатических сосудов представляет собой актуальную задачу, решение которой может быть использовано при разработке и оптимизации методов терапии хронического простатита.
Цель исследования — изучить влияние субстанции-смеси «Простатилен®» (далее — Простатилен®) на функциональную активность лимфатических сосудов как потенциальной мишени терапевтического воздействия исследуемого экстракта.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена на изолированных сегментах переднего брыжеечного лимфатического протока половозрелых самцов нелинейных белых крыс массой 250–300 г, полученных из филиала НИЦ «Курчатовский институт» ПИЯФ — «Питомник лабораторных животных «Рапполово» (Ленинградская область). Содержание и кормление лабораторных животных производилось в соответствии с ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными» от 2016 г. Для исследований применяли здоровых половозрелых животных, прошедших 14-суточный карантин. В помещениях вивария контролировали параметры микроклимата (температуру, относительную влажность, параметры кратности воздухообмена), а также качество кормов и подстилочного материала. Животные находились на стандартном рационе в виде гранулированного корма. В помещениях, где содержались экспериментальные животные, был установлен режим освещения 12 ч день / 12 ч ночь.
Экспериментальное исследование проводилось в соответствии с Европейской конвенцией о защите животных, используемых в эксперименте (Директива 86/609/ЕЕС), и было одобрено комиссией по биоэтике (протокол №5 от 16.12.2022).
В ходе эксперимента определяли влияние Простатилена® на функциональные параметры работы изолированных лимфатических сосудов крыс ex vivo с использованием многоканального миографа Multi Wire Myograph System DMT 620M (DMT, Дания) согласно методике, описанной ранее [12]. Параметры сократительной активности лимфатических сосудов, к которым относятся уровень тонического напряжения, амплитуда и частота фазных сокращений (ЧС), регистрировали с помощью системы PowerLab Data acquisition system 8/30 (ADInstruments, США) с последующей обработкой в программе «LabChartProUpgrade 7.0».
Тестируемый объект — субстанция-смесь «Простатилен®», а также раствор Простатилена® с содержанием водорастворимых пептидов 11,7% (согласно паспорту производителя). Простатилен® использовался в концентрациях (в расчете на содержание водорастворимых пептидов): 1, 2, 5, 10 мкг/мл и добавлялся в перфузат для определения реактивности лимфатических сосудов. Время экспозиции каждой концентрации составляло 20 минут. В качестве контроля использовался физиологический раствор Кребса — Хензелейта с тем же временем экспозиции.
Статистическую обработку данных проводили с помощью методов описательной и аналитической статистики с использованием программы GraphPad Prism 5.04. За критический уровень значимости принимали p ≤ 0,05. Для описания центральной тенденции использовалось значение медианы, в качестве меры рассеяния — первый (Q1) и третий (Q3) квартили. Данные анализировали с использованием Т-критерия Вилкоксона для связанных выборок. Для выявления межгрупповых различий использовали U-критерий Манна — Уитни.
РЕЗУЛЬТАТЫ
Параметры фазной активности лимфатических сосудов, как и любого биологического объекта, характеризовались определенной вариабельностью (табл. 1), в связи с чем при анализе полученных результатов использовали относительные единицы, характеризующие изменение параметров при действии препарата по сравнению с фоновыми значениями, которые принимались за 100%. При выполнении работы, набор данных проходил параллельно (одновременно) во всех экспериментальных группах.
Результаты экспериментов по оценке влияния Простатилена® на изолированные лимфатические сосуды представлены в таблице 2.
Установлено, что применение Простатилена® в минимальной изучаемой концентрации (1 мкг/мл) в течение 20-минутного периода не оказывало влияния на сократительную активность лимфангионов. При 20-минутном воздействии в концентрациях 2, 5 и 10 мкг/мл Простатилен® вызывал увеличение ЧС от фоновых показателей на 23,7% (p ≤ 0,05), 37,6% (p ≤ 0,05) и 26,8% (p ≤ 0,05) соответственно. Амплитуда сокращений и тонус лимфатических сосудов при воздействии субстанции-смеси во всех изучаемых концентрациях регистрировались на уровне фоновых значений и статистически значимо не отличались от контроля.
Помимо биорегуляторных пептидов в состав Простатилена® входит аминокислота глицин. Являясь неотъемлемой частью дыхательной цепи митохондрий, глицин активно участвует в процессе обновления клеток и их оксигенации, в синтезе белков, в частности трипептида глутатиона, в реакциях детоксикации и обладает широким спектром противовоспалительных, цитопротекторных и иммуномодулирующих свойств [13]. Согласно литературным данным глицин оказывает действие и на объекты сердечно-сосудистой системы — кровеносные и лимфатические сосуды [14–16]. С целью исключения собственного эффекта глицина на брыжеечные лимфатические сосуды были проведены эксперименты с раствором Простатилена®, используемого для изготовления жидкой формы Простатилена® (раствор для внутримышечного введения) и не содержащего глицин. В качестве тестируемой концентрации была выбрана минимальная действующая — 2 мкг/мл (в расчете на содержание водорастворимых пептидов).
Как следует из приведенных в таблице 2 данных, раствор Простатилена® в концентрации 2 мкг/мл приводил к увеличению ЧС лимфангионов на 29,6% (p ≤ 0,05) в сравнении с фоном. При этом амплитуда сокращений и тоническое напряжение регистрировались на уровне фоновых значений. Полученные результаты сопоставимы с результатами, полученными при изучении влияния субстанции-смеси «Простатилена®» на лимфатические сосуды, что доказывает механизм хронотропного эффекта Простатилена®, обусловленного действием биорегуляторных пептидов.
Таблица 1. Фоновые показатели сократительной активности лимфатических сосудов крысы в опытных группах. Представлены абсолютные данные в виде Ме (0,25; 0,75)
|
Показатель |
Физиологический раствор, n = 12 |
Субстанция-смесь «Простатилен®» |
|||
|
1 мкг/мл, n = 11 |
2 мкг/мл, n = 11 |
5 мкг/мл, n = 11 |
10 мкг/мл, n = 13 |
||
|
ЧС, мин–1 |
4,55 (3,28; 6,95) |
3,00 (2,60; 6,25) |
5,70 (2,35; 6,65) |
5,20 (2,85; 7,10) |
5,60 (4,15; 8,50) |
|
Амп., мН |
0,62 (0,49; 0,83) |
0,45 (0,34; 0,70) |
0,80 (0,31; 0,90) |
0,73 (0,42; 1,03) |
0,65 (0,40; 0,97) |
|
Тонус, мН |
1,38 (1,29; 0,75) |
1,69 (1,38; 2,15) |
1,72 (1,16; 2,15) |
1,82 (1,55; 2,54) |
1,49 (1,11; 1,76) |
Таблица подготовлена авторами по собственным данным
Таблица 2. Параметры сократительной активности лимфатических сосудов крысы при влиянии Простатилена®. Представлены относительные данные в процентах в виде Ме (0,25; 0,75)
|
Исследуемая субстанция |
n |
ЧС |
Амплитуда |
Тонус |
|
Физиологический раствор |
12 |
103,6 (98,5; 109,1) |
100,6 (96,9; 104,8) |
98,5 (97,5; 100,4) |
|
Субстанция-смесь «Простатилен®», 1 мкг/мл |
11 |
106,6 (101,7; 108,7) |
104,0 (94,6; 106,6 |
99,3 (97,9; 103,9) |
|
Субстанция-смесь «Простатилен®», 2 мкг/мл |
11 |
123,7 (111,9; 130,6)* |
100,4 (97,7; 104,5) |
99,8 (97,2; 101,7) |
|
Субстанция-смесь «Простатилен®», 5 мкг/мл |
11 |
137,6 (129,9; 158,3)* |
99,0 (94,0; 101,8) |
99,9 (97,4; 100,9) |
|
Субстанция-смесь «Простатилен®», 10 мкг/мл |
13 |
126,8 (114,7; 129,8)* |
97,6 (94,6; 100,7) |
100,7 (99,1; 104,7) |
|
Раствор «Простатилена®», 2 мкг/мл (без глицина) |
12 |
129,6 (112,8; 144,0)* |
100,8 (97,9; 107,7) |
99,6 (97,8; 101,0) |
Таблица подготовлена авторами по собственным данным
Примечание: * статистически значимое отличие от фоновых значений при p ≤ 0,05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Начальные изменения частоты фазных сокращений возникали при влиянии субстанции-смеси «Простатилен®» в концентрации 2 мкг/мл, и с увеличением концентрации Простатилена® эффект возрастал. Максимальное увеличение ЧС наблюдалось при действии Простатилена® в концентрации 5 мкг/мл. При увеличении концентрации субстанции до 10 кг/мл положительный хронотропный эффект на лимфатические сосуды сохранялся. Несмотря на то что рост ЧС был несколько ниже, чем в предыдущей концентрации, это увеличение также статистически значимо отличалось от контроля (p ≤ 0,05). Таким образом, Простатилен® оказывает положительный хронотропный эффект на лимфатические сосуды. Динамика изменений ЧС лимфангионов при воздействии Простатилена® во всех концентрациях представлена на рисунке 1.
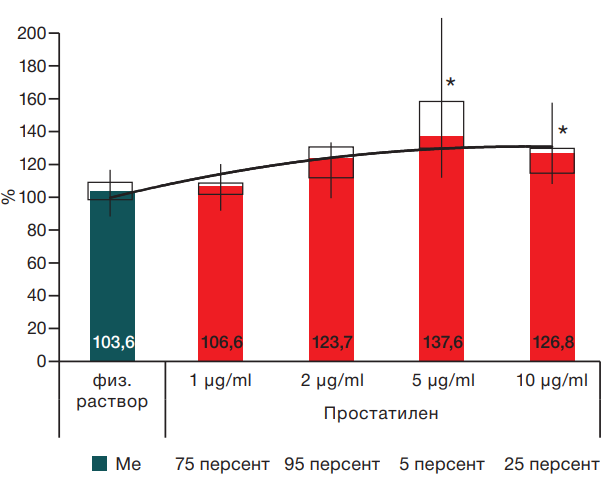
Рисунок подготовлен авторами по собственным данным
Рис. 1. Изменение частоты сокращений лимфатических сосудов при воздействии Простатилена®. Время воздействия — 20 мин. Данные представлены в процентах по отношению к фону в виде Ме. * — статистически значимое отличие от физиологического раствора при p ≤ 0,05
ЧС связана с частотой спонтанной генерации потенциалов действия в клетках-пейсмейкерах гладких мышц, а в основе возникновения потенциалов действия лежит спонтанная кратковременная деполяризация (Spontaneous Transitory Depolarization), которая возникает вследствие открытия Ca2+-зависимых Cl-каналов при внутриклеточном высвобождении ионов Ca2+ из инозитол-1,4,5-трифосфат-чувствительных хранилищ [17]. Можно предположить, что Простатилен® способствует выходу ионов Ca2+ из внутриклеточных хранилищ, что, в свою очередь, приводит к увеличению ЧС.
Для изучения устойчивости полученного стимулирующего эффекта Простатилена® было проанализировано изменение ЧС в период «отмывания», когда в рабочую камеру миографа поступал перфузируемый раствор Кребса — Хензелейта без действующего вещества. По истечении 30-минутного периода отмывания после действия Простатилена® в концентрации 10 мкг/мл частота фазной сократительной активности превышала фоновые показатели на 30,1% (p ≤ 0,05), что свидетельствует о пролонгированном действии препарата. Такой эффект последействия биорегуляторных пептидов может быть объяснен теорией И.П. Ашмарина о функциональной непрерывности и регуляторном континууме системы регуляторных пептидов [18]. Внутриклеточные процессы, следующие за рецепцией пептидов, связаны с действием последних на системы вторичных мессенджеров, которые запускают, в свою очередь, внутриклеточный каскад последовательной активации ферментов, что, в конечном счете, проявляется в виде изменения метаболических процессов в клетке и обусловливает физиологический ответ. Принципиально важно, что биорегуляторные пептиды способны запускать после взаимодействия с рецептором ряд процессов на всех уровнях метаболической иерархии клеток (от мембраны до генома) с различной продолжительностью — от минут (долей минут) до часов. Это делает возможным существование каскадных эффектов в организме, вызванных введением или высвобождением того или иного биорегуляторного пептида [19].
ВЫВОДЫ
- В результате проведенного исследования впервые было показано, что субстанция-смесь «Простатилен®» проявляет вазоактивные свойства в отношении лимфатических сосудов. В диапазоне концентраций 2—10 мкг/мл Простатилен® стимулирует моторику лимфангионов, что позволяет рассматривать изолированные лимфатические сосуды в качестве адекватной физиологической модели для исследования вазоактивных свойств препарата.
- По результатам проведенной работы можно предположить, что водорастворимые биорегуляторные пептиды, входящие в состав ЛС «Простатилен®», не только обладают направленным (органотропным) действием на предстательную железу и органы мочеполовой системы, но и могут способствовать снижению отека ткани путем активации моторики лимфатических сосудов органов малого таза, что еще раз подтверждает целесообразность применения регуляторных пептидов при лечении заболеваний, ассоциированных с воспалительными и застойными явлениями.
Список литературы
1. Белый ЛЕ. Пептиды предстательной железы в коррекции патоспермии у пациентов с хроническим бактериальным простатитом. Медицинский совет. 2018;21:178–82. https://doi.org/10.21518/2079-701X-2018-21-178-182
2. Гориловский ЛМ, Доброхотов М.М. Хронический простатит. Медицинский совет. 2010;(7–8):72–7. EDN: MVYXVD
3. Учваткин ГВ, Татаринцева МБ. Простатические пептиды в лечении заболеваний предстательной железы. Урологические ведомости. 2017;7(3):44–8. https://doi.org/10.17816/uroved7344-48
4. Петренко ВМ. Сосудистое русло простаты. Международный журнал экспериментального образования. 2010;7:48–9. EDN: RAJOOF
5. Хавинсон ВХ, Морозов В Г, Кузник БИ и др. Влияние полипептидов предстательной железы на систему гемостаза. Фармакология и токсикология. 1985;48(5):69–71. EDN: OXGGLQ
6. Савельев СА, Дорош МЮ, Опарина ТИ и др. Влияние технологии производства на свойства фармацевтических субстанций простаты экстракта. Химико-фармацевтический журнал. 2022;56(3):50–8. https://doi.org/10.30906/0023-1134-2022-56-3-50-58
7. Кузьмин ИВ, Боровец СЮ, Горбачев АГ, Аль-Шукри СХ. Простатический биорегуляторный полипептид Простатилен®: фармакологические свойства и опыт 30-летнего клинического применения в урологии. Урологические ведомости. 2020;10(3):243–58. https://doi.org/10.17816/uroved42472
8. https://cytomed.ru/wp-content/uploads/2023/11/ohlp_prostatilen-3-mg.pdf
9. Razavi MS, Dixon JB, Gleason RL. Characterization of rattail lymphatic contractility and biomechanics: incorporating nitric oxide-mediated vasoregulation. JR Soc Interface. 2020;17(170):20200598. https://doi.org/10.1098/rsif.2020.0598
10. Johnston MG., Gordon JL. Regulation of lymphatic contractility by arachidonate metabolites. Nature. 1981;293:294–7. https://doi.org/10.1038/293294a0
11. Лобов ГИ, Унт ДВ. Глюкокортикоиды стимулируют сократительную активность лимфатических сосудов и узлов. Регионарное кровообращение и микроциркуляция. 2017;4(64):73–9. https://doi.org/10.24884/1682-6655-2017-16-4-73-79
12. Нечайкина ОВ, Лаптев ДС, Петунов СГ, Бобков ДВ. Влияние несимметричного диметилгидразина на изолированное сердце и лимфатические сосуды. Бюллетень экспериментальной биологии и медицины. 2021;172(9):283–6. https://doi.org/10.1007/s10517-022-05380-y
13. Perez-Torres I. Zuniga-Munoz A. M., Guarner-Lans V. Beneficial Effects of the Amino Acid Glycine. Mini Rev Med Chem. 2017;17(1);15–32. https://doi.org/10.2174/1389557516666160609081602
14. Stalberg HP, Hahn RG, Hjelmqvist H, Ullman J, Rundgren M, Stalberg HP. Haemodynamics and fluid balance after intravenous infusion of 1.5% glycine in sheep. Acta Anaesthesiol Scand. 1993;37(3):281–7. https://doi.org/10.1111/j.1399-6576.1993.tb03716.x
15. Podoprigora GI, Nartsissov YR. Effect of glycine on the microcirculation in rat mesenteric vessels. Bull Exp Biol Med. 2009;147(3):308–11. https://doi.org/10.1007/s10517-009-0498-y
16. Sawada M, McAdoo DJ, Ichinose M, Price CH. Influences of glycine and neuron R14 on contraction of the anterior aorta of Aplysia. Jpn J Physiol. 1984;34(4):747–67. https://doi.org/10.2170/jjphysiol.34.747
17. Von der Weid PY, Rahman M, et al. Spontaneous transient depolarizations in lymphatic vessels of the guinea pig mesentery: Pharmacology and implication for spontaneous contractility. Am J Physiol Heart Circ Physiol. 2008;295:1989–2000. https://doi.org/10.1152/ajpheart.00007.2008
18. Ашмарин ИП, Обухова МФ. Cовременное состояние гипотезы о функциональном континууме регуляторных пептидов. Вестник Российской академии медицинских наук. 1994;10:28–34. PMID: 7534535.
19. Ашмарин ИП, Обухова МФ. Регуляторные пептиды, функционально непрерывная совокупность. Биохимия. 1986;51(4):531–45.
Об авторах
О. В. НечайкинаРоссия
Нечайкина Ольга Валерьевна
г.п. Кузьмоловский, Ленинградская область
Д. С. Лаптев
Россия
Лаптев Денис Сергеевич, канд. биол. наук
г.п. Кузьмоловский, Ленинградская область
С. Г. Петунов
Россия
Петунов Сергей Гервасиевич, канд. мед. наук, доцент
г.п. Кузьмоловский, Ленинградская область
Д. В. Бобков
Россия
Бобков Дмитрий Владимирович
г.п. Кузьмоловский, Ленинградская область
Т. А. Кудрявцева
Россия
Кудрявцева Татьяна Анатольевна, канд. биол. наук
Санкт-Петербург
Дополнительные файлы
Рецензия
Для цитирования:
Нечайкина О.В., Лаптев Д.С., Петунов С.Г., Бобков Д.В., Кудрявцева Т.А. Влияние экстракта простаты быка на сократительную активность лимфатических сосудов крысы. Медицина экстремальных ситуаций. 2024;26(3):87-91. https://doi.org/10.47183/mes.2024-26-3-87-91
For citation:
Nechaykina O.V., Laptev D.S., Petunov S.G., Bobkov D.V., Kudryavtseva T.A. Effect of bovine prostate extract on the contractile activity of lymphatic vessels in rats. Extreme Medicine. 2024;26(3):87-91. https://doi.org/10.47183/mes.2024-26-3-87-91

















