Перейти к:
Ретроспективная биодозиметрия. Проблема конвертации частоты хромосомных транслокаций в дозу на органы
https://doi.org/10.47183/mes.2024-26-3-5-14
Аннотация
Введение. Одним из методов ретроспективной биодозиметрии является учет стабильных хромосомных аберраций (транслокаций) в Т-лимфоцитах периферической крови человека с использованием метода FISH (fluorescence in situ hybridization). В случае равномерно внешнего или внутреннего облучения интерпретация данных FISH не вызывает проблем: доза на Т-лимфоциты, определяющая частоту транслокаций, трактуется как доза на другие органы и ткани. В случае неравномерного внутреннего облучения, когда дозы облучения органов различаются на порядок величины, переход от частоты транслокаций к оценкам дозы требует особых подходов.
Цель. Рассмотреть основные параметры, которые необходимы для ретроспективной оценки доз с использованием метода FISH в случае внутреннего неравномерного и пролонгированного β-облучения.
Обсуждение. В аналитическом обзоре были проанализированы проблемы, связанные с определением следующих параметров.
- Частота радиационно-индуцированных и фоновых транслокаций.
- Коэффициенты перехода от частоты радиационно-индуцированных транслокаций к дозе на Т-лимфоциты (α). Были рассмотрены общие подходы и оценки переходных коэффициентов на основе построения калибровочных кривых in vivo и in vitro при внешнем и внутреннем облучении.
- Коэффициенты перехода от дозы на Т-лимфоциты (цитогенетической дозы) к дозе на критические органы и ткани (Borg ), которые существенно зависят от возраста.
Были проанализированы особенности накопления дозы в различных популяциях Т-клеток при длительном внутреннем неравномерном облучении (на примере 90Sr), а также применимость модельного подхода к оценке накопленных доз. В работе обсуждаются неопределенности дозовых оценок и дальнейшие направления исследований в рамках ретроспективной биодозиметрии.
- Заключение. В случае неравномерного внутреннего облучения с низкой мощностью дозы конвертация частоты хромосомных транслокаций в значения доз является сложной задачей. Коэффициенты конвертации α и Borg определяются по независимым наборам данных и опираются на разные, в том числе модельные подходы. Эти коэффициенты требуют дальнейшего уточнения. В настоящее время подходы к оценке их неопределенностей, а также неопределенностей дозы, получаемой с помощью метода FISH, остаются неразработанными.
Ключевые слова
Для цитирования:
Толстых Е.И., Ахмадуллина Ю.Р., Шарагин П.А., Шишкина Е.А., Аклеев А.В. Ретроспективная биодозиметрия. Проблема конвертации частоты хромосомных транслокаций в дозу на органы. Медицина экстремальных ситуаций. 2024;26(3):5-14. https://doi.org/10.47183/mes.2024-26-3-5-14
For citation:
Tolstykh E.I., Akhmadullina Y.R., Sharagin P.A., Shishkina E.A., Akleyev A.V. Retrospective biodosimetry: Conversion of frequency of chromosomal translocations into organ doses. Extreme Medicine. 2024;26(3):5-14. https://doi.org/10.47183/mes.2024-26-3-5-14
ВВЕДЕНИЕ
Ретроспективная биодозиметрия применяется, когда необходимо восстановить дозу облучения человека, не имевшего дозиметра в момент радиационного воздействия. Одним из методов биодозиметрии является учет стабильных хромосомных аберраций (транслокаций) в Т-лимфоцитах периферической крови человека [1–3]. Применение метода базируется на следующих допущениях: частота хромосомных транслокаций в Т-лимфоцитах пропорциональна дозе облучения; частота остается постоянной в течение длительного времени (не снижается со временем); доза облучения, полученная Т-лимфоцитами, приведшая к образованию транслокаций, соответствует дозе воздействия на другие органы и ткани, в частности на красный костный мозг (ККМ). Последний постулат верен в случае равномерного внешнего или внутреннего облучения. Однако при неравномерном внутреннем облучении, например за счет 89,90Sr, когда дозы на ККМ и другие органы могут различаться на порядок величины, возникают трудности в интерпретации результатов применения цитогенетических методов. Эта проблема подробно обсуждалась в ряде обзоров [1][2]. Для целей биодозиметрии была разработана модель облучения Т-лимфоцитов в случае накопления 89,90Sr в минерализованных тканях тела человека [4–6].
Для оценки частоты транслокаций в клетке используется метод FISH (fluorescence in situ hybridization). Ниже перечислены основные параметры, которые необходимы для ретроспективной оценки доз с использованием метода FISH в случае внутреннего неравномерного и пролонгированного β-облучения.
(1) Число транслокаций yi в ncell, просчитанных в Т-лимфоцитах испытуемого лица или группы испытуемых, оценивается с использованием метода FISH. Особенности применения и требования к унификации метода описаны в ряде нормативно-правовых документов, таких как [1][7]. Для оценки уровня доз используется частота транслокаций (μi), которая должна быть представлена в расчете на один геном-эквивалент (Genomic Equivalent GE), по другой терминологии — на один клеточный эквивалент (Cell Equivalent CE). Коэффициент (Gj) перехода от числа просчитанных клеток (метафаз) ncell к числу геномных эквивалентов nge зависит от набора окрашенных хромосом и типа окраски (одноцветный или многоцветный). Если используется 24-цветная окраска, то пересчета на GE не требуется.
(2) Фоновая (нерадиационная) частота транслокаций μ0(τ), зависящая от возраста. Поправка на фоновые значения (вычитание фоновых значений) необходима, поскольку транслокации могут возникать под воздействием иных (нерадиационных) неблагоприятных эндогенных и экзогенных факторов. Число транслокаций в Т-лимфоцитах накапливается с возрастом в течение жизни. По данным научной литературы, пол не оказывает существенного влияния на формирование транслокаций, влияние курения и алкоголя также не является значительным. В качестве уже известных фоновых значений используется зависимость частоты транслокаций, полученная в объединенном международном исследовании необлученных доноров, в терминах «число транслокаций на GE» [8].
(3) Коэффициенты зависимости «доза-эффект» (С — свободный член, α — линейный коэффициент, β — квадратичный коэффициент), комбинация которых позволяет перейти от скорректированной на возраст частоты транслокаций μi_age к дозе, поглощенной в Т-лимфоцитах (DL). Коэффициенты определяются на основании калибровочной кривой (линейно-квадратичной или линейной). Для построения калибровочной кривой принципиальное значение имеет надежность оценки доз облучения и единообразие критериев подсчета транслокаций. Форма и параметры калибровочной кривой зависят от типа излучений (линейной передачи энергии, ЛПЭ), а для редко ионизирующих гамма- и бета-излучений — от мощности дозы. Калибровочные кривые подробно обсуждаются в литературе [1][7][9].
(4) Коэффициент перехода (Brbm) от дозы облучения лимфоцитов (DL) к дозе на красный костный мозг (Drbm). Для остеотропных 89,90Sr этот коэффициент зависит от возраста на момент начала облучения (τ1) и времени после начала облучения (τs – τ1), где τs — возраст донора на момент забора крови. Кроме того, коэффициент зависит от пола, поскольку от пола зависит метаболизм стронция и его накопление в костной ткани [10].
Цель работы — рассмотреть основные параметры1, которые необходимы для ретроспективной оценки доз с использованием метода FISH в случае внутреннего неравномерного и пролонгированного β-облучения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Хромосомные транслокации, которые учитываются при ретроспективной биодозиметрии
Для хорошей воспроизводимости метода биодозиметрии важно, чтобы типы хромосомных транслокаций, которые учитываются исследователями, были однозначно определены. В радиационной цитогенетике используются разные номенклатурные подходы, чаще PAINT (Protocol for Aberration Identification Nomenclature Terminology) [11], S&S (Savage and Simpson) [12], а также комбинированный подход с применением терминологии медицинской генетики ISCN (The International System for Human Cytogenomic Nomenclature) [13]. В русскоязычной литературе это приводит к большому числу синонимов для обозначения транслокаций.
При действии редкоионизирующего β-излучения, характерного для 89,90Sr, большинство регистрируемых транслокаций являются реципрокными (синонимы: полными, двусторонними, two-way). В этом случае происходит взаимный обмен концевыми участками между двумя негомологичными хромосомами без потери генетического материала. Несмотря на то что в процесс вовлекаются две хромосомы, реципрокная транслокация рассматривается как одно событие, т.е. одна транслокация. Небольшую долю составляют нереципрокные (неполные, односторонние, one-way) транслокации, когда перенос материала происходит только от одной негомологичной хромосомы к другой, т.е. однонаправленно, и учитывается как одно событие. Предполагается [1][14][15], что неполная транслокация может в действительности быть полной, но второй участок хромосомы, участвующий в обмене, слишком мал для визуализации. Реципрокные и нереципрокные (полные и неполные) транслокации также называют простыми. Именно их частота является основным показателем, на основании которого рассчитывается доза облучения при использовании метода FISH.
Сложные/комплексные транслокации, когда в обмен вовлекаются три и более хромосомы, составляют небольшую долю от общего числа транслокаций при пролонгированном редкоионизирующем излучении [14][16]. Cложные транслокации учитывают как сумму простых транслокаций, число которых определяют по количеству цветовых переходов, что может вызвать затруднения [17]. При плотноионизирующем излучении доля сложных (комплексных) транслокаций значительно увеличивается [18][19].
В публикации International Atomic Energy Agency, 2011 [1], к хромосомным транслокациям также относят инсерции в случае, если наблюдается видимая вставка участка одной хромосомы в плечо негомологичной хромосомы. Частота инсерций может учитываться или не учитываться при оценке дозы облучения, что всегда отмечается авторами.
При цитогенетическом анализе также можно учитывать инверсии — внутрихромосомные аберрации, при которых происходит разворот на 180° участка хромосомы. Индикация инверсий требует более сложной окраски, например методом Многоцветного бендинга индивидуальных хромосом (Multicolor Banding Probes, mBAND) или комбинированием зондов на целую хромосому совместно с теломерными зондами. Частота инверсий значительно повышается при воздействии плотноионизирующего излучения [18][19]
Если несколько лимфоцитов содержат одинаковые транслокации (совпадают номера вовлеченных в обмен хромосом и длина перемещенных участков), то такие клетки считаются клонами [1]. В этом случае принимается, что произошла одна транслокация в одной клетке, независимо от числа клеток с одинаковыми транслокациями.
Оценку частоты хромосомных транслокаций для целей ретроспективной биодозиметрии обычно производят в так называемых стабильных клетках, то есть в клетках, в которых отсутствуют нестабильные хромосомные аберрации типа колец и дицентриков, препятствующих нормальному прохождению клеточного цикла. Нестабильные клетки содержат вышеназванные аберрации.
КОЭФФИЦИЕНТЫ ПЕРЕХОДА ОТ ЧАСТОТЫ РАДИАЦИОННО-ИНДУЦИРОВАННЫХ ТРАНСЛОКАЦИЙ К ДОЗЕ НА Т-ЛИМФОЦИТЫ
Общие подходы
Описание зависимостей «доза-эффект» для частоты транслокаций и подходы к определению параметров подробно описаны в литературе [1, 7, 9, 13, 20]. В нашем случае интерес представляют зависимости для редкоионизирующего излучения.
Как показали многочисленные эксперименты, при высокой мощности дозы (время облучения менее 2-х часов) имеет место линейно-квадратичная зависимость частоты радиационно-индуцируемых транслокаций (μi) от дозы облучения лимфоцитов DL:
μi = C + α ∙ DL + β ∙ DL2, (1)
где С — свободный член зависимости «доза-эффект»;
α — линейный коэффициент зависимости «доза-эффект»
β — квадратичный коэффициент зависимости «доза-эффект».
Подобная форма зависимости объясняется следующим образом. Предполагается, что квадратичный член β учитывает повреждения ДНК (источник формирования транслокаций Tr), возникающих при повторных попаданиях ионизирующих частиц в ядро клетки с небольшим промежутком времени (<2 ч). Другими словами, коэффициент β учитывает аберрации, которые могут быть изменены механизмами репарации в случае, если они успевают «сработать» в ходе длительного воздействия или в периоды между прерывистыми (фракционированными) острыми воздействиями. Большинство повреждений, которые приводят к хромосомным аберрациям, либо репарируются, либо становятся недоступными для репарации в течение примерно 5–6 часов после облучения. Поэтому для квадратичного члена был предложен дополнительный коэффициент в виде G-функции [1][21][22], которая учитывает время, необходимое для репарации повреждений, то есть учитывает мощность дозы:
μi = C + α ∙ DL + β ∙ G(x) ∙ DL2, (2)
G(x) = 2/x2 ∙ [x – 1 + e–x], (3)
при этом x = t / t0, (4)
где t — время (длительность) облучения,
t0 — среднее время жизни разрывов, которое, как было показано, составляет порядка 2-х часов.
Когда доза накапливается в течение длительного времени, G(x) уменьшается практически до нуля. Следовательно, даже если пролонгированное облучение происходит с высокой дозой (>1,0 Гр), зависимость частоты транслокаций от дозы становится линейной:
μi = C + α ∙ DL. (5)
Кроме того, очевидно, что при действии редкоионизирующего излучения в небольших дозах (<0,3 Гр), но с высокой мощностью большинство аберраций возникает при прохождении одиночных ионизирующих треков, так что зависимость приближается к линейной.
Таким образом, зависимость, близкая к линейной, наблюдается, когда имело место пролонгированное облучение (длительность облучения составляла сутки, месяцы, годы), в том числе с высокими накопленными дозами (до 2–3 Гр), или в случае острого облучения с низкими дозами, когда не было выявлено острого лучевого синдрома. Поэтому для ретроспективной оценки доз в случае внутреннего воздействия 89,90Sr принципиальное значение имеет оценка линейного коэффициента α.
Как показывает анализ экспериментальных данных [1], линейный коэффициент в формуле 5 будет одинаков как при исследовании зависимости частоты транслокаций от дозы, так и при анализе зависимости выхода нестабильных аберраций (дицентриков, колец) от дозы. Как отмечается в публикациях [23][24], соотношение дицентриков и транслокаций, индуцированных облучением, составляет примерно 1:1, поэтому можно ожидать схожих коэффициентов в зависимости «доза-эффект». Согласно данным по дицентрикам, для высокоэнергетических гамма-лучей линейный коэффициент для транслокаций в случае равномерного пролонгированного облучения составляет 0,015–0,020 Tr/GE на Гр [25], что может быть использовано для перехода от частоты транслокаций к дозе на лимфоциты. В работе [26] рекомендованная величина составляет ~0,015.
Таким образом, на основании (5) и с учетом фоновых значений для соответствующего возраста (μ0(τs)), доза на Т-лимфоциты находится по формуле:
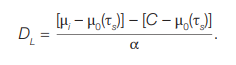 (6)
(6)
Поскольку свободный член С обусловлен в основном частотой фоновых транслокаций, то выражение [С – μ0(τs)] принимается близким к нулю, поэтому:
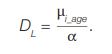 (7)
(7)
Ниже рассматриваются подходы к оценкам коэффициентов α.
Оценки параметра α, полученные при остром внешнем гамма-облучении лимфоцитов доноров in vitro
В последнее время появился ряд исследований, направленных на получение калибровочных кривых для транслокаций, оцененных методом FISH при условии стандартизации [1][9][20], которая предполагает острое облучение, применение линейно-квадратичной модели, стандартные статистические подходы и т.д. Для использования параметров этих зависимостей для ретроспективной дозиметрии нужно, чтобы транслокации были просчитаны в стабильных клетках, где отсутствуют нестабильные аберрации, препятствующие прохождению клеточного цикла. Поскольку при пролонгированном облучении зависимость выхода транслокаций от дозы близка к линейной, то из полученных параметров линейно-квадратичной зависимости для перехода от частоты транслокаций к дозе на лимфоциты следует рассмотреть линейный коэффициент α.
В статье [9] приводится обзор параметров калибровочных кривых для транслокаций (определяли коэффициенты α и β линейно-квадратичной зависимости), полученных методом FISH после вычитания фоновых значений. Такие работы единичны, они также отличаются подходами к учету транслокаций (Tr). В таблице 1 приведены результаты наиболее подходящих цитогенетических исследований, где коэффициент α был статистически значимо определен при облучении лимфоцитов in vitro. Во всех случаях авторы проводили облучение донорской крови от источника 60Co с высокой мощностью дозы, время облучения — минуты, доза-эффект описывалась линейно-квадратичной зависимостью (формула 1). Как следует из таблицы 1, разброс значений α значительный (от 0,012 до 0,0447), при этом медианное значение равно 0,0178 (95% 0,012–0,044) Tr/GE на Гр.
Оценки параметра α, полученные при облучении человека in vivo
При облучении in vivo доза на Т-лимфоциты и другие органы рассчитывается на основе дозиметрических измерений. При этом измерения дозы проводятся не непосредственно в клетках или тканях-мишенях, а с помощью расположенного близко к телу дозиметра (у профессионалов), или при измерении содержания радионуклида в организме у населения (измерение содержания 90Sr в организме жителей прибрежных сел реки Теча), или при восстановлении гамма-полей и спектров излучений, как в случае ядерной бомбардировки Хиросимы и Нагасаки.
Острое внешнее облучение сложного спектра с высокой мощностью (население Хиросимы и Нагасаки)
При атомной бомбардировке имело место острое однократное облучение населения с высокой мощностью дозы и разной ЛПЭ. Поэтому для анализа дозовой зависимости необходимо вводить коэффициенты, учитывающие относительную биологическую эффективность (ОБЭ) излучения, что вносит дополнительную неопределенность в оценки доз. Кроме того, известно, что плотноионизирующее излучение приводит к большому числу комплексных (сложных) повреждений ДНК и хромосом [18][19]. Это затрудняет прямое использование этих данных для случаев редкоионизирующего излучения. С другой стороны, когорта облученных вследствие атомных бомбардировок является наиболее изученной, поэтому результаты цитогенетических исследований заслуживают внимания. Анализ зависимости от дозы частоты стабильных хромосомных аберраций для жителей Хиросимы и Нагасаки проводился начиная с 60-х годов ХХ века. Результаты публиковались по мере накопления цитогенетических данных и/или улучшения системы расчета индивидуальных доз [31–34]. Анализ цитогенетических данных в интересующем нас ключе (но с использованием рутинной окраски хромосом по Гимзе) был выполнен в работе [34], где в качестве стабильных учитывались реципрокные транслокации, перицентрические инверсии или небольшие делеции (или их комбинации). Подсчитывались транслокации в стабильных клетках, то есть в клетках без дицентриков и колец. Зависимость «доза-эффект» описывалась линейно-квадратичной функцией (формула 1). Всего в исследование включили 1703 человека. Индивидуальные эквивалентные дозы рассчитывались с поправкой на ОБЭ нейтронов и γ-излучения. Максимальные индивидуальные дозы составляли 1,5 Зв. Получены следующие значения линейного коэффициента:
Для жителей Хиросимы α = 0,03915 ± 0,00315 Tr на клетку на Зв.
μi = (0,01274 ± 0,01399) +(0,03915 ± 0,00315) DL + (0,00970 ± 0,00155) DL2.
Для жителей Нагасаки α = 0,02350 ± 0,00246 Tr на клетку на Зв.
μi = (0,01274 ± 0,11399) +(0,02350 ± 0,00246) DL +(0,01870 ± 0,00099) DL2.
В целом эти значения выше, чем те, которые получены для калибровочных кривых (табл. 1), но попадают в диапазон разброса их значений.
Последний анализ данных, полученных с использованием FISH и обновленной версии дозиметрической системы, был выполнен в работе [35]. Учитывались реципрокные и нереципрокные транслокации, вставки (инсерции) и сложные обмены. Рассчитывался относительный показатель частоты транслокаций ERR (excess relative rate) с поправкой на фон. Параметры «доза–эффект» для ERR не могут быть напрямую использованы для количественного сравнения с данными литературы, однако авторами были найдены интересные закономерности. Показано, что линейно-квадратичная зависимость частоты транслокаций (в терминах ERR) от дозы наблюдалась до 1,25 Гр. Далее зависимость имела более сложный характер. Было показано, что возраст на момент облучения является значимым фактором, влияющим на параметры «доза-эффект». Минимальные значения частоты транслокаций на 1 Гр наблюдались в группе детей 0–5 лет, затем частота возрастала и вновь снижалась после 25 лет.
Длительное внешнее γ-облучение с низкой мощностью дозы (профессионалы)
Анализ выполнен в работе [36], в исследование были включены рабочие-мужчины (n = 459), доза до 1,6 Гр (накопленную дозу определяли на основании данных индивидуальных дозиметров как дозу на ККМ). Используя метод FISH, подсчитывали простые транслокации Tr в стабильных клетках в расчете на GE. Данные описывались линейной регрессией (распределение Пуассона по частоте транслокаций проверялось для каждой дозовой группы). Для расчетов использовали модуль AMFIT программы EPICUR: α = 0,01174 ± 0,00164
Эти значения попадают в нижнюю границу интервала оценок коэффициента α по калибровочным кривым in vitro.
Длительное внешнее и внутреннее облучение жителей прибрежных сел реки Теча (Южный Урал) со снижающейся мощностью дозы
Жители прибрежных сел реки Теча пострадали от радиационного воздействия (смешанное γ-, β-облучение с низкой мощностью дозы, как внешнее, так и внутреннее) после сбросов радиоактивных отходов ПО «Маяк» в реку Течу в 50-е годы прошлого века. Внешнее облучение было более выражено в верховьях реки Теча, недалеко от места сбросов радиоактивных отходов. Однако на всем протяжении реки основной вклад в дозу внутреннего облучения ККМ вносили 89,90Sr. Анализ дозовых зависимостей был выполнен в 2023 г. и подробно описан [37]. Использовали объединенные данные за длительный период исследований с 1994 по 2021 г. (197 доноров, 212 проб крови). Для каждого донора рассчитывали дозу на Т-лимфоциты с учетом возрастной динамки и кинетики Т-клеточных популяций. Учитывали простые транслокации и комплексные обмены в стабильных клетках. Как и в упомянутом выше исследовании [33], зависимость частоты транслокаций от дозы описывали линейной регрессией (распределение Пуассона по частоте транслокаций проверяли для каждой дозовой группы); для расчетов использовали модуль AMFIT программы EPICUR.
В таблице 2 представлены значения линейных коэффициентов α-зависимости «доза-эффект» для доноров разного возраста на момент начала облучения в 1950 г.
Наиболее низкие значения частоты транслокаций на 1 Гр дозы на Т-лимфоциты получены для детей первых лет жизни (табл. 2). Максимальные значения наблюдались в группе от 5 до 18 лет. Данные таблицы 2 не противоречат результатам, полученным in vitro (табл. 1) и in vivo для профессионалов [36]. Следует отметить, что эти данные согласуются с результатами по оценке влияния возраста на момент облучения на частоту транслокаций в японской когорте [35], где наблюдались относительно низкие значения ERR на 1 Гр у детей первых лет жизни, последующее возрастание частоты транслокаций и последующее снижение у взрослых после 25 лет.
Подводя итоги, следует отметить, что описанные в литературе калибровочные кривые in vitro были получены при облучении проб крови с высокой мощностью дозы (облучение длится минуты). В качестве доноров были взяты взрослые люди в возрасте от 25 до 45 лет. Число доноров для построения одной калибровочной кривой невелико (максимум 11 человек [7], из которых для двух доноров были получены резко выпадающие значения, отличающиеся от остальной группы почти в 10 раз). International Organization for Standardization (ISO) [7] рекомендует лабораториям, занимающимся биодозиметрией, разрабатывать собственные калибровочные кривые, учитывающие методы окраски и подсчета транслокаций, принятые в лаборатории, и возрастной диапазон испытуемых. Примерами такой работы можно считать [20][30].
Оценки, полученные in vivo, базируются на исследовании большого числа доноров, но точность дозовых оценок значительно ниже. В этих исследованиях значения параметров могут меняться при усовершенствовании дозиметрических подходов, как это делается при исследованиях японской когорты и исследованиях на реке Тече.
Таблица 1. Значения линейного коэффициента α (Tr/GE на Гр) линейно-квадратичной зависимости частоты транслокаций (с поправкой на фоновые значения) от дозы на лимфоциты
|
Коэффициент α ± SE |
Количество наблюдений, n |
Значения, комментарии |
Источник |
|
0,0119 ± 0,0083 CV = 70% |
2 |
Учитывали только реципрокные транслокации во всех клетках (стабильные и нестабильные). μi = (0,0014 ± 0,0005) + (0,0119 ± 0,0083) DL + (0,0357 ± 0,0135) DL2 |
[27] |
|
0,0178 ± 0,0037 CV = 21% |
5 |
Учитывали все простые транслокации и относили ко всем клеткам (стабильные и нестабильные). Сложные транслокации конвертировали в эквивалентное число простых транслокаций. μi = (0,0005 ± 0,0001) + (0,0178 ± 0,0037) DL + (0,0901 ± 0,0054) DL2 |
[9] |
|
0,0152 ± 0,0108 CV = 71% |
11 |
Учитывали все простые транслокации только в стабильных клетках. μi = (0,0001 ± 0,0021) + (0,0152 ± 0,0108) DL + (0,0809 ± 0,0061) DL2 |
[28] |
|
0,0447 ± 0,0144 CV = 30% |
1 |
Учитывали все простые транслокации и относили только к стабильным клеткам. μi = (0,001 ± 0,0008) + (0,0447 ± 0,0144) DL + (0,0142 ± 0,0195)DL2 |
[29] |
|
0.0343 ± 0,0107 CV = 31% |
5 |
Учитывали все простые транслокации и относили ко всем клеткам (стабильные и нестабильные). Сложные транслокации конвертировали в эквивалентное число простых транслокаций. Не делали коррекцию на фоновые транслокации. μi = (0,0040 ± 0,0017) + (0,0343 ± 0,0107) DL + (0,0779 ± 0,0052) DL2 |
[30] |
Таблица подготовлена авторами по данным источников [9][27–30]
Примечание: n — число доноров крови, взрослые люди в возрасте от 25 до 45 лет.
Таблица 2. Значения коэффициента α-линейной зависимости частоты транслокаций от дозы на Т-лимфоциты для жителей прибрежных сел реки Теча
|
Возраст на начало облучения, лет |
Число проб |
Число транслокаций на GE на 1 Гр α ± SE (95% ДИ) |
|
0–5 |
58 |
0,0093 ± 0,013 (0,0067–0,0119) |
|
5–18 |
108 |
0,0153 ± 0,0015* (0,0124–0,0183) |
|
18–38 |
46 |
0,0119 ± 0,0029 (0,0063–0,0178) |
Таблица подготовлена авторами по собственным данным [37]
Примечание: * статистически значимые различия относительно группы 0–5 лет.
КОЭФФИЦИЕНТЫ ПЕРЕХОДА ОТ ДОЗЫ НА Т-ЛИМФОЦИТЫ (ЦИТОГЕНЕТИЧЕСКОЙ ДОЗЫ) К ДОЗЕ НА КРИТИЧЕСКИЕ ОРГАНЫ И ТКАНИ
В случае неравномерного внутреннего облучения доза на Т-лимфоциты не совпадает с дозой на другие органы и ткани, из которых наибольший интерес представляет доза на ККМ. Коэффициент (Borg) позволяет перейти от дозы на лимфоциты (DL) к дозе на орган (Dorg). Таким образом, с учетом формулы (7) доза на конкретный орган на основе цитогенетических данных будет рассчитываться по формуле:
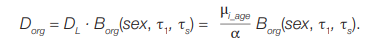 (8)
(8)
Формирование дозы на различные популяции Т-клеток при длительном внутреннем неравномерном облучении (на примере 90Sr)
Если облучение произошло десятилетия назад, то в крови донора находится смесь Т-лимфоцитов, которые являются потомками Т-клеток, облучившихся в разной дозе. Можно выделить две группы Т-лимфоцитов, доза на которые различается наиболее существенно в случае локального облучения ККМ 90Sr:
(1) Т-лимфоциты — потомки лимфоцитов, сформированных (вышедших из тимуса) до начала облучения. Их доля может быть весьма существенна, если облучение произошло в подростковом и зрелом возрасте. Несмотря на то что продолжительность жизни отдельных лимфоцитов составляет несколько лет (варьирует в различных субпопуляциях) [38–40], Т-лимфоциты способны пролиферировать в периферических лимфоидных органах, поддерживая количественное постоянство периферического пула Т-клеток [41][42] на фоне резкого возрастного снижения продукции тимуса [39][40][43]. Эти Т-лимфоциты облучаются только при циркуляции в организме, проводя определенное время, в том числе и в костном мозге.
(2) Т-лимфоциты, потомки прогениторов (стволовых клеток), облучившихся в ККМ после попадания 90Sr в организм. Дозовая нагрузка на них значительно выше, чем на Т-лимфоциты из первой группы, поскольку 90Sr накапливается в костной ткани и локально облучает ККМ, включая Т-прогениторы. После прохождения стадий дифференцировки, пролиферации в ККМ и в тимусе сформированные Т-лимфоциты продолжают циркулировать в организме, часть из них пролиферирует, и их потомки оказываются в пробе крови донора через десятилетия после начала облучения.
В работах [4][6][37][44] подробно описаны подходы к моделированию динамики и биокинетики Т-клеток на основе концепции Т-клеточного рода, когда единицей моделирования является прогенитор и все его потомки (потенциальные носители стабильной аберрации). Модельные подходы позволяют определить взвешивающие коэффициенты для этих двух групп Т-лимфоцитов и оценивать средневзвешенную дозу на Т-лимфоциты. Оценки опираются на расчеты доз на ККМ и другие органы и ткани на основе дозиметрических и биокинетических моделей для 90Sr [45][46].
Оценка коэффициентов перехода от дозы на Т-лимфоциты (DL) к дозе на критические органы на примере 90Sr
Оценка коэффициентов перехода от дозы на Т-лимфоциты к дозе на критические органы (Borg) на примере 90Sr была описана нами ранее [10]. Этот коэффициент представляет собой отношение соответствующих дозовых коэффициентов, то есть значений накопленной дозы в случае единичного поступлении радионуклида. Для однократного поступления используется формула:
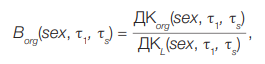 (9)
(9)
где τ1 — возраст донора на момент поступления 90Sr (лет),
τs — возраст донора на момент забора крови для цитогенетического исследования FISH,
ДКorg(sex, τ1, τs) — доза, накопленная в органе org за период времени (τs – τ1) после однократного поступления с пищей 1 Бк 90Sr; рассчитывается с использованием дозиметрической [45] и биокинетической моделей [46], учитывающих пол (sex) и возраст индивида;
ДКL(sex, τ1, τs) — средневзвешенная доза, накопленная за период времени (τs – τ1) в ряду поколений Т-клеток после однократного поступления с пищей 1Бк 90Sr; рассчитывается с использованием модели возрастной динамики и кинетики Т-клеток, а также известных значений доз Dorg для органов и тканей, где Т-клетки проводят какое-то время [47]; Гр/Бк. Для расчетов использовалась компьютерная программа «Лимфоциты». Численные значения ДКL(sex, τ1, τs) для 90Sr представлены в работе [47].
В случае хронического поступления рассчитывали сумму значений доз от поступления активности Ai(t) в каждый выделенный период времени. Поэтому для Borg имеем:
 (10)
(10)
Очевидно, что в случае равномерного поступления значения Ai(t) в числителе и знаменателе формулы (10) сокращаются, поэтому:
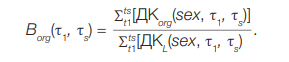 (11)
(11)
Однако если хроническое поступление было неравномерным (функция Ai(t) не является константой), коэффициент Borg должен рассчитываться с учетом этой функции.
Численные значения коэффициентов Borg, связывающих дозу на Т-лимфоциты и дозу на ККМ, были рассчитаны и проанализированы для 89,90Sr (BSrrbm) [10]. Оказалось, что коэффициенты BSrrbm существенно зависят от возраста на момент поступления 89,90Sr. Чем старше человек на начало облучения, тем в большей мере цитогенетическая доза отличается от дозы на ККМ, так как коэффициент BSrrbm увеличивается с возрастом и может превышать значения 5. Это связано с возрастной динамикой Т-клеточных популяций. Только для новорожденных и детей первых лет жизни правомерно допущение, что цитогенетическая доза соответствует дозе на ККМ, а значения BSrrbm близки к единице.
Пол не оказывает существенного влияния на BSrrbm. Если однородное поступление было растянуто во времени на полгода, то это существенно не влияло на значение BSrrbm. Изучение влияния более длительного поступления 90Sr на BSrrbm (до 5 лет) показало, что наиболее чувствительной группой являются подростки 15 лет. Для них различия BSrrbm в случае однократного и 5-летнего равномерного поступления 90Sr составляют около 13%.
НЕОПРЕДЕЛЕННОСТЬ ОЦЕНОК ДОЗ ПРИ РЕТРОСПЕКТИВНОЙ БИОДОЗИМЕТРИИ, НАПРАВЛЕНИЯ ИССЛЕДОВАНИЙ
В случае острого гамма-облучения всего тела подходы к неопределенности оценки доз подробно описаны в [7]. Учитываются неопределенности всех входящих параметров: неопределенность оценки частоты транслокаций, неопределенность калибровочной кривой и неопределенность оценки фоновой частоты транслокаций, характерной для конкретного возраста. Эти подходы позволяют оценивать границы 95% доверительного интервала (ДИ) дозы облучения Т-лимфоцитов, которая мало отличается от дозы на ККМ и другие органы и ткани. Наиболее простой метод [48] основан на оценках нижней и верхней границы ДИ частоты хромосомных аберраций (в приближении распределения Пуассона) и сопоставления их с ДИ калибровочной кривой. При этом ширина ДИ для частоты хромосомных аберраций выбирается равной 83%, что дает 95% ДИ при переходе к оценке неопределенности доз [49]. Более сложным является метод распространения неопределенностей, или дельта-метод [1][7], который основан на оценках вариаций (и ковариаций) параметров калибровочной кривой и дисперсии частоты аберраций в терминах стандартного отклонения. При этом 95% ДИ оценки дозы рассчитывается в приближении нормального распределения. Это консервативный метод, применяемый, например, при использовании «чужих» калибровочных кривых.
Необходимость перехода от дозы облучения Т-лимфоцитов к дозе на другие органы и ткани актуальна для неравномерного внешнего и внутреннего облучения.
Для случая неравномерного (частичного) внешнего облучения рассматриваются сценарии локального облучения различных сегментов тела человека, содержащих ККМ (например, грудина, область таза, голова и др.). Однако все предложенные статистические методы оценки дозы, накопленной тканями в облученном участке (с оценкой их неопределенности), базируются на анализе дицентриков, то есть должны применяться в короткий период времени после воздействия [1][50]. Методы базируются на использовании «загрязненного» метода Пуассона, который позволяет оценить дозу, учитывая распределение дицентриков среди всех пораженных клеток, и дает дополнительную информацию об облучаемом объеме тела и ККМ. Вышеназванные методы, в частности, с использованием Байесовского подхода [51], реализованы в компьютерных программах BiodoseTool, DoseEstimate, CABAS [50–53]. Применимость этих статистических методов для ретроспективной дозиметрии внутреннего облучения (с использованием частоты транслокаций) вызывает большие сомнения, поскольку, как отмечалось выше, к моменту забора крови различные субпопуляции лимфоцитов накопили разные дозы в зависимости возраста донора на момент поступления 90Sr, и распределение Пуассона невозможно разделить на две составляющие.
При неравномерном внутреннем облучении, как в случае с 90Sr, суммарная неопределенность должна включать в том числе неопределенность оценок коэффициента Borg (формула 11). В настоящее время подходы к ее оценке разрабатываются. Это является одним из важных направлений нашей работы. Следует отметить, что свой вклад в неопределенность дозовых оценок вносят индивидуальные различия доноров по способности репарировать повреждения ДНК (индивидуальные различия в эффективности ферментов репарации), а также стиль жизни доноров, который определяет встречаемость иных эндогенных и экзогенных факторов, влияющих на фоновую частоту транслокаций.
Суммарная неопределенность определяет порог индивидуальных доз, которые можно детектировать с использованием метода FISH (минимально детектируемая величина). В обзоре Edwards et al. [26] указывается, что с применением FISH могут быть измерены надфоновые индивидуальные дозы порядка 0,5 Гр. В целом в обзорах по применению методов ретроспективной дозиметрии отмечается детектируемая величина индивидуальной дозы 0,25–0,3 Гр [54–57] или 0,25–0,4 Гр [3]. Для случая внутреннего облучения 90Sr эта величина должна быть ожидаемо выше.
Для целей ретроспективной дозиметрии востребованы не только индивидуальные, но и среднегрупповые оценки доз с использованием метода FISH. Такие оценки используются в случае радиационных аварий, в которых пострадали большие группы населения, или есть необходимость оценить средние дозы в каком-либо населенном пункте с условно равномерным уровнем загрязнения/облучения. При таком среднегрупповом подходе суммируется общее число транслокаций, обнаруженных у всех доноров из группы, а также суммируется число фоновых транслокаций в соответствии с возрастом каждого донора группы. Разность этих показателей считается радиационно индуцируемыми транслокациями и относится к общему числу просчитанных в группе геном-эквивалентов. Такой подход позволяет избежать нулевых и отрицательных значений, которые часто возникают при вычитании фона на индивидуальном уровне при низких дозах облучения, что позволяет значительно снизить порог обнаружения надфоновой дозы. Однако среднегрупповой подход требует тщательного формирования групп с максимально схожими условиями облучения.
Среднегрупповые оценки могут быть также использованы для валидации индивидуализированных дозовых оценок, полученных с использованием моделей и/или других методов ретроспективной дозиметрии, к которым относятся: восстановление внешней дозы в органах и тканях человека по уровню загрязнения почвы (включает расчеты с использованием фантомов тела человека); восстановление внутренних доз по загрязнению рационов питания (включают использование дозиметрических и биокинетических моделей); использование других методов биодозиметрии, таких как метод электронного парамагнитного резонанса (ЭПР) применительно к эмали зубов; дозиметрия с использованием материалов, чувствительных к ионизирующему излучению (например, термолюминесцентная дозиметрия с использованием образцов керамики). Примером использования цитогенетических данных для целей валидации доз внешнего облучения являются исследования на реке Тече [58][59], где показана хорошая сходимость результатов оценки доз облучения членов эпидемиологических когорт, оцененных на основе прямых измерений гамма-полей, моделей облучения тела человека, данных цитогенетических исследований FISH, исследований зубной эмали методом ЭПР и др.
ЗАКЛЮЧЕНИЕ
Переход от частоты транслокаций к дозовым оценкам является сложной задачей, особенно в случае неравномерного внутреннего облучения с низкой мощностью дозы. Коэффициенты перехода от частоты хромосомных транслокаций к дозе на Т-лимфоциты (α) и далее от дозы на Т-лимфоциты к дозе на органы и ткани (Borg) определяются по независимым наборам данных и опираются на разные подходы.
Коэффициент α требует экспериментального определения параметров калибровочных кривых, его оценки широко варьируют, зачастую отличаясь в разы; кроме того, значения зависят от конкретной методики FISH. Не описаны калибровочные кривые, полученные in vitro, для детей и подростков на время облучения, хотя параметры для них могут отличаться от параметров для взрослых. Нет калибровочных кривых, полученных in vitro, при длительном облучении с низкой мощностью дозы. Ввиду небольшого числа доноров кривые могут давать систематическое смещение параметров «доза-эффект».
Оценка коэффициента Borg опирается на набор моделей, которые, в свою очередь, базируются на большом объеме экспериментальных данных по физиологии человека, его минеральном обмене, анатомическом строении органов и т.д. Коэффициенты существенно зависят от возраста на момент облучения. На настоящий момент остаются не разработанными подходы к оценке их неопределенностей.
Список литературы
1. IAEA, International Atomic Energy Agency. Cytogenetic dosimetry: applications in preparedness for and response to radiation emergencies. EPR-Biodosimetry. IAEA, Vienna, Austria. 2011.
2. Giussani A, Lopez MA, Romm H, Testa A, Ainsbury EA, Degteva M, et al. Eurados review of retrospective dosimetry techniques for internal exposures to ionising radiation and their applications. Radiat Environ Biophys. 2020;59(3):57–387. https://doi.org/10.1007/s00411-020-00845-y
3. Nakayama R, Abe Y, Goh Swee Ting V, Nakayama R, Takebayashi N, Nakata A, A Riyoshi K et al. Cytogenetic Biodosimetry in Radiation Emergency Medicine: 4. Overview of Cytogenetic Biodosimetry. Radiation Environment and Medicine. 2022;11(2):91–103. https://doi.org/10.51083/radiatenvironmed.11.2_91
4. Tolstykh EI, Degteva MO, Vozilova AV, Anspaugh LR. Local bonemarrow exposure: how to interpret the data on stable chromosome aberrations in circulating lymphocytes? (some comments on the use of FISH method for dose reconstruction for Techa riverside Residents). Radiat Environ Biophys. 2017;56(4):389–403. https://doi.org/10.1007/s00411-017-0712-7
5. Tolstykh EI, Degteva MO, Vozilova AV, Akleyev AV. Interpretation of FISH Results in the Case of Nonuniform Internal Radiation Exposure of Human Body with the Use of Model Approach.
6. Russian Journal of Genetics. 2019;55(10):1227–33 https://doi.org/10.1134/S1022795419100132
7. Tolstykh EI, Vozilova AV, Akleyev AV, Zalyapin VI. Model of agedependent dynamics and biokinetics of T-cells as natural biodosimeters. Radiat Environ Biophys. 2024 Aug;63(3):405–21. https://doi.org/10.1007/s00411-024-01072-5
8. Radiological protection — Performance criteria for laboratories using Fluorescence In Situ Hybridization (FISH) translocation assay for assessment of exposure to ionizing radiation. ISO 20046. 2019.
9. Sigurdson AJ, Ha M, Hauptmann M, Bhatti P, Sram RJ, Beskid O, et al. International study of factors affecting human chromosome translocations. Mutat Res. 2008;652(2):112–21. https://doi.org/10.1016/j.mrgentox.2008.01.005
10. Goh VST, Fujishima Y, Abe Y, Sakai A, Yoshida MA, Ariyoshi K et al. Construction of fluorescence in situ hybridization (FISH) translocation dose-response calibration curve with multiple donor data sets using R, based on ISO 20046:2019 recommendations. Int J Radiat Biol. 2019;95(12):1668–84. https://doi.org/10.1080/09553002.2019.1664788
11. Толстых ЕИ. Переход от частоты хромосомных транслокаций в Т-лимфоцитах к дозе на костный мозг в отдаленные сроки после внутреннего облучения 89,90Sr. Радиационная гигиена. 2024;17(2):53–63. https://doi.org/10.21514/1998-426X-2024-17-2-53-63
12. Tucker JD, Morgan WF, Awa AA, Bauchinger M, Blakey D, Cornforth MN, et al. PAINT: a proposed nomenclature for structural aberrations detected by whole chromosome painting. Mutat Res. 1995 Jun;347(1):21–4. https://doi.org/10.1016/0165-7992(95)90028-4
13. Savage JR, Tucker JD. Nomenclature systems for FISH-painted chromosome aberrations. Mutat Res. 1996 Nov;366(2):153–61. https://doi.org/10.1016/s0165-1110(96)90036-6
14. Stevens-Kroef M, Simons A, Rack K, Hastings RJ. Cyto-genetic Nomenclature and Reporting. Methods Mol Biol. 2017;1541:303–9. https://doi.org/10.1007/978-1-4939-6703-2_24
15. Нугиc ВЮ. FISH-метод: способ цитогенетической ретроспективной оценки дозы (обзор). Саратовский научно-медицинский журнал. 2016;12(4):671–8.
16. Fomina J, Darroudi F, Natarajan AT. Accurate detection of true incomplete exchanges in human lymphocytes exposed to neutron radiation using chromosome painting in combination with a telomeric PNA probe. Int J Radiat Biol. 2001;77(12):1175–83. https://doi.org/10.1080/09553000110083951
17. Vozilova AV, Krivoshchapova YV. Investigation of the Frequency of Inversions and Complex Translocations in T-Lymphocytes in Exposed Residents of the Southern Urals. Biology Bulletin. 2023;(50):2979–85. https://doi.org/10.1134/s1062359023110237
18. Pouzoulet F, Roch-Lefèvre S, Giraudet AL, Vaurijoux A, Voisin P, Buard V et al. Monitoring translocations by M-FISH and threecolor FISH painting techniques: a study of two radiotherapy patients. J Radiat Res. 2007;48(5):425–34. https://doi.org/10.1269/jrr.07013
19. Сотник НВ, Азизова ТВ, Жунтова ГВ. Биоиндикация внутреннего облучения при аварийном поступлении радионуклидов. Медицина экстремальных ситуаций. 2019;21(4):540–7.
20. Hada M, Wu H, Cucinotta FA. mBAND analysis for high- and low-LET radiation-induced chromosome aberrations: a review. Mutat Res. 2011;711(1–2):187–92. https://doi.org/10.1016/j.mrfmmm.2010.12.018
21. Нугис ВЮ, Снигирева ГП, Ломоносова ЕЕ, Козлова МГ, Никитина ВА. Трехцветный FISH-метод: кривые доза-эффект для транслокаций в культурах лимфоцитов периферической крови после гамма-облучения in vitro. Медицинская радиология и радиационная безопасность. 2021;5:12–20. https://doi.org/10.12737/1024-6177-2020-65-5-12-20
22. Lea DE, Catcheside DG. The mechanism of the induction by radiation of chromosome aberrations in Tradescantia. Journal of Genetics. 1942; 44(2):216–45. https://doi.org/10.1007/BF02982830
23. Bauchinger M, Schmid E, Dresp J. Calculation of the dose-rate dependence of the decentric yield after Co gamma-irradiation of human lymphocytes. Int J Radiat Biol Relat Stud Phys Chem Med. 1979;35(3):229–33. https://doi.org/10.1080/09553007914550261
24. Bauchinger M, Schmid E, Zitzelsberger H, Braselmann H, Nahrstedt U. Radiation-induced chromosome aberrations analysed by two-colour fluorescence in situ hybridization with composite whole chromosome-specific DNA probes and a pancentromeric DNA probe. Int J Radiat Biol. 1993;64(2):79–184. https://doi.org/10.1080/09553009314551271
25. Fernández JL, Campos A, Goyanes V, Losada C, Veiras C, Edwards AA. X-ray biological dosimetry performed by selective painting of human chromosomes 1 and 2. Int J Radiat Biol. 1995;67(3):295–302. https://doi.org/10.1080/09553009514550351
26. Sasaki MS. Advances in the biophysical and molecular bases of radiation cytogenetics. Int J Radiat Biol. 2009;85(1):26–47. https://doi.org/10.1080/09553000802641185
27. Edwards AA, Lindholm C, Darroudi F, Stephan G, Romm H, Barquinero J, et al. Review of translocations detected by FISH for retrospective biological dosimetry applications. Radiat Prot Dosimetry. 2005;113(4):396–402. https://doi.org/10.1093/rpd/nch452
28. Lindholm C, Luomahaara S, Koivistoinen A, Ilus T, Edwards AA, Salomaa S. Comparison of dose-response curves for chromosomal aberrations established by chromosome painting and conventional analysis. Int J Radiat Biol. 1998;74(1):27–34. https://doi.org/10.1080/095530098141690
29. Barquinero JF, Beinke C, Borràs M, Buraczewska I, Darroudi F, Gregoire E, et al. RENEB biodosimetry intercomparison analyzing translocations by FISH. Int J Radiat Biol. 2017;93(1):30–5. https://doi.org/10.1080/09553002.2016.1222092
30. Rodríguez P, Montoro A, Barquinero JF, Caballín MR, Villaescusa I, Barrios L. Analysis of translocations in stable cells and their implications in retrospective biological dosimetry. Radiat Res. 2004;162(1):31–8. https://doi.org/10.1667/rr3198
31. Jeong SK, Oh SJ, Kang YR, Kim H, Kye YU, Lee SH, et al. Biological dosimetry dose-response curves for residents living near nuclear power plants in South Korea. Sci Prog. 2023;106(3):368504231198935. https://doi.org/10.1177/00368504231198935
32. Sposto R, Stram DO, Awa AA. An estimate of the magnitude of random errors in the DS86 dosimetry from data on chromosome aberrations and severe epilation. Radiat Res. 1991;128(2):157–69. PMID: 1947012
33. Stram DO, Sposto R, Preston D, Abrahamson S, Honda T, Awa AA. Stable chromosome aberrations among A-bomb survivors: an update. Radiat Res. 1993;136(1):29–36. PMID: 8210335
34. Awa A. Analysis of chromosome aberrations in atomic bomb survivors for dose assessment: studies at the Radiation Effects Research Foundation from 1968 to 1993. Stem Cells. 1997;15 Suppl 2:163–73.https://doi.org/10.1002/stem.5530150724
35. Sasaki MS, Endo S, Ejima Y, et al. Effective dose of A-bomb radiation in Hiroshima and Nagasaki as assessed by chromosomal effectiveness of spectrum energy photons and neutrons. Radiat Environ Biophys. 2006;45(2):79–91. https://doi.org/10.1007/s00411-006-0051-6
36. Sasaki MS, Endo S, Ejima Y, Saito I, Okamura K, Oka Y, et al. The Association of Radiation Exposure with Stable Chromosome Aberrations in Atomic Bomb Survivors Based on DS02R1 Dosimetry and FISH Methods. Radiat Res. 2023;199(2):170–81. https://doi.org/10.1667/RADE-22-00154.1
37. Tawn EJ, Curwen GB, Jonas P, Gillies M, Hodgson L, Cadwell KK. Chromosome Aberrations Determined by FISH in Radiation Workers from the Sellafield Nuclear Facility. Radiat Res. 2015;184(3):296–303.https://doi.org/10.1667/RR14125.1
38. Толстых ЕИ, Возилова АВ, Дегтева МО, Аклеев АВ. Зависимость частоты транслокаций в лимфоцитах крови от дозы и возраста на начало облучения у жителей прибрежных сел реки Теча. Радиационная биология. Радиоэкология. 2023;63(2):3184–95.
39. Vrisekoop N, den Braber I, de Boer AB, Ruiter AF, Ackermans MT, van der Crabben SN, et al. Sparse production but preferential incorporation of recently produced naive T cells in the human peripheral pool. Proc Natl Acad Sci USA. 2008;105(16):6115–20. https://doi.org/10.1073/pnas.0709713105
40. De Boer RJ, Perelson AS. Quantifcation T lymphocyte turnover. J Theor Biol. 2013;(327):45–87. https://doi.org/10.1016/j.jtbi.2012.12.025
41. De Boer RJ, Tesselaar K, Borghans JAM. Better safe than sorry: Naive T-cell dynamics in healthy ageing. Semin Immunol. 2023;70:101839. https://doi.org/10.1016/j.smim.2023.101839
42. Yan J, Greer JM, Hull R, O’Sullivan JD, Henderson RD, Read SJ, et al. The effect of ageing on human lymphocyte subsets: comparison of males and females. Immun Ageing. 2010;7:4. https://doi.org/10.1186/1742-4933-7-4
43. Den Braber I, Mugwagwa T, Vrisekoop N, Westera L, Mögling R, de Boer AB, et al. Maintenance of peripheral naive T cells is sustained by thymus output in mice but not humans. Immunity. 2012;36(2):288–97 https://doi.org/10.1016/j.immuni.2012.02.006
44. Steinmann GG, Klaus B, Muller-Hermelink HK. The involution of the ageing human thymic epithelium is independent of puberty. A morphometric study. Scand J Immunol. 1985;(22):563–75. https://doi.org/10.1111/j.1365–3083.1985.tb01916.x
45. Tolstykh EI, Vozilova AV, Degteva MO, et al. Concept of T-cell genus as the basis for the analysis of FISH results after local bone marrow exposure. Biology Bulletin. 2020;47(11):1495– 506. https://doi.org/10.1134/S1062359020110151
46. Degteva MO, Tolstykh EI, Shishkina EA, Sharagin PA, Zalyapin VI, Volchkova AY, et al. Stochastic parametric skeletal dosimetry model for humans: General approach and application to active marrow exposure from bone-seeking beta-particle emitters. PLoS One. 2021;16(10):e0257605. https://doi.org/10.1371/journal.pone.0257605
47. Shagina NB, Tolstykh EI, Degteva MO, Anspaugh LR, Napier BA. Age and gender specific biokinetic model for strontium in humans. J Radiol Prot. 2015;35(1):87–127. https://doi.org/10.1088/0952-4746/35/1/87
48. Толстых ЕИ, Дегтева МО. Оценка доз облучения лимфоцитов и их предшественников при пероральном поступлении стронция-89,90. Радиационная гигиена. 2022;15(3):82–91. https://doi.org/10.21514/1998-426X-2022-15-3-82-91
49. Merkle W. Statistical methods in regression and calibration analysis of chromosome aberration data. Radiat Environ Biophys. 1983;21(3):217–33.
50. Austin PC, Hux JE. A brief note on overlapping confidence intervals. J Vasc Surg. 2002;36(1):194–5. https://doi.org/10.1067/mva.2002.125015
51. Hernández A, Endesfelder D, Einbeck J, Puig P, Benadjaoud MA, Higueras M, et al. Biodose Tools: An R Shiny Application for Biological Dosimetry. 2023;99(9):1378–90. https://doi.org/10.1080/09553002.2023.2176564
52. Higueras M, Puig P, Ainsbury EA, Vinnikov VA, Rothkamm K. A new Bayesian model applied to cytogenetic partial body irradiation estimation. Radiat Prot Dosimetry. 2016;168(3):330–6. https://doi.org/10.1093/rpd/ncv356
53. Ainsbury EA, Lloyd DC: Dose estimation software for radiation biodosimetry. Health Phys. 2010;98(2):290–5. https://doi.org/10.1097/01.HP.0000346305.84577.b4
54. Deperas J, Szluinska M, Deperas-Kaminska M, Edwards A, Lloyd D, Lindholm C, et al. CABAS: a freely available PC program for fitting calibration curves in chromosome aberration dosimetry. Radiat Prot Dosimetry. 2007;124(2):115–23. https://doi.org/10.1093/rpd/ncm137
55. Gnanasekaran TS. Cytogenetic biological dosimetry assays: recent developments and updates. Radiat Oncol J. 2021;39(3):159–66. https://doi.org/10.3857/roj.2021.00339
56. Beinke C, Siebenwirth C, Abend M, Port M. Contribution of Biological and EPR Dosimetry to the Medical Management Support of Acute Radiation Health Effects. Appl Magn Reson. 2022;(53):265–87. https://doi.org/10.1007/s00723-021-01457-5
57. M’Kacher R, Colicchio B, Junker S, El Maalouf E, Heidingsfelder L, Plesch A, et al. High Resolution and Automatable Cytogenetic Biodosimetry Using In Situ Telomere and Centromere Hybridization for the Accurate Detection of DNA Damage: An Overview. Int J Mol Sci. 2023;24(6):5699. https://doi.org/10.3390/ijms24065699
58. Herate C, Sabatier L. Retrospective biodosimetry techniques: Focus on cytogenetics assays for individuals exposed to ionizing radiation. Mutat Res Rev Mutat Res. 2020;(783):108287. https://doi.org/10.1016/j.mrrev.2019.108287
59. Degteva MO, Shagina NB, Shishkina EA, Vozilova AV, Volchkova AY, Vorobiova MI, et al. Analysis of EPR and FISH studies of radiation doses in persons who lived in the upper reaches of the Techa River. Radiat Environ Biophys. 2015;54(4):433–44. https://doi.org/10.1007/s00411-015-0611-8
60. Degteva MO, Shishkina EA, Tolstykh EI, et al. Application of the EPR and FISH Methods to Dose Reconstruction for People Exposed in the Techa River Area. Radiats Biol Radioecol. 2017;57(1):30–41. English, Russian. https://doi.org/10.7868/S0869803117010052
Об авторах
Е. И. ТолстыхРоссия
Толстых Евгения Игоревна, д-р биол. наук
Челябинск
Ю. Р. Ахмадуллина
Россия
Ахмадуллина Юлия Рафисовна, канд. биол. наук
Челябинск
П. А. Шарагин
Россия
Шарагин Павел Алексеевич
Челябинск
Е. А. Шишкина
Россия
Шишкина Елена Анатольевна, д-р. биол. наук
Челябинск
А. В. Аклеев
Россия
Аклеев Александр Васильевич, д-р мед. наук, профессор
Челябинск
Дополнительные файлы
Рецензия
Для цитирования:
Толстых Е.И., Ахмадуллина Ю.Р., Шарагин П.А., Шишкина Е.А., Аклеев А.В. Ретроспективная биодозиметрия. Проблема конвертации частоты хромосомных транслокаций в дозу на органы. Медицина экстремальных ситуаций. 2024;26(3):5-14. https://doi.org/10.47183/mes.2024-26-3-5-14
For citation:
Tolstykh E.I., Akhmadullina Y.R., Sharagin P.A., Shishkina E.A., Akleyev A.V. Retrospective biodosimetry: Conversion of frequency of chromosomal translocations into organ doses. Extreme Medicine. 2024;26(3):5-14. https://doi.org/10.47183/mes.2024-26-3-5-14

















