Перейти к:
Оценка депрессивноподобного поведения у мышей после фракционированного гамма-облучения
https://doi.org/10.47183/mes.2024-26-3-30-39
Аннотация
Введение. Облучение мозга в больших дозах ионизирующего излучения является установленным фактором риска развития новообразований и когнитивных нарушений. Однако нерешенной проблемой остается влияние длительного облучения в малых дозах на головной мозг и высшую нервную деятельность, в том числе на развитие тревожно-депрессивных расстройств.
Цель. Изучить влияние фракционированного гамма-облучения в дозах 0,1 Гр, 1 Гр и 5 Гр в ранний постнатальный период на показатели депрессивноподобного состояния у мышей линии C57Bl/6 в возрасте 1 и 6 мес.
Материалы и методы. Животных облучали в течение первого месяца жизни. Необходимые кумулятивные дозы (0,1 Гр, 1 Гр и 5 Гр) были получены в режиме фракционированного облучения (20 фракций). Были сформированы 2 контрольные группы: интактные животные и ложно облученные животные. Депрессивноподобное состояние оценивали в тесте «удержания хвоста» в возрасте 1 и 6 мес.
Результаты. Возрастные изменения проявлялись в снижении депрессивноподобного поведения у мышей в возрасте 6 мес. по сравнению с мышами в возрасте 1 мес. Стресс, вызванный выполнением манипуляций, связанных с облучением, не оказывал существенного влияния на мышей в возрасте 1 мес., но вызывал развитие выраженного депрессивноподобного состояния у этих же животных в возрасте 6 мес. Радиационное воздействие привело к развитию зависимого от дозы антидепрессивноподобного эффекта, который был более выражен у животных в возрасте 6 мес. после фракционированного облучения в дозах 0,1 Гр и выше.
Выводы. Фракционированное гамма-облучение в ранний постнатальный период не приводит к развитию депрессивноподобной симптоматики у мышей, а, напротив, характеризуется антидепрессивным действием.
Ключевые слова
Для цитирования:
Обвинцева Н.А., Атаманюк Н.И., Шапошникова И.А., Перетыкин А.А., Пряхин Е.А. Оценка депрессивноподобного поведения у мышей после фракционированного гамма-облучения. Медицина экстремальных ситуаций. 2024;26(3):30-39. https://doi.org/10.47183/mes.2024-26-3-30-39
For citation:
Obvintseva N.A., Atamanyuk N.I., Shaposhnikova I.A., Peretykin A.A., Pryakhin E.A. Assessment of depression-like behavior in mice after fractional gamma irradiation. Extreme Medicine. 2024;26(3):30-39. https://doi.org/10.47183/mes.2024-26-3-30-39
ВВЕДЕНИЕ
Несмотря на значительное количество информации о влиянии ионизирующего излучения на организм человека, по-прежнему остаются малоисследованными такие эффекты, как формирование психических расстройств и характер психических нарушений у человека в зависимости от дозы облучения. Известно, что острое облучение головного мозга в высоких дозах приводило к когнитивной дисфункции, проявляющейся, как правило, в виде дефицита гиппокамп-зависимых функций обучения и памяти, причем эти эффекты коррелировали с дозой облучения [1–3].
Помимо изменений когнитивной функции, в ряде работ отмечались также изменения эмоционального поведения, в частности развитие признаков тревоги и депрессии. Так, среди ликвидаторов чернобыльской аварии отмечали высокую распространенность цереброваскулярных заболеваний, органических психических и депрессивных расстройств, когнитивных нарушений и деменций, которые повышались с увеличением дозы облучения, некоторые эффекты регистрировались при дозах от 50 мЗв [4][5]. Повышенная частота депрессий и суицидальных мыслей была отмечена среди подростков, подвергшихся в раннем возрасте влиянию радиоактивных осадков после чернобыльской аварии [6]. Широкий спектр депрессивной патологии на фоне органических расстройств выявлен у лиц, облученных в зоне радиационных аварий на Южном Урале [7].
Однако при анализе данных о радиационных эффектах у населения, облученного в результате радиационных инцидентов, следует учитывать, что стресс, связанный с получением информации о возможном радиационном воздействии, независимо от того, имело ли место превышение фоновых доз облучения на самом деле, может быть причиной повышения частоты психических расстройств [8].
Поэтому особый интерес представляет исследование особенностей воздействия радиационного излучения на состояние психической сферы у экспериментальных животных, где можно исключить действие других факторов кроме радиационного воздействия. Поведенческие изменения, характеризующие повышение тревожности, выявлялись у грызунов при облучении в дозах в пределах 0,25–1 Гр [9–11]. М. Dos Santos и соавт. у животных зарегистрировали депрессивноподобную симптоматику, проявляющуюся в увеличении времени неподвижности в тесте принудительного плавания Порсольта при облучении головного мозга в области зубчатой извилины в дозах от 0,25 Гр [10]. В то же время группой авторов (H. Wang, Z. Ma, H. Shen и др.) отмечено, что при облучении на уровне 5 Гр у крыс в раннем возрасте депрессивноподобное поведение, проявляющееся в тесте принудительного плавания и тесте удержания хвоста, сохранялось через 4 мес. после облучения [12].
Облучение мозга в больших дозах ионизирующего излучения является установленным фактором риска развития новообразований и когнитивных нарушений [1]. Однако нерешенной проблемой остается проблема влияния длительного облучения в малых дозах на ЦНС и высшую нервную деятельность. Длительное облучение характерно для профессионалов и населения, пострадавшего от радиационных инцидентов. Кроме этого, такой вид радиационного воздействия будет характерен для космонавтов при длительных космических перелетах вне магнитного поля Земли (полеты на Луну, Марс и т.д.).
Необходимо отметить, что имеющиеся сведения относительно эффектов при хроническом или фракционированном излучении и их воздействия на высшую нервную деятельность экспериментальных животных, особенно в аспекте длительного облучения в малых дозах, являются противоречивыми [1][3]. Большинство исследований влияния ионизирующего излучения на психические функции проводились с использованием однократного острого облучения, в то время как клинически и экологически значимые воздействия на человека происходят преимущественно в режиме хронического или фракционированного облучения. В связи с тем что у человека и мышей могут регистрироваться половые различия в поведении, связанном с депрессией [13], исследования по оценке влияния фракционированного облучения на депрессивноподобное поведение у мышей должны учитывать гендерные особенности в реализации радиационно-индуцированных изменений поведения.
Цель работы — оценить влияние фракционированного облучения в раннем возрасте в кумулятивных дозах 0,1, 1 и 5 Гр на депрессивноподобное поведение у мышей разного пола в ранние и отдаленные сроки после облучения.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали самцов и самок мышей линии C57BL/6 (питомник SPF-вивария ИЦиГ СО РАН, г. Новосибирск). Животных содержали в стандартных условиях вивария на стандартном рационе при естественном освещении.
Оценивали влияние длительного радиационного воздействия в ранний постнатальный период, который отличается наибольшей чувствительностью головного мозга к действию ионизирующего излучения, в малых (0,1 Гр), средних (1 Гр) и больших (5 Гр) дозах. Животных подвергали фракционированному общему внешнему гамма-облучению в течение первого месяца жизни, начиная с 0–3 сут после рождения 5 суток в неделю в течение 4 недель (всего 20 фракций).
Все экспериментальные животные были разделены на группы в зависимости от гендерной принадлежности и уровня внешнего гамма-облучения:
1) группа 5 Гр — мыши (40 самцов и 40 самок), облученные в кумулятивной дозе 5 Гр (20 фракций по 0,25 Гр);
2) группа 1 Гр — мыши (40 самцов и 40 самок), облученные в кумулятивной дозе 1 Гр (20 фракций по 0,05 Гр);
3) группа 0,1 Гр — мыши (40 самцов и 40 самок), облученные в кумулятивной дозе 0,1 Гр (20 фракций по 0,005 Гр);
4) группа 0 Гр — ложное облучение (0 Гр) (40 самцов и 40 самок), с животными этой группы проводили аналогичные манипуляции и в том же количестве, как в группах «облучения», но без воздействия ионизирующего излучения. Стресс, связанный с манипуляциями, включал в себя: ранний постнатальный стресс в виде кратковременной (3–5 мин) депривации от матери; стресс, связанный с переносом клеток, звуковой, световой имитацией облучения на установке ИГУР-1М;
5) группа биологического контроля (БК) — интактные животные (40 самцов и 40 самок).
Облучение проводили на экспериментальной радиобиологической установке ИГУР-1М с 137Cs-источниками (ЗАО «Квант», Россия). Мощность дозы при облучении в разовых дозах 0,25 и 0,05 Гр составляла 0,72 Гр/мин, для получения разовой дозы 0,005 Гр использовали свинцовые коллиматоры, снижающие мощность дозы до 0,015 Гр/мин. Неравномерность гамма-поля в рабочем пространстве составляла не более 10%. Для облучения мышей помещали внутрь установки в домашних клетках, удаляя из них на время облучения кормящих самок.
На установке ИГУР-1М облучали одновременно по 5 клеток с животными, составленных друг на друга вертикально. Каждый день положение клеток в ряду из 5 клеток меняли. Контроль поглощенной дозы в каждом цикле облучения проводили с помощью клинического дозиметра ДКС5350/1 (УП «Атомтех», Республика Беларусь) с цилиндрической ионизационной камерой ТМ31010 фирмы PTW-Freiburg, Германия (объем 0,125 см3), в режиме измерения K(a) кермы в воздухе рентгеновского и гамма-излучения. Для каждой клетки с животными индивидуально рассчитывали фактическую поглощенную дозу за 20 фракций облучения с учетом показаний дозиметра и расчетного значения неопределенности дозы.
При расчете фактически полученной кумулятивной поглощенной дозы для животных каждой экспериментальной группы, на основе показаний дозиметра ДКС5350/1 в каждом цикле облучения и расчетных значений стандартных неопределенностей доз облучения на установке ИГУР-1М для мышей были получены следующие значения: для группы 0,1 Гр фактическая доза составила 0,11 ± 0,01 Гр, для группы 1 Гр — 1,00 ± 0,08 Гр, для группы 5 Гр — 5,2 ± 0,4 Гр [14].
В возрасте 1 мес. мышей рассаживали по 10 особей одного пола в отдельные клетки, индивидуально маркировали каждое животное. Тестирование проводили в возрасте 35–37 сут (через неделю после завершения облучения и отсадки от матери), а также повторно в возрасте 6 мес. (через 5 мес. после завершения облучения). В каждой экспериментальной группе тестировали по 80 животных (40 самцов и 40 самок).
Оценку депрессивноподобного состояния у мышей проводили в тесте удержания хвоста (аналог теста принудительного плавания Порсольта), который представляет собой реакцию животного на кратковременный неизбежный стресс в виде неподвижного зависания (иммобильности) [15]. В тесте оценивали время, в течение которого животное от активных попыток освободиться из неприятного положения (подвешивание за хвост) переходит к иммобильности, что интерпретируется как проявление поведения отчаяния и отражает депрессивноподобное состояние у грызунов [15].
Для выполнения теста мышей подвешивали за хвост с помощью кусочков малярного скотча длиной 15 см к перекладине, расположенной на двух штативах. Одновременно тестировали по 4 животных, разделяя их друг от друга картонными перегородками. На хвост надевали пластиковые трубочки длиной в 2/3 хвоста, чтобы предотвратить возможность мыши взбираться вверх по своему хвосту. Между носом мыши и поверхностью стола оставалось не менее 30 см. После подвешивания фиксировали поведение мышей на видео (фотокамера Sony α37) в течение 6 минут, после чего животных освобождали [15]. Регистрировали суммарное время, в течение которого мыши висели неподвижно, не предпринимая активных попыток освободиться (общее время неподвижности); количество таких неподвижных зависаний; время до наступления первого неподвижного зависания; среднее время одного неподвижного зависания. Учет показателей проводили с использованием программы RealTimer (ООО «НПК Открытая Наука», Россия).
Данные анализировали в программе Microsoft Exсel и с использованием языка программирования R [16], результаты выражали в виде средних значений и стандартных ошибок (M ± SE). Оценивали соответствие измеренных показателей в каждой группе нормальному распределению по критерию согласия типа Колмогорова — Смирнова с уровнем статистической значимости 0,05. Так как все анализируемые показатели соответствовали нормальному распределению, экспериментальные группы сравнивали с помощью t-критерия Стьюдента. Достоверным принимали уровень значимости 0,05. Проводили многофакторный дисперсионный анализ с использованием обобщенной линейной модели для оценки линейной зависимости изучаемых показателей от дозы облучения, пола и фактора стресса, связанного с манипуляциями при облучении животных (принимали, что животные из группы биологического контроля не испытывали стресс, а животные из остальных групп, в том числе из группы 0 Гр, подвергались воздействию стресса).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В группе БК у мышей в возрасте 1 и 6 мес. все анализируемые показатели у мышей в возрасте 6 мес. не имели статистически значимых отличий у самцов и самок, за исключением среднего времени одного неподвижного зависания (t = 2,33; p = 0,02): время до первого неподвижного зависания в возрасте 1 мес. (t = 1,03; p = 0,31), в возрасте 6 мес. (t = 0,74; p = 0,46); общее время неподвижности в возрасте 1 мес. (t = 0,20; p = 0,84), в возрасте 6 мес. (t = 1,41; p = 0,16); число неподвижных зависаний у мышей в возрасте 1 мес. (t = 0,17; p = 0,86), в возрасте 6 мес. (t = 1,25; p = 0,22) и среднее время одного неподвижного зависания у мышей в возрасте 1 мес. (t = 0,86; p = 0,39). В экспериментальных группах в целом отличий между самцами и самками не наблюдалось. Хотя у животных в группе ложного облучения (0 Гр) в возрасте 1 мес. были выявлены гендерные отличия: у самцов было меньше время до первого неподвижного зависания (t = 2,13; p = 0,04), больше общее время неподвижности (t = 2,5; p = 0,01) и среднее время одного неподвижного зависания (t = 2,3; p = 0,02) по сравнению с самками. Среди облученных животных только в одной группе (1 мес., 1 Гр) были выявлены отличия между самками и самцами по показателю времени до первого неподвижного зависания (t = 2,6; p = 0,01), которое было меньше у самцов. Далее анализировали результаты теста в каждой экспериментальной группе без разделения по полу (табл. 1).
Были отмечены существенные различия поведения мышей в возрасте 1 и 6 мес. в группе БК. Так, время до первого неподвижного зависания у мышей в возрасте 1 мес. составило 39 ± 3 с, а у этих же мышей по достижении ими возраста 6 мес. значение этого показателя было в 2,7 раза больше (t = 11,3; p < 0,001). Общее время неподвижности с возрастом снижалось в 2 раза (t = 15,7; p < 0,001), сокращалось число неподвижных зависаний с 10,8 ± 0,3 до 7,5 ± 0,3 раза (t = 7,8; p < 0,001). Среднее время одного неподвижного зависания также сократилось с 23,0 ± 1,2 до 15 ± 1,1 с (t = 4,9; p < 0,001).
В группе ложного облучения (0 Гр) стресс, вызванный выполнением манипуляций, связанных с облучением (перенос клеток, отлучение мышат от матери на период до 5 мин, имитация облучения на установке ИГУР-1М) у мышей в возрасте 1 мес. привел к изменению только одного показателя — к снижению общего времени неподвижности на 8% (t = 2,2; p = 0,03) (табл. 1). Однако такой стресс привел к выраженным изменениям 3-х из 4-х анализируемых показателей (время до первого неподвижного зависания, общее время неподвижности, число неподвижных зависаний) при достижении этими мышами возраста 6 мес. Так, у мышей в группе 0 Гр по сравнению с группой БК время до первого неподвижного зависания снизилось на 16% (t = 2,2; p = 0,03); общее время неподвижности увеличилось на 75% (t = 6,4; p < 0,001); число неподвижных зависаний увеличилось на 71% (t = 6,2; p < 0,001). Такие изменения поведения у мышей в группе 0 Гр можно интерпретировать как проявление депрессивноподобного состояния. В связи с выявленными различиями в группах БК и 0 Гр анализируемые показатели облученных мышей сравнивали с показателями группы 0 Гр соответствующего возраста.
У мышей в возрасте 1 мес. не выявлено статистически значимых отличий всех исследованных показателей (время до первого неподвижного зависания, общее время неподвижности, число неподвижных зависаний, среднее время одного неподвижного зависания) в группах 0,1 и 1 Гр от группы 0 Гр. У животных, облученных в дозе 5 Гр, отмечали удлинение времени до первого неподвижного зависания (t = 2,6; p = 0,01), сокращение общего времени неподвижности (t = 4,1; p < 0,001) и среднего времени неподвижного зависания (t = 4,0; p < 0,001). Такие изменения можно интерпретировать как проявление антидепрессивноподобного эффекта при фракционированном облучении в суммарной дозе 5,2 Гр.
У мышей в возрасте 6 мес. во всех дозовых группах было выявлено статистически значимое снижение общего времени неподвижного зависания и количества неподвижных зависаний (табл. 2). Также отмечено статистически значимое увеличение времени до первого неподвижного зависания в группе 5 Гр (t = 2,6; p = 0,01) и снижение среднего времени одного неподвижного зависания в группе 1 Гр (t = 2,9; p = 0,005). Такие изменения можно интерпретировать как проявление антидепрессивноподобного эффекта через 5 мес. после облучения в дозах 0,1 Гр и больше.
Важным этапом установления причинно-следственных связей между анализируемым фактором и его эффектами является оценка зависимости «доза–эффект». Выявленные изменения зависели от уровня радиационного воздействия. При проведении регрессионного анализа показано, что доза радиационного воздействия оказывает статистически значимое влияние на время до первого неподвижного зависания в возрасте 1 мес. (R2 = 0,03; F = 12,5; p < 0,001) и в возрасте 6 мес. (R2 = 0,02; F = 8,3; p = 0,004) (рис. 1).
При этом коэффициенты наклона в уравнениях зависимости времени до первого неподвижного зависания у мышей разного возраста не отличались (t = 0,2; p = 0,8), что говорит о том, действие фракционированного облучения по показателю времени до первого неподвижного зависания не отличался у одних и тех же животных в возрасте 1 и 6 мес., хотя регистрируются выраженные возрастные изменения в виде увеличения времени до первого неподвижного зависания у мышей в возрасте 6 мес. по сравнению с одномесячными животными.
Общее время неподвижности зависело от дозы облучения как в возрасте 1 мес. (R2 = 0,14; F = 66,6; p < 0,001), так и в 6 мес. (R2 = 0,13; F = 49,8; p < 0,001) (рис. 2).
Несмотря на то что зависимость этого показателя от дозы облучения удовлетворительно описывается линейными функциями с близкими углами наклона, эта зависимость для мышей в возрасте 6 мес. (рис. 2) носит нелинейный характер и лучше описывается логарифмической функцией (R2 = 0,19; F = 75,6; p < 0,001), что позволяет полагать, что с возрастом происходит изменение реакции животных на радиационное воздействие: у мышей в возрасте 6 мес. регистрируется снижение выраженности депрессивноподобного поведения начиная с уровня радиационного воздействия 0,1 Гр, тогда как у мышей в возрасте 1 мес. статистически значимое радиационно-индуцированное снижение депрессивноподобного состояния отмечается только при облучении в дозе 5 Гр.
Число неподвижных зависаний у животных в возрасте 1 мес. статистически значимо не изменялось с увеличением дозы облучения, тогда как у этих же мышей в возрасте 6 мес. отмечали высоко достоверную зависимость от уровня радиационного воздействия, которая также лучше всего описывалась логарифмической функцией (R2 = 0,18; F = 67,1; p < 0,001) (рис. 3).
По показателю «число неподвижных зависаний» четко видно, что через 5 мес. после фракционированного облучения облученные животные иначе реагируют на кратковременный неизбежный стресс (подвешивание за хвост) по сравнению с ложнооблученными животными: у облученных одномесячных животных не наблюдалось отличий от мышей из группы ложного облучения, а у тех же мышей в возрасте 6 мес. зарегистрировано дозозависимое снижение этого показателя начиная с уровня 0,1 Гр.
При анализе средней длительности одного неподвижного зависания также выявлены возрастные изменения реакции на кратковременный неизбежный стресс у мышей в возрасте 1 и 6 мес.: у одномесячных животных выявлена линейная зависимость этого показателя от дозы облучения (R2 = 0,09; F = 40,5; p < 0,001), а у мышей в возрасте 6 мес. средняя длительность одного неподвижного зависания не зависела от уровня радиационного воздействия (рис. 4).
Особенностями долгосрочного эксперимента по оценке влияния фракционированного гамма-облучения на физиологические процессы, связанные с развитием депрессивноподобного состояния, являются неизбежное влияние таких факторов, как возраст, пол, стресс, связанный с манипуляциями при облучении животных. Действие этих факторов по отдельности приведено выше, однако для получения целостной картины во взаимосвязи этих факторов между собой необходимо проведение многофакторного анализа. Проведение многофакторного дисперсионного анализа с использованием обобщенной линейной модели показало, что на время до первого неподвижного зависания статистически значимое влияние оказывали такие факторы, как пол, возраст, доза облучения, а фактор стресса оказывал статистически значимое влияние только на мышей в возрасте 6 мес. Установлено, что «время до первого неподвижного зависания» у самок было на 8 ± 3 с дольше, чем у самцов (табл. 3).
Стресс не оказывал статистически значимого влияния на время до первого неподвижного зависания у мышей в возрасте 1 мес., но достоверно снижал значение этого показателя у этих же животных в 6 мес. Радиационное воздействие оказывало статистически значимое влияние на время до первого неподвижного зависания, при этом значение показателя нарастало на 3,0 ± 0,8 секунды с увеличением дозы на 1 Гр.
По данным многофакторного дисперсионного анализа общее время неподвижности зависело от возраста, стресса, дозы облучения и не зависело от пола мышей. Фактор стресса, рассчитанный для животных из групп 0, 0,1, 1 и 5 Гр, вызывал в среднем увеличение показателя на 40 ± 8 с, при этом значение этого параметра было меньше в среднем на 49 ± 11 с у мышей в возрасте 1 мес. Радиационное воздействие оказывало статистически значимое влияние на общее время неподвижности, которое снижалось на 9,4 ± 1,1 секунды с увеличением дозы на 1 Гр (табл. 3).
Количество неподвижных зависаний статистически значимо зависело от возраста, стресса, дозы облучения и не зависело от пола животных. У мышей в возрасте 6 мес. отмечалось уменьшение количества неподвижных зависаний по сравнению с одномесячными мышами. Стресс в среднем приводил к увеличению числа неподвижных зависаний на 2,9 ± 0,5 в группах, подвергавшихся процедурам, связанным с облучением мышей. При этом стресс оказывал влияние на животных в возрасте 6 мес. и не влиял в возрасте 1 мес. В многофакторном дисперсионном анализе такие возрастные отличия в реакции на стресс выражались в виде увеличения коэффициента для фактора «Стресс» и одинаковом по величине снижении коэффициента для фактора «Стресс×возраст» для мышей в возрасте 1 мес., где фактор стресса не влиял на количество неподвижных зависаний.
С увеличением дозы на 1 Гр количество неподвижных зависаний снижалось в среднем на 0,6 ± 0,1. Такие изменения определялись преимущественно реакцией мышей в возрасте 6 мес., у которых при проведении регрессионного анализа была выявлена высокодостоверная зависимость анализируемого показателя от дозы облучения (рис. 3). У мышей в возрасте 1 мес. количество неподвижных зависаний по данным регрессионного анализа не зависело от дозы. Такие возрастные особенности выражены в снижении коэффициента для фактора «Доза облучения» на 0,6 ± 0,1 и компенсирующем повышении коэффициента для фактора «Возраст×доза» у мышей в возрасте 1 мес. (табл. 2).
Среднее время одного неподвижного зависания статистически значимо зависело от возраста и дозы облучения и не зависело от пола и стресса. У животных в возрасте 6 мес. среднее время одного неподвижного зависания было на 5,7 ± 0,9 с меньше, чем у животных в возрасте 1 мес. При облучении этот показатель снижался с увеличением дозы на 1 Гр в среднем на 0,14 ± 0,02 с. Также следует отметить, что на величину среднего времени одного неподвижного зависания оказывало статистически значимое влияние сочетание факторов «Пол×возраст» и «Возраст×доза». У самцов в возрасте 1 мес. время одного неподвижного зависания было на 3,3 ± 1,1 с больше, чем у этих же самцов в возрасте 6 мес. и самок в возрасте 1 и 6 мес. Влияние модифицирующего действия возраста проявлялось в отсутствии статистически значимой зависимости данного показателя от дозы облучения в возрасте 6 мес., хотя в возрасте 1 мес. среднее время одного неподвижного зависания закономерно снижалась с дозой на 1,0 ± 0,27 с при увеличении дозы на 1 Гр (табл. 3).
Таблица 1. Показатели теста «удержание хвоста» у мышей в возрасте 1 мес. в разных экспериментальных группах
|
Группы |
Пол |
Время до первого неподвижного зависания, с |
Общее время неподвижности, с |
Число неподвижных зависаний, (М±SE) |
Среднее время одного неподвижного зависания, (М±SE), с |
|
БК |
♂ |
42 ± 5 |
230 ± 7 |
10,9 ± 0,5 |
24 ± 2,1 |
|
♀ |
36 ± 3 |
228 ± 7 |
10,8 ± 0,3 |
22 ± 1,0 |
|
|
♂+♀ |
39 ± 3 |
229 ± 5 |
10,8 ± 0,3 |
23,0 ± 1,2 |
|
|
0 Гр |
♂ |
28 ± 4* |
226 ± 8 |
11 ± 0,5 |
23,2 ± 1,8 |
|
♀ |
51 ± 10 |
194 ± 10* |
10,6 ± 0,4 |
18,3 ± 1,1* |
|
|
♂+♀ |
39 ± 5 |
211 ± 7* |
10,8 ± 0,3 |
20,9 ± 1,1 |
|
|
0,1 Гр |
♂ |
44 ± 3† |
222 ± 7 |
10,9 ± 0,5 |
21,7 ± 1,3 |
|
♀ |
50 ± 4* |
222 ± 5† |
10,9 ± 0,4 |
22,3 ± 1,0† |
|
|
♂+♀ |
47 ± 3 |
226 ± 5 |
10,9 ± 0,3 |
22 ± 0,8 |
|
|
1 Гр |
♂ |
41 ± 4† |
212 ± 8 |
11,1 ± 0,4 |
20,6 ± 1,2 |
|
♀ |
54 ± 3* |
230 ± 6† |
11,4 ± 0,4 |
20,7 ± 1,0 |
|
|
♂+♀ |
47 ± 2,5* |
217 ± 5 |
11,2 ± 0,3 |
20,6 ± 0,8 |
|
|
5 Гр |
♂ |
49 ± 4† |
181 ± 9*† |
11,4 ± 0,5 |
16,8 ± 1,1*† |
|
♀ |
64 ± 8* |
163 ± 9*† |
11,4 ± 0,6 |
14,7 ± 1,0*† |
|
|
♂+♀ |
56 ± 5*† |
172 ± 7*† |
11,4 ± 0,4 |
15,7 ± 0,8*† |
Таблица подготовлена авторами по собственным данным
Примечание: ♂ — самцы; ♀ — самки; * — статистически значимые отличия от показателя в группе биологического контроля, р < 0,05; † — статистически значимые отличия от значения показателя в группе 0 Гр, р < 0,05.
Таблица 2. Показатели теста «удержание хвоста» у мышей в возрасте 6 мес. в разных экспериментальных группах
|
Группы |
Пол |
Время до первого неподвижного зависания, с |
Общее время неподвижности, с |
Число неподвижных зависаний |
Среднее время одного неподвижного зависания, с |
|
БК |
♂ |
101 ± 9‡ |
97 ± 8‡ |
7,9 ± 0,5‡ |
12,5 ± 1,0‡ |
|
♀ |
109 ± 6‡ |
114 ± 9‡ |
7,1 ± 0,4‡ |
17,5 ± 1,9‡ |
|
|
♂+♀ |
105 ± 5‡ |
106 ± 6‡ |
7,5 ± 0,3‡ |
15,0 ± 1,1‡ |
|
|
0 Гр |
♂ |
88 ± 8 |
168 ± 17* |
11,7 ± 1,0* |
14,5 ± 1,0 |
|
♀ |
87 ± 8* |
204 ± 13* |
13,9 ± 1,1* |
16,7 ± 1,2 |
|
|
+♀ |
88 ± 6* |
186 ± 11* |
12,8 ± 0,8* |
15,6 ± 0,8 |
|
|
0,1 Гр |
♂ |
82 ± 8 |
133 ± 9* |
9,7 ± 0,5* |
13,4 ± 0,9 |
|
♀ |
95 ± 5 |
135 ± 8† |
8,7 ± 0,4*† |
16,2 ± 1,2 |
|
|
♂+♀ |
88 ± 5* |
134 ± 6*† |
9,2 ± 0,3*† |
14,8 ± 0,8 |
|
|
1 Гр |
♂ |
96 ± 9 |
106 ± 8† |
8,9 ± 0,5† |
12,1 ± 0,9 |
|
♀ |
99 ± 8 |
95 ± 9† |
7,7 ± 0,4† |
12,5 ± 1,3*† |
|
|
♂+♀ |
98 ± 6 |
101 ± 6† |
8,3 ± 0,3† |
12,3 ± 0,8*† |
|
|
5 Гр |
♂ |
113 ± 10 |
104 ± 10† |
7,2 ± 0,6† |
14,9 ± 1,6 |
|
♀ |
111 ± 9† |
103 ± 9† |
7,9 ± 0,5† |
12,9 ± 1,1*† |
|
|
♂+♀ |
112 ± 7† |
104 ± 7† |
7,6 ± 0,4† |
13,9 ± 1,0 |
Таблица подготовлена авторами по собственным данным
Примечание: ♂ — самцы; ♀ — самки; * — статистически значимые отличия от показателя в группе биологического контроля, р < 0,05; † — статистически значимые отличия от значения показателя в группе 0 Гр, р < 0,05; ‡ — статистически значимые отличия в группах БК у мышей в возрасте 1 и 6 мес., р < 0,05.
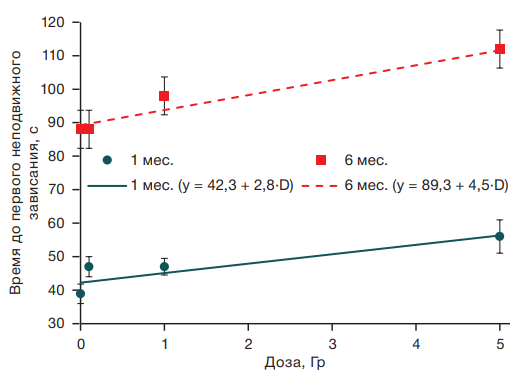
Рисунок подготовлен авторами по собственным данным
Рис. 1. Зависимость времени до первого неподвижного зависания от дозы гамма-облучения у мышей в возрасте 1 и 6 мес.
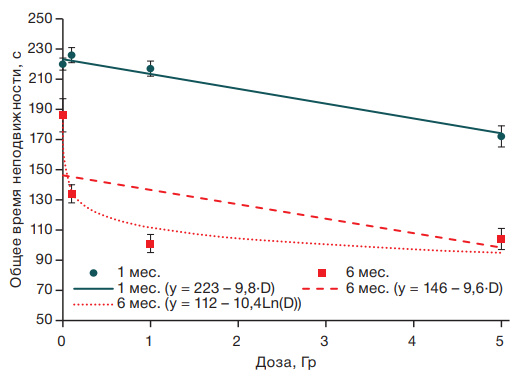
Рисунок подготовлен авторами по собственным данным
Рис. 2. Зависимость общего времени неподвижности от дозы гамма-облучения у мышей в возрасте 1 и 6 мес.
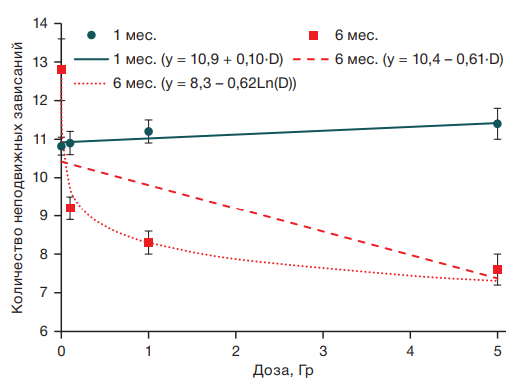
Рисунок подготовлен авторами по собственным данным
Рис. 3. Зависимость количества неподвижных зависаний от дозы гамма-облучения у мышей в возрасте 1 и 6 мес.
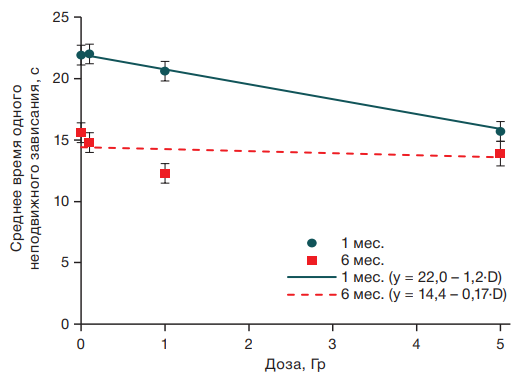
Рисунок подготовлен авторами по собственным данным
Рис. 4. Зависимость среднего времени одного неподвижного зависания от дозы гамма-облучения у мышей в возрасте 1 и 6 мес.
Таблица 3. Результаты оценки влияния различных факторов на показатели в тесте «удержание хвоста» с применением многофакторного дисперсионного анализа в обобщенной линейной модели
|
Факторы |
F |
Р |
Коэффициенты |
|
|
Время до первого зависания, с (R2 = 0,28) |
||||
|
Пол животных |
6,44 |
0,011 |
самцы: 8 ± 3; самки: 0 |
|
|
Возраст животных |
222,23 |
<0,001 |
1 мес.: 0 |
6 мес.: 49 ± 3 |
|
Стресс |
1,96 |
0,16 |
стресс–: 0 |
стресс+: 0 |
|
Доза облучения |
19,85 |
<0,001 |
D (3 ± 0,8) |
|
|
Стресс×Возраст |
4,59 |
0,032 |
стресс–, 1 мес.: 0 стресс+, 1 мес.: 0 |
стресс–, 6 мес.: 0 стресс+, 6 мес.: -16 ± 8 |
|
Общее время зависания, с (R2 = 0,356) |
||||
|
Пол животных |
0,027 |
0,87 |
самцы: 0 |
самки: 0 |
|
Возраст животных |
320,9 |
<0,001 |
1 мес.: 0 |
6 мес.: -75 ± 5 |
|
Стресс |
7,57 |
0,006 |
стресс–: 0 |
стресс+: 40 ± 8 |
|
Доза облучения |
73,42 |
<0,001 |
D (-9,4 ± 1,1) |
|
|
Стресс×возраст |
19,17 |
<0,001 |
стресс–, 1 мес.: 0 стресс+, 1 мес.: -49 ± 11 |
стресс–, 6 мес.: 0 стресс+, 6 мес.: 0 |
|
Количество зависаний (R2 = 0,126) |
||||
|
Пол животных |
0,004 |
0,95 |
самцы: 0 |
самки: 0 |
|
Возраст животных |
30,04 |
<0,001 |
1 мес.: 0 |
6 мес.: -0,5 ± 0,04 |
|
Стресс |
18,78 |
<0,001 |
стресс–: 0 |
стресс+: 2,9 ± 0,5 |
|
Доза облучения |
15,2 |
<0,001 |
D (-0,6 ± 0,1) |
|
|
Стресс×возраст |
15,79 |
<0,001 |
стресс–, 1 мес.: 0 стресс+, 1 мес.: 0 |
стресс–, 6 мес.: 0 стресс+, 6 мес.: -2,8 ± 0,7 |
|
Возраст×доза |
28,17 |
< 0,001 |
1 мес.: D (-0,5 ± 0,04) |
6 мес.: D · 0 |
|
Среднее время одного зависания, с (R2 = 0,126) |
||||
|
Пол животных |
0,002 |
0,97 |
самцы: 0 |
самки: 0 |
|
Возраст животных |
114,97 |
<0,001 |
1 мес.: 0 |
6 мес.: -5,7 ± 0,9 |
|
Стресс |
1,67 |
0,2 |
стресс–: 0 |
стресс+: 0 |
|
Доза облучения |
19,42 |
<0,001 |
D (-0,14 ± 0,021) |
|
|
Пол×возраст |
8,57 |
0,004 |
самцы, 1 мес.: 3,3 ± 1,1 самцы, 6 мес.: 0 |
самки, 1 мес.: 0 самки, 6 мес.: 0 |
|
Возраст×доза |
13,33 |
<0,001 |
1 мес.: D (-1,0 ± 0,27) |
6 мес.: D · 0 |
Таблица подготовлена авторами по собственным данным
Примечание: «стресс–» — отсутствие фактора стресса, связанного с облучением животных (группа БК); «стресс+» — наличие фактора стресса, связанного с облучением животных (группы 0; 0,1; 1; 5 Гр).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В проведенном исследовании выявлено, что фракционированное облучение в раннем возрасте приводило к дозозависимому снижению депрессивноподобного поведения у мышей в тесте удержания хвоста, максимально выраженному при облучении в суммарной дозе 5,2 Гр. На это указывает изменение всех показателей, регистрируемых в данном тесте: сокращается общее время неподвижности, интерпретируемое как поведение отчаяния; животные дольше предпринимают попытки освободиться из неприятного положения, прежде чем зависнут неподвижно впервые; снижается число таких актов неподвижного зависания и средняя длительность одного неподвижного зависания.
У животных в возрасте 6 мес. отмечены менее выраженные признаки депрессивноподобного поведения, чем в раннем возрасте: так, в группе биологического контроля общее время неподвижности с возрастом снизилось более чем в 2 раза, в 2,5 раза дольше мыши пытались активно освободиться, прежде чем впервые неподвижно зависли. При этом в полной мере сохранились выявленные ранее эффекты облучения: с возрастанием дозы облучения признаки депрессивноподобного поведения облученных животных снижались.
Данный эффект облучения оказался довольно неожиданным: при остром облучении в сопоставимых дозах в литературе описано развитие депрессивноподобного поведения у грызунов. Так, при облучении крыс в возрасте 3 сут в дозе 5 Гр через 120 суток отмечалось увеличение времени неподвижности в тесте удержания хвоста и тесте принудительного плавания Порсольта без изменения их общей двигательной активности [12]. В данном исследовании авторы выявили у облученных животных также гипоплазию гранулярного слоя зубчатой извилины гиппокампа, нарушение деления нейрональных стволовых клеток и изменение процесса их миграции и созревания, что может представлять собой физиологическую основу выявленных изменений поведения [12].
Важная роль изменений нейрогенеза в области зубчатой извилины гиппокампа в развитии постлучевой депрессии выявлена и при изучении эффектов прицельного облучения зубчатой извилины по сравнению с общим облучением головного мозга у мышей в возрасте 10 сут [10]. Здесь через 3 мес. после облучения показано усиление тревожности, выявляемой в приподнятом крестообразном лабиринте при остром облучении в дозах от 0,25 Гр, усиление тревожности, выявляемой в тесте закапывания стеклянных шариков, при остром облучении в дозах от 0,5 Гр, усиление проявлений депрессивного поведения в тесте принудительного плавания при остром облучении в дозах от 0,25 Гр. Более выраженными все эффекты были при прицельном облучении вентральной части зубчатой извилины.
При фракционированном рентгеновском облучении в кумулятивных дозах 0,4 и 0,5 Гр (разовая доза 0,1 Гр) у мышей отмечалось более тревожное поведение в тесте открытого поля [17]. При длительном моделировании хронического нейтронно-фотонного облучения выявлялось повышение тревожности у мышей в тесте открытого поля при накопленной за 600 суток облучения дозе 0,4 Гр [18]. Однако показано также и снижение выраженности эффектов при фракционировании дозы по сравнению с острым облучением: если острое облучение в дозе 5 Гр приводило к угнетению нейрогенеза в зубчатой извилине, дефициту обучения и памяти в тесте на контекстуальное обусловливание страха и памяти в тесте распознавания новых объектов, то при разделении этой дозы на 10 ежедневных фракций подобных поведенческих изменений не наблюдалось, а угнетение нейрогенеза было незначительным [19].
В наших же исследованиях фракционированное гамма-облучение в течение первого месяца жизни в суммарной дозе 5,2 Гр привело не только к снижению депрессивноподобного поведения, но и, как сообщалось ранее, к формированию наименее тревожного фенотипа: у облученных в этой дозе животных снижались показатели тревожности в приподнятом крестообразном лабиринте и тесте закапывания стеклянных шариков [20]. Повышение же тревожности и неофобного поведения отмечалось при облучении в кумулятивной дозе 0,1 Гр [20], что, однако, не сопровождается усилением проявлений депрессии.
Важно отметить выявленное влияние стресса, перенесенного в раннем возрасте, на развитие признаков депрессии в отдаленные сроки после завершения стрессового воздействия. Фактором стресса в данном исследовании выступают манипуляции в процессе облучения или его имитации, длящиеся в первый месяц жизни животных. Так, если в возрасте 1 мес. показатели депрессивноподобного поведения мышей в группе ложного облучения 0 Гр были близки к показателям интактных животных группы биологического контроля, то в возрасте 6 мес. отмечены существенные отличия, указывающие на развитие депрессивноподобного поведения у мышей группы ложного облучения. Эти результаты вполне соответствуют как результатам моделирования стресса в раннем возрасте у мышей [21], так и клиническим данным о повышении риска развития тревожных и депрессивных психопатологий у людей, перенесших психические травмы в детстве [22][23].
Однако, по полученным данным, у животных, подвергнутых и действию фактора стресса, и фракционированному облучению, показатели депрессивноподобного поведения снижаются дозозависимым образом вплоть до значений биологического контроля при облучении в дозе 5,2 Гр. Похожие результаты были получены в исследовании вызванной диазепамом депрессии у крыс, где рентгеновское облучение в дозе 3 Гр, разделенное на 6 фракций, привело к снижению депрессивной симптоматики и нормализации уровня нейротрансмиттеров [24].
Также в ряде работ были выявлены слабые нейропротективные эффекты однократного облучения в дозах до 0,1 Гр, такие как снижение признаков провоспалительной активации микроглии, повышение плотности нейронов в области зубчатой извилины гиппокампа, повышение функциональной активности митохондрий [1][25][26]. Подобные изменения со стороны зубчатой извилины гиппокампа могут лежать в основе описанной антидепрессивной симптоматики облученных животных.
Для прояснения механизмов выявленного антидепрессивноподобного действия фракционированного гамма-облучения необходимы дальнейшие исследования, которые, вероятно, должны быть направлены на изучение нейрогенеза и созревания нейронов в области зубчатой извилины гиппокампа.
ВЫВОДЫ
Выявлено дозозависимое изменение депрессивноподобного поведения у мышей при фракционированном облучении в первый мес. жизни (период активного созревания мозга), с увеличением суммарной дозы от 0,1 до 5 Гр показатели депрессивного поведения снижались. Данная закономерность показана как в ранний период сразу после завершения облучения (в возрасте 1 мес.), так и в отдаленные сроки (в возрасте 6 мес.).
Стресс, перенесенный в раннем возрасте, приводил к развитию депрессивноподобного поведения у взрослых необлученных мышей, но при одновременном воздействии стресса и фракционированного облучения в дозах 1–5 Гр показатели депрессивноподобного поведения мышей в возрасте 6 мес. не отличались от интактных животных.
Список литературы
1. Атаманюк НИ. Влияние средних и малых доз ионизирующего излучения на высшую нервную деятельность человека и животных. Медицина экстремальных ситуаций. 2023;25(3):5–13. https://doi.org/10.47183/mes.2023.029
2. Tanguturi SK, Alexander BM. Neurologic complications of radiation therapy. Neurol Clin. 2018; 36(3):599–625. https://doi.org/10.1016/s0733-8619(02)00031-2
3. Pasqual E, Boussin F, Bazyka D, Nordenskjold A, Yamada M, Ozasa K et al. Cognitive effects of low dose of ionizing radiation — Lessons learned and research gaps from epidemiological and biological studies. Environ Int. 2021;147:106295. https://doi.org/10.1016/j.envint.2020.106295
4. Loganovsky K, Marazziti D. Mental health and neuropsychiatric aftermath 35 years after the chernobyl catastrophe: current state and future perspectives. Clin Neuropsychiatry. 2021;18(2):101–6. https://doi.org/10.36131/cnfioritieditore20210204
5. Loganovsky KN, Masiuk SV, Buzunov VA, Marazziti D, Voychulene YS. Radiation risk analysis of neuropsychiatric disorders in ukrainian chornobyl catastrophe liquidators. Front Psychiatry. 2020;(11):553420. https://doi.org/10.3389/fpsyt.2020.553420
6. Contis G, Foley TP, Jr. Depression, suicide ideation, and thyroid tumors among ukrainian adolescents exposed as children to chernobyl radiation. J. Clin. Med. Res. 2015;(7):332–8. https://doi.org/10.14740/jocmr2018w
7. Балашов ПП, Буйков ВА, Колмогорова ВВ, Буртовая ЕЮ. Клинические варианты органических расстройств с депрессивными проявлениями у облученного населения в зоне радиационных аварий на Южном Урале. Сибирский вестник психиатрии и наркологии. 2009;(3):92–5.
8. Collett G, Craenen K, Young W, Gilhooly M, Anderson RM. The psychological consequences of (perceived) ionizing radiation exposure: a review on its role in radiation-induced cognitive dysfunction. Int J Radiat Biol. 2020;96(9):1104–18. https://doi.org/10.1080/09553002.2020.1793017
9. Njamnshi AK, Ahidjo N, Ngarka L, Nfor LN, Mengnjo MK, Njamnshi WY, et al. Characterization of the Cognitive and motor changes revealed by the elevated plus maze in an experimental rat model of radiation-induced brain injury. Adv Biomed Res. 2020;9:72. https://doi.org/10.4103/abr.abr_62_20
10. Dos Santos M, Kereselidze D, Gloaguen C, Benadjaoud MA, Tack K, Lestaevel P, Durand C. Development of whole brain versus targeted dentate gyrus irradiation model to explain low to moderate doses of exposure effects in mice. Sci Rep. 2018;8(1):17262. https://doi.org/10.1038/s41598-018-35579-x
11. Whoolery CW, Walker AK, Richardson DR, Lucero MJ, Reynolds RP, Beddow DH, et al. Whole-Body exposure to 28Siradiation dose-dependently disrupts dentate gyrus neurogenesis and proliferation in the short term and new neuron survival and contextual fear conditioning in the long term. Radiat Res. 2017;188(5):532–51. https://doi.org/10.1667/RR14797.1
12. Wang H, Ma Z, Shen H, Wu Z, Liu L, Ren B, et al. Early life irradiation-induced hypoplasia and impairment of neurogenesis in the dentate gyrus and adult depression are mediated by MicroRNA-34a-5p/T-Cell intracytoplasmic antigen-1 pathway. Cells. 2021;10(9):2476. https://doi.org/10.3390/cells10092476
13. Pitzer C, Kurpiers B, Eltokhi A. Sex differences in depression-like behaviors in adult mice depend on endophenotype and strain. Front Behav Neurosci. 2022;16:838122. https://doi.org/10.3389/fnbeh.2022.838122
14. Шишкина ЕА, Атаманюк НИ, Перетыкин АА, Пряхин ЕА. Дозы на весь организм и их неопределенность при облучении мышей на гамма-радиобиологической установке ИГУР1М. АНРИ. 2024;117(2):63–75. https://doi.org/0.37414/2075-1338-2024-117-2-63-75
15. Can A, Dao DT, Terrillion CE, Piantadosi SC, Bhat S, Gould TD. The tail suspension test. J Vis Exp. 2012;59:e3769. https://doi.org/10.3791/3769
16. R Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria, 2022. Available at: https://www.R-project.org.
17. Koturbash I, Jadavji NM, Kutanzi K, Rodriguez-Juarez R, Kogosov D, Metz GAS, et al. Fractionated low-dose exposure to ionizing radiation leads to DNA damage, epigenetic dysregulation, and behavioral impairment. Environ Epigenet. 2017;2(4):dvw025. https://doi.org/10.1093/eep/dvw025
18. Perez RE, Younger S, Bertheau E, Fallgren CM, Weil MM, Raber J. Effects of chronic exposure to a mixed field of neutrons and photons on behavioral and cognitive performance in mice. Behav Brain Res. 2020;379:112377. https://doi.org/10.1016/j.bbr.2019.112377
19. Tang FR, Loke WK, Wong P, Khoo BC. Radioprotective effect of ursolic acid in radiation-induced impairment of neurogenesis, learning and memory in adolescent BALB/c mouse. Physiol Behav. 2017;175:37–46. https://doi.org/10.1016/j.physbeh.2017.03.027
20. Атаманюк НИ, Обвинцева НА, Перетыкин АА, Пряхин ЕА. Зависимость тревожного поведения у мышей от дозы при фракционированном гамма-облучении в первый месяц жизни. Бюллетень экспериментальной биологии и медицины. 2023;176(12):698–702. https://doi.org/10.47056/0365-9615-2023-176-12-698-702
21. He T, Guo C, Wang C, Hu C, Chen H. Effect of early life stress on anxiety and depressive behaviors in adolescent mice. Brain Behav. 2020;10(3):e01526. https://doi.org/10.1002/brb3.1526
22. Ochi S, Dwivedi Y. Dissecting early life stress-induced adolescent depression through epigenomic approach. Mol Psychiatry. 2023;28(1):141–53. https://doi.org/10.1038/s41380-022-01907-x
23. Juruena MF. Early life stress, depression and epigenetics. Vitam Horm. 2023;(122):307–37. https://doi.org/10.1016/bs.vh.2023.01.004
24. Kaur A, Singla N, Dhawan DK. Low dose X-irradiation mitigates diazepam induced depression in rat brain. Regul Toxicol Pharmacol. 2016;(80):82–90. https://doi.org/10.1016/j.yrtph.2016.06.004
25. Casciati A, Dobos K, Antonelli F, Benedek A, Kempf SJ, Belles M et al. Age-related effects of X-ray irradiation on mouse hippocampus. Oncotarget. 2016;7(19):28040–58. https://doi.org/10.18632/oncotarget.8575
26. Ung MC, Garrett L, Dalke C, Leitner V, Dragosa D, Hladik D et al. Dose-dependent long-term effects of a single radiation event on behaviour and glial cells. Int J Radiat Biol. 2021;97(2):156–69. https://doi.org/10.1080/09553002.2021.1857455
Об авторах
Н. А. ОбвинцеваРоссия
Обвинцева Надежда Александровна
Челябинск
Н. И. Атаманюк
Россия
Атаманюк Наталья Игоревна, канд. биол. наук
Челябинск
И. А. Шапошникова
Россия
Шапошникова Ирина Александровна, канд. биол. наук
Челябинск
А. А. Перетыкин
Россия
Перетыкин Андрей Анатольевич
Челябинск
Е. А. Пряхин
Россия
Пряхин Евгений Александрович, д-р биол. наук, профессор
Челябинск
Дополнительные файлы
Рецензия
Для цитирования:
Обвинцева Н.А., Атаманюк Н.И., Шапошникова И.А., Перетыкин А.А., Пряхин Е.А. Оценка депрессивноподобного поведения у мышей после фракционированного гамма-облучения. Медицина экстремальных ситуаций. 2024;26(3):30-39. https://doi.org/10.47183/mes.2024-26-3-30-39
For citation:
Obvintseva N.A., Atamanyuk N.I., Shaposhnikova I.A., Peretykin A.A., Pryakhin E.A. Assessment of depression-like behavior in mice after fractional gamma irradiation. Extreme Medicine. 2024;26(3):30-39. https://doi.org/10.47183/mes.2024-26-3-30-39

















