Перейти к:
Влияние комбинаций антибиотиков, фагов и деполимеразы на биопленки лекарственно-устойчивого штамма Klebsiella pneumoniae
https://doi.org/10.47183/mes.2024-26-4-58-65
Аннотация
Введение. Klebsiella pneumoniae представляет серьезную угрозу глобальному здравоохранению из-за высокой доли изолятов с множественной лекарственной устойчивостью. Более того, формирование бактерией биопленок значительно усложняет лечение инфекций.
Цель. Оценка эффективности индивидуального и комбинированного действия антибиотиков и бактериофагов или полисахарид-деполимеразы на биопленки клинически значимого штамма K. pneumoniae.
Материалы и методы. В работе использовали штамм K. pneumoniae с множественной лекарственной устойчивостью 9faiz, 4 антибиотика различных классов (гентамицин, левофлоксацин, меропенем и хлорамфеникол), 3 бактериофага различных родов (Dlv622, Seu621 и FRZ284) и 1 полисахарид-деполимеразу (Dep622). Эксперименты проводили на сформированных биопленках путем обработки 24-часовых пленок K. pneumoniae антимикробными агентами индивидуально или в комбинациях. Способность штамма образовывать биопленки оценивали окрашиванием кристаллическим фиолетовым. Сравнение между средними значениями оптической плотности проводилось с помощью t-теста и считалось значимым при p ≤ 0,05.
Результаты. Индивидуальное применение антибиотиков в пиковых концентрациях (Cmax) или деполимеразы в концентрации 100 МДК (минимальная действующая концентрация) не приводило к значимому снижению биомассы биопленки, тогда как бактериофаги в титре 5×109 БОЕ/мл статистически значимо снижали ее биомассу на 27–31% (p ≤ 0,05). Большинство комбинаций фагов и антибиотиков не приводило к значимому повышению эффективности разрушения биопленок; лишь сочетание фага FRZ284 с гентамицином статистически значимо показало дополнительное снижение биомассы биопленки на 27% (p ≤ 0,05). Комбинации деполимеразы со всеми антибиотиками, кроме меропенема, приводили к значимому увеличению биомассы биопленки на 27–39% (p ≤ 0,05).
Выводы. Результаты показывают необходимость индивидуального подбора антимикробных комбинаций для борьбы с биопленками K. pneumoniae из-за возможного влияния эффектов синергии и антагонизма на исход терапии.
Ключевые слова
Для цитирования:
Кривуля А.О., Городничев Р.Б., Корниенко М.А., Абдраймова Н.К., Малахова М.В., Зайчикова М.В., Шитиков Е.А. Влияние комбинаций антибиотиков, фагов и деполимеразы на биопленки лекарственно-устойчивого штамма Klebsiella pneumoniae. Медицина экстремальных ситуаций. 2024;26(4):58-65. https://doi.org/10.47183/mes.2024-26-4-58-65
For citation:
Krivulia A.O., Gorodnichev R.B., Kornienko M.A., Abdraimova N.K., Malakhova M.V., Zaychikova M.V., Shitikov E.A. Effect of combinations of antibiotics, phages, and depolymerase on biofilms of the drug-resistant Klebsiella pneumoniae strain. Extreme Medicine. 2024;26(4):58-65. https://doi.org/10.47183/mes.2024-26-4-58-65
ВВЕДЕНИЕ
Klebsiella pneumoniae — условно патогенная грамотрицательная бактерия, представляющая серьезную угрозу для глобального здравоохранения из-за стремительного распространения штаммов с множественной лекарственной устойчивостью (МЛУ). Резистентные штаммы вызывают значительное число нозокомиальных инфекций, таких как пневмония, инфекции мочевыводящих путей и кровотока, характеризующихся высоким уровнем смертности, достигающим 50% [1].
Терапия инфекций, вызванных K. pneumoniae, затруднена в связи со способностью патогена образовывать биопленки. Биопленки представляют собой организованные сообщества микроорганизмов, прикрепленные к различным биотическим и абиотическим субстратам посредством экзополимерной матрицы, состоящей из белков, полисахаридов и внеклеточной ДНК. По данным исследований, около 60–80% хронических инфекций связано с образованием биопленок [2]. Кроме того, биопленки часто формируются на инвазивных медицинских изделиях, что увеличивает риск развития острых инфекций у пациентов, находящихся на стационарном лечении [3].
Клетки внутри биопленок характеризуются замедленным метаболизмом и сниженной скоростью роста, а также повышенной частотой горизонтального переноса мобильных генетических элементов. Последние часто содержат гены вирулентности и устойчивости к антибиотикам, что позволяет клеткам биопленки эффективнее противостоять антимикробным препаратам и избегать иммунного ответа организма хозяина. В совокупности такие особенности увеличивают устойчивость биопленок к антибиотикам в 100–1000 раз по сравнению с планктонными формами микроорганизмов [2][4]. Вследствие этого стандартные схемы антибиотикотерапии демонстрируют недостаточную эффективность в отношении инфекций, ассоциированных с биопленками, что обусловливает необходимость разработки новых терапевтических подходов.
Одним из перспективных подходов для борьбы с биопленками является применение бактериофагов или их производных, таких как полисахарид-деполимеразы. Бактериофаги способны деградировать внеклеточный матрикс биопленок за счет действия полисахарид-деполимераз, что нарушает целостность структуры биопленки и повышает чувствительность бактерий к антимикробным препаратам и факторам окружающей среды [5]. Это открывает возможности для использования бактериофагов как самостоятельных терапевтических агентов, а также в комбинации с клинически применяемыми антибиотиками.
Совместное использование антимикробных агентов может приводить к различным типам взаимодействия, включая синергизм, аддитивный эффект или антагонизм. Синергизм наблюдается в тех случаях, когда совокупный эффект от применения нескольких антимикробных агентов превосходит сумму их индивидуальных воздействий. Аддитивный эффект подразумевает, что суммарное действие агентов равно сумме их отдельных эффектов, то есть они не влияют на эффективность друг друга. Антагонизм характеризуется тем, что общий эффект комбинации антимикробных агентов меньше суммы их индивидуальных воздействий, и свидетельствует о том, что действие одного из них каким-то образом препятствует действию другого [6].
На планктонных клетках было показано, что фаги или полисахарид-деполимеразы в сочетании с антибиотиками демонстрируют преимущественно синергизм, приводящий к более эффективной элиминации бактерий по сравнению с монотерапией антимикробными препаратами [4][7–9]. Однако в ряде публикаций также сообщается, что некоторые комбинации антибактериальных препаратов демонстрируют антагонистическое взаимодействие [7][10]. Тем не менее влияние таких комбинаций на биопленки остается недостаточно изученным, что подчеркивает необходимость углубленного исследования возможных эффектов, возникающих при сочетанном действии фагов и их ферментов с антибиотиками.
Цель исследования: оценка эффективности индивидуального и комбинированного действия антибиотиков и бактериофагов или полисахарид-деполимеразы на биопленки клинически значимого штамма K. pneumoniae.
МАТЕРИАЛЫ И МЕТОДЫ
Бактериальные штаммы
Исследование проведено на штамме K. pneumoniae 9faiz из коллекции лаборатории молекулярной генетики микроорганизмов Федерального научно-клинического центра физико-химической медицины им. академика Ю.М. Лопухина ФМБА России. Штамм, высеянный из биологического материала в 2019 году, принадлежал к капсульному типу KL23 и клинически значимому сиквенс-типу ST39, что было определено ранее согласно стандартным методам типирования [11][12].
Бактериальную культуру выращивали на лизогенном бульоне (LB, от англ. lysogeny broth) в модификации Lennox («Диа-М», Россия). Культуру бактерий инкубировали в течение 18 ч при температуре 37 °C.
Минимальная ингибирующая концентрация (МИК) антибиотиков определялась методом микроразведений в соответствии с российскими рекомендациями «Определение чувствительности микроорганизмов к антимикробным препаратам» [13], согласно которым микроорганизмы классифицируются как чувствительные при стандартном режиме дозирования (S: МИК ≤ пограничное значение чувствительности), чувствительные при увеличенной экспозиции антимикробного препарата промежуточные (I: пограничное значение < МИК ≤ пограничное значение) или устойчивые (R: МИК > граничное значение) (табл. 1). Ингибирующее действие антибиотиков оценивалось с помощью планшетного спектрофотометра FlexA-200 (Allsheng, КНР) на основании оптической плотности (OD, от англ. optical density) бактериальной культуры при длине волны 620 нм. Для работы использовались антибактериальные препараты четырех классов: аминогликозиды — гентамицин (GEN), фторхинолоны ІІІ поколения — левофлоксацин (LVX), карбапенемы — меропенем (MEM) и амфениколы — хлорамфеникол (CMP), набор реактивов HiMedia (Индия).
Штаммы K. pneumoniae Kp9068 и K. pneumoniae Kp284 использовались в качестве штаммов-хозяев для наращивания фаговых лизатов [14][15].
Таблица 1. Границы чувствительности K. pneumoniae к антибиотикам и максимально допустимые концентрации этих препаратов в сыворотке крови
Антибактериальный препарат | Границы чувствительности, мкг/мл | Пиковая концентрация антибиотика в сыворотке (Cmax), мкг/мл | ||
≤S | I | R≥ | ||
Гентамицин | 4 | 8 | 16 | 16 [16] |
Левофлоксацин | 2 | 4 | 8 | 6 [17] |
Меропенем | 1 | 2 | 4 | 28 [18] |
Хлорамфеникол | 8 | 16 | 32 | 25 [19] |
Таблица подготовлена авторами по собственным данным
Бактериофаги
В работе использовали три ранее описанных бактериофага K. pneumoniae: Dlv622, Seu621 и FRZ284 (GenBank MT939252, MT939253 и MZ602148), относящихся к родам Drulisvirus, Mydovirus и Jiaodavirus соответственно [14][15]. Фаги Dlv622 и Seu621 обладают капсульной специфичностью, а FRZ284 характеризуется широким спектром хозяев и не связан с капсульным типом. Для постановки экспериментов использовались фаговые лизаты в бульоне LB, стерилизованные фильтрацией через шприцевой фильтр 0,22 мкм (Merk, Millipor). Готовые стерильные лизаты хранились в холодильнике при температуре +4 °С.
Титр фагов определяли методом спот-тестирования [20]. Способность фагов заражать и лизировать исследуемый штамм анализировали на основании расчета эффективности посева (EOP, от англ. efficiency of plating) в соответствии со стандартной методикой [21]. Величину EOP вычисляли как отношение титра бактериофага на исследуемом штамме к титру фага на штамме-хозяине. Если фаг не образовывал единичных бляшек, а вызывал появление ореола на поверхности чашек Петри, который исчезал при уменьшении концентрации фага, это явление мы называли лизисом извне. Литическую активность фагов измеряли с помощью титрования по Аппельману согласно классической методике с модификациями [22]. Суспензию бактериофагов последовательно разводили десятикратно в бульоне LB. Затем по 190 мкл каждого разведения добавляли в лунки плоскодонного вентилируемого 96-луночного планшета (Thermo Scientific, Дания) и инокулировали 10 мкл (5×10⁵ КОЕ/мл) бактериальной культуры на логарифмической стадии роста (OD600 = 0,3), дополнительно разведенной в 100 раз свежим бульоном LB. После 24-часовой инкубации планшета при 37 °C измеряли оптическую плотность при длине волны 620 нм с использованием планшетного спектрофотометра FlexA200. Титр по Аппельману определяли как наибольшее разведение фагового лизата, при котором оптическая плотность не увеличивалась по сравнению с отрицательным контролем, что указывало на отсутствие видимого роста бактерий.
Полисахарид-деполимераза
В работе использовали рекомбинантную полисахарид-деполимеразу Dep622 хвостовой фибриллы бактериофага Dlv622, полученную в виде очищенного белка, как описано ранее [14]. Способность Dep622 к деградации капсульных полисахаридов штамма 9faiz оценивали по методике, аналогичной титрованию бактериофагов. Для этого суспензию рекомбинантной полисахарид-деполимеразы серийно разводили в среде LB с шагом 2 (1392,64-0,085 мкг/мл). Полужидкий LB-агар (LB-бульон с добавлением 0,7% агарозы), содержащий 100 мкл ночной культуры исследуемого штамма, распределяли по поверхности чашки Петри. Аликвоты (5 мкл) каждого разведения наносили на поверхность агара и оставляли до высыхания капель. Чашки Петри инкубировали при температуре 37 °C в течение 24 ч. На сформированном бактериальном газоне в местах нанесения фермента определяли появление полупрозрачных пятен, увеличивающихся в диаметре после 48 ч инкубации, что свидетельствовало о ферментативной активности деполимеразы. Минимальная действующая концентрация (МДК) определялась как концентрация последнего разведения, при которой еще наблюдалось действие фермента.
Метод оценки эффективности биопленкообразования
Биопленки штамма 9faiz выращивали в 96-луночном планшете. Для этого в каждую лунку вносили по 190 мкл питательной среды LB и инокулировали 10 мкл (5×10⁵ КОЕ/мл) бактериальной культуры на логарифмической стадии роста (OD600 = 0,3), дополнительно разведенной в 100 раз свежим бульоном LB. В качестве отрицательного контроля для оценки отсутствия роста бактериальной культуры использовали чистую среду LB. Планшет инкубировали в термостате в течение 24 часов при 37 °C. По завершении инкубации среду удаляли, а биопленки отмывали от остатков планктонных клеток, трижды промывая стерильным физиологическим раствором (0,9%). Полученные биопленки окрашивали раствором кристаллического фиолетового в соответствии со стандартной методикой [23]. Биопленку инкубировали с 0,1% водно-спиртовым раствором кристаллического фиолетового («Химмед», Россия) в течение 30 мин при комнатной температуре. После инкубации несвязанный краситель удаляли тройным промыванием дистиллированной водой. Для последующего анализа связанный краситель в каждой лунке элюировали добавлением 200 мкл 96% этанола и измеряли оптическую плотность раствора на спектрофотометре FlexA200 при длине волны 575 нм. По результатам измерения оптической плотности оценивали и классифицировали способность штамма образовывать биопленки следующим образом: не образующие биопленки (OD ≤ ODc), слабо (ODc < OD ≤ 2×ODc), умеренно (2×ODc < OD ≤ 4×ODc) или обильно (OD > 4×ODc) образующие биопленки. Порог оптической плотности (ODc, от англ. optical density cut-off) определялся как среднее арифметическое значение оптической плотности отрицательного контроля плюс три стандартных отклонения [23].
Изучение индивидуального и комбинированного воздействия антибиотиков и бактериофагов/полисахарид-деполимераз
Биопленки штамма 9faiz выращивали и отмывали по ранее описанному алгоритму, после чего среду меняли на свежую среду LB, содержащую исследуемые антибиотики, фаги или деполимеразу, как по отдельности, так и в комбинациях. Концентрации антибиотиков соответствовали пиковой концентрации (Cmax), достигаемой в сыворотке крови после введения стандартной терапевтической дозы (табл. 1). Фаговый лизат добавляли в концентрации 5×10⁹ БОЕ/мл, а рекомбинантную полисахарид-деполимеразу — в дозировке 100 МДК (68 мг/мл). Количества антимикробных агентов подбирались из расчета на объем лунки 200 мкл.
Для положительного контроля роста бактериальной культуры в условиях отсутствия антимикробного воздействия использовали среду LB без добавок. В случае индивидуального воздействия добавляли один антибактериальный агент, а для комбинированного — попарно антибиотик и бактериофаг или деполимеразу (всего 16 сочетаний). Инкубация биопленок с антимикробными агентами проводилась 24 ч, после чего биопленки промывали и окрашивали кристаллическим фиолетовым, как описано выше.
Оптическую плотность окрашенных биопленок измеряли при на спектрофотометре FlexA200 при длине волны 575 нм. Все эксперименты проводились в трех биологических повторностях, каждая из которых включала пять технических повторов для каждой комбинации.
Нормальность распределения проверяли тестом Шапиро — Уилка. Статистическая значимость и достоверность различий определялись t-критерием Стьюдента. Различие между средними считалось значимым при p ≤ 0,05. Анализ и визуализация данных выполнялись с использованием программного пакета GraphPad Prism 8.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Характеристика штамма и его устойчивости к антимикробным агентам
Планктонные клетки штамма 9faiz демонстрировали устойчивость ко всем исследуемым антибиотикам. Значения МИК для гентамицина составили 128 мкг/мл, для левофлоксацина — 128 мкг/мл, для меропенема — 32 мкг/мл, и для хлорамфеникола — 128 мкг/мл. Также 9faiz был охарактеризован как штамм, обильно образующий биопленки.
Бактериофаги Dlv622 и Seu621 показали низкую эффективность посева на штамме 9faiz (EOP = 0,01). При титровании по Аппельману Dlv622 и Seu621 в концентрациях 5×10⁹ БОЕ/мл также проявляли слабую активность, не подавляя полностью рост планктонных клеток. FRZ284 при определении эффективности посева показывал лизис извне, однако при титровании по Аппельману в концентрации 5×10⁹ БОЕ/мл на 80% подавлял бактериальный рост.
Рекомбинантная деполимераза Dep622, нанесенная на бактериальный газон штамма 9faiz, образовывала полупрозрачные зоны, напоминающие ореол фаговой бляшки, что свидетельствовало о ферментативной активности. На основании результатов МДК Dep622 была определена как 0,68 мкг/мл.
Индивидуальное и комбинированное действие антимикробных агентов на биопленки
При индивидуальном применении бактериофагов Dlv622, Seu621 или FRZ284 в концентрации 5×10⁹ БОЕ/мл биомасса биопленки статистически значимо снижалась на 27–30% по сравнению с контролем (рис. 1). В то же время применение антибиотиков в Cmax концентрациях или деполимеразы Dep622 в 100 МДК не приводило к значимому разрушению биопленки.
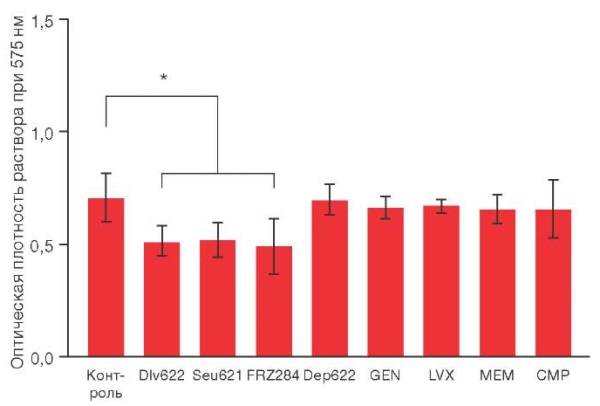
Рисунок подготовлен авторами по собственным данным
Рис. 1. Изменение биомассы биопленки штамма K. pneumoniae при индивидуальном действии различных антибактериальных агентов. * p ≤ 0,05
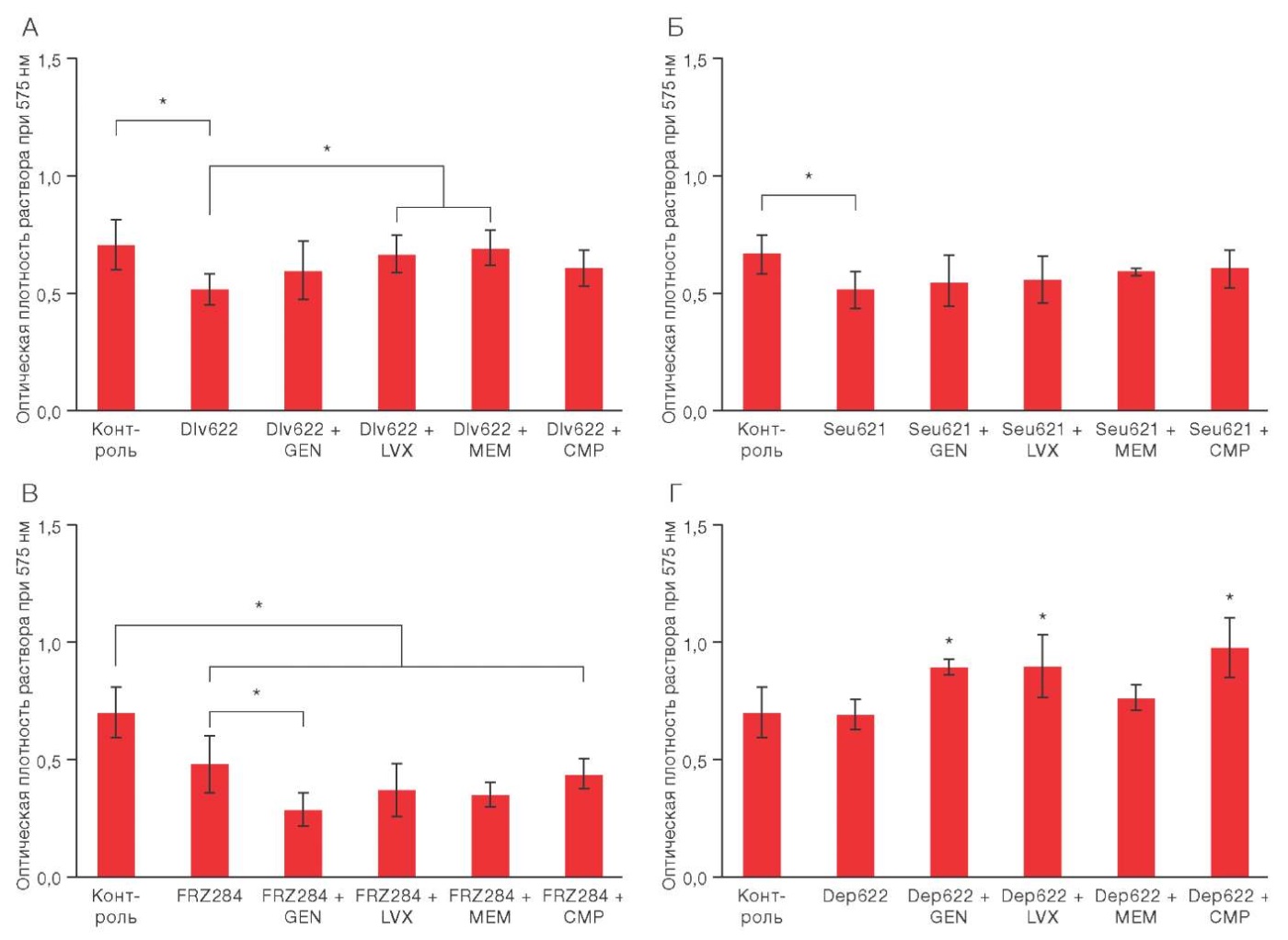
Рисунок подготовлен авторами по собственным данным
Рис. 2. Изменение биомассы биопленки K. pneumoniae 9faiz при комбинированном действии различных антибактериальных агентов. * p ≤ 0,05
Комбинированное применение бактериофага Dlv622 с исследуемыми антибиотиками не приводило к статистически значимому снижению биомассы биопленки по сравнению с контролем (рис. 2А). Однако сочетание Dlv622 с левофлоксацином или меропенемом показало статистически значимые отличия от индивидуального действия фага, снижая его эффективность на 30 и 34% соответственно, что свидетельствовало о возможном антагонистическом взаимодействии этих антимикробных агентов.
Использование бактериофага Seu621 с исследуемыми антибиотиками не приводило к изменению биомассы биопленки: результаты статистически значимо не отличались ни от индивидуального действия фага, ни от контроля (p = 0,05) (рис. 2Б).
Комбинированное использование FRZ284 с левофлоксацином, меропенемом или хлорамфениколом статистически значимо снижало биомассу биопленки по сравнению с контролем, однако эти результаты не отличались от индивидуального действия фага (рис. 2В). В сочетании с гентамицином FRZ284 показал значительное снижение биомассы биопленки на 58% относительно контроля и на 39% по сравнению с индивидуальным действием фага, что свидетельствует о синергетическом (предположительно) потенцировании между фагом и антибиотиком.
Деполимераза Dep622 в сочетании с гентамицином, левофлоксацином и хлорамфениколом значимо увеличивала биомассы биопленок на 27, 28 и 39% соответственно по сравнению с контролем и индивидуальным действием фермента, что указывает на потенциальный антагонизм между исследуемыми антимикробными агентами (рис. 2Г). Комбинация Dep622 с меропенемом статистически значимо не повлияла на биомассу биопленки по сравнению с контролем и индивидуальным действием фермента.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование проводилось на штамме K. pneumoniae 9faiz, относящемся к капсульному типу KL23, часто ассоциируемому с устойчивостью к карбапенемам. Среди изолятов, продуцирующих карбапенемазы, доля KL23 может достигать 9–17% [24]. Кроме того, штамм принадлежал к сиквенс-типу ST39, который характеризовался высокой устойчивостью к карбапенемам и был связан с несколькими вспышками карбапенем-резистентных штаммов K. pneumoniae в России и Греции [25]. Тесты на антибиотикорезистентность продемонстрировали устойчивость K. pneumoniae 9faiz к четырем основным классам антибиотиков, применяемых для лечения клебсиеллезной инфекции: аминогликозидам, фторхинолонам, карбапенемам и хлорамфениколам. Также штамм обладал выраженной способностью к формированию биопленок, что дополнительно подчеркивает его патогенность и устойчивость к терапевтическому воздействию стандартными дозами антибиотиков.
С целью выявления широкого спектра эффектов для исследования использовались бактериофаги, принадлежащие к различным таксономическим группам: Dlv622 (Autographiviridae, Slopekvirinae, Drulisvirus), Seu621 (Vequintavirinae, Mydovirus) и FRZ284 (Straboviridae, Tevenvirinae, Jiaodavirus). Бактериофаги Dlv622 и Seu621 имеют гомологичные рецептор-связывающие белки, представленные полисахарид-деполимеразами, специфичными в отношении штаммов K. pneumoniae с капсульным типом KL23 [14]. Напротив, бактериофаг FRZ284 лизирует штаммы K. pneumoniae независимо от капсульного типа и имеет рецептор-связывающий белок неизвестной специфичности [15]. Для исследования чувствительности штамма 9faiz бактериофаги использовались в концентрации 5×10⁹ БОЕ/мл, которая считается стандартной терапевтической дозой [26]. Результаты титрования по Аппельману показали, что данной дозы недостаточно для полного подавления роста планктонных клеток. Кроме того, оценка эффективности посева выявила, что фаги Dlv622 и Seu621 размножаются на штамме 9faiz в 100 раз хуже, чем на штамме-хозяине, в то время как фаг FRZ284 демонстрирует исключительно лизис извне.
Ввиду устойчивости штамма 9faiz к исследуемым антибиотикам и недостаточной чувствительности к бактериофагам монотерапия антимикробными агентами оказалась малоэффективной для разрушения биопленок, что было подтверждено в ходе настоящего исследования. Индивидуальное воздействие бактериофагов уменьшало биомассу биопленок, но не приводило к их полному разрушению (рис. 1). Антибиотики статистически значимо не изменяли биомассу биопленки, что объясняется использованием низких концентраций антимикробных агентов. Для эксперимента были выбраны концентрации антибиотиков значительно ниже МИК, но соответствующие пиковым концентрациям антибиотика в сыворотке крови человека (табл. 1). Несмотря на высокую устойчивость биопленок к антибиотикам, превышение концентрации Cmax является неприемлемым в рамках практической терапии из-за потенциального токсического действия. Это подчеркивает необходимость учитывать данный фактор при подборе соответствующих концентраций антибиотиков для исследований in vitro.
Недостаточная эффективность индивидуального применения антимикробных агентов подчеркивает необходимость их комбинированного использования. В существующих на данный момент исследованиях установлено, что комбинация антибиотиков и бактериофагов против биопленок демонстрирует более высокую эффективность по сравнению с монотерапией. Так, в нескольких работах было показано, что сочетание бактериофагов с ципрофлоксацином [27], амоксициллином или фосфомицином [9] проявляет синергетический эффект при разрушении биопленок K. pneumoniae. Результаты настоящего исследования также выявили один случай потенциального синергизма. Комбинированное применение бактериофага FRZ284 с гентамицином статистически значимо снижало биомассу биопленки штамма 9faiz по сравнению с индивидуальным использованием бактериофага (рис. 2В). Для антибиотиков класса аминогликозидов, к которым относится гентамицин, ранее были предложены механизмы подавления репликации бактериофагов [10], что может приводить к антагонизму. Согласно нашим результатам, действие гентамицина, вероятно, не нарушало репликативный цикл фага, что может объяснять наблюдаемую синергию и выявленные расхождения с ранее описанными исследованиями. Хотя в литературе отсутствуют данные о синергии антибиотиков и Т4-подобных бактериофагов K. pneumoniae, к числу которых относится FRZ284, подобные случаи были описаны для комбинаций меропенема, ципрофлоксацина и колистина с Т4-подобными фагами Acinetobacter baumannii [28].
Кроме того, в рамках проведенных экспериментов были выявлены два случая антагонизма при комбинированном применении бактериофага Dlv622 с левофлоксацином или меропенемом (рис. 2А). Несмотря на наличие в литературе данных о синергетическом взаимодействии антибиотиков и бактериофагов, антагонистические эффекты, выявленные для использованных в данной работе комбинаций антимикробных препаратов против биопленок K. pneumoniae, ранее не описывались. Поскольку левофлоксацин ингибирует ДНК-гиразу и топоизомеразу IV, полученные результаты могут свидетельствовать о снижении скорости репликации ДНК бактериофага Dlv622. Левофлоксацин также способен стимулировать образование более толстой биопленки у K. pneumoniae [2], что может затруднять проникновение бактериофага и снижать эффективность его действия. При этом ингибирование литической активности бактериофага меропенемом, блокирующим синтез клеточной стенки, остается трудным для объяснения из-за недостаточного понимания механизма этого эффекта.
Для остальных сочетаний антибиотиков и бактериофагов статистическая значимость не позволила судить об эффекте, однако, ориентируясь на средние значения, можно отметить, что комбинации с бактериофагами Dlv622 и Seu621 приводили скорее к снижению эффективности разрушения биопленок. Напротив, сочетания антибиотиков с бактериофагом FRZ284 просто не привели к повышению эффективности. Полученные результаты свидетельствуют о необходимости более тщательного подхода к подбору антибиотиков и бактериофагов для целей терапии.
В работе также была оценена эффективность разрушения биопленок посредством индивидуального воздействия полисахарид-деполимеразы и в сочетании с антибиотиками. Для этого использовался рекомбинантный белок Dep622, рецептор-связывающий белок фага Dlv622, который эффективно разрушал капсульные полисахариды штамма K. pneumoniae 9faiz в тестах in vitro. Ввиду применения рекомбинантных полисахарид-деполимераз исключительно в лабораторных исследованиях на сегодняшний день в литературе отсутствуют стандартизированные терапевтические дозировки для ферментов данной группы. Тем не менее эксперименты на животных моделях не выявили токсических эффектов при использовании деполимераз в различных концентрациях [4]. В связи с этим в настоящем исследовании применялась максимальная кратная доза (100 МДК), которую можно было достичь в лунке планшета без значительного разбавления среды.
В литературе данные относительно комбинации полисахарид-деполимеразы с антибиотиками показывали как эффекты синергии, так и отсутствие каких-либо эффектов [29, 30]. Полученные в ходе работы результаты продемонстрировали, что индивидуального действия Dep622 недостаточно для разрушения биопленок штамма 9faiz. Более того, сочетание полисахарид-деполимеразы с гентамицином, левофлоксацином и хлорамфениколом достоверно значимо увеличивало биомассу биопленки (рис. 2Г), что указывает на возможный антагонизм между антимикробными агентами. Подобные эффекты антагонизма между деполимеразами и антибиотиками ранее не были описаны и требуют дальнейшего изучения.
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования продемонстрировали неэффективность монокомпонентных подходов и выявили разнообразие эффектов, возникающих при комбинированном применении антибиотиков и бактериофагов или полисахарид-деполимеразы против биопленок. В частности, был выявлен один случай синергии и несколько случаев потенциального антагонизма между антимикробными агентами, который недостаточно освещен в существующей литературе.
Принимая во внимание, что в настоящее время терапия бактериофагами не подразумевает отмены курса антибиотиков, потенциальный антагонизм между двумя антимикробными агентами может стать существенной проблемой в терапии инфекций, ассоциированных с биопленками, что подчеркивает необходимость дальнейших исследований в этом направлении.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.О. Кривуля — разработка концепции исследования, обработка и визуализация данных, написание текста статьи; Р.Б. Городничев — методологическое обеспечение, обработка экспериментальных данных, участие в подготовке статьи; М.А. Корниенко — планирование экспериментальной части, сбор и участие в анализе данных; Н.К. Абдраймова — проведение экспериментов, обработка данных; М.В. Малахова — сбор данных для исследования; М.В. Зайчикова — участие в сборе данных; Е.А. Шитиков — управление процессом исследования, выполнение аналитической части, редактирование текста статьи.
Список литературы
1. Han YL, Wen XH, Zhao W, Cao XS, Wen JX, Wang JR, et al. Epidemiological characteristics and molecular evolution mechanisms of carbapenem-resistant hypervirulent Klebsiella pneumoniae. Front Microbiol. 2022;13:1003783. https://doi.org/10.3389/fmicb.2022.1003783
2. Li L, Gao X, Li M, Liu Y, Ma J, Wang X, et al. Relationship between biofilm formation and antibiotic resistance of Klebsiella pneumoniae and updates on antibiofilm therapeutic strategies. Front Cell Infect Microbiol. 2024;14:1324895. https://doi.org/10.3389/fcimb.2024.1324895
3. Mishra SK, Basukala P, Basukala O, Parajuli K, Pokhrel BM, Rijal BP. Detection of Biofilm Production and Antibiotic Resistance Pattern in Clinical Isolates from Indwelling Medical Devices. Curr Microbiol. 2015;70(1):128–34. https://doi.org/10.1007/s00284-014-0694-5
4. Guo Z, Liu M, Zhang D. Potential of phage depolymerase for the treatment of bacterial biofilms. Virulence. 2023;14(1):2273567. https://doi.org/10.1080/21505594.2023.2273567
5. Chang C, Yu X, Guo W, Guo C, Guo X, Li Q, et al. BacteriophageMediated Control of Biofilm: A Promising New Dawn for the Future. Front Microbiol. 2022;13:825828. https://doi.org/10.3389/fmicb.2022.825828
6. Gu Liu C, Green SI, Min L, Clark JR, Salazar KC, Terwilliger AL, et al. Phage-Antibiotic Synergy Is Driven by a Unique Combination of Antibacterial Mechanism of Action and Stoichiometry. mBio. 2020;11(4):e01462-20. https://doi.org/10.1128/mbio.01462-20
7. Li X, He Y, Wang Z, Wei J, Hu T, Si J, et al. A combination therapy of Phages and Antibiotics: Two is better than one. Int J Biol Sci. 2021;17(13):3573–82. https://doi.org/10.7150/ijbs.60551
8. Xu W, Zhao Y, Qian C, Yao Z, Chen T, Wang L, et al. The identification of phage vB_1086 of multidrug-resistant Klebsiella pneumoniae and its synergistic effects with ceftriaxone. Microb Pathog. 2022;171:105722 https://doi.org/10.1016/j.micpath.2022.105722
9. Lew BYX, Njondimackal NL, Ravisankar V, Norman NA. Enhanced Antibacterial Activity of a Novel Phage-Antibiotic Combination Against Klebsiella pneumoniae Isolates. In: Lu J, Guo H, McLoughlin I, Chekole EG, Lakshmanan U, Meng W, et al., editors. Proceedings of the 9th IRC Conference on Science, Engineering, and Technology. Singapore:2023.
10. Kever L, Hardy A, Luthe T, Hünnefeld M, Gätgens C, Milke L, et al. Aminoglycoside Antibiotics Inhibit Phage Infection by Blocking an Early Step of the Infection Cycle. mBio. 2022;13(3): e0078322 https://doi.org/10.1128/mbio.00783-22
11. Brisse S, Passet V, Haugaard AB, Babosan A, Kassis-Chikhani N, Struve C, et al. wzi Gene sequencing, a rapid method for determination of capsular type for Klebsiella strains. J Clin Microbiol. 2013 Dec;51(12):4073–8. https://doi.org/10.1128/jcm.01924-13
12. Diancourt L, Passet V, Verhoef J, Grimont PAD, Brisse S. Multilocus sequence typing of Klebsiella pneumoniae nosocomial isolates. J Clin Microbiol. 2005 Aug;43(8):4178–82. https://doi.org/10.1128/jcm.43.8.4178-4182.2005
13. Клинические рекомендации МАКМАХ. Определение чувствительности микроорганизмов к антимикробным препаратам
14. Gorodnichev RB, Volozhantsev NV, Krasilnikova VM, Bodoev IN, Kornienko MA, Kuptsov NS, et al. Novel Klebsiella pneumoniae K23-Specific Bacteriophages From Different Families: Similarity of Depolymerases and Their Therapeutic Potential. Front Microbiol. 2021;12:669618. https://doi.org/10.3389/fmicb.2021.669618
15. Gorodnichev RB, Kornienko MA, Kuptsov NS, Malakhova MV, Bespiatykh DA, Veselovsky VA, et al. Molecular genetic characterization of three new klebsiella pneumoniae bacteriophages suitable for phage therapy. Extreme medicine. 2021;23(3):90–7 (In Russ.). https://doi.org/10.47183/mes.2021.035
16. Gonçalves-Pereira J, Martins A, Póvoa P. Pharmacokinetics of gentamicin in critically ill patients: pilot study evaluating the first dose. Clin Microbiol Infect Off Publ Eur Soc Clin Microbiol Infect Dis. 2010;16(8):1258–63. https://doi.org/10.1111/j.1469-0691.2009.03074.x
17. Wagenlehner FME, Kinzig-Schippers M, Sörgel F, Weidner W, Naber KG. Concentrations in plasma, urinary excretion and bactericidal activity of levofloxacin (500 mg) versus ciprofloxacin (500 mg) in healthy volunteers receiving a single oral dose. Int J Antimicrob Agents. 2006;28(6):551–9. https://doi.org/10.1016/j.ijantimicag.2006.07.026
18. Thalhammer F, Schenk P, Burgmann H, El Menyawi I, Hollenstein UM, Rosenkranz AR, et al. Single-Dose Pharmacokinetics of Meropenem during Continuous Venovenous Hemofiltration. Antimicrob Agents Chemother. 1998;42(9):2417–20. https://doi.org/10.1128/aac.42.9.2417
19. Wenk M, Vozeh S, Follath F. Serum level monitoring of antibacterial drugs. A review. Clin Pharmacokinet. 1984;9(6):475–92. https://doi.org/10.2165/00003088-198409060-00001
20. Mazzocco A, Waddell TE, Lingohr E, Johnson RP. Enumeration of bacteriophages using the small drop plaque assay system. Methods Mol Biol Clifton NJ. 2009;501:81–5. https://doi.org/10.1007/978-1-60327-164-6_9
21. Kutter E. Phage host range and efficiency of plating. Methods Mol Biol Clifton NJ. 2009; 501:141–9. https://doi.org/10.1007/978-1-60327-164-6_14
22. Burrowes BH, Molineux IJ, Fralick JA. Directed in Vitro Evolution of Therapeutic Bacteriophages: The Appelmans Protocol. Viruses. 2019;11(3):241. https://doi.org/10.3390/v11030241
23. Stepanović S, Vuković D, Hola V, Di Bonaventura G, Djukić S, Cirković I, et al. Quantification of biofilm in microtiter plates: overview of testing conditions and practical recommendations for assessment of biofilm production by staphylococci. APMIS Acta Pathol Microbiol Immunol Scand. 2007;115(8):891–9. https://doi.org/10.1111/j.1600-0463.2007.apm_630.x
24. Satlin MJ, Chen L, Patel G, Gomez-Simmonds A, Weston G, Kim AC, et al. Multicenter Clinical and Molecular Epidemiological Analysis of Bacteremia Due to Carbapenem-Resistant Enterobacteriaceae (CRE) in the CRE Epicenter of the United States. Antimicrob Agents Chemother. 2017;61(4):e02349-16. https://doi.org/10.1128/aac.02349-16
25. Chatzidimitriou M, Tsolakidou P, Panagiota C, Mylona E, Mitka S. KPC-2 and VIM-1 producing Klebsiella pneumoniae ST39 highrisk clone isolated from a clinical sample in Volos, Greece. Acta Microbiol Immunol Hung. 2024;71(1):43–51. https://doi.org/10.1556/030.2024.02226
26. Petrovic Fabijan A, Khalid A, Maddocks S, Ho J, Gilbey T, Sandaradura I, et al. Phage therapy for severe bacterial infections: a narrative review. Med J Aust. 2020;212(6):279–85. https://doi.org/10.5694/mja2.50355
27. Verma V, Harjai K, Chhibber S. Restricting ciprofloxacin-induced resistant variant formation in biofilm of Klebsiella pneumoniae B5055 by complementary bacteriophage treatment. J Antimicrob Chemother. 2009;64(6):1212–8. https://doi.org/10.1093/jac/dkp360
28. Jansen M, Wahida A, Latz S, Krüttgen A, Häfner H, Buhl EM, et al. Enhanced antibacterial effect of the novel T4-like bacteriophage KARL-1 in combination with antibiotics against multi-drug resistant Acinetobacter baumannii. Sci Rep. 2018;8(1):14140. https://doi.org/10.1038/s41598-018-32344-y
29. Wu Y, Wang R, Xu M, Liu Y, Zhu X, Qiu J, et al. A Novel Polysaccharide Depolymerase Encoded by the Phage SHKP152226 Confers Specific Activity Against Multidrug-Resistant Klebsiella pneumoniae via Biofilm Degradation. Front Microbiol. 2019;10:2768. https://doi.org/10.3389/fmicb.2019.02768
30. Latka A, Drulis-Kawa Z. Advantages and limitations of microtiter biofilm assays in the model of antibiofilm activity of Klebsiella phage KP34 and its depolymerase. Sci Rep. 2020;10(1):20338. https://doi.org/10.1038/s41598-020-77198-5
Об авторах
А. О. КривуляРоссия
Кривуля Анастасия Олеговна
Москва
Р. Б. Городничев
Россия
Городничев Роман Борисович
Москва
М. А. Корниенко
Россия
Корниенко Мария Андреевна, канд. биол. наук
Москва
Н. К. Абдраймова
Россия
Абдраймова Нарина Казбековна
Москва
М. В. Малахова
Россия
Малахова Майя Владимировна, канд. биол. наук
Москва
М. В. Зайчикова
Россия
Зайчикова Марина Викторовна, канд. биол. наук
Москва
Е. А. Шитиков
Россия
Шитиков Егор Александрович, д-р биол. наук
Москва
Рецензия
Для цитирования:
Кривуля А.О., Городничев Р.Б., Корниенко М.А., Абдраймова Н.К., Малахова М.В., Зайчикова М.В., Шитиков Е.А. Влияние комбинаций антибиотиков, фагов и деполимеразы на биопленки лекарственно-устойчивого штамма Klebsiella pneumoniae. Медицина экстремальных ситуаций. 2024;26(4):58-65. https://doi.org/10.47183/mes.2024-26-4-58-65
For citation:
Krivulia A.O., Gorodnichev R.B., Kornienko M.A., Abdraimova N.K., Malakhova M.V., Zaychikova M.V., Shitikov E.A. Effect of combinations of antibiotics, phages, and depolymerase on biofilms of the drug-resistant Klebsiella pneumoniae strain. Extreme Medicine. 2024;26(4):58-65. https://doi.org/10.47183/mes.2024-26-4-58-65

















