Перейти к:
Липосомы из соевого лецитина для лимфатической доставки биологически активных веществ
https://doi.org/10.47183/mes.2025-255
Аннотация
Введение. Лимфатический путь доставки может быть перспективен для липофильных химиотерапевтических и иммуномодулирующих средств, применяемых при лечении онкологических заболеваний. Носители на основе липидов (например, липосомы) могут не только повысить растворимость и стабильность лекарственных средств, но и защитить их от разложения в желудочно-кишечном тракте. Исследование возможности лимфатической доставки липосомами биологически активных веществ позволит в дальнейшем повысить эффективность многих липофильных препаратов.
Цель. Изучение перспектив применения липосом первого поколения (без холестерина) из соевого лецитина в качестве возможного лимфатического носителя для биологически активных веществ.
Материалы и методы. Получены липосомы из соевого лецитина, содержащие зеленый флуоресцентный белок GFP (с максимумом флуоресценции при длине волны 506 нм), методом гидратации/регидратации тонкой пленки. Для модификации некоторых липосом использовали раствор хитозана в концентрациях 1, 0,5 и 0,1%. Визуализация включения GFP в липосомы проведена методом конфокальной микроскопии. Исследования in vivo проводили в 3 группах самок мышей линии Balb/c возрастом 11–13 недель (по 3 животных в группе): контрольная группа; группа, получающая нативный флуоресцентный белок, и группа с исследуемой конструкцией (липосома, содержащая флуоресцентный белок). После введения проведен забор тонкой кишки, ее подготовка и окрашивание криосрезов. Анализ клеточной суспензии проведен на проточном цитофлуориметре CytoFLEX в конфигурации V5-B5-R3.
Результаты. При оценке полученных методом гидратации тонкой пленки липосом с использованием конфокальной микроскопии установлено, что большинство частиц имело размеры в диапазоне 1–5 мкм. Включение модельного белка в липосомы, как показали результаты измерения его содержания до и после формирования липосом, составило не менее 60%. В эксперименте на мышах in vivo выявлено, что внутрижелудочное введение липосом с флуоресцентным белком позволяет обеспечить доставку белка в стенку кишечника.
Выводы. Применение метода гидратации тонкой пленки позволило получить липосомы из соевого лецитина. Методом конфокальной микроскопии проведена оценка размера полученных липосом и качественно оценено включение в них зеленого флуоресцентного белка. Включение хитозана в оболочку липосом приводило к значительной агрегации конечного продукта, что может приводить к снижению эффективности доставки липосом в клетки. Конфокальная микроскопия криосрезов и цитофлуориметрический анализ клеточных суспензий, полученных из фрагментов тонкой кишки, показали, что примененная система позволяет доставить флуоресцентный белок и, вероятно, неразрушенные липосомы в стенку кишечника.
Ключевые слова
Для цитирования:
Федотова Е.В., Скворцов Н.В., Перевозников И.Е., Роговская Н.Ю., Бельтюков П.П., Бардин А.А., Бабаков В.Н., Криворотов Д.В., Радилов А.С. Липосомы из соевого лецитина для лимфатической доставки биологически активных веществ. Медицина экстремальных ситуаций. 2025;27(3):320-327. https://doi.org/10.47183/mes.2025-255
For citation:
Fedotova E.V., Skvortsov N.V., Perevoznikov I.E., Rogovskaya N.Yu., Beltyukov P.P., Bardin A.A., Babakov V.N., Krivorotov D.V., Radilov A.S. Soy lecithin-based liposomes for lymphatic delivery of biologically active substances. Extreme Medicine. 2025;27(3):320-327. https://doi.org/10.47183/mes.2025-255
ВВЕДЕНИЕ
При приеме внутрь многие лекарственные вещества (ЛВ) могут расщепляться ферментами желудочно-кишечного тракта (ЖКТ), плохо всасываются в тонком кишечнике и подвергаются метаболизму при первом прохождении через печень. Для таких препаратов используют различные микро- и наноносители на основе липидов с целью их защиты от деградации под воздействием компонентов пищеварительных соков, для контроля высвобождения, в целях корректировки распределения и повышения биодоступности, а также для целенаправленной доставки препарата к месту действия [1]. Модификация лекарственного препарата путем конъюгации с липидами (жирными кислотами, глицеридами и фосфолипидами) позволяет повысить его липофильность и, как следствие, обеспечить увеличение биодоступности [2]. Однако следует иметь в виду, что в этом случае необходимо доказать, что препарат, конъюгированный с липидами, как минимум так же эффективен, как и оригинальный препарат. В некоторых случаях возможно повысить биодоступность лекарственного препарата за счет поверхностно-активных веществ. Например, капрат натрия может способствовать повышению биодоступности некоторых лекарственных препаратов за счет увеличения проницаемости через кишечный эпителий путем парацеллюлярного транспорта [3].
В последние несколько лет активно изучается возможность разработки лимфатических систем доставки различных препаратов энтерально, минуя эффект «первого прохождения» через печень [4–6]. Такой путь поступления может способствовать увеличению биодоступности. Данная стратегия особенно интересна для доставки антигенов в лимфатические узлы и повышения адаптивного иммунного ответа, вызванного вакцинами. Традиционная системная химиотерапия требует использования высоких доз препаратов и является зачастую неэффективной для их доставки в лимфатическую систему. Разработка носителей для лекарственных препаратов, нацеленных на лимфоциты — уникальная возможность повысить эффективность терапии против ВИЧ/СПИД [7].
В настоящее время известно большое число разнообразных носителей, которые могут быть перспективными для лимфатической доставки лекарственных препаратов (рис. 1). При этом носитель должен длительное время циркулировать в крови, удерживать лекарственное средство до тех пор, пока не будет достигнуто его накопление в органе-мишени [8–10]. Кроме того, включенное в носитель ЛВ не должно терять свою активность во время циркуляции. При выборе носителя лекарственного вещества следует помнить, что эффективность интернализации в клетке зависит от его размера, формы и заряда. Например, наноразмерные носители лучше контактируют с биологическими мембранами, чем эти же носители микронного размера [9]. Системы доставки ЛВ на основе полимеров не всегда являются подходящими кандидатами для лимфатической доставки. Некоторые заряженные полимеры (например, хитозан) могут связываться с клетками слизистой оболочки кишечника за счет нековалентных электростатических взаимодействий, водородных связей и ван-дер-ваальсовых сил [11].
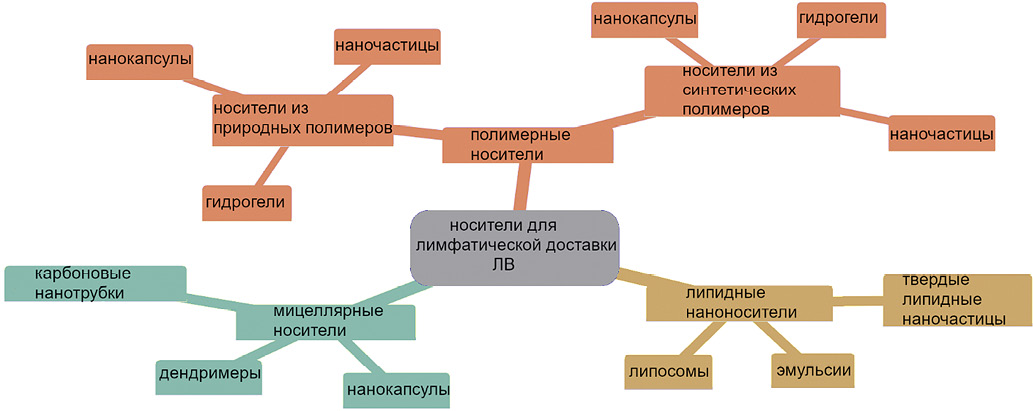
Рисунок подготовлен авторами в графическом редакторе Mermaid по данным [4–11]
Рис. 1. Перспективные носители для лимфатической доставки лекарственных веществ
Из всех наноносителей на основе липидов наиболее перспективными являются липосомы, поскольку по сравнению с другими наночастицами на основе липидов они позволяют не только инкапсулировать и защищать лекарственные препараты от деградации, но и усиливать их всасывание в кишечнике [4][12].
Липосомы — это везикулярные системы доставки сферической формы, содержащие в составе липиды, в которых фосфолипидный бислой расположен между двумя гидрофильными слоями [13].
Механизмы доставки макромолекул, «упакованных» в липосомы, по-видимому, могут различаться в зависимости от размеров липосом. Микрочастицы, в том числе гигантские липосомы, имеющие линейные размеры, близкие к размерам хиломикронов, не способны проникать в кровеносные капилляры, размер пор которых составляет около 60 нм. При этом возможность прохождения микрочастиц через слизистый слой кишечника экспериментально подтверждена на лабораторных грызунах как для бионедеградируемых частиц латекса или полистирола [14][15], так и для крупных липосом размером до 10 и более микрометров [16]. В качестве одного из возможных путей, по которому микроразмерные частицы проникают через кишечный барьер, рассматривается поглощение их через микроскладчатые (microfold) М-клетки. Несмотря на то что популяция М-клеток среди общего числа клеток невелика (~1%), их положение и особенности микроокружения таковы, что они способны обеспечивать трансцитоз микрочастиц, бактерий, вирусов, липополисахаридов и т.п. Это связано с особенностями их структуры и микроокружения (уменьшенная плотность гликокаликса, меньшая выраженность щеточной каймы и микроворсинок), что обусловливает их способность поглощать микрочастицы, размеры которых превышают 200 нм — максимальный размер липидных комплексов (мицелл), способных поглощаться энтероцитами. Считается, что главной функцией М-клеток является доставка антигенов для последующего процессинга и их представления гетерогенной популяции лимфоцитов, макрофагов и дендритных клеток, составляющих комплекс клеток иммунной системы, ассоциированных с желудочно-кишечным трактом (ЖКТ). Вместе с тем известно, что доставка, например, циклоспорина А в крупных липосомах (~10 мкм) при внутрижелудочном введении крысам приводит к увеличению биодоступности этого лекарственного препарата более чем в 9 раз [16][17]. Следует отметить, что, например, для белковых антигенов данный путь доставки является наиболее перспективным, поскольку в этом случае доставка антигена происходит непосредственно в лимфоидную ткань ЖКТ. При переходе крупных липосом в результате трансцитоза в подслизистый слой часть из них может по лимфатическим сосудам попадать и в другие части сосудистой системы, в том числе системный кровоток.
Цель исследования — изучение перспектив применения липосом первого поколения (без холестерина) из соевого лецитина в качестве носителя для возможной лимфатической доставки биологически активных веществ.
МАТЕРИАЛЫ И МЕТОДЫ
В настоящей работе использовали соевый лецитин (Ультралек Р, ADM, США), рекомбинантный зеленый флуоресцентный белок zFP506 (ZsGreen1), полученный в трансфицированных плазмидой pAAV-ZsGreen1 Vector (Takara Bio) клетках HEK293 (Thermo Fisher), гексан (чда, «Вектон», Россия), 0,05 М раствор двузамещенного фосфорнокислого натрия (чда, «Вектон», Россия), 0,05 М раствор однозамещенного фосфорнокислого натрия, 0,1 М хлористоводородная кислота («Вектон», Россия), 0,01 М фосфатно-солевой буфер (PBS) — pH 7,3, содержащий 0,137 М NaCl и 0,0027 М KCl («Биолот», Россия), раствор Дульбекко без Ca и Mg («Биолот», Россия), бычий сывороточный альбумин (BSA) (Sigma-Aldrich), формалин нейтральный 10% («Синтакон», Россия).
Получение липосом методом гидратации/регидратации тонкой пленки
В круглодонной колбе 100 мг соевого лецитина растворяли в 20 мл гексана, служившего в качестве растворителя. Полученную смесь выпаривали на роторном испарителе (Heidolph, Германия) до образования тонкой пленки (температура водяной бани 45 °С, давление 65 мбар). Зеленый флуоресцентный белок (GFP) из исходного раствора доводили до концентрации 5 мг/мл в 50 мл 0,01 М натриевого фосфатного буфера (pH 7,4). Включение белка в липосомы происходило пассивно при формировании липосом из полученного раствора GFP в колбе при постоянном перемешивании на магнитной мешалке (Heidolph, Германия) при 400 об/мин (4 ч при комнатной температуре) до полной регидратации пленки со стенок. Полученные липосомы центрифугировали на центрифуге (Heidolph, Германия) при скорости вращения ротора 20 000 об/мин в течение 15 мин для осаждения полученных липосом, отбирали надосадочную жидкость и однократно промывали деионизированной водой.
Для оценки эффективности включения белка в состав липосом определяли содержание белка по методу Лоури в соответствии с ОФС.1.7.2.0023.15 в растворе до и после формирования липосом. Концентрация белка в растворе снижалась после завершения процесса примерно на 60% по сравнению с исходной, что должно соответствовать эффективности включения GFP.
Приготовление раствора хитозана
Раствор хитозана в концентрациях 1, 0,5 и 0,1% готовили путем растворения сухих навесок в 1%-ном растворе уксусной кислоты. Контроль pH полученных растворов осуществляли при помощи pH-метра, pH полученных растворов составил 5,4.
Получение липосом методом гидратации/регидратации тонкой пленки с введением хитозана
В круглодонной колбе 100 мг соевого лецитина растворяли в 20 мл гексана. Полученный раствор лецитина выпаривали на роторном испарителе (Heidolph, Германия) до образования тонкой пленки (температура водяной бани 45 °С, давление 65 мбар). Зеленый флуоресцентный белок концентрации 5 мг/мл растворяли в 50 мл 0,01 М натрий-фосфатного буфера (pH 7,4) и вводили совместно с растворами хитозана выбранных концентраций. Формирование липосом проходило при постоянном перемешивании на магнитной мешалке (Heidolph, Германия) при 400 об/мин в течение 4 часов при комнатной температуре до полной регидратации пленки со стенок. Полученные липосомы центрифугировали (Heidolph, Германия) при 20000 об/мин в течение 15 мин, удаляли надосадочную жидкость и однократно промывали водой.
Конфокальная микроскопия
Проведена конфокальная микроскопия (микроскоп Zeiss «LSM 710», CarlZeiss, Германия; увеличение ×63) с аргоновым лазером λ = 488 нм. В исследуемых образцах для визуализации липосом в качестве модельного белка использовали GFP с максимумом флуоресценции при длине волны 506 нм.
Очистка GFP и определение его концентрации
GFP выделяли из клеточного экстракта HEK293, трансфицированных плазмидой pAAV-ZsGreen1 Vector (Takara Bio) с использованием метода спиртовой экстракции и осаждения сульфатом аммония, описанного в статье [18].
Исследования in vivo
Работа проведена с использованием мышей самок линии Balb/c, распределенных на 3 группы по 3 мыши:
группа 1 — контрольная группа;
группа 2 — животные получали нативный флуоресцентный белок;
группа 3 — животные получали суспензию с исследуемой конструкцией (липосомы без хитозана, содержащие GFP).
Выбор такого количества подопытных животных в группах является достаточным для оценки характера и частоты проявления регистрируемых эффектов. Возраст животных к началу эксперимента составлял 11–13 недель, масса тела не отклонялась от среднего значения по всем экспериментальным группам больше чем на 20%.
Подопытным мышам вводили липосомы без хитозана с GFP или водный раствор GFP в соответствии с описанием, приведенным выше. В контрольной группе были интактные мыши. В полученных от животных клеточных суспензиях оценивали наличие флуоресцентного свечения GFP методом проточной цитометрии.
Процедура внутрижелудочного введения выполнена квалифицированными специалистами с использованием зонда. Объем введения был одинаков для всех животных и составлял 300 мкл. Концентрация GFP в водном растворе, использованном для введения мышам, определена методом Лоури и составляла 0,86 мг/мл. Такой же раствор GFP использовали при изготовлении липосом. В исследуемых образцах эффективность включения GFP в липосомы составила не менее 60%.
Через 3 ч после введения раствора GFP или липосом с GFP мыши были подвергнуты эвтаназии путем цервикальной дислокации. После вскрытия брюшной полости извлекали фрагмент тонкой кишки длиной 2 см на удалении 1 см от желудка и переносили в отдельную пробирку объемом 5 мл, содержащую PBS.
От каждого фрагмента кишки отделяли часть длиной в 1 см и разрезали вдоль, чтобы получить препарат прямоугольной формы.
Приготовление и окрашивание криосрезов тонкой кишки
Неразрезанные фрагменты тонкой кишки длиной 1 см отмывали в PBS, разрезали на фрагменты длиной 0,5 см и заключали в гель Tissue-Tek® O.C.T. Compound (Sakura Finetek, Япония), наполняя гелем изнутри для сохранения структуры криосрезов. Образцы замораживали в жидком азоте и нарезали при помощи криотома (SLEE medical, Германия). Криосрезы толщиной 10 мкм помещали на предметное стекло, дважды промывали PBS и фиксировали в нейтральном формалине (3,7%) в течение 30 мин. Фиксированные образцы дважды промывали PBS и пермеабилизовали 0,1% раствором Triton X-100 на PBS с 1% BSA в течение 30 мин, после чего дважды промывали PBS с 1% BSA.
Для визуализации клеток при конфокальной микроскопии F-актин клеточного цитоскелета окрашивали флуоресцентным красителем Alexa Fluor 594 phalloidin (Invitrogen, США), разведенным в PBS с 1% BSA в соотношении 1:40, затем 30 мин и инкубировали в темноте. После этого образцы дважды промывали PBS с 1% BSA и заключали в ProLong Gold antifade reagent (Invitrogen, США). Хранили препараты в темноте при температуре 2–6 °C.
Проточная цитометрия
После отмывки препарата от слизи и крови в кювете с раствором PBS его переносили на клеточное сито с сечением ячеек 40 мкм с внесенным в него 1 мл раствора Дульбекко («Биолот») и получали клеточную суспензию путем протирания. Затем суспензию дважды отмывали раствором Дульбекко с центрифугированием (8 мин, 800 об/мин). Отмытый осадок клеток ресуспендировали в объеме 400 мкл раствора Дульбекко.
Анализ клеточной суспензии проводили на проточном цитофлуориметре CytoFLEX в конфигурации V5-B5-R3 (Beckman Coulter, США). Для каждого образца набирали по 50 000 событий (для контрольных образцов не менее 20 000) в режиме скорости подачи образца 10 мкл/с.
Подсчет количества клеток, содержащих GFP, проводили с использованием стандартных детекторов прямого и бокового светорассеяния (для определения морфологических характеристик клеток: линейного размера и сложности внутриклеточной структуры соответственно), а также пригодного для визуализации GFP светофильтра (канал FITC).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе работы методику формирования липосом выбирали по следующим критериям.
- В процессе получения носителя могут использоваться только щадящие методики по отношению к ЛВ (т.е. в ходе получения системы доставки не следует использовать растворители, способные изменить свойства ЛВ; необходимо минимизировать внешнее воздействие: температура, ультразвук, высокие скорости перемешивания и т.д.).
- Размер частиц системы доставки должен быть менее 10 мкм.
- Система доставки должна содержать биосовместимые нетоксичные компоненты.
- Полученная система после приема внутрь должна обеспечивать доставку упакованного ЛВ в подслизистый слой кишечника, в том числе, возможно, путем транспорта через лимфатические сосуды.
В настоящее время существенно расширен спектр различных модифицированных липосом. Считается, что полимерные покрытия повышают способность липосом преодолевать эпителиальный барьер. Для этого широко используются хитозаны и их производные. Хитозан при взаимодействии с мембранными белками способен стимулировать конформационные изменения белковых молекул, которые могут приводить к увеличению парацеллюлярного транспорта биологически активных молекул. Вместе с тем далеко не всегда нанесение на липосомы гидрофильных полимеров приводит к положительному эффекту (например, не всегда достигается защита от деградации таких липосом пищеварительными ферментами). Липосомы, имеющие в своем составе хитозан, чувствительны к изменению pH и могут агрегировать в желудочно-кишечном тракте, что, в свою очередь, может стать причиной снижения всасывания препарата. Эффект был продемонстрирован на примере перорального введения циклоспорина А, включенного в липосомы, модифицированные хитозаном [19].
В ходе работы были сформированы два варианта липосом: со встроенным в липосомы хитозаном (для повышения мукоадгезивных свойств) и без модификации. В исследовании были апробированы несколько концентраций полимера (1%-, 0,5%-, 0,1%-ный раствор хитозана в уксусной кислоте). Как оказалось, введение хитозана в состав липосом во всех выбранных концентрациях может приводить к их сильной агрегации (рис. 2А), что существенно уменьшает перспективы их использования в качестве системы доставки. Наиболее логичным решением проблемы агрегации может стать применение ультразвукового воздействия на частицы в ходе их формирования. Однако, согласно выбранным нами критериям формирования липосом, такое воздействие недопустимо. Поэтому в дальнейшем нами для исследований in vivo была выбрана система доставки без каких-либо модификаций. Размеры полученных липосом без хитозана имели стабильный линейный размер 1–5 мкм (рис. 2Б), агрегация при этом отсутствовала.
При анализе результатов цитофлуориметрии за уровень аутофлуоресценции по каналу FITC, которая всегда присутствует в биологических объектах, приняли значение, соответствующее группе контроля, — оно составляло около 1% от родительской популяции клеток во всех исследованных образцах (рис. 3А). В образцах клеточных суспензий от мышей из группы, получившей GFP без липосом, количество событий, соответствующих флуоресценции GFP, не превышало уровня аутофлуоресценции в контроле (рис. 3Б).
В образцах клеток кишечника, полученных от животных из группы, получивших GFP в липосомах, наблюдали существенное увеличение событий, соответствующих свечению GFP, — до 8–10% от родительской популяции клеток (рис. 3В).
Методом конфокальной микроскопии показано, что молекулы GFP, упакованные в липосомы, не разрушаются в желудке и могут быть доставлены в клетки кишечника (рис. 4В). Перспективы дальнейшего использования примененной системы доставки зависят от эффективности действия упакованного в липосомы ЛВ и его физико-химических характеристик. Кроме того, в дальнейшем предполагается модификация липосом нанесением Pluronic 127 на их оболочку. Известно, что данный лиганд способствует улучшению захвата липосом энтероцитами и повышению стабильности липосом. Подобная модификация может позволить повысить поглощение системы доставки клетками и обеспечить эффективный транспорт по лимфатической системе. При пероральной доставке циклоспорина А липосомами с Pluronic 127 была продемонстрирована хорошая стабильность системы доставки в желудочно-кишечном тракте. Выбранный носитель достигал поверхности эпителия, что приводило к высокому всасыванию препарата [19].
Эффективность доставки макромолекул в составе липосом при приеме внутрь до сих пор не может считаться удовлетворительной. Улучшение доставки липосом в клетки остается одной из важных проблем, которым посвящены текущие научные исследования [20]. Авторами данного исследования использованы наноразмерные липосомы, содержащие холестерин, для доставки мРНК, кодирующей GFP, в клетки Caco-2, часто применяющиеся в качестве модели при оценке доставки ЛВ путем трансцитоза. Публикаций, посвященных доставке макромолекул в составе липосом на биомодели in vivo, практически нет. Полученный в ходе нашего исследования результат важен именно с позиции практической оценки применения липосом для доставки макромолекул через ЖКТ.

Фотографии выполнены авторами
Рис. 2. Конфокальные микрофотографии липосом с GFP: А — с покрытием хитозаном; B — выбранная методика без модификаций; метка — липосомы с GFP
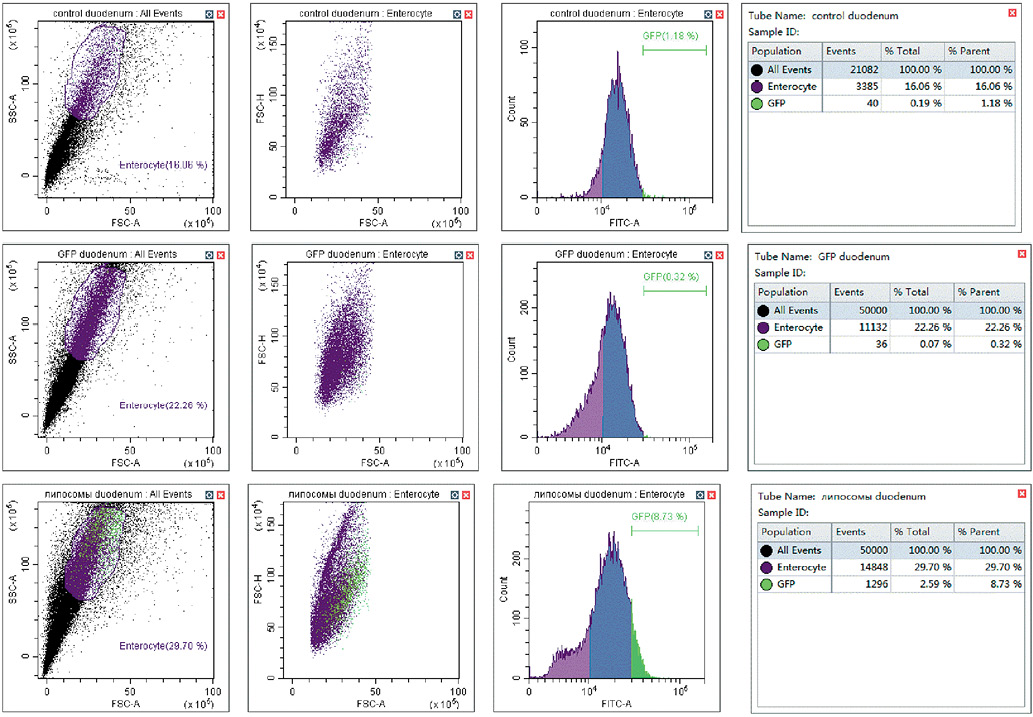
Рисунок подготовлен авторами по собственным данным
Рис. 3. Результаты проточной цитометрии для липосом с GFP
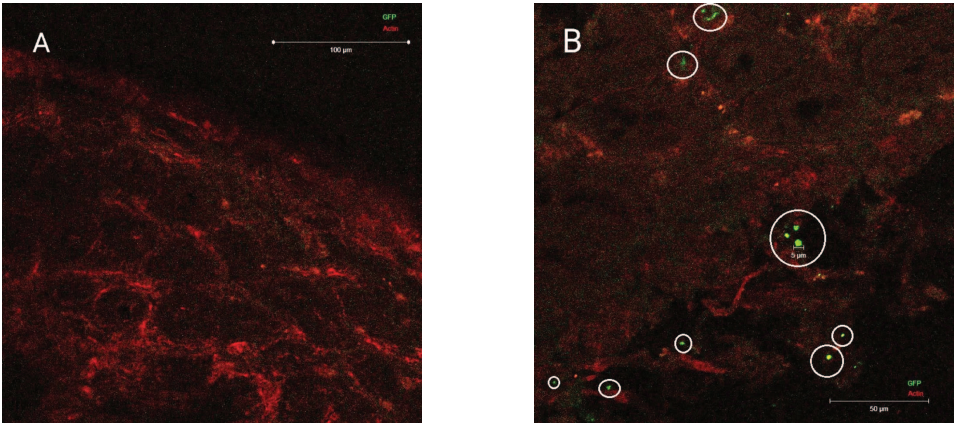
Фотография выполнена авторами
Рис. 4. Результаты конфокальной микроскопии стенки кишечника: А — после введения GFP без упаковки в липосомы (отсутствуют комплексы GFP); В — стенка кишечника после введения липосом с GFP; метка — липосомы с GFP
ВЫВОДЫ
- Методом гидратации тонкой пленки были получены липосомы из соевого лецитина.
- Методом конфокальной микроскопии проведена оценка размера полученных липосом и показано включение в них зеленого флуоресцентного белка. Продемонстрировано, что полученные выбранным методом липосомы имеют средний размер 3–5 мкм.
- Показано, что нанесение хитозана в выбранных концентрациях на липосомы может приводить к сильной агрегации конечного продукта, что, в свою очередь, может негативно повлиять на его дальнейший захват клетками.
- Выявление липосом в срезах стенки кишечника свидетельствует о возможности их перехода в подслизистый слой и отсутствии полного разрушения в средах желудочно-кишечного тракта.
- Методом проточной цитометрии подтверждена доставка флуоресцентного белка в клетки кишечника после внутрижелудочного введения GFP в составе липосом, что подтверждается увеличением доли клеток, обладающих флуоресценцией, соответствующей GFP.
- В криосрезах кишечника при конфокальной микроскопии выявлены участки флуоресценции, близкие по размерам к примененным в эксперименте липосомам. Вероятно, часть поглощаемых в результате трансцитоза липосом не подвергается биодеградации в течение минимум трех часов после введения.
- Можно предположить, что такие липосомы могут быть использованы для доставки белков или иных макромолекул в качестве антигенов для иммунизации, опосредуемой клетками лимфоидной ткани ЖКТ. Однако это требует дополнительного подтверждения.
Список литературы
1. McCright J, Naiknavare R, Yarmovsky J, Maisel K. Targeting lymphatics for nanoparticle drug delivery. Frontiers in Pharmacology. 2022;13:887402. https://doi.org/10.3389/fphar.2022.887402
2. Kim H, Kim Y, Lee J. Liposomal formulations for enhanced lymphatic drug delivery. Asian Journal of Pharmaceutical Sciences. 2013;8(2):96–103. https://doi.org/10.1016/j.ajps.2013.07.012
3. Rama A, Govindan I, Kailas AA, Annadurai T, Lewis SA, Pai SR, et al. Drug delivery to the lymphatic system: The road less travelled. Journal of Applied Pharmaceutical Science. 2024;14(6):1–10. https://doi.org/10.7324/JAPS.2024.180277
4. Ahn H, Park JH. Liposomal delivery systems for intestinal lymphatic drug transport. Biomaterials Research. 2016;20(1):36. https://doi.org/10.1186/s40824-016-0083-1
5. Nishioka Y, Yoshino H. Lymphatic targeting with nanoparticulate system. Advanced Drug Delivery Reviews. 2001;47(1):55–64. https://doi.org/10.1016/S0169-409X(00)00121-6
6. Yang Q, Forrest L. Drug delivery to the lymphatic system. Drug Delivery: Principles and Applications. 2016:503–48. https://doi.org/10.1002/9781118833322.ch21
7. Shao J, Kraft JC, Li B, Yu J, Freeling J, Koehn J, et al. Nanodrug formulations to enhance HIV drug exposure in lymphoid tissues and cells: clinical significance and potential impact on treatment and eradication of HIV/AIDS. Nanomedicine. 2016;11(5):545–64. https://doi.org/10.2217/nnm.16.1
8. Singh I, Swami R, Khan W, Sistla R. Lymphatic system: a prospective area for advanced targeting of particulate drug carriers. Expert Opinion on Drug Delivery. 2014;11(2):211–29. https://doi.org/10.1517/17425247.2014.866088
9. Cho HY, Lee YB. Nano-sized drug delivery systems for lymphatic delivery. Journal of Nanoscience and Nanotechnology. 2014;14(1):868–80. https://doi.org/10.1166/jnn.2014.9122
10. Porter CJ. Drug delivery to the lymphatic system. Critical Reviews in Therapeutic Drug Carrier Systems. 1997;14(4):333–94. https://doi.org/10.1615/CritRevTherDrugCarrierSyst.v14.i4.10
11. Managuli RS, Raut SY, Reddy MS, Mutalik S. Targeting the intestinal lymphatic system: a versatile path for enhanced oral bioavailability of drugs. Expert Opinion on Drug Delivery. 2018;15(8):787–804. https://doi.org/10.1080/17425247.2018.1503249
12. Cai S, Yang Q, Bagby TR, Forrest ML. Lymphatic drug delivery using engineered liposomes and solid lipid nanoparticles. Advanced Drug Delivery Reviews. 2011;63(10–11):901–8. https://doi.org/10.1016/j.addr.2011.05.017
13. Nsairat H, Khater D, Sayed U, Odeh F, Al Bawab A, Alshaer W. Liposomes: Structure, composition, types, and clinical applications. Heliyon. 2022;8(5):e09394. https://doi.org/10.1016/j.heliyon.2022.e09394
14. Hodges GM, Carr EA, Hazzard RA, Carr KE. Uptake and translocation of microparticles in small intestine. Digestive Diseases and Science. 1995;40:967–75. https://doi.org/10.1007/BF02064184
15. Donkers JM, Höppener EM, Grigoriev I, Will L, Melgert BN, van der Zaan B, et al. Advanced epithelial lung and gut barrier models demonstrate passage of microplastic particles. Microplastics and Nanoplastics. 2022;2(6):2–18. https://doi.org/10.1186/s43591-021-00024-w
16. Shah NM, Parikh J, Namdeo A, Subramanian N, Bhowmick S. Preparation, Characterization and In Vivo Studies of Proliposomes Containing Cyclosporine A. Journal of Nanoscience and Nanotechnology. 2006;6(9):2967–73. https://doi.org/10.1166/jnn.2006.403
17. Lee M.K. Liposomes for Enhanced Bioavailability of Water-Insoluble Drugs: In Vivo Evidence and Recent Approaches. Pharmaceutics. 2020;12(3):264. https://doi.org/10.3390/pharmaceutics12030264
18. Samarkina ON, Popova AG, Gvozdik EY, Chkalina AV, Zvyagin IV, Rylova YuV, et al. Universal and rapid method for purification of GFP-like proteins by the ethanol extraction. Protein Expression and Purification. 2009;65(1):108–13. https://doi.org/10.1016/j.pep.2008.11.008
19. Chen D, Xia D, Li X, Zhu Q, Yu H, Zhu C, et al. Comparative study of Pluronic® F127-modified liposomes and chitosan-modified liposomes for mucus penetration and oral absorption of cyclosporine A in rats. International Journal of Pharmaceutics. 2013;449(1–2):1–9. https://doi.org/10.1016/j.ijpharm.2013.04.002
20. Dürr V, Wohlfart S, Eisenzapf T, Mier W, Fricker G, Uhl P. Oral Delivery of mRNA by Liposomes Functionalized with Cell-Penetrating Peptides. Applied Nano. 2023;4:293–308. https://doi.org/10.3390/applnano4040017
Об авторах
Е. В. ФедотоваРоссия
Федотова Елена Викторовна, канд. хим. наук
Ленинградская область
Санкт-Петербург
Н. В. Скворцов
Россия
Скворцов Никита Владиславович
Ленинградская область
И. Е. Перевозников
Россия
Перевозников Илья Евгеньевич
Ленинградская область
Н. Ю. Роговская
Россия
Роговская Надежда Юрьевна
Ленинградская область
П. П. Бельтюков
Россия
Бельтюков Петр Петрович, канд. мед. наук, доцент
Ленинградская область
А. А. Бардин
Россия
Бардин Александр Александрович
Ленинградская область
В. Н. Бабаков
Россия
Бабаков Владимир Николаевич, канд. биол. наук
Ленинградская область
Д. В. Криворотов
Россия
Криворотов Денис Викторович, канд. хим. наук
Ленинградская область
А. С. Радилов
Россия
Радилов Андрей Станиславович, д-р. мед. наук, профессор
Ленинградская область
Дополнительные файлы
Рецензия
Для цитирования:
Федотова Е.В., Скворцов Н.В., Перевозников И.Е., Роговская Н.Ю., Бельтюков П.П., Бардин А.А., Бабаков В.Н., Криворотов Д.В., Радилов А.С. Липосомы из соевого лецитина для лимфатической доставки биологически активных веществ. Медицина экстремальных ситуаций. 2025;27(3):320-327. https://doi.org/10.47183/mes.2025-255
For citation:
Fedotova E.V., Skvortsov N.V., Perevoznikov I.E., Rogovskaya N.Yu., Beltyukov P.P., Bardin A.A., Babakov V.N., Krivorotov D.V., Radilov A.S. Soy lecithin-based liposomes for lymphatic delivery of biologically active substances. Extreme Medicine. 2025;27(3):320-327. https://doi.org/10.47183/mes.2025-255

















