Перейти к:
Перспективы интеграции мультиплексного фосфоресцентного иммуноанализа пулированных сухих образцов мочи в скрининговое обследование при диспансерном наркоконтроле
https://doi.org/10.47183/mes.2025-261
Аннотация
Введение. С учетом сложной наркоситуации в России, роста числа скрытых потребителей наркотических средств (НС) представляется целесообразным расширение рамок скрининговых обследований для выявления НС с использованием новых методических подходов, позволяющих сократить стоимость тестирования за счет снижения затрат на этапах сбора, транспортировки, хранения и аналитического исследования биологических образцов.
Цель. Разработка на основе технологии ФОСФАН метода мультиплексного иммуноанализа для обнаружения основных групп наркотических, психотропных средств в пулах образцов мочи, высушенных на бумаге, с последующей оценкой перспектив его применения для выявления наркозависимых лиц в рамках расширенного диспансерного наркоконтроля.
Материалы и методы. Сухие образцы мочи (n = 31) приготовлены на бумажных тест-полосках из жидких образцов, содержащих (n = 30) или не содержащих (n = 1) кокаин, каннабиноиды, амфетамин, опиаты, бензодиазепины, барбитураты, метамфетамин или метадон по данным химико-токсикологического исследования (ХТИ). Образцы исследованы в виде пулов, содержащих 1–40 фрагментов (0,45×0,45 см) тест-полосок. Люминесцентный сигнал регистрировали на микропланшетном иммуночипе с помощью индикатора фотолюминесценции импульсного ИФИ-05. Наличие НС в образцах оценивали по степени ингибирования связывания антител в соответствующей тестовой зоне иммуночипа (отношение В/В0). Статистическую обработку результатов проводили с помощью стандартных программ Microsoft Office.
Результаты. Включение в состав пулов до 10 сухих образцов мочи, только один из которых содержит искомое НС, не оказало значимого влияния на способность разрабатываемого метода выявлять НС с показателями чувствительности, соответствующими требованиям ХТИ. В исследованных пулах обнаружены: кокаин — в 2 образцах, каннабиноиды — в 11 пробах, амфетамин — в 6, опиаты — в 9, бензодиазепины — в 7, барбитураты — в 10, метамфетамин — в 7, метадон — в 6 пробах, в том числе на фоне высоких концентраций опиатов и амфетаминов.
Выводы. Разработан метод мультиплексного фосфоресцентного микропланшетного иммуноанализа для выявления восьми основных групп наркотических, психотропных средств в пулах из высушенных на бумаге образцов мочи. Пределы детекции исследуемых НС в экстрактах из высушенных на тест-полосках образцов мочи составили 2–8 нг/мл, что существенно ниже рекомендованных для скринингового обследования пределов детекции. Предложенный подход может составить основу новой методологии скрининга, включающей отбор проб мочи, нанесение их на бумажные тест-бланки и транспортировку в лабораторию для проведения обследования групп лиц на критически важных объектах. Использование мультиплексного фосфоресцентного иммуноанализа и пулированных образцов мочи позволит кардинально (более чем в 10 раз) снизить стоимость тестирования по сравнению с традиционными технологиями иммунохроматографического анализа.
Ключевые слова
Для цитирования:
Бекман Н.И., Помелова В.Г., Осин Н.С. Перспективы интеграции мультиплексного фосфоресцентного иммуноанализа пулированных сухих образцов мочи в скрининговое обследование при диспансерном наркоконтроле. Медицина экстремальных ситуаций. 2025;27(3):400-409. https://doi.org/10.47183/mes.2025-261
For citation:
Bekman N.I., Pomelova V.G., Osin N.S. Integration prospects for the multiplex phosphorescence immunoassay of pooled dry urine samples into screening examinations in dispensary drug control. Extreme Medicine. 2025;27(3):400-409. https://doi.org/10.47183/mes.2025-261
ВВЕДЕНИЕ
Незаконное употребление наркотических средств (НС) или их химических аналогов продолжает оставаться глобальной мировой проблемой, затрагивающей порядка 292 миллионов человек (более 5% взрослого населения планеты)1. В России примерно 2% населения в возрасте 15–64 лет используют наркотики2. Это обусловлено не только масштабным поступлением из-за рубежа опийных НС, но и появлением новых групп НС и психотропных веществ — синтетических каннабиноидов, «спайсов», с продолжающимся вовлечением в потребление наркотиков лиц молодого возраста [1]. Основной особенностью современной наркоситуации в России является рост числа скрытых потребителей наркотиков. В эту группу входят люди 30–40 лет с высоким уровнем образования и социальным статусом, которые допускают использование «легких» наркотиков; такой способ потребления способствует формированию наркозависимости с отложенными сроками острого периода и не попадает в поле зрения ни правоохранительных органов, ни медиков [2].
В настоящее время медицинское освидетельствование на наличие в организме человека потенциально опасных веществ проводится в случаях, определенных российским законодательством в рамках двухступенчатой процедуры химико-токсикологических исследований3. Вместе с тем с учетом сложной наркоситуации, роста числа скрытых потребителей НС, а также факта, что даже однократное употребление наркотиков может воздействовать на способность человека трезво оценивать окружающую обстановку и предпринимать адекватные действия при возникновении опасных ситуаций, представляется целесообразным расширение границ скрининговых обследований для выявления НС путем организации диспансерного наркоконтроля. Выявление наркозависимых лиц особенно актуально на критически важных и потенциально опасных объектах инфраструктуры России, поскольку напрямую связано с обеспечением безопасности государства [3].
Организация расширенного диспансерного наркоконтроля требует ощутимых финансовых затрат: так, например, стоимость наиболее популярных и дешевых иммунохроматографических тест-полосок для выявления 6–8 основных групп НС составляет не менее 300 рублей, что практически исключает возможность введения на предприятиях наркоконтроля за счет бюджетного финансирования. Приемлемый для скрининга уровень затрат на исследование одного образца на 8–13 основных групп НС должен быть в десятки раз ниже. Новые методические подходы, появившиеся в последние годы, в том числе пулирование исследуемых проб, использование высушенных на специальной бумаге клинических образцов, централизация лабораторных исследований, внедрение технологий мультиплексного анализа, могли бы кардинально (более чем в 10–20 раз) снизить стоимость тестирования за счет снижения затрат на этапах сбора, транспортирования, хранения и анализа образцов [4–10].
Ключевым элементом организации нового подхода к диспансерному наркоконтролю могла бы стать методология пулирования [4–10], т.е. объединение для анализа образцов, взятых от разных людей. Очевидные преимущества группового тестирования обусловлены снижением стоимости исследования пропорционально количеству образцов в пуле, сокращением общего количества тестов, минимизацией ошибок дозирования [7]. Эффективность такого подхода была продемонстрирована во время пандемии COVID-19, когда многократно возросло число проводимых обследований [8–10]. Вместе с тем остаются сомнения в возможности широкого использования группового тестирования в лабораторной практике в связи с повышенным уровнем риска пропуска инфицированных пациентов и вероятностью перепутывания проб при дополнительных манипуляциях, связанных с процедурами объединения образцов [7].
С учетом этого были предложены критерии, позволяющие оценить применимость методики пулирования для выявления искомого аналита:
1) уровень аналита у тестируемых пациентов должен быть по меньшей мере в 10 раз выше, чем у здоровых индивидуумов;
2) разбавление образца не должно существенно снижать клиническую чувствительность;
3) распространенность тестируемой патологии должна быть низкой, в пределах 1–10%;
4) должны отсутствовать требования к быстродействию анализа;
5) должна быть необходимость в экономии ресурсов для достижения максимальной эффективности принимаемых по результатам тестирования мер [11].
По нашему мнению, методология выявления НС в пулированных образцах соответствует практически всем перечисленным выше критериям, что обосновывает несомненную целесообразность ее разработки в сочетании с использованием высокочувствительных мультиплексных тестов.
Существенное снижение затрат обеспечивает также централизация лабораторных исследований путем сбора образцов биологического материала (мочи, крови и других биологических жидкостей) в виде пятен, высушенных на фильтровальной бумаге, с последующим транспортированием в центральную лабораторию для проведения анализа [12][13]. Почтовая пересылка тест-бланков не требует «холодовой цепи» и может быть использована для аккумуляции образцов в едином (или региональном) центре диагностических исследований, как это реализовано в государственных программах скрининга наследственных болезней обмена у новорожденных. Надежность тестирования биологически активных соединений, в том числе НС, в высушенных на бумаге образцах послужила основой для внедрения этой технологии в мировую систему Всемирного антидопингового агентства (WADA)4 допинг-контроля спортсменов.
Для анализа пулированных сухих проб мочи (или крови) требуются высокочувствительные и экономичные средства детектирования НС. Традиционные иммунохроматографические тесты для реализации такого подхода малопригодны из-за недостаточной чувствительности и точности. Возможно применение чувствительного метода хромато-масс-спектрометрии [14], однако его потенциал для скрининга ограничен высокой стоимостью тестирования и сложностью обслуживания.
Высокоэкономичным решением представляется разработка отечественной технологической платформы мультиплексного иммуноанализа на основе микропланшетных иммуночипов с детектированием люминесцентного сигнала в режиме временного разрешения (технология ФОСФАНТМ) [15][16]. Иммуночипы, выполненные по этой технологии, представляют собой микроэррэи (микрозоны) на дне 96 луночных микропланшетов, каждый из которых предназначен для выявления одного из видов НС. Расход ключевых реагентов для создания таких тестов снижается многократно по сравнению с традиционными иммунохроматографическими методами, при этом микропланшетный формат иммуночипов позволяет осуществлять высокопроизводительный параллельный скрининг множества образцов.
Цель исследования — разработка на основе технологии ФОСФАНТМ метода мультиплексного иммуноанализа для обнаружения основных групп наркотических, психотропных средств в пулах образцов мочи, высушенных на бумаге, с последующей оценкой перспектив его применения для выявления наркозависимых лиц в рамках расширенного диспансерного наркоконтроля.
МАТЕРИАЛЫ И МЕТОДЫ
При создании теста для выявления НС использовали следующие иммунобиологические препараты: мышиные моноклональные антитела (МКА) к морфину (MOR), бензоилэкгонину (BZE), амфетамину (AMP), метамфетамину (mAMP), метадону (MTD), бензодиазепинам (BZD), барбитуратам (BAR) и D9-тетра-гидроканнабинолу (THC) (CalBioreagents Inc., США), меченные биотином по стандартной методике (SIGMA, США); конъюгаты MOR, BZE, AMP, mAMP, MTD, BZD, BAR и THC с бычьим сывороточным альбумином (CalBioreagents, США).
В качестве проявляющего реагента использовали конъюгат стрептавидина с Pt-копропорфирином («Иммуноскрин», РФ).
Сухие образцы для исследования были приготовлены из 50 жидких образцов мочи человека, содержащих различные наркотические и ненаркотические соединения в различных сочетаниях и концентрациях (образцы предоставлены МГМУ им. И.М. Сеченова). Жидкие образцы аттестованы по результатам химико-токсикологического исследования (ХТИ)5, а также предварительно охарактеризованы в разработанном нами ранее мультиплексном тесте НАРК-ФОСФАН [15].
Для приготовления сухих образцов использовали тест-полоски (бланки) фильтровальной бумаги (Whatman 903, США) шириной 0,45 см и длиной не менее 3–4 см; полоски пропитывали мочой, погружая в емкость с жидким образцом на 1 мин, с последующим высушиванием на воздухе. Бланки хранили при температуре плюс 4 °С с осушителем в пакете из фольги. Для проведения анализа использовали фрагменты бумажной тест-полоски размером 0,45×0,45 см, содержащие сухой материал, эквивалентный по объему 8,0 ± 0,4 мкл жидкой мочи. Бумага Whatman 903 обеспечивала стандартность объема пробы в расчете на единицу площади и хорошую сохранность биоматериала.
Сухие образцы мочи (всего 31 образец) были приготовлены из 50 жидких проб следующим образом: 30 сухих образцов — из 30 жидких образцов, содержащих НС в разных сочетаниях и концентрациях; один образец (отрицательный сухой образец) — из смеси 20 жидких образцов мочи, в которых по результатам ХТИ были выявлены различные распространенные лекарственные препараты, но не детектированы наркотические соединения [15].
Для исследования стабильности НС в сухих образцах при хранении приготовленные образцы выдерживали при температурах 25 ± 5, 4–8 или -20 °С в течение 14 дней, 6 или 12 мес. соответственно. Влияние температуры хранения биообразцов считали несущественной при различии в уровне НС до и после хранения образцов менее 15%.
Для анализа сухих образцов мочи использовали модифицированный вариант тест-системы НАРК-ФОСФАН, разработанной нами ранее [15]. Иммуночипы представляли собой напечатанные на дне лунок 96-луночного полистиролового планшета (Nunc, Дания) 8 тестовых микрозон для выявления исследуемых НС (BZE (кокаин); THC (каннабиноиды); AMP (амфетамин); MOR (опиаты); BZD (бензодиазипины); BAR (барбитураты); mAMP (метамфетамин); MTD (метадон) и одной контрольной зоны С; в тестовых зонах сорбированы соответствующие конъюгаты НС с белком (сывороточным альбумином), в контрольной зоне С — конъюгат биотина с сывороточным альбумином (рис. 1). Печать иммуночипов проводили методом бесконтактной печати, что позволило снизить вариабельность приготовления микроэррэев и уменьшить объем сорбируемых иммунореагентов до 2,5 нл по сравнению с прежним вариантом тест-системы [15].
Созданный иммуночип позволяет выявлять восемь НС (MOR, BZE, THC, MTD, BZD, BAR, AMP и mAMP) в одной лунке планшета. Принцип анализа — конкурентная реакция между НС из исследуемой пробы и конъюгатами НС в тестовых зонах иммуночипа за связывание с биотинилированными антителами к НС. При отсутствии в пробе НС специфические меченные биотином МКА связываются в соответствующих микрозонах лунки планшета, которые затем проявляются с помощью стрептавидина, меченного длительно люминесцирующим метчиком Pt-копропорфирином. При наличии в пробе НС часть специфичных биотинилированных антител связывается с ними и удаляется в ходе промывки лунок планшета. Чем выше концентрация НС в пробе, тем ниже остаточный уровень сигнала в тестовой микрозоне.
Схема проведения иммуноанализа на НС с использованием бумажных тест-полосок и пулирования образцов представлена на рисунке 2.
От тест-полосок, пропитанных образцами мочи, отрезали по линии перфорации квадратные фрагменты размером 0,45×0,45 см и помещали их в лунки вспомогательного несорбирующего плоскодонного планшета. В каждую лунку добавляли экстрагирующий раствор (объем раствора варьировали от 25 до 500 мкл), содержащий смесь биотинилированных мышиных МКА к 8 анализируемым НС, и инкубировали в течение 30 мин. Затем 25 мкл образовавшейся реакционной смеси переносили в лунки планшета с напечатанными иммуночипами и инкубировали в течение 1 ч. После отмывки в лунки добавляли по 25 мкл конъюгата стрептавидина с Pt-копропорфирином и инкубировали 15 мин. Разведения МКА и конъюгата готовили в буфере (рН 7,75), содержащем 12,1 мг/мл трис-(гидроксиметил)-аминометана, 0,1 мл/л твин 20, 0,5 мг/мл БСА (бычий сывороточный альбумин), 8,7 мг/мл хлорида натрия, 0,5 мг/мл азида натрия (все реагенты SIGMA, США). Все инкубации проводили при встряхивании 700 об/мин при комнатной температуре. Затем планшет промывали и высушивали.
Наличие НС в образце оценивали по степени ингибирования связывания антител в соответствующей тестовой зоне с помощью расчета отношения В/В0 (В — уровень фосфоресцентного сигнала при заданной концентрации НС, В0 — уровень фосфоресцентного сигнала при нулевой концентрации НС), характеризующего степень ингибирования сигнала фосфоресценции в соответствующей тестовой зоне иммуночипа. Работоспособность теста контролировали по уровню сигнала, регистрируемого в контрольной зоне иммуночипа, в которой происходит связывание конъюгата стрептавидина с люминесцирующим метчиком Pt-копропорфирином.
Регистрацию фосфоресцентного сигнала осуществляли на индикаторе фотолюминесценции импульсном ИФИ-05 («Иммуноскрин», Россия) путем сканирования дна лунки планшета импульсами света с длиной волны излучения 365 нм в стробоскопическом режиме с частотой следования импульсов 10 кГц и выделением сигнала длительной люминесценции Pt-копропорфирина с максимумом 645 нм и постоянной времени затухания 40 мкс. Обработку и представление результатов осуществляли с помощью программных средств индикатора. Для каждого исследуемого образца и выявляемого НС автоматически было рассчитано отношение (В/В0) интенсивностей сигнала фосфоресценции, регистрируемых в соответствующей тестовой зоне иммуночипа в лунках с анализируемым образцом (В) и без добавления образца В0.
Измерения проводили в трех повторах с расчетом среднего значения (М) результатов измерений и ошибки среднего (SE). Для статистической обработки результатов использовали стандартные программы Microsoft Office Professional Plus Excel 2013 (версия 15.0.4727.1000, США).

Рисунок подготовлен авторами
Рис. 1. Схема размещения микрозон иммуночипа на дне лунок 96-луночного микропланшета: BZE (кокаин); THC (каннабиноиды); AMP (амфетамин); MOR (опиаты); BZD (бензодиазепины); BAR (барбитураты); mAMP (метамфетамин); MTD (метадон); С (контроль)
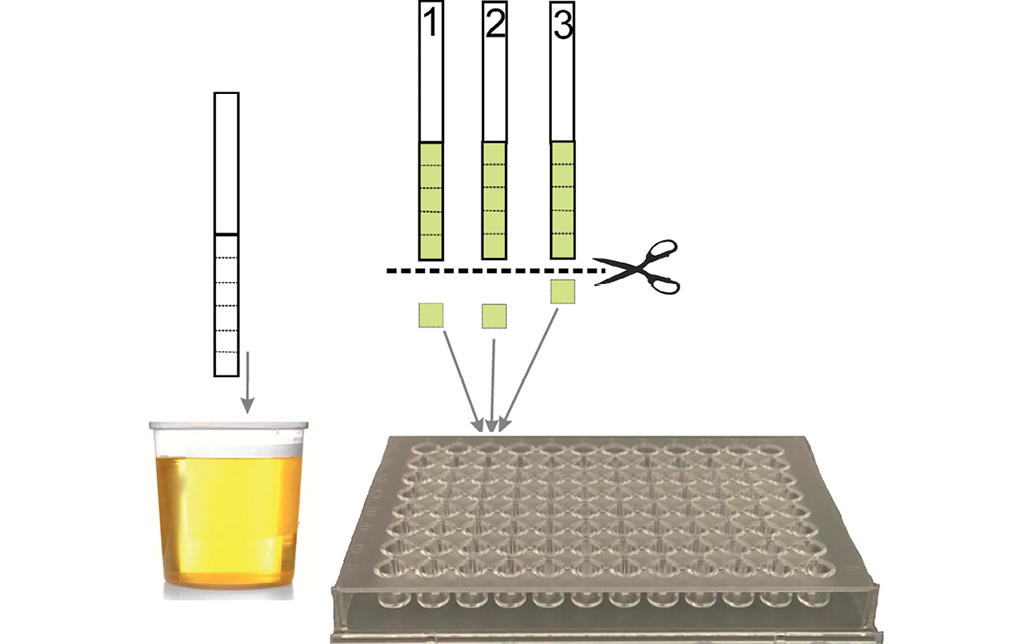
Рисунок подготовлен авторами
Рис. 2. Схема проведения исследования образцов мочи на НС с использованием бумажных тест-стрипов и процедуры пулирования
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При разработке технологии мультиплексного иммуноанализа с использованием пулированных высушенных проб в первую очередь следовало оценить чувствительность обнаружения каждого из исследуемых НС. С этой целью был проведен анализ тест-полосок с пробами мочи с известными уровнями НС. Для приготовления модельных экстрактов фрагменты тест-полосок помещали в экстрагирующий раствор различного объема, подобранного таким образом, чтобы концентрация НС в образующихся реакционных смесях охватывала диапазон 5–300 нг/мл. На основе кривых ингибирования регистрируемого сигнала для каждого из восьми НС (рис. 3) были рассчитаны вероятные пределы детекции анализа ФОСФАН (как уровни НС, соответствующие значению интенсивности регистрируемого сигнала при анализе пробы, не содержащей данное НС, минус два стандартных отклонения), которые оказались для разных НС в 3–150 раз ниже значений, рекомендованных для скрининговых тестов при проведении ХТИ (табл.).
При переходе к исследованию пулированных образцов необходимо было учесть, что увеличение числа анализируемых одновременно фрагментов тест-полосок приводит к возрастанию объема экстрагирующего раствора, необходимого для полного пропитывания всех фрагментов и экстрагирования исследуемых НС с последующим отбором 25 мкл образовавшейся реакционной смеси для анализа с использованием иммуночипов. Проведенные нами исследования показали, что для анализа одного фрагмента достаточно 50 мкл экстрагирующего раствора; для пулов из 5, 10, 20 и 40 образцов минимальный объем раствора составил 100, 160, 240 и 400 мкл соответственно. Следовательно, разведение исследуемого образца мочи по мере увеличения числа образцов в пуле последовательно возрастало в 2, 3, 5 и 8 раз по сравнению с анализом одного образца.
На рисунке 4 представлены результаты применения иммуночипа для анализа четырех сухих образцов мочи человека, содержащих восемь НС в различных сочетаниях и концентрациях; указанные образцы исследовали индивидуально и в составе пулов из 5, 10, 20 и 40 образцов. В каждом пуле содержался один положительный образец и различное число фрагментов полосок отрицательного сухого образца.
Для всех исследованных образцов значения отношений В/В0 в тестовых зонах для специфического связывания присутствующих в образце наркотических соединений линейно повышались от очень низких значений до 75% при увеличении кратности пулирования. Значения В/В0, рассчитанные в тестовых зонах для выявления отсутствующих в образце НС, варьировали в пределах 70–110% (рис. 4).
Основываясь на результатах этих опытов (рис. 4), был сделан вывод о целесообразности (по аналитическим и экономическим параметрам) использования пулов не более чем из 10 образцов. В этом случае отношение В/В0, регистрируемое в специфических тестовых зонах иммуночипа в присутствии НС, не превышало 40% для всех исследованных образцов. Диапазоны значений параметра В/В0 в тестовых зонах в присутствии искомого НС заведомо не пересекались с диапазонами значений, регистрируемых в них при отсутствии данного НС в образце. Исходя из полученных результатов значение В/В0, равное 50%, было выбрано в качестве порогового уровня для обнаружения НС.
Используя выбранную процедуру анализа с применением 10-кратного пулирования (1 образец с НС + 9 образцов без НС), были исследованы 30 сухих образцов, содержащих по данным исследования исходных жидких проб мочи в различных сочетаниях НС с диапазонами концентраций: 168–230 нг/мл BZE, 81–206 нг/мл THC, 405–1250 нг/мл AMP, 35–2500 нг/мл
MOR, 251–800 нг/мл BZD, 75–350 нг/мл BAR, 115–471 нг/мл mAMP и 84–375 нг/мл MTD. Результаты представлены на рисунке 5, где для каждой тестовой зоны отдельно обозначены данные анализа образцов, содержащих и не содержащих соответствующие НС.
Согласно полученным данным (рис. 5) в исследованных пулах выявлены: кокаин — в 2 образцах, каннабиноиды — в 11 образцах, амфетамин — в 6 образцах, опиаты — в 9 образцах, бензодиазепины — в 7 образцах, барбитураты — в 10 образцах, метамфетамин — в 7 образцах, метадон — в 6 образцах. В некоторых образцах обнаружены одновременно кокаин и метадон, бензодиазепины и барбитураты, а также другие смеси НС в присутствии очень высоких концентраций опиатов (>2500 нг/мл) и амфетаминов (>1250 нг/мл).
Для всех положительных сухих образцов, содержащих НС, значения В/В0 в соответствующих специфических тестовых зонах были значительно ниже 50%; для остальных образцов, содержащих другие НС, — значительно выше 50% (рис. 5). Следовательно, разработанный метод мультиплексного фосфоресцентного иммуноанализа позволил правильно обнаружить искомые НС в пулах из 10 сухих образцов мочи при отсутствии ложноположительных результатов с другими НС.
Специфичность иммуноанализа также оценили по результатам исследования трех пулов, составленных из 10 фрагментов тест-полосок только отрицательного образца мочи; этот образец был приготовлен из смеси жидких проб от пациентов, в моче которых содержались различные лекарственные ненаркотические препараты, в том числе способные вызывать ложноположительные реакции при постановке иммуноанализа (например, карбамазепин, амитриптилин, декстрометорфан, верапамил и др.) [17]. При проведении тестирования не были выявлены искомые НС ни в одном из исследованных пулов, что подтвердило специфичность разработанного метода мультиплексного фосфоресцентного иммуноанализа.
Таблица. Чувствительность обнаружения НС в модельных экстрактах из высушенных на тест-полосках образцов мочи при анализе методом ФОСФАН
Наркотические, психотропные средства | Аналит | Рекомендованный предел детекции НС при проведении ХТИ, нг/мл | Расчетное значение предела детекции НС по данным ФОСФАН, нг/мл | |
Скрининг | Подтверждение | |||
Опиаты | MOR | 300 | 10 | 2 |
Кокаин | BZE | 25 | 50 | 8 |
Каннабиноиды | THC | 15 | 15 | 6 |
Амфетамин | AMP | 25 | 20 | 8 |
Метамфетамин | mAMP | 25 | 20 | 6 |
Метадон | MTD | 25 | 50 | 2 |
Бензодиазепины | BZD | 20 | 50 | 4 |
Барбитураты | BAR | 50 | 100 | 2 |
Таблица подготовлена авторами по собственным данным
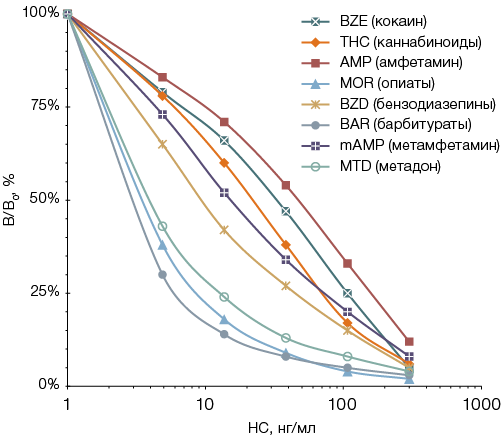
Рисунок подготовлен авторами
Рис. 3. Кривые ингибирования люминесцентных сигналов при определении восьми НС в модельных экстрактах из высушенных на тест-полосках образцов мочи: данные представлены в формате среднего значения (М) результатов измерений (n = 3); ошибка среднего (SE) не превышала 15%
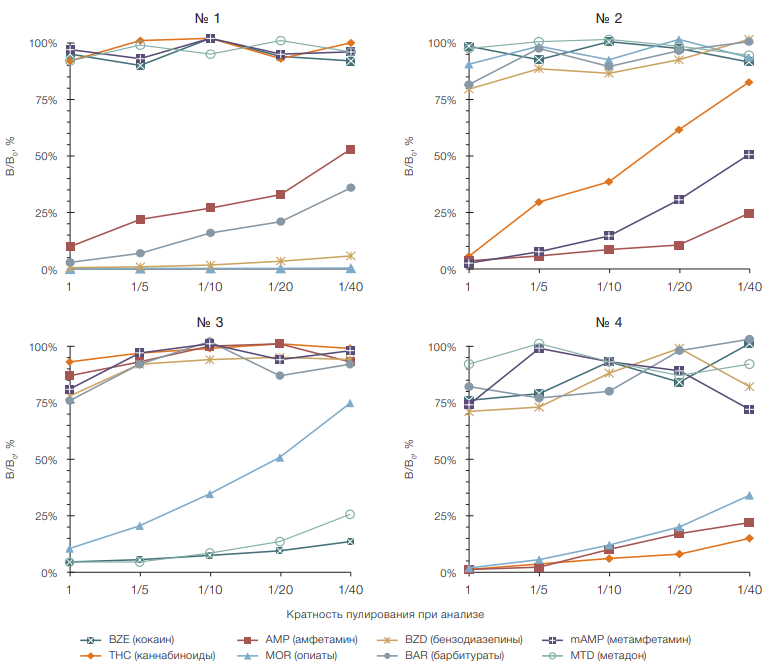
Рисунок подготовлен авторами
Рис. 4. Степень ингибирования сигнала фосфоресценции при обнаружении 8 НС в сухих образцах мочи (№ 1–4) методом ФОСФАН в зависимости от кратности пулирования: исходный уровень НС в жидких пробах мочи (до высушивания на бумажной тест-полоске) составил: образец № 1 — 405 нг/мл AMP, 2500 нг/мл MOR, 506 нг/мл BZD и 75 нг/мл BAR; образец № 2 — 115 нг/мл THC, 1250 нг/мл AMP и 471 нг/мл mAMP; образец № 3 — 230 нг/мл BZE, 36 нг/мл MOR и 375 нг/мл MTD; образец № 4 — 206 нг/мл THC, 1250 нг/мл AMP и 2500 нг/мл MOR; данные представлены в формате среднего значения (М) результатов измерений (n = 3); ошибка среднего (SE) не превышала 15%

Рисунок подготовлен авторами
Рис. 5. Результаты обнаружения 8 НС в 30 сухих образцах мочи, исследованных в виде пулов из 10 образцов методом мультиплексного ФОСФАН на микропланшетных иммуночипах: BZE (кокаин); THC (каннабиноиды); AMP (амфетамин); MOR (опиаты); BZD (бензодиазепины); BAR (барбитураты); mAMP (метамфетамин); MTD (метадон); ромб — образцы, содержащие НС, круг — образцы не содержащие НС, соответствующие данной тестовой зоне; по оси ординат приведены средние значения для трех повторных измерений
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При разработке технологической платформы мультиплексного иммуноанализа с использованием пулированных сухих образцов мочи следовало обеспечить чувствительность и специфичность, сопоставимую с высокочувствительными референсными методами хромато-масс-спектрометрии [12–14]. В основу разработки была положена технология мультиплексного фосфоресцентного иммуноанализа на микропланшетных иммуночипах, продемонстрировавшая ранее возможность достижения низких пределов обнаружения НС в жидких пробах мочи (чувствительность составила 1 нг/мл для морфина и метадона, 0,5 нг/мл — для барбитуратов, 2 нг/мл — для бензоилэкгонина, метамфетамина, каннабиноидов и бензодиазепинов, 8 нг/мл — для амфетамина) при отсутствии значимых перекрестных реакций [15].
Задача настоящего исследования состояла в адаптации технологии ФОСФАН для анализа пулированных сухих образцов. Их исследование, как известно, сопровождается неизбежным снижением чувствительности вследствие неполноты десорбции и дополнительного разведения при экстракции аналитов с бумаги. Для решения этой задачи использовали ряд технологических приемов, позволивших повысить уровень чувствительности модифицированных тестов ФОСФАН при сохранении их специфичности.
Формирование иммуночипов проводили методом бесконтактной печати с объемом микроэррэев 2,5 нл (вместо 20–25 нл при контактной печати в ранее использовавшемся методе [15]). Достигнутое таким образом снижение количества конъюгированного антигена НС в тестовой микрозоне иммуночипа привело к 2–3-кратному снижению предела детекции НС в конкурентном иммуноанализе.
В методику добавлена стадия предварительной экстракции НС из бумажных тест-полосок (исследуемых в виде фрагментов размером 4,5×4,5 мм) в присутствии специфических биотинилированных антител. Предварительное взаимодействие НС пробы с антителами в отсутствие конкуренции с конъюгатом БСА за НС обеспечило бóльшую степень ингибирования и, соответственно, дополнительное снижение порога обнаружения.
Способ приготовления сухих проб путем погружения тест-полоски в емкость с образцом мочи человека обеспечивает пропитывание достаточно большой площади, что позволяет провести до 5 повторных измерений образца (рис. 2), в том числе для подтверждающего исследования в случае выявления НС в исследуемом пуле. Формат анализируемых фрагментов тест-полосок (4,5×4,5 мм) обеспечивает возможность пулирования до 10 образцов в одной лунке микропланшета.
Предложенный метод анализа НС из пула сухих образцов мочи может составить основу новой методологии скрининга, включающей отбор проб мочи, нанесение их на бумажные тест-бланки и транспортировку в лабораторию, в том числе путем почтовой пересылки, для проведения исследования на НС.
Важно отметить, что особые требования к «холодовой цепи» при пересылке сухих образцов отсутствуют, так как уровень НС в высушенных на бумаге образцах мочи сохраняется достаточно стабильным. Так, по результатам наших исследований при хранении в течение 5 суток при комнатной температуре, 1 месяца при 4 °С и до 6 месяцев в замороженном виде уровни анализируемых 8 НС снижались не более чем на 15%; это соответствует данным, полученным другими исследователями в отношении широкого спектра аналитов, выявляемых в высушенных на бумаге клинических образцах мочи и крови [14].
В лаборатории собранные пробы можно объединять в пулы из 10 образцов и проводить предварительный анализ, в котором каждый пул исследуется в одной лунке микропланшетного иммуночипа. Если в пуле обнаружено присутствие одного из исследуемых НС, то проводится подтверждающий тест, включающий тестирование каждого из 10 образцов данного пула с определением точного значения концентрации НС в образце по соответствующим калибровочным кривым, встроенным в программное обеспечение биочип-анализатора.
На основании полученных в данной работе результатов пороговым уровнем для признания результата теста положительным было выбрано значение В/В0 = 50%. Для уточнения данного критерия следует провести исследования с использованием более широкой выборки образцов. Возможно, будет необходимо для каждого анализируемого НС выбрать свои критерии оценки с целью снижения вероятности получения ложноположительных или ложноотрицательных результатов.
Благодаря высокой чувствительности разработанный метод мультиплексного фосфоресцентного иммуноанализа позволил обнаружить в пуле из 10 образцов восемь основных НС. Специфичность метода подтверждена правильным выявлением НС во всех исследуемых образцах, в том числе при наличии в пробе других НС, и отсутствием неспецифических реакций при анализе пула из отрицательных образцов мочи, содержащих различные лекарственные ненаркотические препараты.
Предлагаемая технологическая платформа не имеет принципиальных ограничений для расширения панели НС, выявляемых на одном иммуночипе. Проведенные нами предварительные эксперименты показали возможность дополнительного включения в состав тестируемых НС синтетических каннабиноидов (К2) и катинонов (MDPV), фенциклидина, фентанила и экстази (MDMA), чувствительность и специфичность обнаружения которых удовлетворяют требованиям к построению теста с использованием методологии пулирования образцов. Таким образом, число одновременно детектируемых НС может быть расширено как минимум до 13 и охватывать все группы веществ, подлежащие обязательному контролю при проведении химико-токсикологических исследований при выявлении наркозависимых лиц.
ВЫВОДЫ
- Разработан метод мультиплексного фосфоресцентного микропланшетного иммуноанализа для выявления восьми основных групп наркотических, психотропных средств в пулах из высушенных на бумаге образцов мочи.
- Пределы детекции исследуемых НС в экстрактах из высушенных на тест-полосках образцов мочи составили от 2 до 8 нг/мл, что существенно ниже рекомендованных для скринингового обследования пределов детекции.
- Предложенный подход к мультиплексному иммуноанализу НС в пулах сухих образцов мочи может составить основу новой методологии скрининга, включающей отбор проб мочи, нанесение их на бумажные тест-бланки и транспортировку в лабораторию для проведения исследования на НС.
- Согласно нашим оценкам использование мультиплексного фосфоресцентного иммуноанализа и пулированных образцов мочи позволит кардинально (более чем в 10 раз) снизить стоимость тестирования по сравнению с традиционными технологиями иммунохроматографического анализа. Централизованная лаборатория, оснащенная высокопроизводительным отечественным индикатором фотолюминесценции импульсным ИФИ-05, может обеспечить обработку в рабочую смену не менее 10 000 образцов, объединенных в пулы по 10 образцов. При массовом обследовании групп лиц на критически важных объектах стоимость одного обследования на 8–13 НС не превысит 20–30 руб., или 2–3 руб. на один выявляемый вид НС.
- Создание на базе ФГУП ГосНИИБП и ООО «Иммуноскрин» высокоэкономичной отечественной технологии для скрининга НС с использованием пулированных образцов мочи способствует дальнейшему развитию этой технологии, целесообразности подготовки предложений для проведения пилотных обследований, организации расширенного диспансерного наркоконтроля на территориях закрытых административно-территориальных образований, обслуживаемых ФМБА России.
1 United Nations Office on Drugs and Crime (UNODC). World Drug Report; 2024.
2 Roberts L. Drug addiction in Russia: statistics, therapy, prevention. Modern-info.com. 2025.
3 Федеральный закон Российской Федерации 61-ФЗ «Об обращении лекарственных средств». М.: Совет Федерации; 12.04.2010.
4 WADA. Technical Document Dried Blood Spots (DBS) for Doping Control. 2023.
5 Методические указания «Правила проведения химико-токсикологических исследований на предмет наличия в организме человека наркотических средств, психотропных и иных токсических веществ (их метаболитов) при проведении медицинских осмотров и медицинских освидетельствований отдельных категорий граждан». М.: Минздрав России; 2015.
Список литературы
1. Коршунов ВА, Миндлина АЯ, Вязовиченко ЮЕ. Анализ системы первичной профилактики наркомании в Российской Федерации и предложения по ее оптимизации. Сеченовский Вестник. 2016;1(23):31–8.
2. Позднякова МЕ. Наркоситуация в России и новые модели употребления наркотиков. Социология Медицины. 2016;15(1):25–30.
3. Каймак ЕВ. Угрозы наркотизма на критически важных потенциально опасных объектах инфраструктуры России. Биосфера. 2012;2:107–15.
4. Grobe N, Cherif A, Wan X, Don Z, Kotanko P. Sample pooling: burden or solution? Clinical Microbiology and Infection. 2021;27:1212–20. https://doi.org/10.1016/j.cmi.2021.04.007
5. Mardal M, Kinyua J, Ramin P, Miserez B, van Nuijs ALN, Covaci A, et al. Screening for illicit drugs in pooled human urine and urinated soil samples and studies on the stability of urinary excretion products of cocaine, MDMA, and MDEA in wastewater by hyphenated mass spectrometry techniques. Drug Testing and Analysis 2017;9(1):106–14. https://doi.org/10.1002/dta.1957
6. Dziadosz M, Klintschar M, Teske J. Sample pooling as an effective way of simultaneous analysis of new designer drugs together with synthetic cannabinoids in human serum provided by therapy and forensic psychiatric centres. Medicine, Science and the Law. 2016;56(2):155–6. https://doi.org/10.1177/0025802415587319
7. Ольховский ИА, Гущин ВА, Кузнецова НА, Рубальский ОВ. Об использовании объединенных (пулированых) образцов при исследованиях на наличие РНК вируса SARS-CoV-2 методом полимеразной цепной реакции. Лабораторная Служба. 2021;10(1):68–75. https://doi.org/10.17116/labs20211001168
8. Phan T, Tran NYK, Gottlieb T, Siarakas S, McKew G. Evaluation of the influenza and respiratory syncytial virus (RSV) targets in the AusDiagnostics SARS-CoV-2, Influenza and RSV 8-well assay: sample pooling increases testing throughput. Pathology.2022;54(4):466–71. https://doi.org/10.1016/j.pathol.2022.02.002
9. Mulu A, Alemayehu DH, Alemu F, Tefera DA, Wolde S, Aseffa G, et al. Evaluation of sample pooling for screening of SARS CoV-2. PLoS One. 2021;16(2):e0247767. https://doi.org/10.1371/journal.pone.0247767
10. Griesemer SB, Van Slyke G, St George K. Assessment of sample pooling for clinical SARS-CoV-2 testing. Journal of Clinical Microbiology. 2021;59(4):e01261–20. https://doi.org/10.1128/JCM.01261-20
11. Tan JG, Omar A, Lee W, Wong MS. Considerations for group testing: a practical approach for the clinical laboratory. The Clinical Biochemist. Review. 2020;41(3):79–92. https://doi.org/10.33176/AACB-20-00007
12. Meikopoulos T, Gika H, Theodoridis G, Begou O. Detection of 26 Drugs of Abuse and Metabolites in Quantitative Dried Blood Spots by Liquid Chromatography-Mass Spectrometry. Molecules. 2024;29(5):975. https://doi.org/10.3390/molecules29050975
13. Mazzarino M, Di Costanzo L, Comunità F, Stacchini C, de la Torre X, Botrè F. UHPLC-HRMS method for the simultaneous screening of 235 drugs in capillary blood for doping control purpose: Comparative evaluation of volumetric and non-volumetric dried blood spotting devices. ACS Omega. 2022;7:31845–68. https://doi.org/10.1021/acsomega.2c01417
14. Gaugler S, Al-Mazroua MK, Issa SY, Rykl J, Grill M, Qanair A, et al. Fully automated forensic routine dried blood spot screening for workplace testing. Journal of Analytical Toxicology. 2019;43(3):212–20. https://doi.org/10.1093/jat/bky074
15. Бекман НИ, Помелова ВГ, Осин НС. Мультиплексный анализ наркотических средств на основе технологии иммуночипов ФОСФАН. Клиническая Лабораторная Диагностика. 2018;63(3):178–83. EDN: YVQOVH
16. Бекман НИ, Помелова ВГ, Осин НС. Новая методология скрининга для выявления наркозависимых лиц. Интерпретация результатов лабораторных исследований: мат-лы XXIX Всеросс. науч.-практ. конф. с междунар. участием. М.; 2024.
17. Saitman A, Hyung-Doo P, Fitzgerald R. False-positive interferences of common urine drug screen immunoassays. Journal of Analytical Toxicology. 2014;38(7):387–96. https://doi.org/10.1093/jat/bku075
Об авторах
Н. И. БекманРоссия
Бекман Наталья Игоревна, канд. хим. наук
Москва
Дубна, Московская обл.
В. Г. Помелова
Россия
Помелова Вера Гавриловна, д-р биол. наук
Москва
Дубна, Московская обл.
Н. С. Осин
Россия
Осин Николай Сергеевич, д-р биол. наук
Москва
Дубна, Московская обл.
Дополнительные файлы
Рецензия
Для цитирования:
Бекман Н.И., Помелова В.Г., Осин Н.С. Перспективы интеграции мультиплексного фосфоресцентного иммуноанализа пулированных сухих образцов мочи в скрининговое обследование при диспансерном наркоконтроле. Медицина экстремальных ситуаций. 2025;27(3):400-409. https://doi.org/10.47183/mes.2025-261
For citation:
Bekman N.I., Pomelova V.G., Osin N.S. Integration prospects for the multiplex phosphorescence immunoassay of pooled dry urine samples into screening examinations in dispensary drug control. Extreme Medicine. 2025;27(3):400-409. https://doi.org/10.47183/mes.2025-261

















