Перейти к:
Регионарный кожный кровоток у здоровых обследуемых в условиях 21-суточной антиортостатической гипокинезии
https://doi.org/10.47183/mes.2025-267
Аннотация
Введение. Исследование микроциркуляторного звена как элемента сердечно-сосудистой системы применительно к космической медицине актуально как для выявления адаптационных изменений к невесомости, так и поиска новых диагностических критериев оценки функционального состояния организма космонавта в перспективе дальних космических полетов.
Цель. Изучение микрокровотока и его регуляции в различных областях кожи у здоровых добровольцев в условиях 21-суточной антиортостатической (–6°) гипокинезии (АНОГ).
Материалы и методы. В эксперименте приняли участие 6 мужчин-добровольцев в возрасте 26–34 лет. Для моделирования транслокации жидких сред и гиподинамии испытуемые находились в антиортостатическом положении в течение 21 сут Микроциркуляцию исследовали с помощью метода лазерной доплеровской флоуметрии с использованием портативных лазерных анализаторов «ЛАЗМА ПФ» (ООО НПП «ЛАЗМА», Россия). Исследование проводили за 2 сут до начала АНОГ, на 3, 7, 15, 18 и 20 сут экспериментального воздействия, а также через 2 сут после окончания АНОГ. Статистический анализ данных проведен с использованием программного обеспечения Statistica 13.0 (IBM; США).
Результаты. Обнаружено статистически значимое снижение базальной перфузии и амплитуды миогенных колебаний в области кожи лба и голени на 3 сут в условиях антиортостатической гипокинезии. Анализ результатов функциональных проб на предплечье показал уменьшение индекса дыхательной пробы на 10,87% на протяжении всего экспериментального периода, снижение венуло-артериолярной реакции на 3 сут гипокинезии в среднем на 10,64% и увеличение на 91,82% резерва капиллярного кровотока на 3 сут, сохраняющееся на протяжении всего воздействия.
Выводы. Эффект воздействия АНОГ выражен в снижении кожной перфузии на фоне увеличенного тонуса терминальных артериол и прекапиллярных сфинктеров в области лба и голеней, что может указывать на распределение микрокровотока в сторону более крупных сосудов. Несмотря на стабильность перфузии в области кожи предплечья в покое, проведенные функциональные пробы показали, что, вероятно, условия АНОГ приводят к изменению вазомоторной функции.
Ключевые слова
Для цитирования:
Пашкова Д.В., Попова Ю.А., Федорович А.А., Шпаков А.В. Регионарный кожный кровоток у здоровых обследуемых в условиях 21-суточной антиортостатической гипокинезии. Медицина экстремальных ситуаций. 2025;27(1):124-130. https://doi.org/10.47183/mes.2025-267
For citation:
Pashkova D.V., Popova J.A., Fedorovich A.A., Shpakov A.V. Regional cutaneous blood flow in healthy subjects under conditions of 21-day head-down bed rest. Extreme Medicine. 2025;27(1):124-130. https://doi.org/10.47183/mes.2025-267
ВВЕДЕНИЕ
Невесомость, являясь одним из основных факторов космического полета (КП), в достаточно сильной степени влияет на состояние сердечно-сосудистой системы (ССС). В первую очередь это влияние вызвано перераспределением крови в краниальном направлении. Кроме того, эффекты, оказываемые факторами КП на ССС, включают такие изменения, как перемещение жидкости из внутрисосудистых отделов во внутриклеточные пространства, снижение общего объема циркулирующей крови, потерю массы миокарда, снижение сосудистого сопротивления, увеличение венозного возврата, ортостатическая непереносимость после возвращения к условиям гравитации [1][2].
Перспектива осуществления дальних космических полетов (на Луну, Марс и т. д.) с возможностью высадки на их поверхности ставит перед исследователями задачи решения медицинских вопросов без возможности оперативной информационной поддержки с Земли. Если принять во внимание этот факт, то оценка функционального состояния кровеносной системы как на макро-, так и на микроуровне в значительной степени способна отражать общую адаптационную реактивность организма и его устойчивость к внешним воздействиям. С этой точки зрения в качестве объекта исследования интерес вызывает микроциркуляторное русло — «конечное» звено сердечно-сосудистой системы, которое одним из первых реагирует на изменения окружающей среды [3]. Кожа является одним из наиболее доступных объектов исследования микроциркуляции крови, при этом следует учитывать, что кожный кровоток принимает непосредственное участие в терморегуляции [4].
По данным N. Charkoudian известно, что кожная микроциркуляция реагирует на тепловой или холодовый стресс [5], при этом научные данные из различных источников могут иметь расхождения, что обусловлено разнообразием применяемых методов оценки общего теплового воздействия [6][7]. Так, по данным А.А. Федорович и соавт., при 30-суточном пребывании в гермообъекте в условиях температуры +30…+38 °С и влажности 30–50% не было обнаружено увеличения тканевой перфузии, регистрируемой методом лазерной доплеровской флоуметрии (ЛДФ) на предплечье, что объяснялось особенностями ангиоархитектоники кожи и глубиной зондирования измерительной аппаратурой [6]. Исследование микроциркуляторного русла кожи Yuan et al. с применением метода ЛДФ в эксперименте со 180-суточной изоляцией в нейтральных по температуре и влажности условиях выявило снижение реакции кровотока на пробу с ацетилхолином, что указывало на проявление эндотелиальной дисфункции [8]. На данный момент известно о двух экспериментах по изучению кожной микрогемоциркуляции в условиях КП. В первом исследовании [9] авторы оценивали кожный кровоток и эндотелийзависимую вазодилатацию на уровне предплечья методом ЛДФ в сочетании с ионофорезом ацетилхолина во время 3-недельного КП на станции «Тяньгун-2» у двух тайконавтов. Авторы наблюдали небольшое снижение базальной перфузии во время и после КП, а также признаки нарушения функции эндотелия. Во втором исследовании [10], проведенном на борту МКС с участием одного космического туриста и одного профессионального космонавта, было обнаружено снижение тканевой перфузии и повышение сосудистого тонуса на 2-е и 3-е сут КП в области кожи I пальца стопы и височной области головы. При этом были обнаружены функциональные различия в показателях кожной перфузии кожи верхних и нижних конечностей между обследуемыми космонавтами, что авторы связывают с применением профилактического средства перераспределения крови у одного из участников исследования [10].
Сложность организации космических экспериментов и малый размер выборок обследуемых космонавтов при многокомпонентности факторов КП на данный момент не позволяют всесторонне изучить микроциркуляторное звено и его регуляцию в этих условиях. На Земле оценить влияние таких эффектов невесомости, как гиподинамия, снятие опорной нагрузки, перераспределение жидких сред в краниальном направлении, позволяют модельные эксперименты. Одним из таких является антиортостатическая гипокинезия (АНОГ), которая в первую очередь позволяет моделировать перераспределение жидких сред организма в краниальном направлении.
Цель исследования — изучение микрокровотока и его регуляции в различных областях кожи у здоровых мужчин-добровольцев в условиях 21-суточной антиортостатической гипокинезии.
МАТЕРИАЛЫ И МЕТОДЫ
Комплексный эксперимент с участием 6 здоровых добровольцев мужского пола (средний возраст 30,3 ± 5,2 года; вес — 72,8 ± 7,7 кг; рост — 177,1 ± 6,3 см) проведен на стендовой базе «Гипогравитация» ГНЦ РФ — ИМБП РАН. Добровольцы находились в антиортостатическом положении с углом наклона тела относительно горизонта -6° без применения профилактических физических упражнений при умеренном ограничении двигательной активности в течение 21 сут. Вертикализация обследуемых осуществлялась для кратковременных гигиенических процедур (один раз ежедневно), а также для проведения пассивного ортостатического теста (на 6, 14 и 19-е сут) и теста с отрицательным давлением на нижнюю половину тела (ОДНТ) на 19 сут. По медицинским показаниям один из испытуемых был допущен для участия в эксперименте с ограничениями: при условии исключения нагрузочных проб, в том числе ортостатических. Подробные условия проведения эксперимента описаны в статье [11].
Для оценки состояния микроциркуляторного русла кожи применяли метод лазерной доплеровской флоуметрии (ЛДФ), в основе которого лежит зондирование исследуемой области с помощью лазерного излучения и анализ отраженного сигнала от движущихся в кровотоке эритроцитов. Критериями исключения для данного исследования микроциркуляторного русла кожи (МЦР) методом ЛДФ являлись: возраст старше 40 лет, наличие дополнительных факторов воздействия (дыхание гипероксическими смесями и т.д.), наличие у обследуемых невусов и татуировок в области наложения датчиков. Все шесть участников эксперимента по этим условиям вошли в группу исследования.
Для регистрации показателей микроциркуляции методом ЛДФ использовали три портативных лазерных анализатора «ЛАЗМА ПФ» (ООО НПП «ЛАЗМА», Россия), длина волны зондирующего излучения — 850 нм. Один датчик располагали на недоминантной руке в области Захарьина — Геда: по срединной линии предплечья, на 3–4 см выше шиловидных отростков лучевой и локтевой костей. Второй — на передне-внутренней поверхности в нижней трети голени. Третий датчик устанавливали в центральной зоне лба (рис. 1).
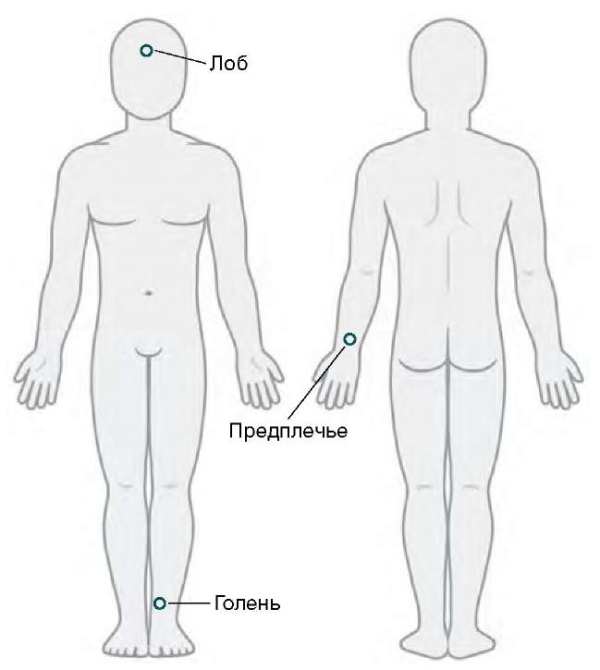
Рисунок подготовлен авторами по данным интернет-источника
Рис. 1. Расположение портативных лазерных анализаторов во время исследования
Анализаторы фиксировали с помощью медицинских трубчатых эластичных бинтов. Общее время исследования составляло 45 минут. На первом этапе регистрировали базальную перфузию в покое: обследуемый находился в расслабленном положении лежа, при спокойном дыхании в состоянии бодрствования. По истечении 10 минут в области предплечья осуществляли функциональные пробы: дыхательную, окклюзионные (венозную и артериальную) пробы. Дыхательная проба включает маневр задержки дыхания (в течение 15 с после быстрого глубокого вдоха через рот) и позволяет провести оценку функционального состояния симпатической вазомоторной регуляции. Венозная окклюзия создается путем нагнетания давления в плечевой манжете до 40 мм рт. ст. и поддержанием его на этом уровне в течение 2 мин, благодаря чему искусственно создается увеличение посткапиллярного давления, но при этом нет препятствия притоку артериальной крови, что позволяет оценить венуло-артериолярную констрикторную реакцию без вовлечения симпатической регуляции. Для определения резерва капиллярного кровотока применяли артериальную окклюзию, для проведения которой в плечевой манжете нагнетали давление на уровне 30–50 мм рт. ст. выше индивидуального систолического и поддерживали на этом уровне в течение 3 мин с последующей регистрацией параметров в периоде постокклюзионной гиперемии. Применение данных проб позволяет оценить состояние механизмов регуляции тканевого кровотока, а также общее функциональное состояние микроциркуляторного русла в области кожи предплечья согласно принятой методологии [12][13].
С помощью специального программного обеспечения «Lazma» (ООО НПП «ЛАЗМА», Россия) рассчитывали базальный уровень перфузии (М) в перфузионных единицах (п.е.), а также амплитудно-частотный спектр осцилляций кровотока на основе вейвлет-анализа: максимальные амплитуды вазомоций определяли в соответствующих частотных диапазонах: Аэ, Ан, Ам, Ав, Ас (эндотелиальные, нейрогенные, миогенные, венулярные (дыхательные) и сердечные компоненты формирования микрососудистого тонуса соответственно). При выполнении функциональных проб оценивали следующие показатели: ИДП — индекс дыхательной пробы, ВАР — венуло-артериолярная реакция, РКК — резерв капиллярного кровотока (по данным ЛДФ-граммы кожи предплечья).
Исследование микроциркуляторного русла проводили за 2 сут до начала воздействия (фоновое исследование), на 3, 7, 15, 18, 20-е сут во время воздействия АНОГ, а также через два дня после окончания воздействия (период последействия). Регистрацию изучаемых параметров до и после периода АНОГ осуществляли в положении обследуемого лежа (через 15 мин. после адаптации к горизонтальному положению), в условиях АНОГ — в антиортостатическом положении обследуемого. Исследование до и после воздействия выполняли в лабораторных условиях с постоянным микроклиматом: температура окружающей среды — 24,33 ± 2,58 °С, влажность — 57,83 ± 6,97%, атмосферное давление — 741,17 ± 16,57 мм рт. ст. В условиях АНОГ исследование проводили в помещении, параметры окружающей среды в котором были следующие: температура окружающей среды — 23,36 ± 1,34 °С, влажность — 54,57 ± 3,03%; атмосферное давление — 744,57 ± 17,08 мм рт. ст.
Статистический анализ массива полученных данных осуществляли с помощью пакета статистических программ Statistica 13.0 (IBM; США) с использованием метода главных компонент и критерия Вилкоксона [14].
РЕЗУЛЬТАТЫ
При анализе данных исследуемая выборка из 6 человек была проверена на однородность с помощью метода главных компонент по всем показателям, зарегистрированным во время эксперимента. Полученные результаты зафиксировали однородность группы (значения не выходят за пределы двух стандартных отклонений).
Статистический анализ показал, что на 3-и сут пребывания в условиях АНОГ отмечено снижение уровня базальной перфузии (p < 0,05, критерий Вилкоксона) на 32,84% в области кожи лба и 22,52% в области кожи голени (рис. 2). Кроме того, снижение данного показателя в области кожи голени было отмечено на 15-е и 18-е сут воздействия и составило 31,64 и 34,68% соответственно, что, вероятно, связано с циклограммой эксперимента, которая включала в себя ортостатический тест. Стоит отметить, что у обследуемого, которому не проводили ортостатический тест и ОДНТ-тест во время периода АНОГ, к 3-м сут гипокинезии снижение перфузии крови в коже лба составило 7,02%, в течение АНОГ тенденция к снижению этого показателя сохранялась и к 20-м сут воздействия достигла максимального различия с фоном (34,21%). Можно было бы предположить, что изменения кожной перфузии связаны с температурными условиями, поскольку кожа является важнейшим компонентом терморегуляционной системы человека [4].
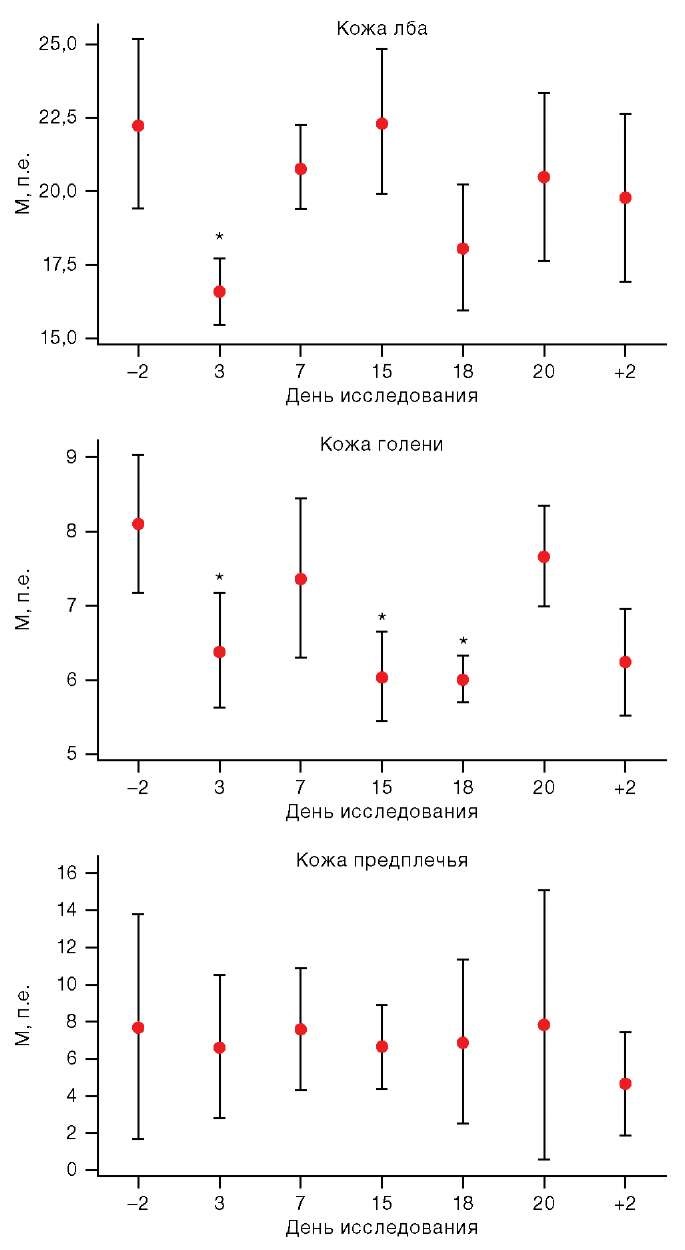
Рисунок подготовлен авторами по собственным данным
Рис. 2. Изменения базальной перфузии в условиях АНОГ
Примечание: на графиках представлены средние значения и интерквартильный размах; по оси Х: –2 и +2 — сутки до и после АНОГ соответственно; * статистически значимые различия р < 0,05.
В нашем исследовании температура окружающей среды в период воздействия составила 23,36 ± 1,34 °С и значимо не отличалась от температуры лабораторной комнаты, в которой проводили исследования до и после АНОГ (24,33 ± 2,58 °С). Кроме того, измерение температуры исследуемой области было произведено с помощью встроенного в ЛДФ-анализатор датчика, этот показатель в течение всего эксперимента статистически значимо не изменялся. Температура в среднем составляла 32,88 ± 1,36 °С в области кожи лба и 32,73 ± 1,38 °С в области кожи голени. Уровень влажности помещений при исследовании практически не отличался между сессиями: во время проведения методики окна были закрыты, система кондиционирования воздуха перед исследованием (за 15 минут до начала измерения) и во время его проведения была отключена. За 15 минут до начала обследования участники эксперимента не были накрыты одеялом, обследуемые участки кожи были открыты (освобождены от одежды) для адаптации к условиям окружающей среды, по субъективным ощущениям все добровольцы чувствовали себя комфортно в данных условиях. Таким образом, влияние колебаний параметров окружающей среды на наши результаты было минимальным.
Как в области кожи лба, так и в области голени было обнаружено снижение амплитуды миогенных колебаний на 51,15% и 41,94% на раннем этапе адаптации организма к условиям АНОГ (3 сут). Стоит отметить, что в области головы значение Ам сохранялось ниже фонового (измеренного за 2 дня до начала воздействия) и снизилось относительно фона на 57,03% — 7-е сут, на 47,23% — 15-е сут и на 47,71% к 18 сут (рис. 3).
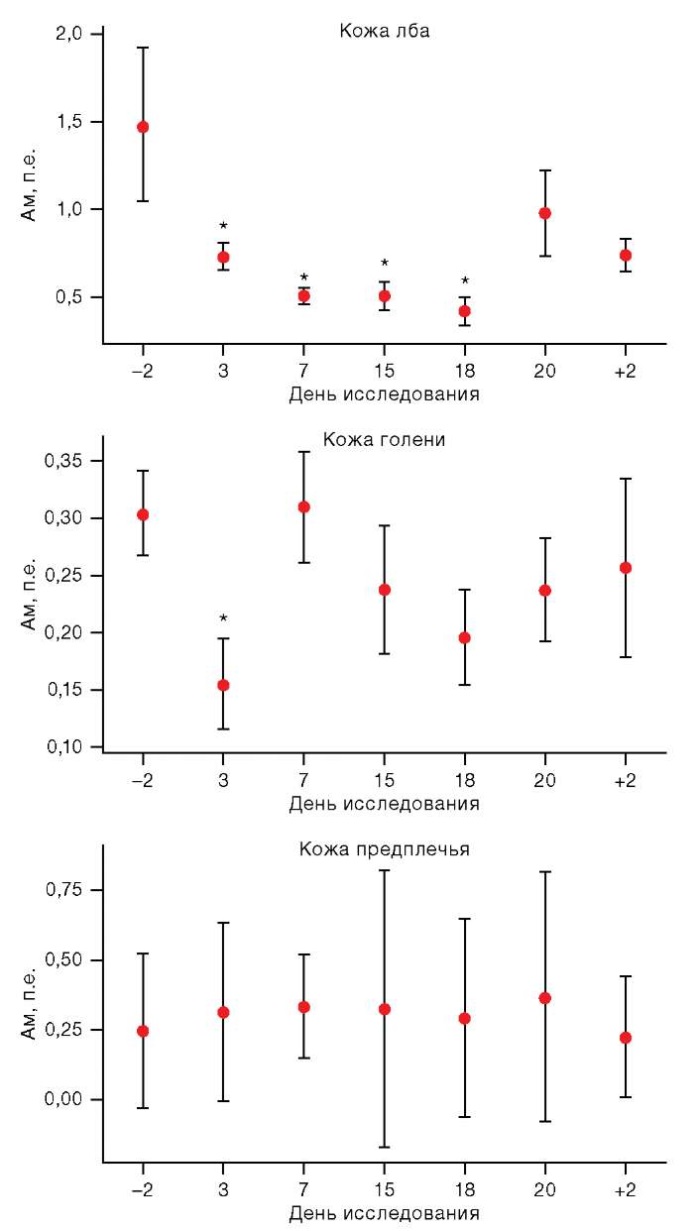
Рисунок подготовлен авторами по собственным данным
Рис. 3. Изменения амплитуды миогенных колебаний (Ам) в условиях АНОГ
Примечание: на графиках представлены средние значения и интерквартильный размах; по оси Х: –2 и +2 — сутки до и после АНОГ соответственно; * статистически значимые различия р < 0,05.
При анализе данных, полученных во время функциональных проб, были обнаружены изменения как в ИДП при проведении дыхательной пробы, так и в ВАР и РКК при проведении венозной и артериальной окклюзии соответственно (рис. 4). Однако эти изменения носили разнонаправленный характер: если ВАР и ИДП снижались, то РКК превышал фоновые величины в период АНОГ. Причем ВАР имел сниженное значение относительно фонового воздействия на 3-и и 15-е сут АНОГ, ИДП — на протяжении всего воздействия.
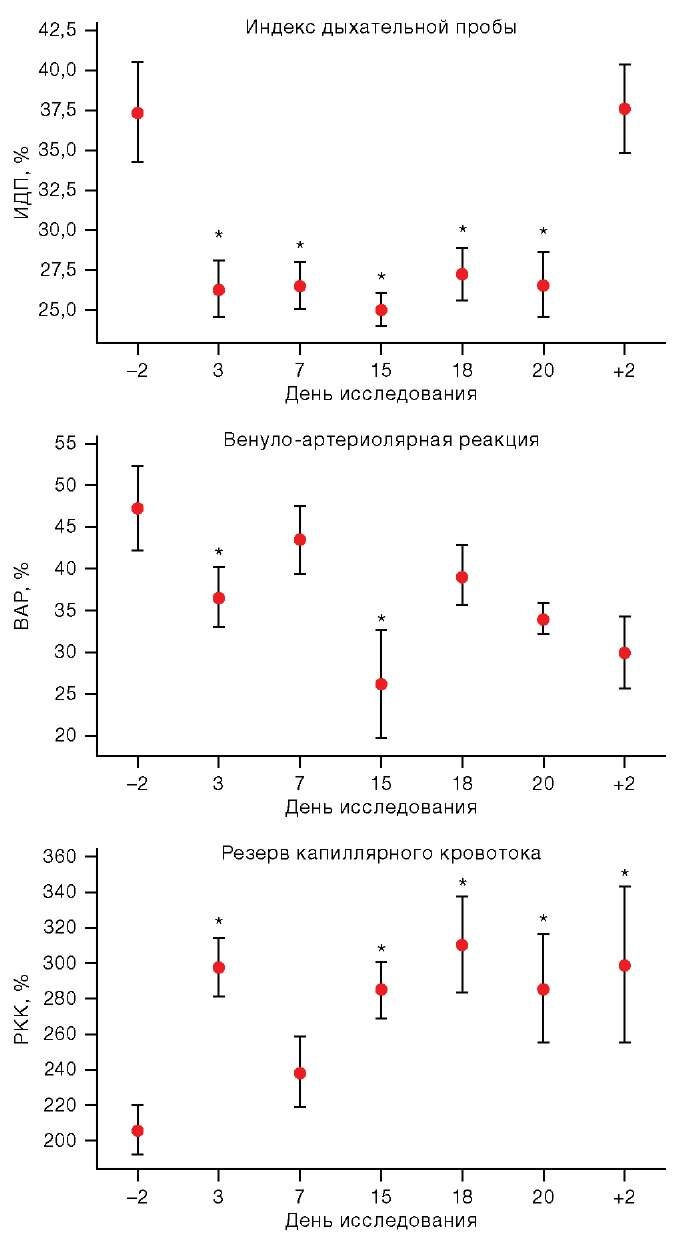
Рисунок подготовлен авторами по собственным данным
Рис. 4. Динамика показателей функциональных проб в условиях АНОГ.
Примечание: на графиках представлены средние значения и интерквартильный размах; по оси Х: –2 и +2 — сутки до и после АНОГ соответственно; * статистически значимые различия р < 0,05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что модель антиортостатической гипокинезии в первую очередь создает такой эффект невесомости, как перераспределение жидкостных сред организма в краниальном направлении. В данном эксперименте, частью которого являлось текущее исследование, коллективом авторов [11] было показано, что в результате воздействия АНОГ со стороны центральной гемодинамики наблюдается среднесуточное снижение частоты сердечных сокращений и артериального давления, в ранее проведенных исследованиях — снижение общего периферического сопротивления [15], со стороны периферической гемодинамики — снижение кровотока в нижних конечностях [16].
Результаты, полученные в нашем исследовании, свидетельствуют о том, что условия АНОГ с углом наклона –6° приводят к изменениям кожного микрокровотока, которые выражены в снижении базальной перфузии в области голени и лба на раннем этапе адаптации организма (3 сут воздействия). Другими словами, изменения носят однонаправленный характер как в коже нижних конечностей, так и в коже головы. Эти данные согласуются с результатами исследования, проведенного Briet et al. [17], которые в условиях АНОГ наблюдали уменьшение перфузии крови в области шеи.
В эксперименте Kurazumi et al. [18] при кратковременном переводе обследуемых в антиортостатическое положение было показано снижение кожного кровотока в области кожи щек при 10-минутном антиортостазе с углом наклона тела –30°, на фоне которого было обнаружено значительное повышение сосудистого сопротивления в данной области.
В нашем исследовании на фоне снижения перфузии было отмечено уменьшение амплитуды миогенных колебаний как в области нижних конечностей, так и в области кожи лба, что указывает на увеличение сосудистого тонуса в микроциркуляторном русле кожи этих регионов. Вследствие относительно повышенного тонуса артериол происходит сужение просвета микрососудов, что снижает кожный кровоток в исследуемых областях. Можно предположить, что уменьшение амплитуды миогенных вазомоций в коже лба может отражать защитные механизмы в бассейне внутренней сонной артерии (в том числе — для капилляров головного мозга) от избыточного повышения гидростатического давления в условиях увеличенного притока артериальной крови и затрудненного венозного оттока (миогенная ауторегуляция сосудистого русла головного мозга). Именно миогенный тонус является последним регуляторным звеном на входе в капилляр. Увеличение уровня тканевой перфузии в коже лба может являться следствием активации других регуляторных механизмов или вкладом в общую спектральную мощность отраженного сигнала венулярного компонента (венулярное полнокровие) на фоне затруднения венозного оттока от головы в условиях АНОГ. Восстановление уровня перфузии крови в коже лба на 7, 15, 20-е сут АНОГ до исходного фонового уровня, вероятно, связано с последствием временной вертикализации обследуемых накануне сессии исследования, связанной с проведением пассивной ортопробы (6, 14, 19-е сут) и пробы с ОДНТ (19-е сут).
Обнаруженные изменения (снижение перфузии и амплитуды миогенных колебаний) на 3-и и 18-е сут могут указывать на распределение крови из области кожи голени и лба в более крупные сосуды на фоне централизации кровотока. Было показано, что в условиях космического полета основной объем внеклеточной жидкости, по данным биоимпедансометрии, наблюдается в области живота [19].
Установлено, что полученные нами изменения кожной перфузии в области лба и голени в условиях АНОГ носят схожий характер с результатами, зарегистрированными в эксперименте по исследованию микроциркуляторно-тканевых систем методом ЛДФ на Международной космической станции [10]. В отличие от полученных результатов ЛДФ в условиях 3-недельного КП, свидетельствующих о некотором снижении базальной перфузии в коже предплечья на протяжении всего полета [20], в нашем исследовании в условиях АНОГ аналогичной длительности не было обнаружено изменений данного параметра ЛДФ в коже предплечья.
Тем не менее анализ данных функциональных проб показал, что условия АНОГ приводят к изменению вазомоторной функции сосудов кожи предплечья, о чем может свидетельствовать как снижение ВАР, так и снижение ИДП, то есть отмечается снижение реакции микрососудов на оба вида констрикторных стимулов. Стабильно сниженная величина ИДП на протяжении всего периода АНОГ указывает на то, что степень укорочения гладкомышечных клеток при активации симпатической адренергической системы снижается либо за счет изменения чувствительности миоцитов к норадреналину, либо за счет повышенного тонуса миоцитов. В связи с этим можно предположить, что тонус миоцитов повышен и на предплечье (чем выше исходный тонус, тем меньше степень укорочения мышцы и, следовательно, ниже амплитуда регистрируемого сигнала), хотя по данным амплитудно-частотного вейвлет-анализа достоверного уменьшения амплитуды миогенных вазомоций мы не зарегистрировали. В основе констрикторной реакции при венозной окклюзии лежит сокращение прекапиллярных артериол в ответ на растяжение миоцитов при повышении давления сначала в венозном отделе, затем в капиллярном и далее в прекапиллярном (механизм Остроумова — Бейлиса).
Снижение показателя ВАР в условиях АНОГ можно объяснить затрудненным притоком крови и свободным венозным руслом в системе МЦР, которое не успевает заполняться за 2 минуты окклюзии. Нельзя также исключить и повышенный тонус миоцитов в условиях АНОГ. Увеличение РКК можно рассматривать с позиции повышения чувствительности гладкомышечных клеток на дилататорное действие продуктов метаболизма при временном ограничении кровотока. В то же время, по некоторым литературным данным, реакция на артериальную окклюзию может косвенно указывать на изменение эндотелиальной функции [13][21]. Мы предположили, что увеличение РКК, наблюдаемое в нашем эксперименте, может опосредованно указывать на изменение эндотелиальной функции, поскольку другими авторами были получены данные о нарушении эндотелийзависимой вазодилатации (в пробе с ацетилхолином) в условиях АНОГ без профилактики как у мужчин [22], так и у женщин [23].
ЗАКЛЮЧЕНИЕ
Таким образом, в нашем исследовании была изучена динамика перфузии и регуляторных механизмов формирования сосудистого тонуса в различных участках кожи у здоровых мужчин в условиях 21-суточной АНОГ. Было показано, что со стороны кожного микрокровотока и его регуляции на данный вид воздействия в большей степени реагируют области кожи лба и нижних конечностей. Эффект перераспределения крови и гиподинамии выражен в снижении кожной перфузии на фоне увеличенного тонуса терминальных артериол и прекапиллярных сфинктеров. Подобная динамика может указывать на распределение микрокровотока в сторону более крупных сосудов. Несмотря на стабильность перфузии в области кожи предплечья в покое, проведенные функциональные пробы показали, что, вероятно, условия АНОГ приводят к изменению вазомоторной функции.
Результаты, полученные в нашем исследовании, позволяют предположить перспективность дальнейшего изучения микрогемодинамики кожи применительно к условиям реальной невесомости при использовании модели АНОГ.
Список литературы
1. Егоров АД, Ицеховский ОГ. Исследование сердечно-сосудистой системы в длительных космических полетах. Космическая биология и авиакосмическая медицина. 1983;17(5):4–6.
2. Blaber AP., Goswami N, Xu D. Prolonged unloading of the cardiovascular system during bedrest and spaceflight weakens neural coupling between blood pressure and heart rate. Acta Astronautica. 2022; 195:567–73. https://doi.org/10.1016/j.actaastro.2022.03.009
3. Pizzorni C, Sulli A, Smith V, Lladó A, Paolino S, Cutolo M, Ruaro B. Capillaroscopy 2016: new perspectives in systemic sclerosis. Acta Reumatol Port. 2016;41:8–14.
4. Johnson JM, Minson CT, Kellogg DL. Cutaneous Vasodilator and Vasoconstrictor Mechanisms in Temperature Regulation. Comprehensive Physiology. 2014;4(1):33–89. https://doi.org/10.1002/cphy.c130015
5. Charkoudian N. Skin blood flow in adult human thermoregulation: how it works, when it does not, and why. Mayo Clin Proc. 2003; 78 (5):603–12. https://doi.org/10.4065/78.5.603
6. Федорович АА, Родненков ОВ, Агеева НВ, Осяева МК, Рогоза АН. Параметры микроциркуляторного кровотока в коже человека в условиях длительного теплового стресса (модельный эксперимент). Кардиологический вестник. 2013;1(20):7–17. EDN: RNIWAT
7. McCord GR, Cracowski JL, Minson CT. Prostanoids contribute to cutaneous active vasodilation in humans. Physiology and Pharmacology of Temperature Regulation. 2006;291:R596–R602. https://doi.org/10.1152/ajpregu.00710.2005
8. Yuan M, Custaud MA, Xu Z, Wang, J, Yuan M, Tafforin C, Treffel L, et al. Multi-system adaptation to confinement during the 180-day controlled ecological life support system (CELSS) experiment. Front. Physiol. 2019;10:575. https://doi.org/10.3389/fphys.2019.00575
9. Lloret J, Arnaud L, Gauquelin G, Ming Y, Yin X, LI Y. Cardiospace French Chinese Cooperation in Gravitational Physiology. 39th ISGP Meeting & ESA Life Sciences Meeting. Noordwijk; 2019.
10. Дунаев АВ, Локтионова ЮИ, Жарких ЕВ, Федорович АА, Сидоров ВВ, Васин АВ, Дубинин ИВ. Исследование микроциркуляции крови в условиях невесомости с помощью портативных лазерных доплеровских флоуметров. Авиакосмическая и экологическая медицина. 2024;58(1):47–54. https://doi.org/10.21687/0233-528X-2024-58-1-47-54.10.1016
11. Пучкова АА, Шпаков АВ, Баранов ВМ, Катунцев ВП, Ставровская ДМ, Примаченко ГК и др. Общие результаты эксперимента с 21-суточной антиортостатической гипокинезией без применения средств профилактики. Авиакосмическая и экологическая медицина. 2023;57(4):31–41. https://doi.org/10.21687/0233-528X-2023-57-4-31-41
12. Лапитан ДГ, Рогаткин ДА. Функциональные исследования системы микроциркуляции крови методом лазерной доплеровской флоуметрии в клинической медицине: проблемы и перспективы. Альманах клинической медицины. 2016;44(2):249–59. https://doi.org/10.18/786/2072-0505-2016-44-2-249-259
13. Сагайдачный АА. Окклюзионная проба: методы анализа, механизмы реакции, перспективы применения. Регионарное кровообращение и микроциркуляция. 2018;17(3):1–18. https://doi.org/10.24884/1682-6655-2018-17-3-5-22
14. Носовский АМ, Попова ОВ, Смирнов ЮИ. Современные технологии статистического анализа медицинских данных и способы их графического представления. Авиакосмическая и экологическая медицина. 2023;57(5):149–54. https://doi.org/10.21687/0233-528X-2023-57-5-149-154
15. Григорьев АИ, Козловская ИБ. Годичная антиортостатическая гипокинезия (АНОГ) — физиологическая модель межпланетного космического полета. М: Российская акад. наук; 2018. EDN: MWLHGQ
16. Руденко ЕА, Баранов МВ, Захаров СЮ. Исследование параметров центральной и периферической гемодинамики при длительном пребывании в условиях ортостатической и антиортостатической гипокинезии. Авиакосмическая и экологическая медицина. 2019;53(7):40–7. https://doi.org/10.21687/0233-528X-2019-53-7-40-47
17. Breit, GA., Watenpaugh DE., Ballard RE., Hargens AR. Acute cutaneous microvascular flow responses to whole-body tilting in humans. Microvascular Research. 1993;46:351–8. https://doi.org/10.1006/mvre.1993.1058
18. Kurazumi T, Kato T, Konishi T, Ogawa Y, Iwasaki K. Alteration in facial skin blood flow during acute exposure to -10 and -30° head-down tilt in young human volunteers Experimental Physiology. 2022;107(12):1432–9. https://doi.org/10.1113/EP090734
19. Носков ВБ, Ничипорук АИ, Васильева ГЮ, Смирнов ЮИ. Состав тела человека при длительном пребывании в невесомости. Авиакосмическая и экологическая медицина. 2015;49(1):19–25. EDN: TJUDQH
20. Navasiolava N, Yuan M, Murphy R, Robin A, Coupé M, Wang L, Custaud MA. Vascular and Microvascular Dysfunction Induced by Microgravity and Its Analogs in Humans: Mechanisms and Countermeasures. Frontiers in Physiology. 2020. https://doi.org/10.3389/fphys.2020.00952
21. Власов ТД, Нестерович ИИ, Шиманьски ДА. Эндотелиальная дисфункция: от частного к общему. Возврат к «старой парадигме»? Регионарное кровообращение и микроциркуляция. 2019;18(2):19–27 https://doi.org/10.24884/1682-6655-2019-18-2-19-27
22. Coupé M, Fortrat JO, Larina I, Gauquelin-Koch G, Gharib C, Custaud MA. Cardiovascular deconditioning: From autonomic nervous system to microvascular dysfunctions. Respiratory Physiology & Neurobiology. 2009;169S:10–12. https://doi.org/10.1016/j.resp.2009.04.009
23. Demiot C, Dignat-George F, Fortrat JO, Sabatier F, Gharib C, Larina I, Gauquelin-Koch G, Hughson R, Custaud MA. WISE 2005: chronic bed rest impairs microcirculatory endothelium in women. American Journal of Physiology-Heart and Circulatory Physiology. 2007;293(5): H3159-H3164
Об авторах
Д. В. ПашковаРоссия
Пашкова Дарья Валерьевна
Москва
Ю. А. Попова
Россия
Попова Юлия Александровна - канд. мед. наук
Москва
А. А. Федорович
Россия
Федорович Андрей Александрович - канд. мед. наук
Москва
А. В. Шпаков
Россия
Шпаков Алексей Васильевич - канд. биол. наук
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Пашкова Д.В., Попова Ю.А., Федорович А.А., Шпаков А.В. Регионарный кожный кровоток у здоровых обследуемых в условиях 21-суточной антиортостатической гипокинезии. Медицина экстремальных ситуаций. 2025;27(1):124-130. https://doi.org/10.47183/mes.2025-267
For citation:
Pashkova D.V., Popova J.A., Fedorovich A.A., Shpakov A.V. Regional cutaneous blood flow in healthy subjects under conditions of 21-day head-down bed rest. Extreme Medicine. 2025;27(1):124-130. https://doi.org/10.47183/mes.2025-267

















