Перейти к:
Новая one-pot методика получения потенциальных метаболитов индапамида путем окисления-конъюгации на МАЛДИ-мишени
https://doi.org/10.47183/mes.2025-27-1-26-36
Аннотация
Введение. Метаболическая активация ксенобиотиков, в том числе лекарственных средств, считается одним из основных механизмов развития идиосинкразических реакций. Соответственно, потенциальная биоактивация ксенобиотика должна быть тщательно оценена на ранних этапах разработки лекарств. В связи с этим поиск новых быстрых и эффективных методик скрининга реакционноспособных метаболитов ксенобиотиков является актуальным.
Цель. Разработка новой методики моделирования процессов биотрансформации ксенобиотиков in vitro для выявления потенциальных метаболитов индапамида.
Материалы и методы. В качестве методов сравнения были выбраны такие неферментативные инструментальные методы, как электрохимическое окисление (ЭХО) и фотокаталитическое окисление (ФКО) в объеме. Моделирование второй фазы метаболизма осуществлялось путем инкубации продуктов окисления индапамида с улавливающим агентом (глутатион, GSH). Продукты окисления, а также их конъюгаты с GSH затем анализировали методом высокоэффективной жидкостной хроматографии с тандемной масс-спектрометрией. В основе новой one-pot методики моделирования метаболизма лежит проведение УФ-индуцированного ФКО ксенобиотика в присутствии GSH на функционализированной диоксидом титана поверхности мишени с последующей регистрацией продуктов с помощью масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией.
Результаты. В случае ЭХО было обнаружено 5 метаболитов и 3 аддукта с GSH, а при использовании ФКО в объеме было выявлено 7 метаболитов и 1 аддукт с GSH. При использовании новой one-pot методики было найдено 8 аддуктов с GSH. Помимо ряда выявленных известных метаболитов индапамида и их конъюгатов с GSH, в совокупности тремя методами для индапамида было зафиксировано по 4 ранее не изученных метаболита и аддукта с GSH.
Выводы. По сравнению с ЭХО и ФКО в объеме предложенный аналитический подход к моделированию метаболизма индапамида показал более высокую информативность в сочетании с простотой и экспрессностью, что делает его перспективным для использования в доклинических исследованиях лекарственных препаратов при прогнозировании метаболизма и токсичности объектов фармацевтической разработки, а также при изучении процессов биотрансформации различных ксенобиотиков.
Ключевые слова
Для цитирования:
Кельциева О.А., Афанасьева А.А., Ильюшонок С.К., Гладчук А.С., Арсеньев А.Н., Фролов А.С., Бабаков В.Н., Краснов К.А., Подольская Е.П. Новая one-pot методика получения потенциальных метаболитов индапамида путем окисления-конъюгации на МАЛДИ-мишени. Медицина экстремальных ситуаций. 2025;27(1):26-36. https://doi.org/10.47183/mes.2025-27-1-26-36
For citation:
Keltsieva O.A., Afanasyeva A.A., Ilyushonok S.K., Gladchuk A.S., Arseniev A.N., Frolov A.S., Babakov V.N., Krasnov K.A., Podolskaya E.P. A new one-pot technique for obtaining potential indapamide metabolites by oxidation and conjugation on MALDI target. Extreme Medicine. 2025;27(1):26-36. https://doi.org/10.47183/mes.2025-27-1-26-36
ВВЕДЕНИЕ
Индапамид (ИПМ), представляющий собой сульфаниламидное производное индольного ряда, рассматривается как одно из наиболее эффективных диуретических средств, применяемых при артериальной гипертензии и застойной сердечной недостаточности1.
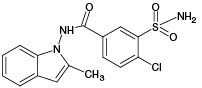
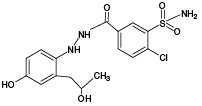
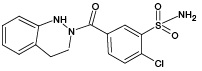
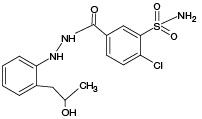
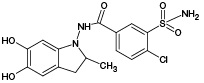
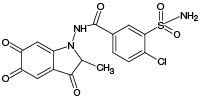
ИПМ, структура которого приведена на рисунке 1, является галогенсодержащим соединением с брутто-формулой C16H16ClN3O3S (m/z [М-Н]- 364,05).
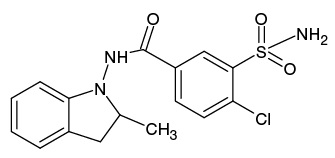
Рисунок подготовлен по данным [1]
Рис. 1. Структурная формула индапамида
Применение ИПМ может сопровождаться рядом побочных эффектов, среди которых отмечены реакции гиперчувствительности: сыпь и фоточувствительность [2–4].
Возникновение идиосинкразических реакций на чужеродные для организма химические соединения (ксенобиотики) во многом определяется их метаболической биотрансформацией2. В этом плане ИПМ, который активно метаболизирует в организме человека, представляется интересным объектом для углубленного изучения продуктов его биотрансформации, идентификация которых может быть весьма полезной для отслеживания механизмов возникновения кожных реакций и иных проявлений индивидуальной непереносимости лекарственных препаратов и ксенобиотиков.
Процессы превращений ксенобиотиков в организме подразделяются на три основные фазы. Первая — химическая трансформация под действием окислительно-восстановительных или гидролитических ферментов с образованием первичных метаболитов, как правило, обогащенных полярными функциональными группами. Это повышает гидрофильность молекул, благодаря чему они эффективнее выводятся из организма [5]. В ходе второй фазы первичные метаболиты могут вступать в реакции конъюгации с эндогенными молекулами, образуя стабильные (ковалентные) аддукты [6]. Во время третьей фазы продукты метаболизма выводятся из организма, что происходит обычно при участии транспортных белков [7].
Следует отметить, что наибольшую опасность для организма представляют короткоживущие метаболиты ксенобиотиков, так как они за счет своей высокой реакционной способности вступают в реакции с белками, нарушая тем самым их функциональную активность. Непосредственно детектировать реактивные метаболиты в организме непросто, однако возможно их косвенное определение через аддукты с биомолекулами. По сравнению со свободными метаболитами такие аддукты (конъюгаты) являются более информативными биомаркерами воздействия на организм экзогенного соединения в связи с более длительным пребыванием в организме [8]. Одним из важнейших конъюгирующих агентов в организме служит восстановленный глутатион (GSH) — трипептид, имеющий ключевое значение для защиты клеток от токсического повреждения ксенобиотиками [9]. В процессе метаболизма ксенобиотиков GSH реагирует с такими субстратами, как эпоксиды, галогениды, активные непредельные соединения, после чего образующиеся аддукты выводятся из организма с желчью или мочой [10]. В связи с этим GSH используют в модельных экспериментах в качестве низкомолекулярной ловушки для выявления реакционноспособных продуктов метаболизма ксенобиотиков. Такие исследования являются важным этапом фармацевтической разработки, поскольку позволяют предсказать токсичность и оценить безопасность потенциального лекарственного препарата [11].
Традиционно для моделирования метаболизма ксенобиотиков применяют биохимические методы с использованием клеток или субклеточных фракций. К последним относятся микросомы печени, содержащие ферменты первой фазы метаболизма (цитохром Р450), цитозоль, обогащенную ферментами второй фазы (трансферазами), или фракцию S9, содержащую полный набор метаболических ферментов I и II фаз биотрансформации ксенобиотиков [5][12][13]. Однако биохимические методы имеют ряд недостатков, среди которых можно отметить низкую производительность, высокую трудозатратность, сложность выделения индивидуальных метаболитов из биологических матриц и другие.
В связи с этим в последнее время активно развиваются альтернативные подходы к моделированию метаболизма на основе неферментативных инструментальных методов, не требующих использования биологических матриц, что позволяет существенно сократить время и затраты на исследование [14]. Чаще всего для этого используют такие методы, как электрохимическое окисление (ЭХО) [15] или фотокаталитическое окисление (ФКО) [16].
В методе ЭХО окисление ксенобиотиков проводят в электрохимическом реакторе, где окислителем выступают активные формы кислорода [17][18]. Сопряжение электрохимической ячейки с масс-спектрометром [19] или хромато-масс-спектрометром [20] позволяет регистрировать продукты ЭХО в режиме реального времени. Этот способ позволяет моделировать не только первую, но и вторую фазу метаболизма, если после ЭХО проводят обработку улавливающими агентами, такими как GSH или цистеин [21]. Как показано на примере N-деалкилирования имипрамина и диазепама в исследовании Shono T. et al. [22], применение ЭХО обеспечивает больший выход метаболитов по сравнению с микросомальной фракцией.
В другом методе моделирования метаболизма ФКО, реакции окисления ксенобиотиков инициируются под действием светового излучения в присутствии катализаторов [23]. Диоксид титана (TiO2) является одним из наиболее активно используемых фотокатализаторов благодаря своим оптическим и фотохимическим свойствам, а также низкой стоимости [24]. Кроме того, в работе Ruokolainen M. et al. [25] было показано, что индуцированное ультрафиолетовым излучением фотокаталитическое окисление в суспензии диоксида титана (УФ/TiO2-ФКО) позволяет воспроизводить больше реакций первой фазы метаболизма, происходящих в микросомах печени человека, чем при использовании ЭХО или реакции Фентона.
Несмотря на развитие новых подходов к моделированию биотрансформации ксенобиотиков, исследование метаболизма в каждом новом случае, тем не менее представляет сложную и трудоемкую задачу. В связи с этим разработка более простой и эффективной методики получения и идентификации метаболитов ксенобиотиков является актуальной.
Цель исследования — разработка новой методики моделирования процессов биотрансформации ксенобиотиков in vitro для выявления потенциальных метаболитов индапамида.
МАТЕРИАЛЫ И МЕТОДЫ
Электрохимическое окисление индапамида и получение аддуктов с глутатионом
При разработке методики ЭХО ИПМ опирались на данные, полученные в работе [26], с использованием аналогичной системы для ЭХО. В пробирку объемом 15 мл помещали 10 мг субстанции ИПМ (analytical standard; Merck, Германия) и добавляли 10 мл метанола (HPLC grade; Merck, Германия), после чего интенсивно перемешивали c помощью перемешивающего устройства типа «вортекс» BR-2000 Vortexer (Bio-Rad, США) до растворения субстанции. Для получения рабочего раствора ИПМ стоковый раствор (1 мг/мл в метаноле) разбавляли 75% (об./об.) водным ацетонитрилом (HPLC grade; Merck, Германия) с добавлением формиата аммония (10 мМ; рН 7,4; чистота 97%; Merck, Германия) до концентрации 50 мкг/мл.
Трехэлектродную электрохимическую ячейку μ-PrepCell™ (объем 0,7 мкл, слой электролита 50 мкм, рабочий электрод — Glassy carbon) в составе ROXY™ ЕС system (Antec, Нидерланды) предварительно промывали 5 мл дистиллированной воды с помощью автоматического шприцевого насоса Harvard (702212B, Harvard Apparatus, США) со скоростью потока 100 мкл/мин. После этого через ячейку пропускали 5 мл 50% (об./об.) водного раствора ацетонитрила со скоростью потока 100 мкл/мин.
Для проведения ЭХО через ячейку пропускали 100 мкл рабочего раствора ИПМ со скоростью 15 мкл/мин. Электролиз проводили при 37 °С и постоянном напряжении 2,4 В. Продукты окисления ИПМ собирали в микропробирку, раствор метаболитов разбавляли пятикратно деионизованной водой и помещали в виалы для последующего ВЭЖХ-МС/МС анализа.
При исследовании аддуктов с GSH (чистота >98%; Merck, Германия) раствор, прошедший через электрохимическую ячейку, собирали в пробирку, содержащую 100 мкл водного раствора GSH (1 мг/мл), и инкубировали в течение часа при температуре 37 °С. Затем полученную смесь с GSH разбавляли в 25 раз деионизованной водой и переносили в виалы для последующего анализа методом высокоэффективной жидкостной хроматографии с тандемной масс-спектрометрией (ВЭЖХ-МС/МС).
Индуцированное ультрафиолетовым излучением фотокаталитическое окисление индапамида в присутствии наночастиц диоксида титана в микропробирке и получение аддуктов с глутатионом
При разработке методики УФ/TiO2-ФКО ИПМ опирались на ранее предложенный подход, описанный в работе [27]. В пробирку объемом 1,5 мл помещали 10 мг субстанции ИПМ и добавляли 1 мл метанола, после чего интенсивно перемешивали c помощью перемешивающего устройства типа «вортекс» BR-2000 Vortexer до растворения субстанции. Для получения рабочего раствора стоковый раствор ИПМ (10 мг/мл в метаноле) разбавляли деионизованной водой до концентрации 1 мг/мл.
В микропробирку объемом 2 мл добавляли 10 мг наночастиц диоксида титана TiO2 (соотношение полиморфных модификаций анатаз: рутил = 80/20; «Плазмотерм», Россия) и 2 мл деионизованной воды. После чего помещали суспензию в ультразвуковую ванну на 10 мин. Полученную суспензию (5 мг/мл) использовали сразу после приготовления.
В микропробирку объемом 0,2 мл добавляли 12,5 мкл раствора ИПМ (1 мг/мл в 10% (об./об.) водном метаноле), 12,5 мкл суспензии TiO2 (5 мг/мл), 150 мкл деионизованной воды. Затем открытую микропробирку помещали в пластиковый держатель и накрывали изготовленной в лаборатории панелью для ультрафиолетового облучения (светодиоды BL-L522VC (λmax = 405 нм; Betlux Electronics, Китай), закрепленные на непроводящей подложке), выдерживали в течение 30 мин. При поиске аддуктов с GSH после завершения облучения к суспензии добавляли 5 мкл водного раствора GSH (5 мг/мл) и инкубировали в течение часа при температуре 37 °С.
Для очистки от TiO2 использовали центрифужные фильтры Costar® Spin-X® (размер пор — 0,22 мкм, нейлоновая мембрана; Corning, США). В фильтр добавляли 150 мкл суспензии с продуктами окисления ИПМ и 150 мкл деионизованной воды, после чего центрифугировали в течение 5 мин при 10 000 g с использованием центрифуги MiniSpin (Eppendorf, Германия). Фильтрат переносили в другую микропробирку, а к использованному фильтру добавляли 300 мкл ацетонитрила с 0,1% (об./об.) муравьиной кислотой (чистота 98%; Merck, Германия) и снова центрифугировали в течение 5 мин при 10 000 g. Данный фильтрат объединяли с полученным ранее и упаривали с помощью центрифужного испарителя SpeedVac (Eppendorf, Германия). К осадку добавляли 5% (об./об.) водный ацетонитрил c 0,1% (об./об.) муравьиной кислотой до итоговой концентрации GSH 20 мкг/мл, полученный раствор затем помещали в виалу для последующего ВЭЖХ-МС/МС анализа.
Индуцированное ультрафиолетовым излучением фотокаталитическое окисление индапамида в присутствии наночастиц диоксида титана и получение аддуктов с глутатионом на поверхности МАЛДИ-мишени
В качестве подложки использовали полированную МАЛДИ-мишень из нержавеющей стали. На поверхность ячеек МАЛДИ-мишени наносили по 2 мкл суспензии TiO2 (2 мг/мл) и высушивали при комнатной температуре.
На ячейки мишени, функционализированные TiO2, наносили:
- 10 мкл деионизованной воды (контроль);
- 9 мкл деионизованной воды и 1 мкл водного раствора GSH (100 мкг/мл) (контроль);
- 7 мкл деионизованной воды, 2 мкл раствора ИПМ (50 мкг/мл) и 1 мкл раствора GSH (100 мкг/мл) (определение аддуктов GSH с продуктами окисления).
Мишень с нанесенными образцами накрывали ранее описанной панелью для ультрафиолетового облучения и облучали в течение 30 мин. После завершения облучения отбирали по 1 мкл из каждой капли и переносили на соседнюю ячейку, после чего добавляли 1 мкл раствора (20 мг/мл в 80% (об./об.) водном ацетонитриле с 0,1% (об./об.) трифторуксусной кислотой (чистота 99%; Merck, Германия)) матрицы 2,5-дигироксибензойной кислоты (DHB; Bruker Daltonik GmbH, Германия). Мишень высушивали при комнатной температуре перед анализом методом МАЛДИ масс-спектрометрии.
Анализ продуктов окисления индапамида и их аддуктов с глутатионом методом высокоэффективной жидкостной хроматографии с тандемной масс-спектрометрией
Для проведения ВЭЖХ-МС/МС анализа использовали аналитическую систему, состоящую из жидкостного хроматографа Agilent 1290 Infinity (Agilent Technologies, США) и масс-спектрометра типа «ионная ловушка» AmaZon ETD (Bruker Daltonik GmbH, Германия) с источником ионов с ионизацией электрораспылением. Экспериментальные данные регистрировали и обрабатывали с помощью программного пакета DataAnalysis 5.0 (Bruker Daltonik GmbH, Германия).
Хроматографическое разделение осуществляли при следующих условиях: колонка — ZORBRAX Eclipse Plus C18 Rapid Resolution High Definition (2,1×150 мм, 1,8 мкм; Agilent Technologies, США); температура колонки 40 °C; скорость потока подвижной фазы 200 мкл/мин; объем вводимой пробы 5 мкл; фаза А — 0,1% (об./об.) водный раствор муравьиной кислоты; фаза Б — 0,1% (об./об.) раствор муравьиной кислоты в 90% (об./об.) водном ацетонитриле; режим элюирования — градиентный: 5% Б (0–2 мин), 5–60% Б (2–30 мин), 60% Б (30–31 мин), 60–5% Б (31–32 мин), 5% Б (32–37 мин).
Масс-спектрометрический анализ осуществляли при следующих условиях работы масс-спектрометра: напряжение на капилляре 4,5 кВ; давление небулайзера 2,2 бар; осушающий газ — азот; скорость потока осушающего газа 9 л/мин; температура осушающего газа 280 °С; режим работы — Auto MS/MS; режим сканирования — Auto MS/MS; диапазон m/z 100–1000; скользящая средняя — отключена; частота спектров 4 Гц; тип фрагментации — диссоциация, активированная соударениями; газ для соударений — гелий; число ионов-предшественников — 3; окно изоляции иона-предшественника — 3,5 m/z. Метаболиты ИПМ анализировали в режиме регистрации отрицательных ионов, а аддукты с GSH — в режиме регистрации положительных ионов. Калибровку масс-спектрометра проводили с использованием 1 мМ раствора формиата натрия (чистота 97%; Merck, Германия) в 90% (об./об.) водном изопропаноле (HPLC grade; Merck, Германия).
МАЛДИ масс-спектрометрический анализ
Масс-спектрометрический анализ реактивных метаболитов ИПМ и их аддуктов с GSH проводили с помощью тандемного времяпролетного масс-спектрометра UltrafleXtreme (Bruker Daltonik GmbH, Германия), оснащенного Nd:YAG лазером (λ = 355 нм), на базе ресурсного центра «Развитие молекулярных и клеточных технологий» Научного парка СПбГУ.
Регистрацию масс-спектров осуществляли в режиме рефлектрон с детектированием положительных ионов при следующих параметрах работы масс-спектрометра: диапазон m/z — 300–1100; напряжение на первом источнике 19,0 кВ; напряжение на втором источнике 16,8 кВ; напряжение на линзах 7,0 кВ; напряжение на первом отражателе 20,5 кВ; напряжение на втором отражателе 10,5 кВ; задержка импульсной экстракции ионов 90 нс. Для получения одного спектра было использовано 10 000 актов облучения образца лазером при мощности лазера 60% и частоте облучения 2000 Гц. Для регистрации и интерпретации масс-спектров были использованы программные продукты Flex Control и Flex Analysis (Bruker Daltonik GmbH, Германия).
Тандемный масс-спектрометрический анализ проводили в режиме индуцированной лазером диссоциации при следующих параметрах работы масс-спектрометра: окно селектора иона-предшественника 2 m/z; напряжение на первом источнике 7,6 кВ; напряжение на втором источнике 6,9 кВ; напряжение на линзах 3,5 кВ; напряжение на первом отражателе 29,4 кВ; напряжение на втором отражателе 14,1 кВ; LIFT 1 (19,0 кВ); LIFT 2 (3,2 кВ); задержка импульсной экстракции ионов 90 нс.
Калибровку масс-спектрометра осуществляли с использованием калибровочной смеси Peptide calibration standard II (Bruker Daltonik GmbH, Германия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе изучения метаболизма ИПМ было проведено сравнение двух наиболее распространенных неферментативных подходов для получения продуктов окисления ксенобиотиков in vitro: электрохимическое окисление (ЭХО) и УФ-индуцированное фотокаталитическое окисление в присутствии наночастиц диоксида титана (УФ/TiO2-ФКО). Согласно литературным данным [28] для ИПМ известно пять метаболитов (М1–М5), каждый из которых способен вступать в реакцию с GSH. Выбор GSH в качестве улавливающего агента обусловлен его важной ролью в метаболизме ксенобиотиков в организме человека (является одной из основных биомолекул, участвующих в связывании реактивных продуктов метаболизма ксенобиотиков), а также его способностью вступать в реакции конъюгации с молекулами, в составе которых есть группы хиноидного типа (присутствие таких групп характерно для ряда метаболитов ИПМ).
Схема проведения эксперимента с использованием ЭХО представлена на рисунке 2А.
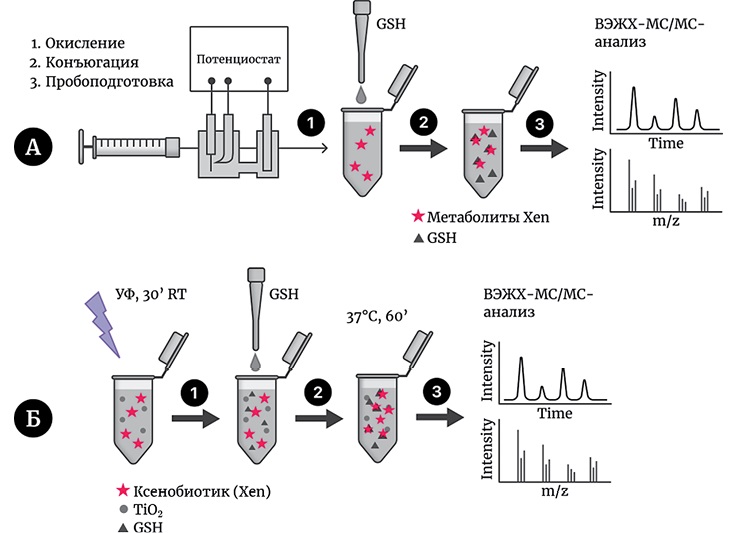
Рисунок подготовлен авторами по собственным данным
Рис. 2. Алгоритм получения продуктов окисления ксенобиотика методом ЭХО (А) или УФ/TiO2-ФКО (Б) с последующей конъюгацией с GSH и ВЭЖХ-МС/МС анализом (на примере ИПМ)
Окисление осуществляли с использованием электрохимической системы Roxy Exceed, оснащенной электрохимическим реактором μ-PrepCell. Часть реакционной смеси затем отбирали для последующего анализа, остальное смешивали с раствором GSH и инкубировали в течение часа при 37 °С.
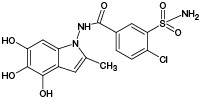
По результатам ВЭЖХ-МС/МС анализа было выявлено наличие 3 известных метаболитов ИПМ (M1, M4, M5), а также 2 метаболитов с m/z 381,93 (ПМ2) и m/z 429,96 (ПМ6), которые в литературе ранее описаны не были; соответствующие данные представлены на рисунке 3А. Кроме того, ВЭЖХ-МС/МС анализ инкубационной смеси продуктов окисления ИПМ и GSH позволил обнаружить 3 сигнала, которые по наличию изотопного распределения, характерного для соединений, содержащих в своем составе атом хлора, и результатам тандемного масс-спектрометрического анализа были отнесены к аддуктам GSH с 2 известными (M2, M4) и 1 необнаруженным (ПМ7) метаболитами ИПМ; соответствующие данные представлены на рисунке 3Б. Сведения об обнаруженных продуктах ЭХО ИПМ, а также аддуктах с GSH представлены в таблице 1.
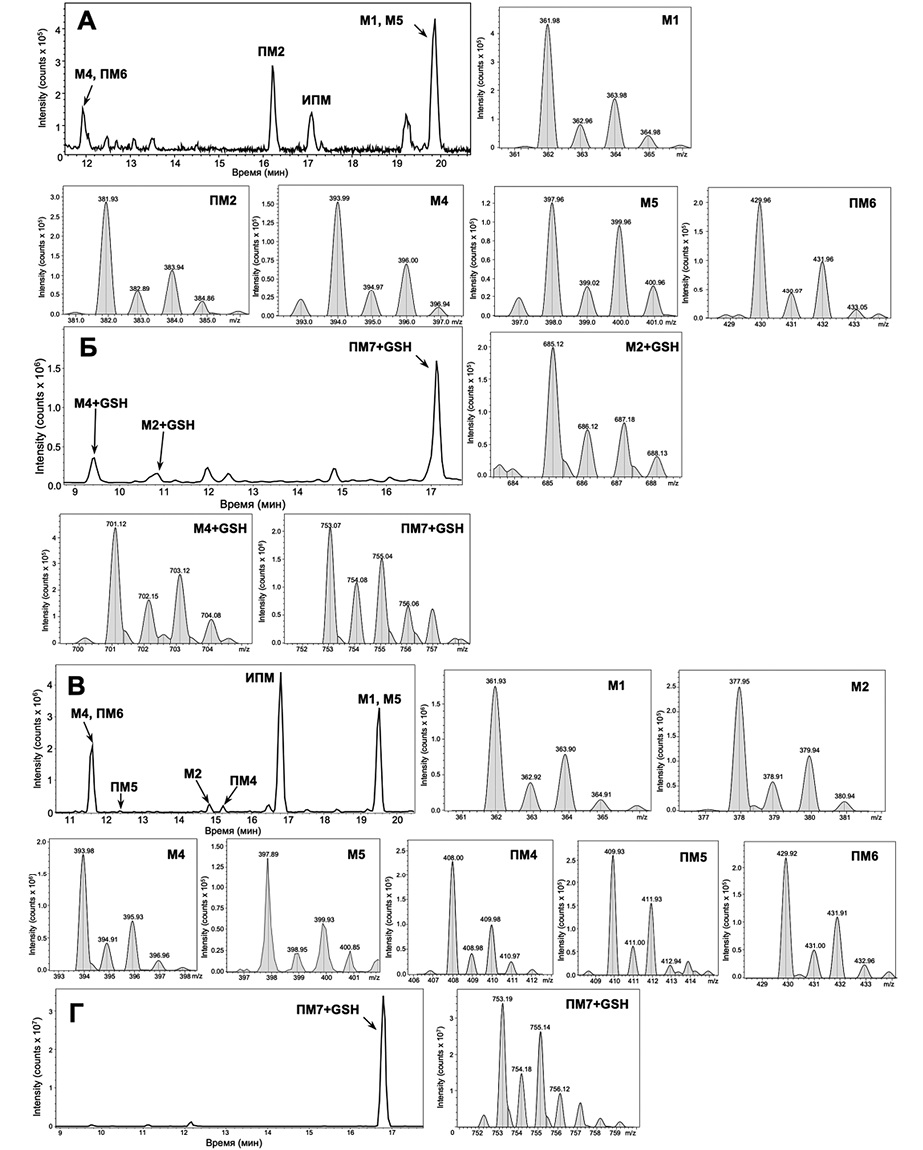
Рисунок подготовлен авторами по собственным данным
Рис. 3. Масс-хроматограммы метаболитов ИПМ, полученных методом ЭХО (А), и их аддуктов с GSH (Б), а также полученных методом УФ/TiO2-ФКО (В) и их аддуктов с GSH (Г)
Примечание: на рисунке представлены фрагменты масс-спектров с указанием обнаруженных метаболитов ИПМ и их аддуктов с GSH.
Таблица 1. Молекулярные массы и вероятные структуры метаболитов ИПМ и их m/z аддуктов с GSH, обнаруженных тремя способами
Метаболит | Структурная формула | Методы моделирования биотрансформации | ||||
ЭХО | УФ/TiO2-ФКО | УФ/TiO2-ФКО/ММ | ||||
m/z метаболита [M-H]– | m/z аддукта с GSH [M+H]+ | m/z метаболита [M-H]– | m/z аддукта с GSH [M+H]+ | m/z аддукта с GSH [M+H]+ | ||
M1 |
| 361,98 | - | 361,93 | - | 669,10 671,10 |
M2 |
| (378) | 685,12 | 377,95 | - | 685,09 |
M3 |
| (380) | - | - | - | 687,11 |
M4 |
| 393,99 | 701,12 | 393,98 | - | 701,09 |
M5 |
| 397,96 | - | 397,89 | - | 705,09 |
ПM1 |
| - | - | - | - | 657,09 |
ПM2 |
| 381,93 | - | - | - | - |
ПM3 |
| - | - | - | - | 703,10 |
ПM4 |
| - | - | 408,00 | - | - |
ПM5 |
| - | - | 409,93 | - | - |
ПM6 |
| 429,96 | - | 429,92 | - | - |
ПM7 |
| - | 753,07 | - | 753,19 | - |
Таблица составлена авторами по собственным данным
Примечание: в скобках приведены значения m/z метаболитов, описанных в литературе, но не обнаруженных в рамках выполненных экспериментов; УФ/TiO2-ФКО/ММ — УФ/TiO2-ФКО на МАЛДИ-мишени.
Таким образом, метод ЭХО позволяет получать метаболиты ИПМ, однако обладает рядом недостатков:
- невозможность одновременного проведения нескольких экспериментов;
- необходимость очистки электрохимической ячейки после каждого использования;
- большой расход реактивов и исследуемых ксенобиотиков.
Учитывая вышеперечисленное, констатировали, что моделирование метаболизма ксенобиотиков методом ЭХО является длительным и затратным.
На следующем этапе исследования нами были смоделированы процессы метаболизма ИПМ методом УФ/TiO2-ФКО. Схема проведения УФ/TiO2-ФКО приведена на рисунке 2Б. На первом этапе осуществлялось облучение УФ-излучением пробирки с инкубационной смесью (водная суспензия наночастиц TiO2, содержащая ИПМ), после завершения облучения в пробирку добавляли GSH и осуществляли процедуру конъюгации улавливающего агента с продуктами УФ/TiO2-ФКО ИПМ. Этапы окисления и конъюгации длятся в сумме 90 мин, как и в случае ЭХО. Однако преимуществом УФ/TiO2-ФКО является возможность параллельного проведения нескольких экспериментов, что значительно экономит время при подборе условий окисления. В целом по сравнению с ЭХО метод УФ/TiO2-ФКО является более экономичным с точки зрения расходов как реактивов, так и исследуемых веществ. Однако при этом для дальнейшего проведения ВЭЖХ-МС/МС анализа возникает необходимость проведения пробоподготовки, включающей удаление частиц диоксида титана во избежание их попадания в хроматографическую систему.
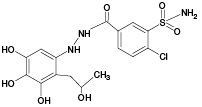
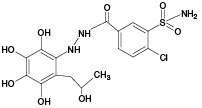
По результатам ВЭЖХ-МС/МС анализа продуктов УФ/TiO2-ФКО ИПМ (рис. 3В) было установлено образование 4 известных метаболитов ИПМ (M1, M2, М4, М5), а также 3 ранее не описанных метаболитов с m/z 408,00 (ПМ4), m/z 409,93 (ПМ5) и m/z 429,92 (ПМ6). Следует отметить, что метаболит М2, как и предполагаемые метаболиты ПМ4 и ПМ5, не был обнаружен при использовании метода ЭХО.
При анализе продуктов взаимодействия GSH с метаболитами ИПМ был зафиксирован только один сигнал, который по наличию характерного изотопного распределения и результатам тандемного масс-спектрометрического анализа был отнесен к аддукту GSH с потенциальным метаболитом ПM7 (рис. 3Г). ПM7-GSH стал единственным обнаруженным аддуктом, в то время как методом ЭХО было идентифицировано 3 аддукта.
Результаты, полученные методами ЭХО и УФ/TiO2-ФКО для ИПМ, в целом сопоставимы, но оба метода имеют ряд недостатков, которые делают их весьма трудоемкими и времязатратными. Можно сформулировать ряд сложностей, которые должны быть решены при разработке более производительной методики скрининга реактивных метаболитов ксенобиотиков:
- Времязатратность. Бóльшая часть времени уходит на проведение конъюгации (1 час) и ВЭЖХ-МС анализа (~40 мин).
- Трудозатратность. Удаление частиц TiO2 при УФ/TiO2-ФКО или промывка электрохимической ячейки после каждого ксенобиотика.
- Поэтапное проведение окисления и конъюгации может приводить к потере короткоживущих метаболитов.
- Возможности параллельного проведения нескольких экспериментов ограничены.
- Большой расход реактивов и исследуемых веществ.
Дальнейшая работа была направлена на разработку методики моделирования метаболизма ИПМ, в которой перечисленные недостатки были бы устранены или значительно уменьшены.
Среди методов определения метаболитов ксенобиотиков и их аддуктов широкое применение получила масс-спектрометрия с матрично-активированной лазерной десорбцией/ионизацией (МАЛДИ). Данный метод отличается экспрессностью и высокой производительностью, так как процедура анализа включает в себя стадию нанесения всех необходимых образцов на одну твердую подложку (мишень) с последующей регистрацией сигналов аналитов без дополнительной пробоподготовки.
Мы установили, что если на ячейку МАЛДИ-мишени, функционализированную TiO2, нанести ксенобиотик с добавкой улавливающего агента (GSH), то образующиеся в ходе проведения УФ/TiO2-ФКО реактивные метаболиты могут in situ связываться с тиольной группой пептида, и последующий МС анализ позволяет детектировать короткоживущие продукты окисления в форме аддуктов.
Исходя из этого был предложен алгоритм проведения УФ/TiO2-ФКО ИПМ на МАЛДИ-мишени (УФ/TiO2-ФКО/ММ), представленный на рисунке 4.
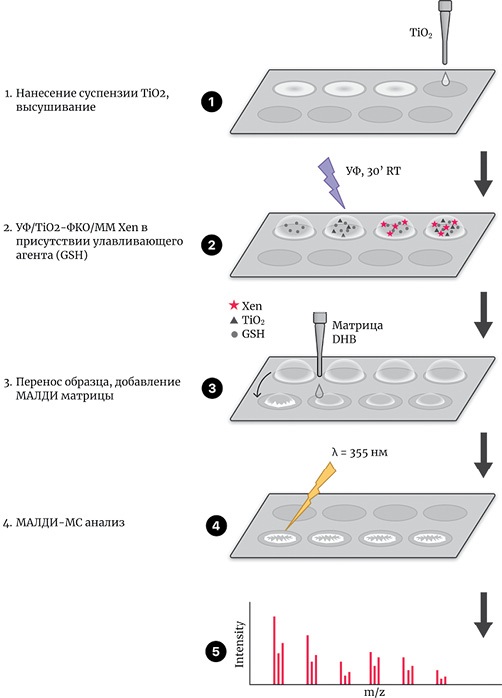
Рисунок подготовлен авторами по собственным данным
Рис. 4. Алгоритм получения метаболитов ИПМ и их аддуктов с GSH методом УФ/TiO2-ФКО/ММ
Для выбора оптимального времени окисления проводили поиск аддуктов после 1, 5, 10, 20 и 30 мин УФ-облучения. Полученные масс-спектры представлены на рисунке 5.
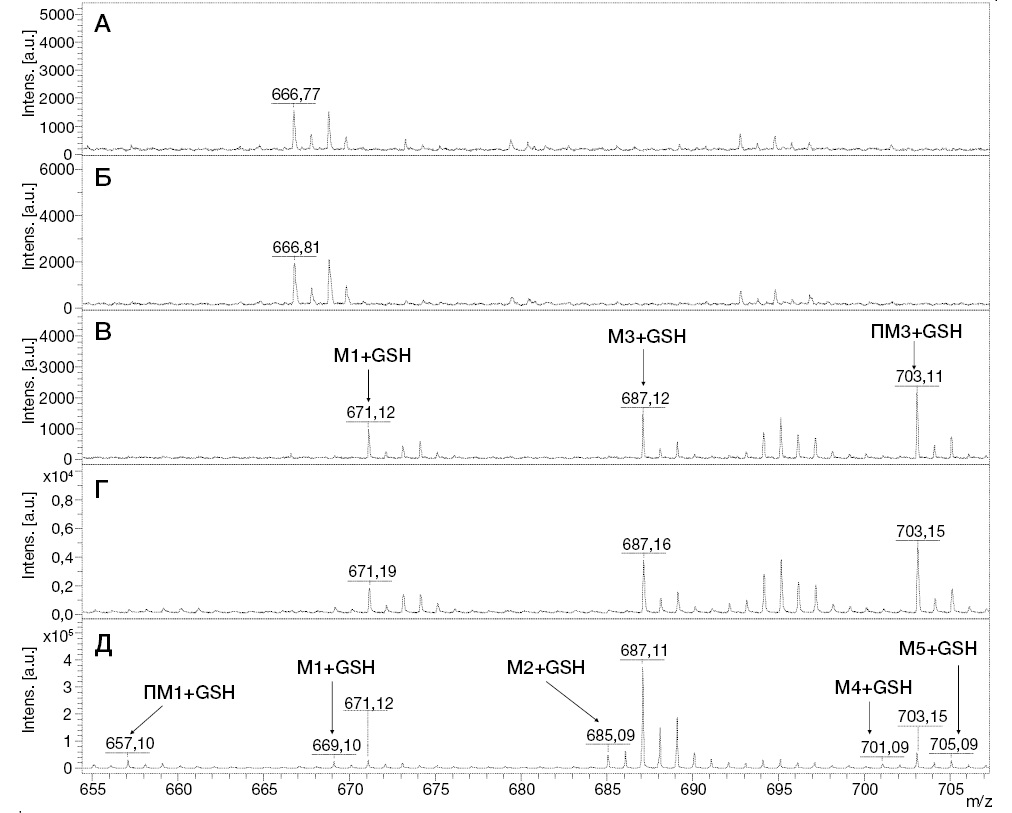
Рисунок подготовлен авторами по собственным данным
Рис. 5. МАЛДИ масс-спектры аддуктов GSH с метаболитами ИПМ при проведении УФ/TiO2-ФКО/ММ при УФ-облучении инкубационной смеси в течение 0 мин (А), 5 мин (Б), 10 мин (В), 20 мин (Г), 30 мин (Д)
Из результатов масс-спектрометрического анализа следует, что после 5 мин облучения сигналы аддуктов GSH с метаболитами ИПМ еще не обнаруживаются. На 10 мин УФ/TiO2-ФКО были зафиксированы три сигнала, один из которых (m/z 687,12) принадлежит продукту конъюгации GSH с известным метаболитом ИПМ (M3), а другой (m/z 703,11) можно отнести к аддукту GSH с ранее не изученным продуктом метаболизма ИПМ (ПМ3). Для образцов, отобранных после 20 мин облучения, в масс-спектрах наблюдался рост интенсивности вышеуказанных сигналов.
Наиболее полную информацию об аддуктах GSH с метаболитами ИПМ предоставлял масс-спектр, соответствующий выдерживанию образцов под УФ- облучением в течение 30 мин. Помимо идентифицированных ранее продуктов конъюгации, были обнаружены сигналы со значениями m/z 669,10, 685,09, 701,09 и 705,10, соответствующие аддуктам с известными метаболитами ИПМ (M1, M2, M4, M5), а также сигнал с m/z 657,09, принадлежащий аддукту с потенциальным метаболитом ПМ1. Сведения о выявленных аддуктах представлены в таблице 1. Следует отметить, что наибольшее внимание с точки зрения опасности для организма заслуживают, с нашей точки зрения, метаболиты М3, ПМ1 и ПМ3, которые регистрируются только в виде аддуктов с GSH, причем только методом УФ/TiO2-ФКО/ММ в условиях конъюгации in situ, что свидетельствует об их высокой реакционной способности.
В отличие от методик ЭХО и УФ/TiO2-ФКО, в этом случае в масс-спектрах было обнаружено значительное количество сигналов, отнесенных к аддуктам GSH с продуктами окисления ИПМ, как показано на диаграмме (рис. 6), что позволяет сделать вывод о перспективности предложенного подхода.
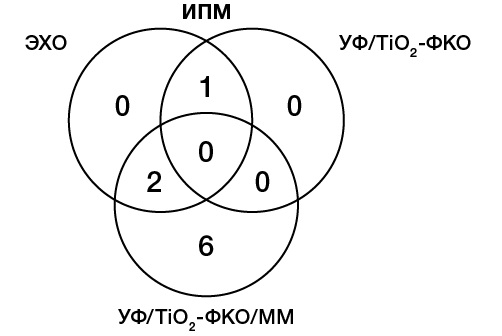
Рисунок подготовлен авторами по собственным данным
Рис. 6. Численное сопоставление обнаруженных аддуктов GSH c продуктами окисления ИПМ, полученных тремя различными методами
В совокупности тремя методами для ИПМ было идентифицировано по 4 ранее не изученных метаболита (m/z [M-H]- 381,93; 408,00; 409,93; 429,96) и аддукта с GSH (m/z [M+H]+ 657,09; 671,10; 703,10; 753,19).
Cледует отметить, что рассмотренные в работе неферментативные методы моделирования биотрансформации ксенобиотиков (ЭХО, УФ/TiO2-ФКО) не могут выступать в качестве полноценной альтернативы классическим биологическим системам (микросомальная или S9 фракции печени, первичные гепатоциты и др.), так как каждый из методов не может полностью воспроизвести полный набор ферментативных реакций, происходящих в ходе первой фазы метаболизма. В то же время данные инструментальные подходы позволяют быстро и относительно дешево получать продукты окисления в чистом растворе без необходимости трудоемкого процесса очистки от биологической матрицы, что особенно актуально при проведении скрининговых исследований потенциальной токсичности ксенобиотика
ЗАКЛЮЧЕНИЕ
В ходе выполнения работы было проведено исследование потенциальных метаболитов ИПМ, полученных с помощью таких неферментативных методов моделирования процессов первой фазы биотрансформации ксенобиотиков, как ЭХО и УФ/TiO2-ФКО в объеме. Моделирование второй фазы метаболизма осуществлялось путем инкубации продуктов окисления индапамида с улавливающим агентом (GSH).
По результатам ВЭЖХ-МС/МС анализа метаболитов и их конъюгатов с GSH в случае ЭХО было обнаружено 5 метаболитов и 3 аддукта с GSH, а при использовании УФ/TiO2-ФКО в объеме было обнаружено 7 метаболитов и 1 аддукт с GSH. Кроме того, была разработана новая методика in vitro выявления реактивных метаболитов ксенобиотиков, основанная на проведении УФ/TiO2-ФКО в присутствии улавливающего агента (GSH) на поверхности МАЛДИ-мишени, функционализированной диоксидом титана, с последующим МАЛДИ масс-спектрометрическим анализом продуктов окисления и их конъюгатов. Продемонстрировано, что разработанная методика выявления реактивных метаболитов ксенобиотиков в случае ИПМ превосходит общепринятые подходы как по производительности, так и по информативности, позволяя обнаруживать большее число потенциально опасных метаболитов (обнаружено 8 аддуктов с глутатионом).
1. Машковский МД. Лекарственные средства. М.: Новая Волна; 2024.
2. Граник ВГ. Метаболизм экзогенных соединений. Лекарственные средства и другие ксенобиотики. М.: Вузовская книга; 2015.
Список литературы
1. Wojnarowska Z, Grzybowska K, Hawelek L, Dulski M, Wrzalik R, Gruszka I et al. Molecular dynamics, physical stability and solubility advantage from amorphous indapamide drug. Mol Pharm. 2013;10(10):3612–27. https://doi.org/10.1021/mp400116q
2. Sanz-Muñoz C, Martínez-Morán C, Torrero-Antón MV, Miranda-Romero A. Indapamide-Associated Stevens-Johnson Syndrome. Actas Dermosifiliogr. 2008;99(4):321–2.
3. Mourad SS, Barary MA, El-Yazbi AF. Sensitive “release-on-demand” fluorescent genosensors for probing DNA damage induced by commonly used cardiovascular drugs: Comparative study. Int J Biol Macromol. 2024;269(1):131821. https://doi.org/10.1016/j.ijbiomac.2024.131821
4. Rutherford T, Sinclair R. Photo-onycholysis due to indapamide. Australas J Dermatol. 2007;48(1):35–6.
5. Liu L, Cui H, Huang Y, Hao Y, Zhou Y, Wan Y. Molecular docking and in vitro evaluations reveal the role of human cytochrome P450 3A4 in the cross-coupling metabolism of phenolic xenobiotics. Environ Res. 2023;220:115256. https://doi.org/10.1016/j.envres.2023.115256
6. Shang J, Coe KJ, Lim HK, Chen L, Khatri BB, Salter R et al. Application of Covalent Binding Body Burden in the HμREL Human Hepatocyte Coculture Model for Reactivity Risk Assessment of Metabolically Low Turnover Drugs. Chem Res Toxicol. 2024;37(4):540–4. https://doi.org/10.1021/acs.chemrestox.4c00046
7. Norman BH. Drug Induced Liver Injury (DILI). Mechanisms and Medicinal Chemistry Avoidance/Mitigation Strategies. J Med Chem. 2020;63(20):11397–419. https://doi.org/10.1021/acs.jmedchem.0c00524
8. Савельева ЕИ, Корягина НЛ, Орлова ОИ. Определение аддуктов отравляющих веществ с биомолекулами как биомаркеров экспозиции/эффекта. Медицина экстремальных ситуаций. 2018;20(S3):451–63. EDN: YPHKSL
9. Gasmi A, Nasreen A, Lenchyk L, Lysiuk R, Peana M, Shapovalova N et al. An Update on Glutathione’s Biosynthesis, Metabolism, Functions, and Medicinal Purposes. Curr Med Chem. 2024;31(29):4579–601. https://doi.org/10.2174/0109298673251025230919105818
10. Gupta PK. Fundamentals of Toxicology: Essential Concepts and Applications. New York: Academic Press; 2016.
11. Pognan F, Beilmann M, Boonen HCM, Czich A, Dear G, Hewitt P et al. The evolving role of investigative toxicology in the pharmaceutical industry. Nat Rev Drug Discov. 2023;22(4):317–35. https://doi.org/10.1038/s41573-022-00633-x
12. Medina D, Omanakuttan B, Nguyen R, Alwarsh E, Walgama C. Electrochemical Probing of Human Liver Subcellular S9 Fractions for Drug Metabolite Synthesis. Metabolites. 2024;14(8):429. https://doi.org/10.3390/metabo14080429
13. Peeters L, Vervliet P, Foubert K, Hermans N, Pieters L, Covaci A. A comparative study on the in vitro biotransformation of medicagenic acid using human liver microsomes and S9 fractions. Chem Biol Interact. 2020;328:109192. https://doi.org/10.1016/j.cbi.2020.109192
14. Sun H, Scott DO. Structure-based Drug Metabolism Predictions for Drug Design. Chem Biol Drug Des. 2010;7(5):3–17. https://doi.org/10.1111/j.1747-0285.2009.00899.x
15. Faber H, Vogel M, Karst U. Electrochemistry/mass spectrometry as a tool in metabolism studies. Anal Chim Acta. 2014;8(34):9–21. https://doi.org/10.1016/j.aca.2014.05.017
16. Gawlik M, Skibiński R, Trawiński J, Komsta Ł. Photocatalysis combined with chromatographic methods as a new promising tool in drug metabolism studies. Acta Chromatogr. 2018;30(1):1–8. https://doi.org/10.1556/1326.2016.00202
17. Álvarez-Lueje A, Pérez M, Zapata C. Electrochemical Methods for the In Vitro Assessment of Drug Metabolism. Topics on Drug Metabolism. InTech. 2012; https://doi.org/10.5772/28647
18. Nikzad N, Rafiee M. Electrochemical study of drug metabolism. Curr Opin Electrochem. 2024;44:101446. https://doi.org/10.1016/j.coelec.2024.101446
19. Mielczarek P, Smoluch M, Kotlinska JH, Labuz K, Gotszalk T, Babij M et al. Electrochemical generation of selegiline metabolites coupled to mass spectrometry. J Chromatogr A. 2015;1389:96–103. https://doi.org/10.1016/j.chroma.2015.02.049
20. Lohmann W, Hayen H, Karst U. Covalent protein modification by reactive drug metabolites using online electrochemistry/liquid chromatography/mass spectrometry. Anal Chem. 2008;80:9714–9. https://doi.org/10.1021/ac801699g
21. Bussy U, Chung-Davidson YW, Li K, Li W. Phase I and phase II reductive metabolism simulation of nitro aromatic xenobiotics with electrochemistry coupled with high resolution mass spectrometry. Anal Bioanal Chem. 2014;406(28):7253–60. https://doi.org/10.1007/s00216-014-8171-3
22. Shono T, Toda T, Oshino N. Preparation of N-dealkylated drug metabolites by electrochemical simulation of biotransformation. Drug Metab Dispos. 1981;9:481–2. https://doi.org/10.1007/s00216-014-8171-3
23. Gawlik M, Trawiński J, Skibiński R. Photocatalysis as a tool for in vitro drug metabolism simulation: multivariate comparison of twelve metal oxides on a set of twenty model drugs. Catalysts. 2020;10:26. https://doi.org/10.3390/catal10010026
24. Ruokolainen M, Valkonen M, Sikanen TM, Kotiaho T, Kostiainen R. Imitation of phase I oxidative metabolism of anabolic steroids by titanium dioxide photocatalysis. Eur J Pharm Sci. 2014;65:45–55. https://doi.org/10.1016/j.ejps.2014.08.009
25. Ruokolainen M, Gul T, Permentier H, Sikanen T, Kostiainen R, Kotiaho T. Comparison of TiO2 photocatalysis, electrochemically assisted Fenton reaction and direct electrochemistry for simulation of phase I metabolism reactions of drugs. Eur J Pharm Sci. 2016;83:36–44. https://doi.org/10.1016/j.ejps.2015.12.012
26. Faber H, Melles D, Brauckmann C, Wehe CA, Wentker K, Karst U. Simulation of the oxidative metabolism of diclofenac by electrochemistry/(liquid chromatography/)mass spectrometry. Anal Bioanal Chem. 2012,403:345–54. https://doi.org/10.1007/s00216-011-5665-0
27. Gladchuk AS, Gorbunov AY, Keltsieva OA, Ilyushonok SK, Babakov VN, Shilovskikh VV et al. Coating of a MALDI target with metal oxide nanoparticles by droplet-free electrospraying — a versatile tool for in situ enrichment of human globin adducts of halogen-containing drug metabolites. Microchem J. 2023;191:108708. https://doi.org/10.1016/j.microc.2023.108708
28. Sun H, Moore C, Dansette PM, Kumar S, Halpert JR, Yost GS. Dehydrogenation of the indoline-containing drug 4-chloro-N-(2-methyl-1-indolinyl)-3-sulfamoylbenzamide (indapamide) by CYP3A4: correlation with in silico predictions. Drug Metab Dispos. 2009;37(3):672–84. https://doi.org/10.1124/dmd.108.022707
Об авторах
О. А. КельциеваРоссия
Кельциева Ольга Александровна
Санкт-Петербург
А. А. Афанасьева
Россия
Афанасьева Анна Андреевна
Санкт-Петербург
С. К. Ильюшонок
Россия
Ильюшонок Семен Кириллович
Санкт-Петербург, Ленинградская обл.
А. С. Гладчук
Россия
Гладчук Алексей Сергеевич - канд. техн. наук
Санкт-Петербург, Ленинградская обл.
А. Н. Арсеньев
Россия
Арсеньев Александр Николаевич
Санкт-Петербург
А. С. Фролов
Россия
Фролов Александр Станиславович
Санкт-Петербург
В. Н. Бабаков
Россия
Бабаков Владимир Николаевич - канд. биол. наук
Ленинградская обл.
К. А. Краснов
Россия
Константин Андреевич Краснов - д-р хим. наук
Санкт-Петербург
Е. П. Подольская
Россия
Подольская Екатерина Петровна - д-р техн. наук
Санкт-Петербург
Дополнительные файлы
Рецензия
Для цитирования:
Кельциева О.А., Афанасьева А.А., Ильюшонок С.К., Гладчук А.С., Арсеньев А.Н., Фролов А.С., Бабаков В.Н., Краснов К.А., Подольская Е.П. Новая one-pot методика получения потенциальных метаболитов индапамида путем окисления-конъюгации на МАЛДИ-мишени. Медицина экстремальных ситуаций. 2025;27(1):26-36. https://doi.org/10.47183/mes.2025-27-1-26-36
For citation:
Keltsieva O.A., Afanasyeva A.A., Ilyushonok S.K., Gladchuk A.S., Arseniev A.N., Frolov A.S., Babakov V.N., Krasnov K.A., Podolskaya E.P. A new one-pot technique for obtaining potential indapamide metabolites by oxidation and conjugation on MALDI target. Extreme Medicine. 2025;27(1):26-36. https://doi.org/10.47183/mes.2025-27-1-26-36