Перейти к:
Болезнь Крона у ребенка с редким первичным иммунодефицитным состоянием: особенности консервативной и хирургической тактики
https://doi.org/10.47183/mes.2025-284
Аннотация
Введение. Первичные иммунодефицитные состояния (ПИДС) — это группа врожденных заболеваний, вызванных генетическими дефектами и обусловливающих разнообразные фенотипические проявления. Классические воспалительные заболевания кишечника (ВЗК) в большинстве случаев являются многофакторными патологиями, когда сочетаются генетическая предрасположенность, изменения кишечной микрофлоры и неблагоприятное влияние окружающей среды. Очень раннее начало ВЗК, с дебютом болезни в возрасте до 6 лет, составляет 3–15% всех детских воспалительных заболеваний кишечника. Именно для этой группы характерна моногенная этиология, протекающая в рамках ПИДС с гастроинтестинальным фенотипом и связанная с мутацией в конкретном гене.
Описание клинического случая. Представлен клинический случай моногенной болезни Крона у ребенка с Х-сцепленным лимфопролиферативным синдромом 2-го типа с демонстрацией многоэтапного командного подхода. Для достижения стойкой ремиссии, помимо подбора консервативной терапии, потребовалось проведение повторных хирургических вмешательств и повторных трансплантаций гемопоэтических стволовых клеток. Индивидуальный подход и планирование лечебной стратегии позволили достичь положительного результата лечения.
Выводы. Очень важно у детей раннего возраста с атипичным течением воспалительного заболевания кишечника и рефрактерностью к стандартной терапии дифференцировать моногенные формы ВЗК. Такие пациенты требуют пристального внимания, динамического наблюдения, мультидисциплинарного подхода с альянсом гастроэнтеролога, иммунолога и хирурга.
Ключевые слова
Для цитирования:
Алиева Э.И., Щербакова О.В., Зябкин И.В. Болезнь Крона у ребенка с редким первичным иммунодефицитным состоянием: особенности консервативной и хирургической тактики. Медицина экстремальных ситуаций. 2025;27(3):410-416. https://doi.org/10.47183/mes.2025-284
For citation:
Alieva E.I., Shcherbakova O.V., Zyabkin I.V. Crohn’s disease complicating a rare primary immunodeficiency in a pediatric patient: challenges in medical and surgical decision-making. Extreme Medicine. 2025;27(3):410-416. https://doi.org/10.47183/mes.2025-284
ВВЕДЕНИЕ
Первичные иммунодефицитные состояния (ПИДС) — генетически обусловленные заболевания, характеризующиеся врожденными дефектами защиты организма, что приводит к нарушению иммунного ответа с развитием рецидивирующих инфекций, повышенному риску злокачественных новообразований и возникновению аутоиммунных болезней [1]. Современная классификация ПИДС принята Международным союзом иммунологических обществ (International Union of Immunologic Societies, IUIS) и учитывает молекулярно-генетические дефекты при том или ином иммунодефиците, выделяя 10 основных групп ПИДС [2].
Х-сцепленный лимфопролиферативный синдром (англ. X-linked lymphoproliferative syndrome, XLP) относится к группе ПИДС с иммунной дисрегуляцией; XLP обусловлен мутациями в генах SH2D1A, XIAP и MAGT1, отличается атипичной реакцией в ответ на вирусную инфекцию Эпштейна – Барр и развитием гемофагоцитоза, дисгамма-глобулинемии и злокачественной лимфопролиферацией. Наиболее изученными являются первый (XLP1) и второй (XLP2) типы, которые встречаются с частотой 1–3 на 1 млн рожденных мальчиков, что вызывает интерес, учитывая редкость данного заболевания. Существенным отличием XLP2 от XLP1 является развитие геморрагического колита, который клинически и морфологически напоминает воспалительные заболевания кишечника (ВЗК).
Воспалительные заболевания кишечника (ВЗК) относят к полигенно наследуемым заболеваниям, при которых обнаруживают более сотни чувствительных локусов, повышающих риск болезни. В настоящее время изучено более 300 генов, мутации в которых приводят к развитию ПИДС [3]. Из них идентифицированы более 75 генов, мутации в которых ассоциированы с ВЗК-подобным фенотипом [4]. У детей с очень ранним началом ВЗК (до 6 лет) и особенно с младенческим ВЗК (с началом заболевания до двухлетнего возраста) необходимо проводить дифференциальный диагноз с ПИДС [5]. ВЗК в рамках моногенного заболевания почти всегда протекает аналогично «классическому» полифакторному ВЗК, отличаясь рефракторностью к терапии, и может являться единственным проявлением ПИДС на момент обращения к врачу, что задерживает верификацию окончательного диагноза [6]. Основными методами лечения ПИДС являются консервативная терапия (симптоматическая, антибактериальная и противогрибковая), заместительная терапия иммуноглобулинами, лечение генно-инженерно-биологическими препаратами (ГИБП) и таргетными иммуносупрессивными средствами, в определенных случаях проводится трансплантация гемопоэтических стволовых клеток (ТГСК) [7].
Однако до настоящего времени отсутствуют общепринятые подходы к лечению таких пациентов. Отдельной важной опцией лечения пациентов с ПИДС с поражением толстой кишки являются малоинвазивные оперативные вмешательства, такие как наложение превентивной илеостомы перед проведением ТГСК с целью снижения риска осложнений трансплантации [8].
Представлено клиническое наблюдение ребенка с ПИДС и кроноподобным поражением кишечника с обсуждением сложностей терапевтических и хирургических этапов лечения.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Мальчик Б., возраст 8 лет (2016 г.р.), наблюдался в отделении гастроэнтерологии ФНКЦ детей и подростков ФМБА России с диагнозом: болезнь Крона толстой кишки средней степени тяжести, минимальная активность (PCDAI 10 баллов); первичное иммунодефицитное состояние, Х-сцепленный лимфопролиферативный синдром 2-го типа (мутация гена BIRC4 (XIAP) c/599G > A (p.Cys200Tyr) в гемизиготном состоянии; аутоиммунная гемолитическая анемия, медикаментозная ремиссия.
Из анамнеза жизни известно, что ребенок родился от 2 физиологической беременности, 2 срочных самостоятельных родов (1 — девочка, 10 лет — здорова). Длина тела при рождении 49 см, вес при рождении 2860 г. Оценка по шкале АПГАР 8/8 баллов. К груди приложен в 1 сут, находился на грудном вскармливании до 1,5 лет. БЦЖ вакцинирован в роддоме. Перенесенные инфекции: частые ОРВИ (в возрасте 1 месяца — ОРВИ с дыхательной недостаточностью), в 1 год — пневмония. Профилактические прививки проведены по национальному календарю; медотвод с 07.2017. Диаскин-тест отрицательный от 29.08.2017. Наследственный анамнез не отягощен.
Из анамнеза заболевания известно, что с 3-х недель жизни у ребенка отмечался частый разжиженный стул со слизью, с 9 месяцев — прожилки крови в стуле. В возрасте 1 года перенес пневмонию, в течение нескольких месяцев после этого сохранялся фебрилитет. В мае 2017 г. (1 год 4 месяца) проведено хирургическое лечение острого парапроктита — вскрытие и дренирование абсцесса.
Очередное ухудшение состояния отмечено в июле 2017 г., ребенок был госпитализирован в гастроэнтерологическое отделение Морозовской ДГКБ (МДГКБ). При осмотре: в области ануса визуализировано свищевое отверстие с гнойным отделяемым, перианальный дерматит, сопровождающийся мокнутием, анальная трещина (рис. 1).
В лабораторных показателях выявлены: лейкоцитоз 22,3×103 клеток/мкл, снижение гемоглобина до 57 г/л, повышение С-реактивного белка (СРБ) до 64,9 мг/л, изменения в иммунограмме (кластер дифференцировки лейкоцитов — CD3+ 2 тыс./мкл, CD4+ 670/мкл, CD8+ 1 335/мкл, CD19+ 339/мкл, NK-клетки 55/мкл). Во время госпитализации в отделение гастроэнтерологии МДГКБ в августе 2017 г. отмечался эпизод подмышечного лимфаденита, проведено вскрытие и дренирование абсцесса. При проведении колоноскопии выявлено язвенное поражение толстой кишки, при гистологическом исследовании — признаки хронического левостороннего язвенного колита высокой степени активности. В 2017 г. специалистами МДГКБ выставлен диагноз: болезнь Крона с поражением толстой кишки; заподозрено первичное иммунодефицитное состояние. Начата гормональная терапия преднизолоном и 5-АСК (5-аминосалициловой кислоты) препаратами, дополнительно ребенок получал противомикробную и противогрибковую терапию (амоксициллин + клавулановая кислота, ципрофлоксацин, цефоперазон + сульбактам, флюконазол). Ребенок направлен на генетическое исследование (полноэкзомное секвенирование генома).
В феврале 2018 г. получено заключение молекулярно-генетического исследования: в экзоне 2 гена XIAP выявлен патогенный вариант с.599G > A (p.Cys200Tyr) в гемизиготном состоянии. В марте 2018 г. в связи с прогрессивным ухудшением состояния в виде выраженного колитического синдрома ребенок госпитализирован в отделение иммунологии НМИЦ ДГОИ им. Дм. Рогачева. Назначена ГИБП-анти-ФНО-терапия препаратом адалимумаб 40 мг 1 раз в неделю. Ввиду риска развития гемофагоцитоза инициирована терапия тоцилизумабом. Перед проведением трансплантации гемопоэтических стволовых клеток с целью уменьшения риска осложнений врачебным консилиумом принято решение наложить илеостому с отключением пассажа по толстой кишке.
В МДГКБ 01.06.2018 проведено лапароскопически-ассистированное наложение двуствольной илеостомы с предоперационной маркировкой расположения стомы (рис. 2).
При лапароскопической ревизии органов брюшной полости были выявлены следующие изменения: правая половина толстой кишки с неизмененными стенками, расширена в диаметре до 4 см; сигмовидная кишка с выраженными воспалительными изменениями, на протяжении 8–10 см — с утолщенными стенками, «наползающей» брыжейкой. Послеоперационный период протекал без осложнений.
Дальнейшее лечение ребенка проводилось в НМИЦ ДГОИ им. Дм. Рогачева. Выполнена аллогенная трансплантация гемопоэтических стволовых клеток от родственного гаплоидентичного донора (матери) с TCRαβ/CD19 деплецией от 25.07.2018. Осложнение — сверхраннее отторжение трансплантата от 15.08.2018.
Учитывая отторжение трансплантата, а также тяжелый энтерит и большие потери по илеостоме (по результатам лабораторных данных — с отсутствием инфекционного процесса, на фоне восстановленного собственного лейкопоэза), была вновь инициирована терапия рекомбинантными моноклональными антителами адалимумаб 40 мг 1 раз в 2 недели.
Повторная аллогенная трансплантация гемопоэтических стволовых клеток от гаплоидентичного донора (отец) с процессингом трансплантата TCRαβ/CD19 деплецией проведена 29.11.2018. Течение аутоиммунного гемолиза выявлено в начале мая 2019 г, (анемия со снижением гемоглобина минимально до 73 г/л, ретикулоциты 10%, прямая проба Кумбса ++++). У ребенка было отмечено прогрессирующее смещение химеризма в сторону собственного, протекал аутоиммунный гемолиз, рефрактерный к введениям внутривенного иммуноглобулина, в связи с чем начата терапия ритуксимабом в начальной дозе 375 мг/м2 с положительным эффектом.
В августе 2019 г. ребенок госпитализирован в НМИЦ ДГОИ им. Дм. Рогачева с выраженным болевым синдромом, эвагинацией кишки через стому. Попытки консервативного вправления кишки на фоне обезболивания трамадолом и под аппаратно-масочным наркозом были безуспешны. Диагностирован некроз эвагинированной кишки, проведено срочное оперативное вмешательство: резекция участка кишки с формированием двуствольной раздельной илеостомы. В послеоперационном периоде отмечено расхождение краев раны, выполнена вторичная хирургическая обработка краев раны, реконструкция стомы.
В сентябре 2019 г. ребенок госпитализирован в хирургическое отделение Российской детской клинической больницы (РДКБ) с перистомальными осложнениями (рис. 3), проведена стоматерапия с положительным эффектом. При эндоскопическом обследовании отключенной толстой кишки (рис. 4) выявлен эрозивный проктосигмоидит и стриктура сигмовидной кишки с облитерацией просвета.
В НМИЦ ДГОИ им. Дм. Рогачева 01.11.2019 на основании исследования химеризма в клетках костного мозга (93,7% собственных клеток) у пациента констатировано отторжение трансплантата. С родителями пациента проведена беседа о необходимости повторной трансплантации гемопоэтических стволовых клеток, рисках ее проведения. Учитывая сохранение эрозивных изменений и развитие стриктуры в «отключенных» отделах толстой кишки, пациенту продолжена местная терапия салофальком, терапия адалимумабом с сокращением введений в дозе 40 мг еженедельно, начата иммуносупрессивная терапия азатиоприном, продолжена комплексная противомикробная терапия и заместительная терапия внутривенным иммуноглобулином. От проведения повторной ТГСК было решено отказаться в связи с аутоиммунной гемолитической анемией, гипофункцией трансплантата по гранулоцитарному типу, выраженным колитическим синдромом.
Принимая во внимание крайне высокие риски усугубления поражения ЖКТ на фоне развития диверсионного колита в «отключенных» отделах кишечника, решено выполнить реконструктивно-восстановительную операцию с резекцией участка кишки со стриктурой, одновременным закрытием илеостомы и восстановлением непрерывности кишечника.
В Российской детской клинической больнице (РДКБ) 27.11.2019 выполнена плановая операция: резекция участка сигмовидной кишки со стриктурой и наложением толсто-толстокишечного анастомоза; закрытие илеостомы с формированием тонко-толстокишечного анастомоза. При ревизии толстой кишки было отмечено, что ободочная кишка на всем протяжении несколько уплотнена, уменьшена в диаметре (вид «отключенной» кишки), брыжейка значительно утолщена, серозная оболочка кишки практически скрыта «наползающим жиром» (рис. 5). В сигмовидной кишке был выявлен участок значительного сужения просвета длиной около 4 см. Отводящий отдел илеостомы расположен в 2 см от илеоцекального перехода, аппендикс «замурован» плоскостными спайками между приводящим и отводящим отделами стомы. Выполнена резекция илеоцекального угла с формированием илеоасцендоанастомоза «конец-в-конец» (рис. 6).
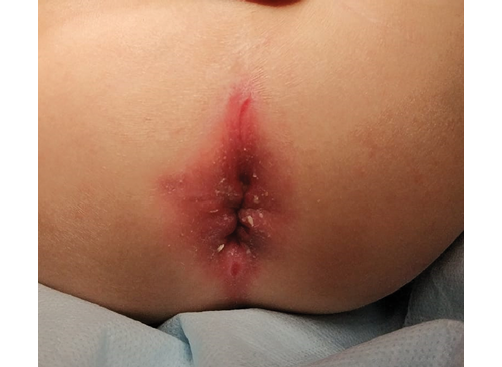
Фотография выполнена авторами
Рис. 1. Вид перианальной области пациента. Определялись множественные анальные трещины, перианальный дерматит

Фотография выполнена авторами
Рис. 2. Предоперационная маркировка расположения илеостомы

Фотография выполнена авторами
Рис. 3. Вид перистомальных осложнений, определяется перистомальный дерматит с инфицированными краями раны в области стомы

Фотография выполнена авторами
Рис. 4. Эндофотография (данные ректороманоскопии). Эндоскопическая картина облитерации просвета сигмовидной кишки

Фотография выполнена авторами
Рис. 5. Интраоперационная фотография. Вид сигмовидной кишки, практически скрытой «наползающим жиром»: в просвет кишки введен желобоватый зонд до уровня стриктуры

Фотография выполнена авторами
Рис. 6. Интраоперационная фотография. Вид прямого илеоасцендоанастомоза
При гистологическом исследовании установлено:
- макроскопическое описание: фрагмент стенки кишки с прилежащей жировой тканью размером 4×3×1 см. На разрезе слизистая оболочка кишки без видимых патологических изменений; фрагмент кишки в области илеоцекального угла с червеобразным отростком, общим размером 5,5×3,5×2 см;
- микроскопическое описание и заключение: фрагмент стенки терминального отдела тонкой кишки с сохранной слизистой оболочкой без признаков воспалительной активности; фрагменты стенки толстой кишки нормального гистологического строения.
Далее состояние ребенка расценивалось как стабильное. Сохранялось смещение химеризма в сторону собственного (93,7% собственных клеток).
В межгоспитальный период продолжена терапия ГИБП адалимумабом в дозе 40 мг 1 раз в 2 недели; иммуносупрессивная терапия (азатиоприн) отменена в августе 2020 г.
С августа 2021 г. по настоящее время ребенок наблюдается в отделении гастроэнтерологии ФГБУ «ФНКЦ детей и подростков ФМБА России», где ему регулярно проводятся медицинские обследования. Сохраняется клинико-эндоскопическая ремиссия. По данным контрольных эндоскопических исследований: зона илеоасцендоанастомоза без признаков воспаления, свободно проходима для аппарата; терминальный отдел подвздошной кишки не изменен; слизистая оболочка толстой кишки гладкая, определяются единичные рубцы звездчатой формы, белесоватого цвета.
В январе 2022 г. проведено обследование в детской больнице г. Цюриха (Швейцария), рекомендовано продолжать терапию иммуноглобулином, медленно снижать иммуносупрессию под контролем гастроэнтеролога.
Пациенту проводятся регулярные консультации иммунолога в НМИЦ ДГОИ им. Дм. Рогачева. С учетом риска развития иммунных осложнений продолжается терапия ритуксимабом. С целью поддержания ремиссии со стороны иммунного колита по жизненным показаниям продолжена терапия адалимумабом в прежнем режиме в дозе 40 мг 1 раз в 2 недели подкожно, а также месалазином в дозе 60 мг/кг перорально. В связи с нарушением антителообразования, принимая во внимание высокий риск тяжелых жизнеугрожающих инфекционных осложнений, продолжена постоянная заместительная терапия иммуноглобулином для подкожного или внутривенного введения в суммарной дозе 0,5 г/кг/мес. С целью профилактики развития инфекционных осложнений проводятся курсы антибактериальной терапии азитромицином.
ОБСУЖДЕНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
ВЗК с очень ранним началом — редкое состояние, характеризующееся дебютом заболевания до 6-летнего возраста, встречается в 3–15% случаев ВЗК у детей, проявляется выраженной клинической активностью, рефрактерностью к терапии и имеет более высокий уровень смертности [5][9]. Традиционные методы лечения пациентов с ранним началом ВЗК, такие как анти-ФНО-терапия, демонстрируют ограниченную эффективность [10]. В случае очень раннего начала ВЗК, особенно до двухлетнего возраста, а также при наличии критериев вероятности ПИДС, т.н. «настораживающих признаков» [4][7], следует провести диагностический поиск моногенных мутаций с верификацией ПИДС [11].
Нами представлен клинический случай моногенной болезни Крона, манифестировавшей кишечными проявлениями с периода новорожденности, перианальными поражениями и рецидивирующими инфекциями различной локализации в раннем детском возрасте, атипичным течением и неэффективностью к стандартной медикаментозной терапии. Информированность и настороженность гастроэнтерологов помогли своевременно заподозрить ПИДС и выполнить полноэкзомное секвенирование генома, по результатам которого выявлен Х-сцепленный лимфопролиферативный синдром 2-го типа (англ. X-linked lymphoproliferative syndrome, XLP).
Из всех ПИДС именно XLP2 наиболее часто имеет ВЗК-подобную клиническую картину, а поражение толстой кишки, имитирующее болезнь Крона, возникает у 19% детей с XLP2 [12]. Причиной Х-сцепленного лимфопролиферативного синдрома является мутация гена XIAP (англ. X-linked inhibitor of apoptosis protein), также известного как BIRC4 (baculoviral IAP repeat-containing protein 4 — бакуловирусный протеин 4, содержащий IAP повторы), усилен апоптоз регуляторных Т-лимфоцитов — NKT-клеток и CD4+Treg, что приводит к выраженному патоген-индуцированному ответу [13].
Кроме своевременной диагностики ПИДС, одним из ключевых моментов успешности лечебного процесса моногенной БК является хирургическое вмешательство с формированием отводящей стомы, направленное на контроль воспаления в толстой кишке и улучшение нутритивного статуса. В настоящее время нет международных и отечественных рекомендаций по показаниям к оперативным вмешательствам при рефрактерном колите, имеются лишь единичные публикации о целесообразности выведения илеостомы для смягчения тяжелых клинических симптомов у детей с очень ранним началом ВЗК и для обеспечения возможности трансплантации стволовых клеток [8][14]. Мы разделяем мнение зарубежных исследователей о важности выведения превентивной илеостомы перед ТГСК с целью уменьшения возможных осложнений, а также считаем целесообразным выключение толстой кишки из пассажа в рамках этапного лечения тяжелого рефрактерного колита с перианальными поражениями при болезни Крона и кроноподобном ПИДС.
В нашем наблюдении мы продемонстрировали, что плановая превентивная илеостомия обеспечила контроль над септическими (инфекционными) осложнениями и уменьшила риск кишечных осложнений при проведении ТГСК, несмотря на эпизоды отторжения трансплантата.
Хотя стома может временно облегчить симптомы, она не может обеспечить долгосрочную клиническую ремиссию у детей с ВЗК; кроме того, с течением времени возрастает частота различных перистомальных осложнений [15]. В нашем случае мы также наблюдали подобные осложнения через год после стомирования (эвагинацию стомы, некроз кишки и расхождение краев раны после экстренной операции). Следует также учитывать, что при длительном носительстве илеостомы в отключенной толстой кишке может возникнуть «диверсионный колит», что требует дифференцировки с атакой иммуноопосредованного колита при развитии рефрактерности к проводимой терапии. Остался неясным генез стриктуры сигмовидной кишки, которая могла сформироваться как в исходе хронической реакции «трансплантат против хозяина», так и в результате кроноподобного трансмурального поражения толстой кишки.
Несмотря на изначальную неэффективность адалимумаба и неуспешность повторной ТГСК, использование индивидуального подхода с комбинированной медикаментозной терапией и подбором симптоматического лечения, выполнение своевременных этапных оперативных вмешательств позволило достичь хорошего результата лечения ребенка с тяжелым ПИДС с кроноподобными кишечными и перианальными проявлениями.
ЗАКЛЮЧЕНИЕ
Своевременная диагностика ПИДС обеспечивает быстрое назначение таргетной терапии или проведение трансплантации гемопоэтических стволовых клеток, что в большинстве наблюдений позволяет достичь ремиссии заболевания, улучшить качество и продолжительность жизни пациентов. Планирование хирургических и терапевтических этапов, наблюдение мультидисциплинарной командой в различных специализированных отделениях в разные периоды лечебного процесса является оптимальным пациенто-ориентированным подходом, особенно у детей с такими тяжелыми заболеваниями, как моногенные формы ВЗК.
Список литературы
1. Yu JE, Orange JS, Demirdag YY. New primary immunodeficiency diseases: context and future. Current Opinion in Pediatrics. 2018;30(6):806–20. https://doi.org/10.1097/MOP.0000000000000699
2. Bousfiha A, Moundir A, Tangye SG, Picard C, Jeddane L, Al-Herz W, et al. The 2022 Update of IUIS Phenotypical Classification for Human Inborn Errors of Immunity. Journal of Clinical Immunology. 2022;42(7):1508–20. https://doi.org/10.1007/s10875-022-01352-z
3. Tangye SG, Al-Herz W, Bousfiha A, Cunningham-Rundles C, Franco JL, Holland SM, et al. Human inborn errors of immunity: 2022 update on the classification from the International Union of Immunological Societies Expert Committee. Journal of Clinical Immunology. 2022;42(7):1473–507. https://doi.org/10.1007/s10875-022-01289-3
4. Uhlig HH, Charbit-Henrion F, Kotlarz D, Shouval DS, Schwerd T, Strisciuglio C, et al. Clinical genomics for the diagnosis of monogenic forms of inflammatory bowel Disease: A position paper from the Paediatric IBD Porto Group of European Society of Paediatric Gastroenterology, Hepatology and Nutrition. Journal of Pediatric Gastroenterology and Nutrition. 2021;72(3):456–73. https://doi.org/10.1097/MPG.0000000000003017
5. Щиголева АЕ, Шумилов ПВ, Суспицын ЕН. Роль таргетного секвенирования в диагностике воспалительных заболеваний кишечника с очень ранним началом. Вопросы Детской Диетологии. 2020;18(1):28–34. https://doi.org/10.20953/1727-5784-2020-1-28-34
6. Tegtmeyer D, Seidl M, Gerner P, Baumann U, Klemann C. Inflammatory bowel disease caused by primary immunodeficiencies — Clinical presentations, review of literature, and proposal of a rational diagnostic algorithm. Pediatric Allergy and Immunology. 2017;28(5):412–29. https://doi.org/10.1111/pai.12734
7. Щербина АЮ. Маски первичных иммунодефицитных состояний: проблемы диагностики и терапии. Российский Журнал Детской Гематологии и Онкологии. 2016;3(1):52–8. https://doi.org/10.17650/2311-1267-2016-3-1-52-58
8. Sun S, Ye Z, Zheng S, Chen G, Qian X, Dong K, et al. Surgical treatment of monogenic infammatory bowel disease: A single clinical center experience. Journal of Pediatric Surgery. 2019;54(10):2155–61. https://doi.org/10.1016/j.jpedsurg.2019.02.013
9. Kelsen JR, Sullivan KE, Rabizadeh S, Singh N, Snapper S, Elkadri A, et al. North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition position paper on the evaluation and management for patients with very early-onset inflammatory bowel disease. Journal of Pediatric Gastroenterology and Nutrition. 2020;70(3):389–403. https://doi.org/10.1097/MPG.0000000000002567
10. Bramuzzo M, Arrigo S, Romano C, Filardi MC, Lionetti P, Agrusti A, et al. Efficacy and safety of infliximab in very early onset inflammatory bowel disease: a national comparative retrospective study. United European Gastroenterology Journal. 2019;7(6):759–66. https://doi.org/10.1177/2050640619847592
11. Ouahed J, Spencer E, Kotlarz D, Shouval DS, Kowalik M, Peng K, et al. Very early onset inflammatory bowel disease: A clinical approach with a focus on the role of genetics and underlying immune deficiencies. Inflammatory Bowel Diseases. 2020;26(6):820–42. https://doi.org/10.1093/ibd/izz259
12. Балашов ДН, Роппельт АА, Румянцев АГ, Щербина АЮ. Первичный иммунодефицит — Х-сцепленный лимфопролиферативный синдром. Федеральные клинические рекомендации, 2020 г. Российский Аллергологический Журнал. 2019;16(4):66–77. https://doi.org/10.36691/RAJ.2020.16.4.008
13. Aguilar C, Latour S. X-linked inhibitor of apoptosis protein deficiency: more than an X-linked lymphoproliferative syndrome. Journal of Clinical Immunology. 2015;35(4):331–8. https://doi.org/10.1007/s10875-015-0141-9
14. Maxwell EC, Dawany N, Baldassano RN, Mamula P, Mattei P, Albenberg L, et al. Diverting ileostomy for the treatment of severe, refractory, pediatric inflammatory bowel disease. Journal of Pediatric Gastroenterology and Nutrition. 2017;65(3):299–305. https://doi.org/10.1097/MPG.0000000000001498
15. Xu X, Zhou Y, Tan Z, Huang Y, Dong K, Gu Y, et al. Risk factors for stoma and incision complications of enterostomy in children with very early-onset inflammatory bowel disease: a prospective cohort study. European Journal of Pediatrics. 2025;184(2):146–70. https://doi.org/10.1007/s00431-024-05952-2
Об авторах
Э. И. АлиеваРоссия
Алиева Эльмира Ибрагимовна, д-р мед. наук
Москва
О. В. Щербакова
Россия
Щербакова Ольга Вячеславовна, д-р мед. наук
Москва
И. В. Зябкин
Россия
Зябкин Илья Владимирович, д-р мед. наук
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Алиева Э.И., Щербакова О.В., Зябкин И.В. Болезнь Крона у ребенка с редким первичным иммунодефицитным состоянием: особенности консервативной и хирургической тактики. Медицина экстремальных ситуаций. 2025;27(3):410-416. https://doi.org/10.47183/mes.2025-284
For citation:
Alieva E.I., Shcherbakova O.V., Zyabkin I.V. Crohn’s disease complicating a rare primary immunodeficiency in a pediatric patient: challenges in medical and surgical decision-making. Extreme Medicine. 2025;27(3):410-416. https://doi.org/10.47183/mes.2025-284

















