Перейти к:
Сравнительная оценка протеомной регуляции состояния костной ткани в 21-суточной антиортостатической гипокинезии (-6°) и 21-суточной «сухой» иммерсии
https://doi.org/10.47183/mes.2025-296
Аннотация
Введение. Экспериментальные возможности во время реального космического полета ограничены, поэтому актуально использование наземных моделей, таких как «сухая» иммерсия (СИ) и антиортостатическая гипокинезия (АНОГ). Изменения костной ткани индуцируются изменением комплекса факторов внешней среды на протеомном уровне, компенсируя изменения, вызванные снижением гравитации и уменьшением двигательной активности, но в дальнейшем с продолжением воздействия включаются другие контуры регуляции.
Цель. Сравнительная оценка протеомной регуляции состояния костной ткани в 21-суточной антиортостатической гипокинезии (-6°) и 21-суточной «сухой» иммерсии.
Материалы и методы. Методами масс-спектрометрии исследовали образцы плазмы крови 8 здоровых испытателей-добровольцев мужчин (средний возраст 20–44 года) в условиях 21-суточной АНОГ и 10 испытателей (средний возраст 23–34 года) в условиях 21-суточной «сухой» иммерсии. Для статистического анализа и определения молекулярных функций и биологических процессов, в которых участвовали белки, применяли программный пакет Perseus. Соответствие основных биологических процессов, согласно генным онтологиям, указанным в базе данных GO, и определенных белков устанавливали с помощью базы знаний системы ANDSystem, STRING.
Результаты. Выявлено 9 белков с достоверно изменяющимся уровнем на 21-е сутки АНОГ (р < 0,05) и 8 белков с достоверно изменяющимся уровнем на 21-е сутки СИ (р < 0,05), связанных с биологическими процессами, протекающими в костной ткани. Часть выявленных белков связаны в устойчивые сети белок-белковых взаимодействий, то есть могут коэкспрессироваться. Выделены два общих белка (гаптоглобин и глутатионпероксидаза) на 21-е сутки СИ, 21-е сутки АНОГ.
Выводы. Полученные данные впервые обращают внимание на протеомные механизмы регуляции биологических процессов костной ткани у здоровых лиц под влиянием 21-суточной АНОГ и 21-суточной «сухой» иммерсии. Приведены аннотации каждого белка — участника биологических процессов в костной ткани в 21-суточной АНОГ (-6°) и 21-суточной «сухой» иммерсии. Эти результаты имеют большое значение для авиакосмической и клинической медицины.
Ключевые слова
Для цитирования:
Пастушкова Л.Х., Гончарова А.Г., Каширина Д.Н., Ларина И.М. Сравнительная оценка протеомной регуляции состояния костной ткани в 21-суточной антиортостатической гипокинезии (-6°) и 21-суточной «сухой» иммерсии. Медицина экстремальных ситуаций. 2025;27(4):558-568. https://doi.org/10.47183/mes.2025-296
For citation:
Pastushkova L.Kh., Goncharova A.G., Kashirina D.N., Larina I.M. Comparative assessment of proteomic regulation of bone tissue during 21-day head-down bed rest (–6°) and 21-day dry immersion. Extreme Medicine. 2025;27(4):558-568. https://doi.org/10.47183/mes.2025-296
ВВЕДЕНИЕ
В планах космических агентств по проведению все более длительных миссий освоения дальнего космоса понимание биологических изменений в костной ткани, возникающих при пролонгированном воздействии микрогравитации как компонента комплекса факторов космического полета (КП), имеет первостепенное значение.
Невесомость вызывает физиологические изменения, влияющие на опорно-двигательный аппарат и взаимосвязанные с ним сенсорные, нейромышечные, сосудистые и другие процессы, для изучения которых необходимо использование наземных моделей в связи с тем, что в режиме реального космического полета экспериментальные возможности ограничены. Эти модели позволяют оценивать эффекты, вызванные микрогравитацией, выявлять гравитационные механизмы регуляции физиологических систем организма, а также механизмы адаптации к условиям невесомости [1].
Сопоставление результатов исследований, полученных в наземных модельных экспериментах (антиортостатическая гипокинезия, «сухая» иммерсия) и выполненных в реальных КП, показало возможность использования данных наземной имитации действия отдельных факторов космического полета для изучения основных закономерностей и изменений в организме. Использование вышеуказанных моделей становится необходимым для исследовательских целей, позволяя расширить спектр участников и повысить научную значимость посредством анализа различных протоколов (различная длительность, использование мер профилактики и др.). Отметим, что проведение инвазивных процедур (венепункции с забором крови, биопсии и т.д.), а также логистика доставки грузов на орбиту и на Землю представляют собой существенные проблемы [2], что еще более актуализирует использование модельных исследований на Земле.
Расширение знаний по данному направлению является важным в социальном и экономическом аспекте сохранения здоровья, трудоспособности и социальной активности общества: исследования о влиянии гиподинамии и вынужденного постельного режима на здоровье человека актуальны в контексте современных проблем со здоровьем и старением населения [2]. Снижение механической нагрузки на скелет, вызванное постельным режимом и/или космическим полетом, приводит к потере костной массы, что отражается в снижении минеральной плотности костной ткани (МПКТ) во всем скелете и отдельных его частях, например в позвоночнике, головке бедренной и большеберцовой костей [3][4].
Авторами R. Baran и соавт.; J. Man и соавт. выявлены изменения в структуре лучевой и большеберцовой костей методом периферической количественной компьютерной томографии (pQCT) и периферической количественной компьютерной томографии высокого разрешения (HR-pQCT) в условиях космических полетов [5][6].
Изменение гормонального статуса, сопутствующего процессам резорбции и новообразования костной ткани, отмечено в ряде работ. Так, описано изменение циркадианных ритмов соматотропина и снижение его среднесуточной концентрации в ходе 370-суточного АНОГ-эксперимента [7]. В исследованиях А.И. Григорьева и соавт., а также K. Austermann и соавт. было показано изменение в содержании гормонов, регулирующих обмен кальция, в ходе как 120-суточной, так и 370-суточной АНОГ. Так, на 75-е сут экспериментов уровень паратиреоидного гормона был ниже фонового, а концентрация кальцитонина повышалась [8][9]. В работе M. Inoue и соавт. установлено, что инсулиноподобный фактор роста I (IGF-I) и его связывающий белок, а также связывающий белок инсулиноподобного фактора роста-3 увеличились во время 120-суточного постельного режима, что указывает на возможность резистентности к IGF-I в костях при сниженной механической нагрузке и напряжении [10].
Хотя модельные исследования не полностью воспроизводят условия, испытываемые астронавтами в условиях КП, существует заметное сходство патофизиологических изменений, отмеченных при длительных ограничениях подвижности (постельном режиме), с проблемами, с которыми сталкиваются астронавты [2].
В условиях «сухой» иммерсии отсутствие механической поддержки определенных зон во время погружения создает состояние, родственное невесомости, которое называется безопорностью, вызывающей физиологические изменения в опорно-двигательной и других системах организма [1]. Гипокинезия и гиподинамия являются основными характеристиками физической бездеятельности, вызванной «сухой» иммерсией (СИ). Гиподинамия подразумевает снижение постуральной мышечной нагрузки, тогда как гипокинезия представляет собой снижение двигательной активности. В дополнение к острому ограничению нормальной мышечной активности и уменьшению нагрузки на мышцы и кости термонейтральная иммерсия быстро вызывает значительное снижение мышечного тонуса и мышечного напряжения [11, 12], чего нельзя достичь даже при длительной модели постельного режима.
С.А. Котов и соавт. установили, что после 7 дней СИ минеральная плотность костной ткани нижней части скелета (проксимальный эпифиз бедренной кости) была снижена на 2%, а плотность верхней части (череп, кисть, реберные кости) была примерно на 2% выше исходных значений. Более того, 3 недели восстановления после сухого погружения достаточны для обращения этих изменений плотности костной ткани [13]. Предполагается, что эти изменения являются вторичным эффектом краниального перераспределения жидкости в верхнюю часть тела, при котором повышенное гидростатическое давление способствует перемещению ионов и белков в кость. Таким образом, СИ, по-видимому, оказывало такое же влияние, как постельный режим, на резорбцию костей в определенных областях тела. Baecker и соавт. показали, что маркеры резорбции костной ткани увеличивались уже на 2-й день в условиях постельного режима [14]. Данные С.А. Котова и соавт. также подтвердили быстрое начало деградации костной ткани в условиях иммобилизации, таких как «сухая» иммерсия или постельный режим.
По данным А.А. Маркина и соавт., биохимические процессы, вовлеченные в формирование костей, не подвержены влиянию СИ в течение 7 дней, о чем свидетельствовало отсутствие изменений в концентрации щелочной фосфатазы в сыворотке [13][15], PINP (сывороточного проколлагенового аминоконцевого пропептида) и BAP (сывороточной костно-специфической щелочной фосфатазы). Маркеры резорбции костной ткани, такие как TRAP (сывороточная тартрат-устойчивая кислая фосфатаза) и CTX (мочевой карбокситерминальный сшитый телопептид коллагена I типа), незначительно увеличились во время СИ в течение 7 дней [16]. Вместе с тем А.А. Маркин и соавт. не обнаружили никаких изменений в активности общей кислой фосфатазы как биомаркера активности остеокластов в течение 7 дней СИ [15].
Очевидно, что изменения костной ткани индуцируются комплексом факторов внешней среды на протеомном уровне, компенсируя снижение гравитации и уменьшение двигательной активности, но в дальнейшем с продолжением воздействия включаются и другие контуры регуляции.
Цель исследования — сравнительная оценка протеомной регуляции состояния костной ткани в условиях 21-суточной антиортостатической гипокинезии (-6°) и 21-суточной «сухой» иммерсии.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании 21-суточной АНОГ приняли участие 8 здоровых добровольцев-мужчин в возрасте 20–44 лет, которые находились в течение 21 сут в антиортостатическом положении, с углом наклона продольной оси тела относительно горизонтального положения -6°, в контролируемых условиях на базе исследовательского центра «MEDES» программы совместных российско-французских исследований лаборатории CaDy WEC (Тулуза, Франция, 2014). Участники эксперимента не подвергались никаким дополнительным воздействиям, направленным на предупреждение развивающихся адаптивных сдвигов в физиологических системах, получали стандартный рацион питания с контролируемым содержанием основных нутриентов и учетом водопотребления. Взятие образцов крови проводили до начала исследований (фон) и на 21-е сут АНОГ.
В эксперименте 21-суточной «сухой» иммерсионной гипокинезии («сухая» иммерсия, СИ) участвовали 10 здоровых добровольцев-мужчин в возрасте 23–34 лет, прошедших врачебно-экспертную комиссию ГНЦ РФ — ИМБП РАН и подписавших добровольное информированное согласие на участие в исследованиях, протокол комиссии по биоэтике ГНЦ РФ — ИМБП РАН № 483 от 03.08.2018. Методология и условия эксперимента полностью соответствовали требованиям Хельсинкской декларации в части обеспечения безопасности участников и допустимых уровней риска. Эксперимент проводился в ГНЦ РФ — ИМБП РАН на стендовой базе «Сухая иммерсия», входящей в состав УНУ «Медико-технический комплекс для отработки инновационных технологий космической биомедицины в интересах обеспечения орбитальных и межпланетных полетов, а также развития практического здравоохранения» по гранту РНФ № 19-15-00435. Протеомные исследования проведены в рамках государственного задания FMFR — 2024-0032. В обоих наземных исследованиях рацион питания и водопотребления по ингредиентному составу и калоражу был сходным.
Объектами исследования служили образцы плазмы крови, собранные в идентичные сроки модельных исследований (за 7 сут до начала экспериментальных воздействий — фон; на 21-е сут проведения СИ и АНОГ). Забор образцов крови осуществляли из периферической локтевой вены в объеме 5 мл в пробирки с ЭДТА натощак. Пробы центрифугировали в вакуумных пробирках объемом 9 мл, содержащих К3 EDTA, при 3000 об/мин. на центрифуге (MPW-350R, Польша) в течение 10 мин при 4 °С. Пробоподготовка всех образцов и последующий хромато-масс-спектрометрический анализ были идентичны для всех биопроб вне зависимости от экспериментального фактора воздействия, что делает сравнение результатов, полученных в обоих экспериментах, корректным.
Для хромато-масс-спектрометрического анализа пробоподготовка проведена с использованием фильтров FASP. Масс-спектрометрический анализ выполняли на приборе MaXis 4G (Bruker Daltonics, Германия), данные проанализированы с помощью пакета программного обеспечения MaxQuant. При построении списка пиков белков для масс-спектрометрического поиска в него включали до 8 главных пиков в 100 Da окне. Идентификацию проводили по прямой и обратной версии базы данных SwissProt, с максимальным допустимым отклонением от массы предшественника 10 ppm. Пептиды идентифицировали минимум по 7 аминокислотам, FDR (false discovery rate, исключение при ложном поиске) 0,01; дополнительно использовали опцию «match between the runs» (алгоритм сравнения образцов).
Для статистического анализа и определения молекулярных функций и биологических процессов, в которых участвовали белки, применяли программный пакет Perseus [17]. Статистические уровни значимости оценивали непараметрическим методом Манна – Уитни для малых выборок. Соответствие основных биологических процессов, согласно генным онтологиям, указанным в базе данных GO, и определенных белков устанавливали с помощью базы знаний системы ANDSystem1, STRING.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сравнительный протеомный анализ статистически значимо различающихся белков в наземных модельных исследованиях представлен в таблице.
Таблица. Сравнительная оценка протеомной регуляции состояния костной ткани в 21-cуточной антиортостатической гипокинезии (-6°) и 21-суточной «сухой» иммерсии
Наименование белков | Гены | 21 сут АНОГ | 21 сут СИ | ||
Уровни белков в % относительно фонового уровня | Уровень достоверности изменений (p-значение) | Уровни белков в % относительно фонового уровня | Уровень достоверности изменений (p-значение) | ||
Аполипопротеин Е (APOE) | APOE | 104,2 | 0,0024 | – | – |
Гаптогобин (Hp) | HP | 105,3 | 0,0047 | 107,8 | 0,000018 |
Комплемент С5 альфа-цепь (Complement C5 alpha chain) | C5 | 115,1 | 0,0014 | – | – |
Антиген CD146 (MUC18) | MCAM | 95,7 | 0,0020 | – | – |
Глутатион пероксидаза внеклеточная (GPx3) | GPX3 | 106,5 | 0,0084 | 113,6 | 0,0000023 |
Ангиотензиноген (AngII) | AGT | 96,1 | 0,0035 | – | – |
Гепариновый кофактор 2 (HCII) | SERPIND1 | 108,1 | 0,0038 | – | – |
Холинэстераза (CHLE) | BCHE | 94,3 | 0,0039 | – | – |
Фосфатидилинозитолгликан — специфическая фосфатаза D (PHLD) | GPLD1 | – | – | 113,2 | 0,000015 |
Сывороточная параоксаназа (PON1) | PON1 | – | – | 115,2 | 0,00005 |
Фибронектин (FINC) | FN1 | – | – | 108,7 | 0,00000013 |
Транстиретин (TTHY) | TTR | – | – | 105,0 | 0,000013 |
Серотрансферрин (TRFE) | TF | – | – | 109,6 | 0,0000018 |
Витронектин (VTNC) | VTN | – | – | 109,9 | 0,0000065 |
Таблица подготовлена авторами по собственным данным
Примечание: «–» — данные не представлены в связи с отсутствием статистической значимости различий.
Анализируя данные, представленные в таблице, отметим, что в ходе исследования выявлены статистически значимые различия (р < 0,05) в уровнях белков по сравнению с фоновыми значениями в условиях 21 сут АНОГ: повышение уровней APOE, Hp, комплемента С5 альфа-цепь, GPx3, HCII и снижение уровней белков антигена CD146, AngII, CHLE. В то же время в условиях воздействия 21 сут СИ отмечено статистически значимое повышение PHLD, PON1, PON1, TTHY, TRFE, VTNC, а также Hp и GPx3 относительно фоновых значений.
Ангиотензиноген (ген AGT) вовлечен в регуляцию ремоделирования костей. Установлено, что ренин- ангиотензин-альдостероновая система (РААС) участвует в регуляции состояния костной ткани. Ангиотензин II активирует остеокласты посредством повышенной экспрессии рецепторного активатора лиганда ядерного фактора-κB (RANKL) на остеобластах, что приводит к снижению минеральной плотности костной ткани. Прием блокаторов рецепторов ангиотензина II связан с более низкой частотой переломов костей в анамнезе [18]. Есть мнение, что использование блокаторов РААС может снизить частоту остеопоротических переломов [19]. Однако результаты других исследований показывают, что блокаторы РААС не снижают частоту остеопоротических переломов и даже их увеличивают [20]. Компоненты РААС экспрессируются в костной ткани, активируя локальные реакции РААС, что приводит к снижению плотности костной ткани [21]. Ангиотензиноген увеличивал секрецию интерлейкина-6 in vitro и снижал активность щелочной фосфатазы только в отосклеротических клетках. Эти наблюдения предполагают связь между локальной активностью ренин-ангиотензиновой системы и отосклерозом, открывая новые терапевтические возможности.
Минералокортикоидные рецепторы также были обнаружены в человеческих остеобластах, остеокластах и костных клетках. Исследования показывают, что локальная РААС кости играет важную роль в различных причинах остеопороза. Блокаторы РААС могут снижать потерю минеральной плотности костной ткани (МПКТ) через каскады к рецептору ангиотензина II первого типа (AT1R), лиганд-рецепторную систему (OPG/RANKL), ангиотензинпревращающий фермент 2 (ACE2/Ang) (1–7)/Mas. Восстанавливая физико-химические свойства кости и снижая риск переломов, блокаторы РААС могут использоваться в качестве эффективной адъювантной терапии при остеопорозе [21].
Кофактор гепарина 2 HCII (ген SERPIND1) является стимулятором остеогенной активности. В работах по влиянию HCII исследованы модели новообразования костной ткани, стимулируемой человеческими опухолями. HCII индуцировал рост новой кости над поверхностью свода черепа, даже находясь на расстоянии от опухолевой массы. Предполагается индуцирование роста кости продукцией факторов роста и воздействие на кость несколькими факторами, работающими совместно [22].
Холинэстераза (ген BCHE) — эстераза с широкой субстратной специфичностью. Известно, что ингибиторы ацетилхолинэстеразы (AChEI) стимулируют ацетилхолиновые рецепторы и используются для лечения болезни Альцгеймера, с защитой от остеопороза и ингибированием дифференциации и функции остеокластов. AChEI в разной степени снижали активатор рецептора ядерного фактора (RANKL)-индуцированную транскрипцию и ядерного фактора активированных Т-клеток 1 (Nfatc1), экспрессию генов — маркеров остеокластов (в основном донепезил и ривастигмин, но не галантамин). Кроме того, AChEI в разной степени ингибировали RANKL-индуцированную сигнализацию MAPK, сопровождавшуюся снижением транскрипции ацетилхолинэстеразы. Наконец, AChEI защищали от OVX-индуцированной потери костной массы в основном путем ингибирования активности остеокластов. В совокупности AChEI (в основном донепезил и ривастигмин) оказали положительное влияние на защиту костей, подавляя функцию остеокластов через сигнальные пути MAPK и Nfatc1 посредством снижения регуляции ацетилхолинэстеразы [23].
Аполипопротеин E (ген APOE) является биомаркером риска переломов и индикатором более низкой МПКТ у пациентов с остеопорозом. Аллели APOE2 и APOE4 были связаны с более низкой МПКТ, а также с более высокими уровнями сывороточного С-концевого коллагенового пептида и мочевых дезоксипиридинолинов, биомаркеров резорбции костей. Кодоминирование аллеля APOE3 также было связано с меньшим количеством случаев переломов костей у этих пациентов в течение 5-летнего наблюдения [24]. Уровень аполипопротеина Е достоверно увеличивается на 7 сут космического полета [25].
В ходе исследования в условиях воздействия АНОГ выделены 33 достоверно изменившихся белка, 9 из которых связаны с биологическими процессами, протекающими в костной ткани (рис. 1), и статистически значимо изменяются по сравнению с фоновыми значениями. Аннотация белков АGT, AGT II приводится вместе, так как они являются локальными регуляторами костной ткани и относятся к одной группе регуляторов ангиотензиновой системы, в связи с чем программой ANDVisio биоинформационно объединяются.
В ходе работы при изучении воздействия 21 сут АНОГ получены статистически значимые взаимосвязи белков со следующими биологическими процессами в костной ткани: процесс оссификации был связан с уровнями 4 белков (MUC18, GPx3, AngII, APOE); дифференциация остеобластов — с уровнем 1 белка (Complement C5 alpha chain); минерализация костей — с уровнем 1 белка (AngII); с развитием костей — 2 белка (AngII, CHLE); резорбция костей связана с 2 белками (AngII, Hp); дифференциация остеокластов — с 2 белками (AngII, Hp); с ростом костей — 1 белок (HCII); регуляция ремоделирования костей — с 1 белком (AngII).
В исследовании в том числе получены данные о белок-белковых взаимодействиях, связанных с регуляцией процессов в костной системе при условии воздействия 21 сут АНОГ; соответствующие данные представлены на рисунке 2.
Так, шесть белков (аполипопротеин Е, гаптогобин, комплемент С5 альфа-цепь, ангиотензин, холинэстераза, глутатион пероксидаза внеклеточная) образуют сеть белок-белковых взаимодействий, то есть могут коэкспрессироваться. Один белок (CD 146 антиген) не связан в эту сеть (рис. 2). Построенная сеть отражает взаимное влияние вышеуказанных белков на общие мишени костной ткани.
В исследованиях S. Bergdolt и соавт. показано, что рецептор белка комплемент C5 (C5aR1) играет важную роль в метаболизме костей и заживлении переломов, будучи высоко экспрессированным на иммунных и костных клетках, включая остеобласты и остеокласты. C5aR1 индуцирует миграцию остеобластов, генерацию цитокинов и остеокластогенез. Сигнализация C5aR1 в остеобластах, возможно, может влиять на баланс RANKL/OPG сигнального пути, регулирующего гомеостаз костной ткани, который включает лиганд рецептор-активируемого ядерного фактора-κB (RANKL) и остеопротегерин (OPG), что приводит к увеличению резорбции кости. Связывание с рецептором C5AR1 вызывает различные реакции, включая высвобождение внутриклеточного кальция, сокращение гладких мышц, повышенную проницаемость сосудов и высвобождение гистамина из тучных клеток и базофильных лейкоцитов [26]. A. Ignatius и соавт. высказали предположение, что комплемент может усиливать воспалительную реакцию остеобластов и увеличивать образование остеокластов, особенно в провоспалительной среде, например во время заживления кости или при воспалительных заболеваниях костей [27].
В исследованиях C. Pimenta-Lopes и соавт. установлено, что генетическая делеция C5ar1, рецептора анафилатоксина C5a, или лечение ингибитором C5AR1 снижали хемотаксис моноцитов и дифференцировку остеокластов, частично предотвращая потерю костной массы и остеокластогенез при химиотерапии или овариоэктомии. Таким образом, ингибирование альтернативных путей комплемента может иметь определенный терапевтический эффект при остеопенических расстройствах [28]. В то же время R. Kunimatsu и соавт. показали, что гликопротеин клеточной поверхности MUC18 (ген MCAM) действует как поверхностный рецептор, который запускает фосфорилирование тирозина FYN и временное увеличение внутриклеточной концентрации кальция. Этот белок стимулирует клеточный пул, способный к формированию костей и трансэндотелиальной миграции in vivo, индуцирующих регенерацию костной ткани [29].
Таким образом, установленные изменения свидетельствовали о вовлечении в биологические процессы метаболизма костной ткани как системных, так и локальных белковых регуляторов состояния костной ткани. Отметим, что локальная РААС кости играет важную роль в развитии остеопороза различной этиологии уже в ранние сроки воздействия комплекса моделируемых факторов космического полета. Блокаторы РААС могут снижать потерю МПКТ через каскады AT1R, OPG/RANKL, ACE2/Ang (1–7)/Mas.
В свою очередь, ингибирование AChEI оказывает положительное влияние на защиту костей, подавляя функцию остеокластов через сигнальные пути MAPK и Nfatc1 посредством снижения регуляции AChE. Изменение уровня аполипопротеина E может отражать активацию протективного биологического процесса остеогенеза в ответ на длительность пребывания в условиях АНОГ.
При анализе протеома плазмы крови на 21-е сут «сухой» иммерсии выделен 31 белок с достоверно изменившимися уровнями, из них 8 белков связаны с регуляцией биологических процессов в костной ткани, таких как ремоделирование кости (сывороточная параоксаназа), дифференцировка остеокластов (гаптогобин и транстиретин), минерализация кости (транстиретин), регенерация кости (транстиретин, фибронектин), дифференцировка остеобластов (фибронектин), резорбция (транстиретин, серотрансферрин), bmp-4 сигнальный путь (фибронектин), биосинтез костей, включая процессы роста и развития кости (фибронектин) (рис. 3).
Эти белки образуют устойчивую сеть белок-белковых взаимодействий (рис. 4). Результаты исследования белок-белковых взаимодействий, связанных с регуляцией процессов в костной системе при условии воздействия 21 сут СИ, представлены на рисунке 4. Семь белков (гаптогобин, глутатион пероксидаза внеклеточная, сывороточная параоксаназа, серотрансферрин, транстиретин, витронектин, фибронектин) образуют сеть белок-белковых взаимодействий, то есть могут коэкспрессироваться, и один белок не связан в эту сеть (фосфатидилинозитолгликан — специфическая фосфатаза) (рис. 4). Построенная сеть отражает взаимное влияние вышеуказанных белков на общие мишени костной ткани.
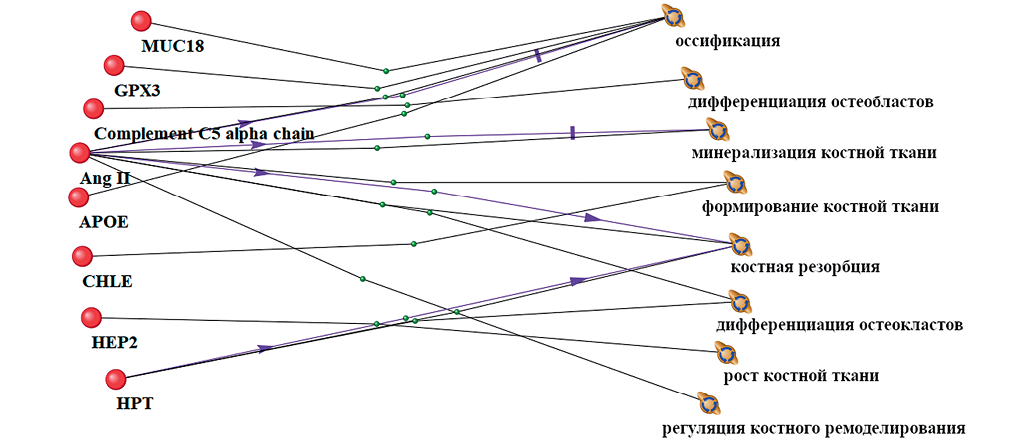
Рисунок подготовлен авторами по собственным данным
Рис. 1. Взаимосвязь достоверно изменяющихся белков и процессов в костной ткани в условиях воздействия 21 сут антиортостатической гипокинезии (АНОГ). Линии разных цветов и метки обозначают связи между явлениями в доказательной литературе: черный цвет линии — совместное упоминание в статьях, ассоциация с биологическим процессом; фиолетовый цвет линии — стимулирование активности биологического процесса; зеленый цвет линии — вовлеченность в биологический процесс
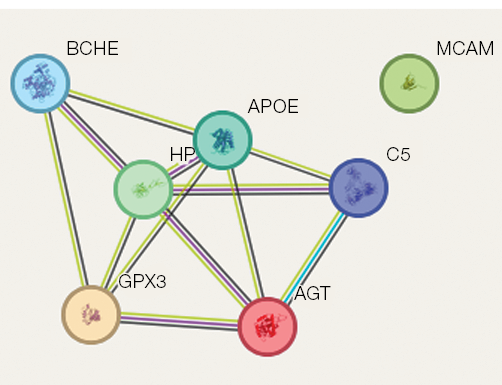
Рисунок подготовлен авторами по собственным данным
Рис. 2. Белок-белковые взаимосвязи, ассоциированные с регуляцией процессов в костной системе в условиях воздействия 21 сут антиортостатической гипокинезии (АНОГ). Линии межбелковых взаимодействий: салатовый — совместное упоминание в статьях; малиновый — взаимодействие белков определено экспериментально; черный — коэкспрессия белков; голубой — взаимодействие указано из проверенных баз данных
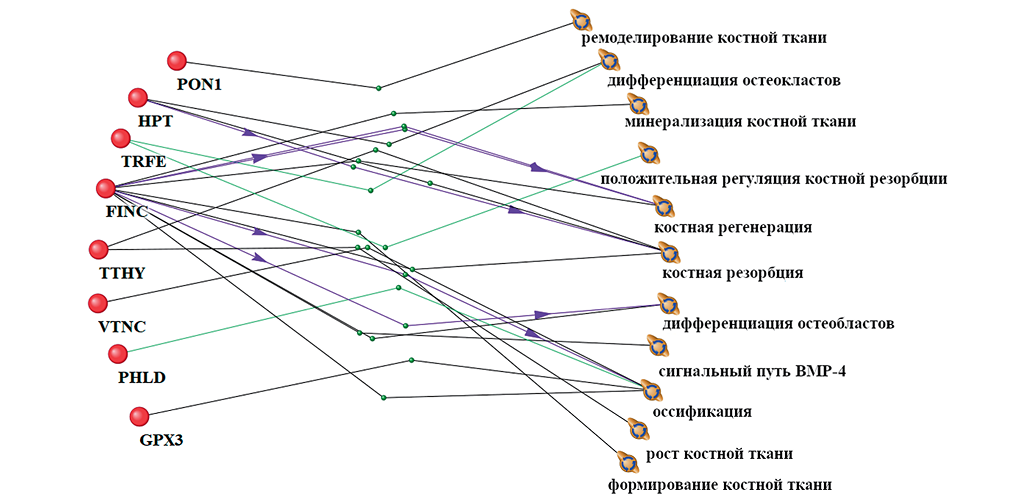
Рисунок подготовлен авторами по собственным данным
Рис. 3. Взаимосвязь достоверно изменяющихся белков и процессов в костной ткани в условиях воздействия 21 сут «сухой» иммерсии (СИ). Линии разных цветов и метки обозначают связи между явлениями в доказательной литературе: черный цвет линии — совместное упоминание в статьях, ассоциация с биологическим процессом; фиолетовый цвет линии — стимулирование активности биологического процесса; зеленый цвет линии — вовлеченность в биологический процесс
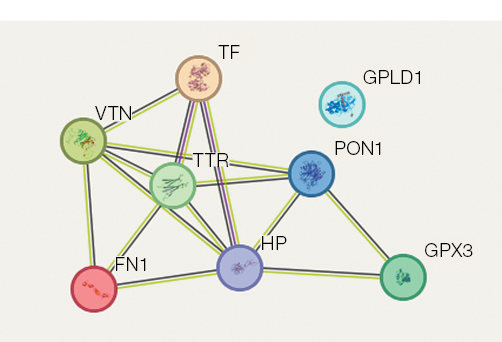
Рисунок подготовлен авторами по собственным данным
Рис. 4. Белок-белковые взаимосвязи, ассоциированные с регуляцией процессов в костной системе в условиях воздействия в 21 сут «сухой» иммерсии (СИ). Цвета белков сгенерированы программой произвольно; линии межбелковых взаимодействий: салатовый — совместное упоминание в статьях; малиновый — взаимодействие белков определено экспериментально; черный — коэкспрессия белков
Фибронектин (ген FN1) участвует в уплотнении остеобластов через процесс сборки матрикса посредством фибриллогенеза фибронектина, регулирует отложение коллагена I типа остеобластами и действует как лиганд для мембранного белка семейства иммуноглобулиноподобных рецепторов (LILRB4), ингибируя активацию моноцитов. Фибриллогенез фибронектина участвует в процессе минерализации костей. Установлена специфическая регуляция FN1 во время различных фаз дифференциации остеобластов.
В работах W. Xiong и соавт. фибронектин-1, тромбоспондин-1 и бигликан были идентифицированы как ключевые гены минерализации костной ткани, а их повышенная регуляция была связана с потенциальными нарушениями в процессе ремоделирования кости. Фибронектин-1 (FN1), тромбоспондин-1 (THBS1) и бигликан (BGN) были определены как наиболее значимые гены при лечении несрастающихся переломов, подчеркивая ключевую роль FN1, THBS1 и BGN в динамике минерализации внеклеточного матрикса и регенерации кости [30]. Повышенная экспрессия FN1 способствует заживлению переломов путем активации сигнального пути TGF-β/PI3K/Akt TGF-β (трансформирующий ростовой фактор бета) и PI3K/Akt (фосфоинозитид-3-киназа/Akt) [31].
Серотрансферрин (ген TF). Сывороточный трансферрин участвует в регуляции биологических процессов резорбции кости и дифференциации остеокластов. Высокий уровень растворимого рецептора трансферрина (sTfR) соотносится с более низким числом трабекул, толщиной кортикального слоя и диаметром пор кортикального слоя. Связь плотности и прочности большеберцовой кости и низкие циркулирующие концентрации маркеров резорбции и формирования кости с уровнем серотрансферрина, вероятно, являются результатом прямой роли ионов железа в синтезе коллагена [32, 33]. Показано, что уровень серотрансферрина в экстрактах сухих пятен крови космонавтов достоверно изменился через 3 и 6 мес. КП [25]. Из этого следует, что модельные наземные исследования воспроизводят некоторые протеомные биологические процессы регуляции костной ткани, отмеченные в разные сроки космического полета [11].
Витронектин (ген VTN) присутствует во всем минерализованном костном матриксе губчатых и кортикальных костей, что предполагает его участие в ремоделировании костей посредством формирования, резорбции костей и биологическом процессе остеогенеза. Известно, что витронектин взаимодействует с гликозаминогликанами и протеогликанами и является ингибитором повреждающего мембрану эффекта терминального цитолитического пути комплемента. Установлено, что дефицит витронектина приводит к увеличению количества остеокластов и уменьшению общего объема бедренной кости на модели остеопороза у оварэктомированных мышей [34]. В ранее проведенных нами исследованиях отмечено, что уровень витронектина достоверно снижался через 6 мес. КП [25], в связи с чем важность роли витронектина в регуляции остеогенеза и ремоделировании костей под влиянием СИ и КП в формировании общего объема костной ткани не вызывает сомнений.
Сывороточная параоксоназа/арилэстераза 1 (ген PON1). Отмечено, что параоксоназа играет важную роль в поддержании буферных коллоидных свойств межпозвоночных дисков. Установлено, что низкая экспрессия PON1 является предиктором дегенерации пульпозного ядра межпозвонковых дисков. Воспаление и окислительный стресс могут ухудшить среду обитания клеток пульпозного ядра, что приводит к дегенерации межпозвонковых дисков. Параоксоназа — это фермент, который обладает противовоспалительным и антиоксидантным действием. M. Aydın и соавт. исследовали экспрессию PON1 в 88 образцах межпозвоночных дисков человека и моделях крыс и содержание фактора некроза опухолей (TNF-α), интерлейкина (IL-1β), митосупероксида (SOX), аггрекана и коллагена II в клетках пульпозного ядра. Экспрессия PON1 была значительно подавлена в дегенеративных межпозвоночных дисках человека и крысы. Уровень PON1 был значительно снижен в моделях дегенеративных клеток, вызванных TNF-α и окислительным стрессом (H2O2). Уровень TNF-α и интерлейкина-1β (IL-1β) явно увеличился; а экспрессия аггрекана и коллагена снизилась в клетках, трансфицированных siРНК PON1. Также показано, что уровни PON1 в группе пациентов с остеопоротическими переломами бедра, в частности межвертельными переломами бедренной кости и переломами шейки бедренной кости, были значительно выше, чем в контрольной группе [35].
Таким образом, низкая экспрессия PON1 является предиктором тяжелой дисфункции межпозвоночных дисков. PON1 играет важную роль в поддержании гомеостатического баланса пульпозного ядра межпозвоночных дисков. Терапевтический подход с мишенью PON1 может быть полезен для облегчения дисфункции пульпозного ядра межпозвоночных дисков в будущем.
Фосфолипаза D, специфичная к фосфатидилинозитолгликану (ген GPLD1). Основной функциональной способностью фосфатидилинозитол-гликан-специфической фосфолипазы D является гидролиз инозитолфосфатной связи в белках, закрепленных фосфатидилинозитолгликанами, что приводит к высвобождению этих белков из мембраны. Кроме того, были подтверждены ассоциации между локусом фосфатидилинозитолгликан-специфической фосфолипазы и уровнями щелочной фосфатазы, в силу чего предполагается специфичность этого белка для костной ткани [36].
Транстиретин (ген TTR), TTHY — переносчик, участвующий в регуляции биологических процессов резорбции костей и их роста. Показано, что уровни транстиретина постепенно снижались по мере уменьшения минеральной плотности костной ткани у пациентов с остеопорозом [37]. Сходные данные по изменению уровня этого белка были выявлены в сухих пятнах крови космонавтов через 6 мес. КП [25].
В ходе работы установлено два общих белка применительно к их участию в регуляции биологических процессов в костной ткани, отмеченных как на 21-е сут АНОГ, так и на 21-е сут СИ: гаптоглобин (Hp) и глутатионпероксидаза (GPx3) (рис. 5).
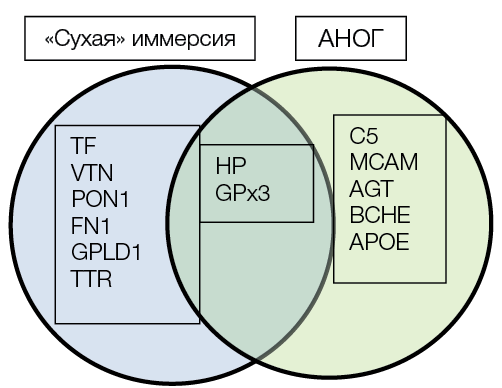
Рисунок подготовлен авторами по собственным данным
Рис. 5. Общие белки, достоверно различающиеся белки, участвующие в процессах регуляции костной ткани при условии воздействия 21 сут антиортостатической гипокинезии (АНОГ) и 21 сут «сухой» иммерсии (СИ)
Рассматривая участие данных белков в регуляции биологических процессов костной ткани, считаем важным отметить следующее: изменение концентрации гаптоглобина (ген Hp) выявлено на 21-е сут при воздействии как СИ, так и АНОГ. Гаптоглобин участвует в регуляции дифференциации остеокластов и резорбции кости. Вероятно, участником изменения транскрипции гаптоглобина при дифференциации остеокластов является белок Zscan10. Исследования Y. Yanagihara и соавт., проведенные in vitro относительно эффектов человеческого гаптоглобина на резорбцию костей и образование простаноидов, показали, что транскрипция гаптоглобина отрицательно регулирует дифференцировку остеокластов и изменяет процесс резорбции костной ткани [38]. Важно отметить, что при изучении протеома сухих пятен крови космонавтов через 3 мес. КП также выявлено достоверное изменение уровня гаптоглобина [25].
В ходе работы у испытуемых выявлено изменение концентрации глутатион пероксидазы 3 (ген GPX3) на 21-е сут при влиянии как СИ, так и АНОГ. Этот белок защищает структурные элементы клеток костной ткани от окислительного повреждения, катализируя восстановление перекиси водорода, липидных перекисей и органических гидроперекисей глутатионом, сдвигая баланс между активностью остеобластов и остеокластов. По мнению U. Föger-Samwald и соавт., повышенная экспрессия SOD2 и GPX3 предполагает повышенную антиоксидантную активность в образцах костей лиц с остеопорозом и переломами бедра [39]. Предполагается, что продукция активных форм кислорода остеокластами подавляет защитные механизмы естественных антиоксидантов. Сопутствующий окислительный стресс может привести к потере костной массы и, следовательно, к развитию остеопороза [40].
Отметим, что при сопоставлении результатов исследования протеома в наземных экспериментах (одинаковые материалы, плазма крови и сроки взятия биоматериала) и продолжительных космических полетах (экстракты высушенных пятен крови, другие сроки взятия биоматериала) имеются общие белки, выявленные в разные сроки (на 7-е сут, 3-й и 6-й месяцы) длительных КП [18], и в образцах плазмы крови, исследованных на 21 сут АНОГ и СИ, среди них: гаптоглобин, аполипопротеин Е, транстиретин, серотрансферрин, витронектин. Их участие в биологических процессах костной ткани описано выше.
ЗАКЛЮЧЕНИЕ
В результате исследования проведена сравнительная оценка протеомной регуляции состояния костной ткани в условиях 21-суточной антиортостатической гипокинезии (-6°) и 21-суточной «сухой» иммерсии. Протеомные исследования механизмов регуляции костной ткани в модельных наземных исследованиях позволили выявить: 9 белков с достоверно изменяющимся уровнем в условиях воздействия АНОГ и 8 белков, уровни которых статистически значимо менялись в условиях СИ, связаны с регуляцией биологических процессов, протекающих в костной ткани (остеогенез, дифференцировка остеобластов, дифференцировка остеокластов, резорбция, минерализация кости, развитие кости, регуляция ремоделирования кости).
Ряд белков (как в исследованиях с АНОГ, так и в условиях СИ) связаны в сети белок-белковых взаимодействий, то есть могут коэкспрессироваться. Различные сети белков-участников связаны с различиями биологического действия антиортостатической гипокинезии и сухой иммерсии одинаковой продолжительности. Выделены два общих белка (гаптоглобин (Hp) и глутатионпероксидаза 3 (GPx3), участвующих в регуляции биологических процессов костной ткани на 21-е сут СИ, 21-е сут АНОГ. Транскрипция Hp отрицательно регулирует дифференцировку остеокластов и изменяет процесс резорбции костной ткани. GPx3 защищает структурные элементы клеток костной ткани от окислительного повреждения, сдвигая баланс между активностью остеобластов и остеокластов.
Метаболизм костной системы — сложный процесс с большим количеством вовлеченных механизмов. Рассматриваемый в данной работе протеомный уровень регуляции позволяет углубить знания о механизмах изменения костной ткани в определенные (21-е сут) сроки антиортостатической гипокинезии и сухой иммерсии. Эти сроки не так велики, чтобы у здоровых испытателей развилась остеопения, однако протеомная регуляция биологических процессов состояния костной ткани достоверно изменяется за это время. Вышеуказанное свидетельствует о вовлечении в биологические процессы метаболизма костной ткани как системных, так и локальных белковых регуляторов состояния костной ткани. Впервые выявлено, что локальная РААС кости играет важную роль в регуляции биологических процессов костной ткани к 21-м сут модельных исследований. Блокаторы РААС могут снижать потерю МПКТ через каскады AT1R, OPG/RANKL, ACE2/Ang (1–7)/Mas. Ингибирование AChEI оказывает положительное влияние на защиту костей, подавляя функцию остеокластов через сигнальные пути MAPK и Nfatc1 посредством снижения регуляции AChE. Изменение уровня аполипопротеина E может отражать активацию протективного биологического процесса остеогенеза в ответ на длительность пребывания в условиях АНОГ.
Обратим внимание на достоверное изменение белков-переносчиков, участвующих в регуляции биологических процессов как резорбции костей, так и их роста.
Отметим производство активных форм кислорода остеокластами и роль окислительного стресса в потере костной массы. Важное значение имеет изменение протеомной регуляции минерализации костного матрикса губчатых и кортикальных костей. Состояние матрикса обусловливает ремоделирование кости посредством формирования структуры, резорбции и остеогенеза.
Полученные данные впервые обращают внимание на первичные протеомные механизмы регуляции биологических процессов костной ткани у здоровых лиц под влиянием 21-суточной АНОГ и 21-суточной сухой иммерсии. Эти результаты имеют большое значение для авиакосмической и клинической медицины.
1 База знаний системы ANDSystem. https://www-bionet.sysbio.cytogen.ru/and/cell/#!/app/about
Список литературы
1. Navasiolava NM, Custaud MA, Tomilovskaya ES, Larina IM, Mano T, Gauquelin-Koch G, et al. Long-term dry immersion: review and prospects. European Journal of Applied Physiology. 2011;111(7):1235–60. https://doi.org/10.1007/s00421-010-1750-x
2. Hajj-Boutros G, Sonjak V, Faust A, Balram S, Lagace JC, St-Martin P, et al. Myths and Methodologies: Understanding the health impact of head down bedrest for the benefit of older adults and astronauts. Study protocol of the Canadian Bedrest Study. Experimental Physiology. 2024;109(5):812–87. https://doi.org/10.1113/EP091473
3. Hargens AR, Vico L. Long-duration bed rest as an analog to microgravity. Journal of Applied Physiology. 2016;120(8):891–903. https://doi.org/10.1152/japplphysiol.00935.2015
4. Oganov VS, Rakhmanov AS, Novikov VE, Zatsepin ST, Rodionova SS, Cann Ch. The state of human bone tissue during space flight. Acta Astronautica. 1991;23:129–33. https://doi.org/10.1016/0094-5765(91)90109-i
5. Baran R, Wehland M, Schulz H, Heer M, Infanger M, Grimm D. Microgravity-related changes in bone density and treatment options: a systematic review. Internation Journal of Molecular Sciences. 2022;23(15):8650. https://doi.org/10.3390/ijms23158650
6. Man J, Graham T, Squires-Donelly G, Laslett AL. The effects of microgravity on bone structure and function. NPJ Microgravity. 2022;8(1):9. https://doi.org/10.1038/s41526-022-00194-8
7. Ларина ИМ, Моруков БВ, Григорьев АИ. Циркадианные ритмы минералотропных гормонов человека во время продолжительной антиортостатической гипокинезии. Физиология человека. 1999;25(6):89–95.
8. Григорьев АИ, Моруков ВВ. 370-суточная антиортостатическая гипокинезия (задачи и общая структура исследования). Космическая Биология и Авиакосмическая Медицина. 1989;23(5):47–50.
9. Austermann K, Baecker N, Zwart SR, Fimmers R, Stehle P, Smith SM, et al. Effects of antioxidant supplementation on bone mineral density, bone mineral content and bone structure in healthy men during 60 days of 6° head-down tilt bed rest: Results from a randomised controlled trial. Nutrition Bulletin. 2023;48(2):256–66. https://doi.org/10.1111/nbu.12619
10. Inoue M, Tanaka H, Moriwake T, Oka M, Sekiguchi C, Seino Y. Altered biochemical markers of bone turnover in humans during 120 days of bed rest. Bone. 2000;26(3):281–6. https://doi.org/10.1016/s8756-3282(99)00282-3
11. Tomilovskaya E, Shigueva T, Sayenko D, Rukavishnikov I, Kozlovskaya I. Dry immersion as a ground-based model of microgravity physiological effects. Frontiers in Physiology. 2019;10:284. https://doi.org/10.3389/fphys.2019.00284
12. Saveko A, Bekreneva M, Ponomarev I, Zelenskaya I, Riabova A, Shigueva T, et al. Impact of different groundbased microgravity models on human sensorimotor system. Frontiers in Physiology. 2023;14:1085545. https://doi.org/10.3389/fphys.2023.1085545
13. Kotov SA, Oganov VS, Skripnikova IA. Imitation of the early effects of weightlessness in human bone tissue in conditions of head down bed rest and dry immersion. Proceedings of the conference of young scientists. Moscow; 2003 (In Russ.).
14. Baecker N, Tomic A, Mika C, Gotzmann A, Platen P, Gerzer R, et al. Bone resorption is induced on the second day of bed rest: results of a controlled crossover trial. Journal of Applied Physiology. 2003;95(3):977–82. https://doi.org/10.1152/japplphysiol.00264.2003
15. Маркин АА, Моруков БВ, Журавлева ОА, Заболотская ИВ, Вострикова ЛВ, Ляпунова НА и др. Динамика биохимических показателей крови в эксперименте с 7-дневной иммерсией. Авиакосмическая и Экологическая Медицина. 2008;42:56–9. EDN: RBLSWZ
16. Linossier MT, Amirova LE, Thomas M, Normand M, Bareille MP, Gauquelin-Koch G, et al. Effects of short-term dry immersion on bone remodeling markers, insulin and adipokines. PLoS One. 2017;12(8):e0182970. https://doi.org/10.1371/journal.pone.0182970
17. Brzhozovskiy AG, Kononikhin AS, Pastushkova LC, Kashirina DN, Indeykina MI, Popov IA, et al. The effects of spaceflight factors on the human plasma proteome, including both real space missions and ground-based experiments. International Journal of Molecular Sciences. 2019;20(13):3194. https://doi.org/10.3390/ijms20133194
18. Shukuri T, Nakai K, Tanaka S, Yamada S, Tokumoto M, Tsuruya K, et al. Angiotensin II receptor blockers and bone fracture in chronic kidney disease patients: the Fukuoka kidney disease Registry Study. Clinical and Experimental Nephrology. 2023;27(11):919–27. https://doi.org/10.1007/s10157-023-02385-3
19. Zhang Y, Wang L, Song Y, Zhao X, Wong MS, Zhang W. Renin inhibitor aliskiren exerts beneficial effect on trabecular bone by regulating skeletal renin-angiotensin system and kallikrein-kinin system in ovariectomized mice. Osteoporosis International. 2016;27:1083–92. https://doi.org/10.1007/s00198-015-3348-y
20. Zhang Y, Li XL, Sha NN, Shu B, Zhao YJ, Wang XL, et al. Differential response of bone and kidney to ACEI in db/db mice: A potential effect of captopril on accelerating bone loss. Bone. 2017;97:222–32. https://doi.org/10.1016/j.bone.2017.01.029
21. Mo C, Ke J, Zhao D, Zhang B. Role of the renin-angiotensinaldosterone system in bone metabolism. Journal of Bone and Mineral Metabolism. 2020;38(6):772–9. https://doi.org/10.1007/s00774-020-01132-y
22. Izbicka E, Dunstan CR, Horn D, Harris S, Adams R, Mundy GR. Effects of human tumor cell lines on local new bone formation in vivo. Calcified Tissue International. 1997;60(2):210–5. https://doi.org/10.1007/s002239900216
23. Li S, Teguh D, Wu D, Hu C, Inderjeeth CA, Xu J. Antidementia medication acetylcholinesterase inhibitors have therapeutic benefits on osteoporotic bone by attenuating osteoclastogenesis and bone resorption. Journal of Cellular Physiology. 2023;238(8):1823–35. https://doi.org/10.1002/jcp.31057
24. Souza LS, Rochette NF, Pedrosa DF, Lopes Magnago RF, Freire Filho TB, Vieira FLH, et al. Role of APOE gene in bone mineral density and incidence of bone fractures in brazilian postmenopausal women. Journal of Clinical Densitometry. 2018;21(2):227–35. https://doi.org/10.1016/j.jocd.2017.03.005
25. Пастушкова ЛХ, Гончарова АГ, Каширина ДН, Поляков АВ, Ларина ИМ. Определение протеомных маркеров, включенных в молекулярные сети нарушений в костной системе во время продолжительных космических полетов. Технологии Живых Систем. 2025;22(1):5–21.
26. Bergdolt S, Kovtun A, Hägele Y, Liedert A, Schinke T, Amling M, et al. Osteoblast-specific overexpression of complement receptor C5aR1 impairs fracture healing. PLoS One. 2017;12(6):e0179512. https://doi.org/10.1371/journal.pone.0179512
27. Ignatius A, Schoengraf P, Kreja L, Liedert A, Recknagel S, Kandert S, et al. Complement C3a and C5a modulate osteoclast formation and inflammatory response of osteoblasts in synergism with IL-1β. Journal of Cellular Biochemistry. 2011;112(9):2594–605. https://doi.org/10.1002/jcb.23186
28. Pimenta-Lopes C, Sánchez-de-Diego C, Deber A, EgeaCortes A, Valer JA, Alcala A, et al. Inhibition of C5AR1 impairs osteoclast mobilization and prevents bone loss. Molecular Therapy. 2023;31(8):2507–23. https://doi.org/10.1016/j.ymthe.2023.04.022
29. Kunimatsu R, Rikitake K, Yoshimi Y, Putrani NAR, Hayashi Y, Tanimoto K. Bone differentiation ability of CD146-positive stem cells from human exfoliated deciduous teeth. International Journal of Molecular Sciences. 2023;24(4):4048. https://doi.org/10.3390/ijms24044048
30. Xiong W, Shu XL, Huang L, He SQ, Liu LH, Li S, et al. Bioinformatics analysis and experimental validation of differential genes and pathways in bone nonunions. Biochemical Genetics. 2024;62(6):4494–517. https://doi.org/10.1007/s10528-023-10633-0
31. Zhang H, Chen X, Xue P, Ma X, Li J, Zhang J. FN1 promotes chondrocyte differentiation and collagen production via TGF-β/PI3K/Akt pathway in mice with femoral fracture. Gene. 2021;769:145253. https://doi.org/10.1016/j.gene.2020.145253
32. Dakkumadugula A, Pankaj L, Alqahtani AS, Ullah R, Ercisli S, Murugan R. Space nutrition and the biochemical changes caused in Astronauts Health due to space flight: A review. Food Chemistry: X. 2023;20:100875. https://doi.org/10.1016/j.fochx.2023.100875
33. O’Leary TJ, Jackson S, Izard RM, Walsh NP, Carswell AT, Oliver SJ, et al. Iron status is associated with tibial structure and vitamin D metabolites in healthy young men. Bone. 2024;186:117145. https://doi.org/10.1016/j.bone.2024.117145
34. Nakashima M, Suzuki A, Hashimoto K, Yamashita M, Fujiwara Y, Miyamoto Y. Vitronectin regulates osteoclastogenesis and bone remodeling in a mouse model of osteoporosis. Anatomy and Cell Biology. 2024;57(2):305–15. https://doi.org/10.5115/acb.23.251
35. Aydın M, Avcı E. The role of oxidative stress and antioxidants in older individuals with osteoporotic hip fractures. Turkish Journal of Trauma and Emergency Surgery. 2025;31(1):9–14. https://doi.org/10.14744/tjtes.2024.89335
36. Cao J, Zhou A, Zhou Z, Liu H, Jia S. The role of GPLD1 in chronic diseases. Journal of Cellular Physiology. 2023;238(7):1407–15. https://doi.org/10.1002/jcp.31041
37. Li XS, Zhang JR, Zhao YL, Li Y, Sun Y, Liu T, et al. Reduced prealbumin is associated with bone mineral density in women with osteoporosis. Nutrition. 2017;33:338–42. https://doi.org/10.1016/j.nut.2016.08.002
38. Yanagihara Y, Inoue K, Saeki N, Sawada Y, Yoshida S, Lee J, et al. Zscan10 suppresses osteoclast differentiation by regulating expression of Haptoglobin. Bone. 2019;22:93–100. https://doi.org/10.1016/j.bone.2019.02.011
39. Föger-Samwald U, Vekszler G, Hörz-Schuch E, Salem S, Wipperich M, Ritschl P, et al. Molecular mechanisms of osteoporotic hip fractures in elderly women. Experimental Gerontology. 2016;73:49–58. https://doi.org/10.1016/j.exger.2015.11.012
40. Zhang W, Dong R, Diao S, Du J, Fan Z, Wang F. Differential long noncoding RNA/mRNA expression profiling and functional network analysis during osteogenic differentiation of human bone marrow mesenchymal stem cells. Stem Cell Research and Therapy. 2017;8(1):30. https://doi.org/10.1186/s13287-017-0485-6
Об авторах
Л. Х. ПастушковаРоссия
Пастушкова Людмила Ханифовна - д-р биол. наук
Москва
А. Г. Гончарова
Россия
Гончарова Анна Георгиевна - д-р мед. наук
Москва
Д. Н. Каширина
Россия
Каширина Дарья Николаевна - канд. биол. наук
Москва
И. М. Ларина
Россия
Ларина Ирина Михайловна - д-р мед. наук
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Пастушкова Л.Х., Гончарова А.Г., Каширина Д.Н., Ларина И.М. Сравнительная оценка протеомной регуляции состояния костной ткани в 21-суточной антиортостатической гипокинезии (-6°) и 21-суточной «сухой» иммерсии. Медицина экстремальных ситуаций. 2025;27(4):558-568. https://doi.org/10.47183/mes.2025-296
For citation:
Pastushkova L.Kh., Goncharova A.G., Kashirina D.N., Larina I.M. Comparative assessment of proteomic regulation of bone tissue during 21-day head-down bed rest (–6°) and 21-day dry immersion. Extreme Medicine. 2025;27(4):558-568. https://doi.org/10.47183/mes.2025-296

















