Перейти к:
Оценка острой токсичности и фармакокинетики производного природного феосферида А на лабораторных грызунах
https://doi.org/10.47183/mes.2025-303
Аннотация
Введение. Определение метаболизма и фармакокинетики является важным условием при разработке любого лекарственного препарата, в том числе противоракового феосферида А (PPA), который относится к группе природных соединений, обладающих противоопухолевыми свойствами, и был впервые выделен из эндофитного гриба FA39 гарвардскими учеными (Клауди и его коллегами) в 2006 году. Объектом исследования выбрано соединение AV6 — производное природного феосферида А.
Цель. Изучение острой токсичности и особенностей фармакокинетики полусинтетической субстанции AV6 на платформе природного фитотоксина феосферида А, обладающего противоопухолевыми свойствами, при однократном внутрижелудочном введении соединения AV6 на лабораторных грызунах.
Материалы и методы. Исследование острой токсичности AV6 выполнено на самцах мышей Balb/c (30 самцов были разделены на 5 групп по 6 животных в каждой группе). Контрольной группе однократно внутрижелудочно вводили растворитель (масляно-спиртовую эмульсию в объеме 300 мкл), четыре группы (экспериментальные животные) получали AV6 в дозах 5, 50, 300 и 2000 мг/кг м.т. Оценивали динамику массы тела животных, рассчитывали массовые коэффициенты органов. Исследования фармакокинетики выполнены при однократном внутрижелудочном введении AV6 в дозе 25 мг/кг м.т. аутбредным крысам-самцам Wistar. Доза AV6 для фармакокинетического исследования рассчитана на основании данных об острой токсичности с учетом коэффициента межвидового переноса. Для количественного определения AV6 в плазме крови и моче использован МС/МС метод. Статистический анализ проведен с использованием ПО GraphPad Prism 5.
Результаты. На основании данных об острой токсичности при внутрижелудочном введении производное феосферида А — AV6 можно отнести к 3-му классу опасности (гибель животных наблюдали исключительно в группе 2000 мг/кг м.т.). При визуальной оценке внутренних органов явных макроскопических признаков патологии выявлено не было. Также не было обнаружено статистически значимых изменений массовых коэффициентов внутренних органов экспериментальных животных по сравнению с контролем. Разработана процедура количественного определения AV6 на основе ВЭЖХ-МС/МС анализа. Определены метаболиты, образующиеся в организме крыс in vivo. При сравнении хроматограмм плазмы крови крысы через 1 час после внутрижелудочного введения AV6 и спустя 10 часов после введения установлено, что через час после введения пик AV6 по интенсивности в 20 раз превосходил пик М2. Однако через 10 часов интенсивность пика AV6 уменьшилась, в то время как интенсивность пика метаболита М2 увеличилась.
Выводы. Соединение AV6 относится к умеренно опасным веществам. Данные о структуре метаболитов AV6, производного природного феосферида А, полученные в ходе фармакокинетического исследования на крысах, свидетельствуют о невысокой скорости метаболизма вещества, что обусловлено преимущественно химическими превращениями у атома азота лактамного цикла, в результате чего образуются метаболиты, которые могут выделяться в составе мочи. Наиболее вероятными механизмами таких превращений являются окислительное деацилирование и следующий за ним гидролиз. Выполненное доклиническое исследование по оценке острой токсичности AV6, его метаболизма и фармакокинетики является одним из этапов для переноса полученных ранее авторами данных о противоопухолевом потенциале этого производного природного феосферида А и дальнейшей реализации исследований in vivo.
Ключевые слова
Для цитирования:
Абзианидзе В.В., Скворцов Н.В., Каракашев Г.В., Бельтюков П.П., Супонина Д.С., Мусатова В.О., Богаченков А.С., Криворотов Д.В. Оценка острой токсичности и фармакокинетики производного природного феосферида А на лабораторных грызунах. Медицина экстремальных ситуаций. 2025;27(4):441-452. https://doi.org/10.47183/mes.2025-303
For citation:
Abzianidze V.V., Skvortsov N.V., Karakashev G.V., Beltyukov P.P., Suponina D.S., Musatova V.O., Bogachenkov A.S., Krivorotov D.V. Evaluation of acute toxicity and pharmacokinetics of a natural phaeosphaeride A derivative in laboratory rodents. Extreme Medicine. 2025;27(4):441-452. https://doi.org/10.47183/mes.2025-303
ВВЕДЕНИЕ
Онкологические заболевания, наряду с заболеваниями сердечно-сосудистой системы, продолжают прочно удерживать лидирующие позиции среди причин смертности. По прогнозу ВОЗ в ближайшие 20 лет заболеваемость раком возрастет на 70%, становясь причиной почти каждой шестой смерти в мире [1].
На протяжении последних 50 лет главным способом лечения рака остается химиотерапия, несмотря на серьезные побочные эффекты. К ним следует отнести множественную лекарственную устойчивость, гепатотоксичность, которая до недавнего времени была практически неотделима от химиотерапии, и ряд других факторов1 [2]. Причины, обусловливающие многочисленные побочные реакции, лежат в сфере научных интересов молекулярной биологии, цитологии, генетики и других.
Перспективность разработки любого противоопухолевого препарата зависит от понимания его молекулярных механизмов действия, особенностей специфического воздействия на опухоль и ее микроокружение, фармакокинетических особенностей, токсичности и безопасности лекарственного препарата и др. Одной из проблем при разработке противоопухолевых препаратов является необходимость достижения in vivo концентрации для полноценного терапевтического эффекта2. Необходимой информацией при разработке являются также данные о системном воздействии потенциального противоопухолевого препарата у животных, используемых при токсикологической оценке прототипа лекарственного средства, для экстраполяции дозировки для человека3.
Доклиническими исследованиями при разработке лекарственных препаратов показано изучение особенностей фармакокинетики на животных, позволяющей дать оценку выяснения наиболее благоприятного профиля эффективности и безопасности вещества. В прошлом такие исследования проводили главным образом с использованием радиоактивно меченых соединений. В последние два десятилетия широко распространены аналитические подходы, основанные на применении тандемной масс-спектрометрии (МС/МС), которые хорошо зарекомендовали себя как при мониторинге лекарственных средств в клинических лабораториях, так и в доклинических исследованиях при разработке новых лекарственных средств [3].
Ранее нами было показано, что производное природного феосферида А [4] — вещество AV6, (2S,3R,4R)-3-гидрокси-6-метокси-3-метил-7-метилен-2-пентил-4-пирролидин-1-yl-3,4,6,7-тетрагидропирано[ 2,3-c]пиррол-5(2H)-он [5–10] демонстрировало in vitro цитотоксические эффекты в отношении клеток ряда опухолевых линий, а также проявляло ингибирующее действие в отношении главного транспортера ксенобиотиков — белка множественной лекарственной устойчивости MDR1 (P-gp). Наличие собственной противоопухолевой активности и способность снижать скорость элиминации субстратов транспортера MDR1 позволило рассматривать AV6 как перспективное соединение, на основе которого может быть создано противоопухолевое лекарственное средство.
Цель работы — изучение острой токсичности и особенностей фармакокинетики полусинтетической субстанции AV6 на платформе природного фитотоксина феосферида А, обладающей противоопухолевыми свойствами, при однократном внутрижелудочном введении соединения AV6 на лабораторных грызунах.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена в соответствии с требованиями Федерального закона от 12.04.2010 № 61-ФЗ4, национальным стандартом ГОСТ Р 53434-20095, принципами надлежащей лабораторной практики (GLP)6, руководством по проведению доклинических исследований7. Требования по содержанию и уходу за животными, используемыми в научных целях, соответствуют Директиве 2010/63/EU8.
Острую токсичность AV6 изучали на самцах мышей линии Balb/c возрастом 8–10 недель, массой 17,5–19,5 г из питомника лабораторных животных «Рапполово» (Филиал НИЦ «Курчатовский институт» — ПИЯФ — ПЛЖ «Рапполово»).
Исследование острой токсичности AV6 на мышах было выполнено с целью установления уровня доз, не вызывающих острой интоксикации или гибели животных при однократном внутрижелудочном введении масляно-спиртовой эмульсии вещества. Выбор такой формы для введения AV6 связан с необходимостью получения гомогенной смеси и необходимостью повышения биодоступности гидрофобного соединения AV6, поскольку при разбавлении исходных растворов AV6 в других растворителях с последующим разбавлением водой происходило мгновенное выпадение осадка.
Эксперименты по оценке острой токсичности при внутрижелудочном пути введения c определением класса опасности исследуемого вещества выполнены в соответствии с ГОСТ 32644-20149, идентичным международному документу OECD Test Guideline No 423:2001(Acute Oral Toxicity — Acute Toxic Class Method, IDT).
Эмульсию AV6 для внутрижелудочного введения готовили путем растворения навески вещества в минимальном объеме этанола (10–72 мкл, в зависимости от требуемого количества AV6) и последующего добавления масляно-спиртовой смеси таким образом, чтобы объем введения всегда составлял 300 мкл. Конечная концентрация AV6 в эмульсии зависела от массы животного и от дозы, используемой в эксперименте, концентрация этанола в препарате составляла ~23%. Добавление масла к спиртовому раствору AV6 позволило получить гомогенную смесь и таким способом обеспечить однотипные условия дозирования для целей исследования. Корм отнимали за 2 ч до введения препарата и вновь предоставляли доступ к корму по истечении 2 ч после введения. Внутрижелудочное введение выполняли с использованием желудочного зонда для мышей и шприца.
Все подопытные животные (30 самцов) были разделены на 5 групп по 6 животных в каждой группе. Контрольной группе внутрижелудочно вводили растворитель (масляно-спиртовую эмульсию в объеме 300 мкл), четыре группы (экспериментальные животные) получали AV6 в дозах 5, 50, 300 и 2000 мг/кг м.т.
Наблюдение за животными осуществляли в течение первых 30 мин после введения дозы, затем периодически в течение первых 24 ч и ежедневно в общей сложности в течение 14 сут с целью регистрации любых клинических признаков токсичности или смертности. Массу тела животных измеряли через сутки после введения и в конце каждой недели наблюдения. По окончании эксперимента через 14 сут была проведена оценка общетоксического действия AV6. Для этого от всех выживших животных получали образцы крови, подвергали цервикальной дислокации, извлекали внутренние органы: сердце, легкие, печень, почки, селезенку и тимус для оценки их внешнего вида и определения масс с целью расчета массовых коэффициентов органов (коэффициент рассчитан как отношение масса органа (г) / масса тела (г) × 100).
Оценку фармакокинетики AV6 провели на пяти аутбредных крысах-самцах Wistar массой 350–380 г из питомника лабораторных животных «Рапполово».
Все животные перед началом эксперимента проходили карантин и адаптацию к условиям вивария. Грызунов содержали по 5 животных в одной клетке в условиях свободного доступа к пище и воде. В качестве корма использован полнорационный гранулированный корм «ЧАРА» для лабораторных грызунов. В помещениях для животных поддерживали цикл день/ночь (12/12 ч), температуру 20–26 °C и влажность от 30 до 70%.
Катетеризацию яремной вены крыс, использованных в фармакокинетических исследованиях, выполняли под ингаляционным наркозом газовой смесью (5% изофлуран в воздухе) на установке Univentor 410 Anaesthesia Unit (Univentor Ltd, Мальта). Животных укладывали на спину и фиксировали передние и задние лапы пластырем на поверхности операционного столика с подогревом и освещением. После обеспечения хирургического доступа к v. jugularis externa и наложения краниальной лигатуры на сосуд выполняли катетеризацию. Катетер вводили в вену по направлению к сердцу до тех пор, пока кольцо катетера не достигало места разреза сосуда. В этом случае конец катетера оказывался в достаточной близости от входа в правое предсердие.
Затем катетер фиксировали в сосуде с использованием оставшихся концов ранее наложенной краниальной лигатуры. После закрепления в сосуде катетер подкожно выводили на холку, а затем через небольшой разрез (~1 см) фиксировали катетер дорсально между лопаток. После ушивания разрезов на животное надевали шлейку, через которую свободный конец катетера выводили для подключения к прибору автоматического отбора крови Accusampler. В этих условиях крысу содержали в специальной клетке с минимальными ограничениями в подвижности. Промывка катетера в течение всего периода после катетеризации проводилась автоматически по программе один раз в 30 мин физиологическим раствором с добавлением гепарина (16 ЕД/мл) в объеме 20 мкл. До начала фармакокинетических исследований после операции проходило не менее 36 ч, чтобы обеспечить восстановление животных и минимизировать влияние операционной травмы и средства для наркоза на процессы всасывания, метаболизма и элиминации исследуемого вещества.
Фармакокинетические исследования
Исследования фармакокинетики выполнены при однократном внутрижелудочном введении гарантированно безопасной дозы AV6 (25 мг/кг м.т.) в масляно-спиртовой эмульсии, которая была выбрана на основании результатов исследования острой токсичности на мышах, с учетом известных межвидовых коэффициентов пересчета на крыс.
Перед введением препарата от всех крыс были получены фоновые образцы крови по 0,2 мл. Система Accusampler, использованная для прижизненного отбора образцов крови, обеспечивает периодическую промывку капилляров и клапанов прибора физиологическим раствором, содержащим гепарин (16 ЕД/мл), и позволяет отбирать цельную кровь в заданном объеме 200 мкл без разбавления. После каждого отбора порции крови объем возмещается автоматически физиологическим раствором, содержащим гепарин. Автоматический отбор образцов крови выполнен через 20, 30 мин, 1, 2, 4, 6, 8, 24 и 48 ч. Пробирки с образцами центрифугировали (5 мин, 11 000 об/мин) при комнатной температуре. Надосадочную жидкость (около 100 мкл) отбирали механическим дозатором в пробирки типа Eppendorf, замораживали и сохраняли для последующего анализа при температуре -80 °С не более двух месяцев.
Образцы мочи (0,3–0,5 мл) собирали интервально до введения препарата, а также через 8, 24 и 48 ч после введения. Полученные образцы центрифугировали (3 мин, 14 000 об/мин) для удаления нерастворимых осадков. Супернатант отбирали механическим дозатором в пробирки типа Eppendorf, замораживали и хранили при температуре -80 °С не более 2 мес. Центрифугирование выполняли на центрифуге Hermle Z160M с угловым ротором (радиус ротора — 8,5 см).
При исследовании особенностей фармакокинетики AV6 и его потенциальных метаболитов определяли следующие показатели: значение константы элиминации (ke), период полувыведения (Т½), площадь под фармакокинетической кривой (AUC0→48), объем распределения (Vd), общий клиренс в фазе элиминации (CLtot).
Пробоподготовка мочи и плазмы крови для определения AV6 и метаболитов
В пробирки типа Eppendorf объемом 2,0 мл вносили по 0,05 мл анализируемой пробы (плазмы крови или мочи), затем добавляли по 0,15 мл ацетонитрила, тщательно перемешивали на вортексе (BioSan FVL-2400n) и центрифугировали 3 мин при 14 000 об/мин. Надосадочную жидкость переносили в хроматографическую виалу со вставкой 0,2 мл. Виалы помещали в автодозатор хроматографа. Объем вводимой пробы составлял 0,005 мл.
Определение AV6 и его метаболитов проводили на жидкостном хроматографе UltiMate 3000, оснащенном автодозатором с масс-селективным детектором Q-Exactive с электрораспылительной ионизацией при атмосферном давлении и программным обеспечением для управления и обработки данных «Xcalibur».
Для количественного определения и точного подтверждения наличия препарата в плазме крови или моче использовали МС/МС метод, где подтверждающим фактором наличия препарата AV6/метаболитов в сложной матрице (плазма крови или моча) являлось наличие трех продукт-ионов, характерных для анализируемого препарата. С учетом предварительного характера исследования, главной целью которого являлось выявление AV6 и потенциальных метаболитов, валидация метода количественного определения в полном объеме не проводилась. Образец AV6 для получения калибровочных проб был предварительно проанализирован с использованием ЯМР на установке Bruker AVANCE III 400 MHz NMR спектрометр. Его чистота составила не менее 99%.
Для приготовления калибровочных проб в пробирку Eppendorf вместимостью 2,0 мл дозатором вносили по 0,495 мл плазмы крови или мочи и по 0,005 мл раствора AV6 (1 мг/мл) в метаноле. Полученные образцы плазмы крови или мочи содержали препарат AV6 в концентрации 10 мкг/мл. Методом последовательных разбавлений (к 0,45 мл плазмы крови или мочи добавляли 0,05 мл приготовленного раствора AV6) полученные растворы имели концентрации AV6 1, 0,1 и 0,01 мкг/мл.
В пробирку Eppendorf вместимостью 2,0 мл механическим дозатором вносили по 0,05 мл каждой калибровочной пробы (плазмы крови или мочи), затем добавляли по 0,15 мл ацетонитрила, тщательно перемешивали и центрифугировали (3 мин, 14 000 об/мин). Надосадочную жидкость переносили в хроматографическую виалу со вставкой 0,2 мл. Виалы помещали в автодозатор хроматографа. Объем вводимой пробы — 0,005 мл.
Условия хроматографического разделения
Анализ проведен на хроматографической колонке ZorbaxSB-C8 (Agilent) длиной 150 мм, диаметром 4,6 мм, диаметр частиц сорбента 1,8 мкм.
Подвижная фаза состояла:
- компонент А — 0,1% раствор муравьиной кислоты в деионизированной воде;
- компонент В — 0,1% раствор муравьиной кислоты в ацетонитриле категории для градиентной ВЭЖХ. Режим хроматографического элюирования — градиентный; соотношение компонентов подвижной фазы приведено в таблице 1.
Исследование выполнено при скорости потока элюента 0,4 мл/мин, температуре термостата колонки 35 °С, объем вводимой пробы составил 5,0 мкл, время анализа — 14 мин.
Таблица 1. Соотношение компонентов подвижной фазы
Время, мин | Компонент, % | |
А | В | |
0,00 | 60 | 40 |
0,50 | 60 | 40 |
7,00 | 10 | 90 |
10,00 | 10 | 90 |
10,10 | 60 | 40 |
14,00 | 60 | 40 |
Таблица составлена авторами по собственным данным
Параметры масс-спектрометрического детектирования
Исследование выполнено при следующих условиях работы масс-спектрометрического детектора Q-Exactive с электрораспылительной ионизацией при атмосферном давлении: поток газа-осушителя — 45 усл. ед.; поток вспомогательного газа — 20 усл. ед.; давление на распылителе — 35 psi; температура газа-осушителя — 350 °С; температура вспомогательного потока — 400 °С; напряжение на капилляре — 3500 В. Детектирование выполнено в режиме сканирования по полному ионному току (SCAN), регистрации ионов в диапазоне m/z от 60 до 900 а.е.м. на протяжении всего анализа (при положительной ионизации).
Режим источника ионизации: ионизация электростатическим распылением при атмосферном давлении.
Режим детектирования: детектирование при положительной ионизации в режиме МС и МС/МС при высоком разрешении.
Полярность детектируемых ионов: детектирование положительных ионов.
Режим сканирования: диапазон детектируемых масс, m/z 60–950 а.е.м., напряжение в камере столкновений — 25 усл. ед.
В режиме МС высокого разрешения масс-хроматограммы снимали по точным массам молекулярных ионов соединений, приведенных выше. Статистический анализ проведен с использованием ПО GraphPad Prism 5.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Острая токсичность при внутрижелудочном применении AV6
В ходе эксперимента гибель животных наблюдали исключительно в группе 2000 мг/кг (три мыши (50%) погибли на 2-е сут после введения AV6). На этом основании можно отнести изучаемое производное феосферида А (AV6) к 3-му классу опасности10, т.к. значение ЛД50 для AV6 в форме масляно-спиртовой эмульсии при внутрижелудочном применении, судя по полученным данным, близко к максимальной из исследованных доз 2000 мг/кг.
Измерения массы тела животных в экспериментальных группах показали, что масса тела у животных не зависела существенно от воздействия AV6 при внутрижелудочном применении. Результаты измерений массы мышей и массовых коэффициентов внутренних органов представлены в таблицах 3 и 4.
По результатам визуальной оценки внутренних органов явных макроскопических признаков патологии выявлено не было. Также не было обнаружено статистически значимых изменений массовых коэффициентов внутренних органов экспериментальных животных по сравнению с контролем.
Исследование фармакокинетики AV6 и выявление его метаболитов
Исследования фармакокинетики AV6 и выявление его потенциальных метаболитов проводили после однократного внутрижелудочного введения AV6 (25 мг/кг м.т.). Данные об изменении концентрации AV6 обрабатывали с использованием бескомпартментного подхода.
Фармакокинетика абсорбции AV6 при внутрижелудочном введении характеризовалась достаточно быстрым достижением максимальной концентрации на уровне 30 нг/мл, величина Tmax составила 30–60 мин. Формальный пересчет на объем циркулирующей крови крыс (58–64 мл/кг веса тела животного) [11, 12] позволяет говорить о том, что в результате абсорбции из желудочно-кишечного тракта около 10–15% от дозы AV6, введенной внутрижелудочно, поступает в организм подопытных крыс.
Изменение концентрации AV6 в заключительной фазе элиминации характеризовалось экспоненциальным убыванием. Значение ke определено из уравнения графика зависимости «концентрация–время» в полулогарифмических координатах для экспериментов, выполненных на пяти животных.
Площадь под кривой «концентрация–время» AUC вычислена с использованием данных о концентрации вещества в крови в диапазоне от 20 мин до 48 ч после введения. Для расчетов использовано правило трапеций. Значение Vd вычислено с учетом предполагаемой оральной биодоступности (около 15%) AV6. Показатели фармакокинетики при условии внутрижелудочного введения AV6 приведены в таблице 5.
В целом экспоненциальное приближение с достаточной точностью описывает кривые «концентрация–время» для AV6 в фазе элиминации, но надо отметить, что в некоторых экспериментах наблюдали повышение концентрации AV6 в плазме крови в интервале от 2 до 5 ч после введения препарата. Наиболее вероятным объяснением такого характера кривой является перераспределение вещества из крови в гидрофобные пространства (межклеточное пространство) и его последующий повторный выход в циркуляторное русло. Нельзя исключить и возможность связывания с белками крови, которое теоретически может повлиять на извлечение AV6 из исследуемого биоматериала.
Снижение концентрации AV6 в фазе элиминации происходит достаточно быстро, о чем свидетельствуют полученные в ходе исследования значения ke и T1/2. Вероятно, это связано с метаболическими превращениями исследованного соединения, что подтверждается данными о присутствии в плазме крови значительного количества метаболита М2 через 10 ч после введения AV6.
Оценка выделения AV6 и его метаболитов с мочой выполнена на основании результатов измерений концентрации вещества в образцах мочи, полученных в процессе интервального сбора в течение 48 ч после внутрижелудочного введения. Суммарное выделение AV6 и метаболитов за сутки (приведенное к примерному суточному объему мочи ~12 мл) может составлять от 750 до 1400 нг, т.е. от 50 до 93% от поступившего в организм препарата (при условии биодоступности на уровне 15% от дозы).
На этом этапе работы получены данные о двух основных метаболитах. На рисунках 2–4 представлены хроматограммы образцов плазмы крови подопытных животных. В образцах, кроме исходного вещества, выявлены его метаболиты M1 и M2.
При анализе хроматограмм плазмы крови крыс (до и после внутрижелудочного введения AV6) установлено появление в плазме крови новых соединений и пиков на хроматограмме плазмы крови крысы через 1 ч после введения (рис. 3), являющихся метаболитами AV6, структура которых приведена в таблице 6.
Наличие AV6 в плазме крови четко видно на рисунке 3а, также выявляли следовые количества метаболита М1 (рис. 3б) и метаболита М2 (рис. 3в). Время выхода (RT) AV6 составляло 7,68 мин, метаболита М2 — 6,53 мин.
При сравнении хроматограмм плазмы крови крысы через 1 ч после внутрижелудочного введения AV6 (рис. 3) и спустя 10 ч после введения (рис. 4) видно, что через час после введения пик AV6 по интенсивности в 20 раз превосходил пик М2. Однако через 10 ч интенсивность пика AV6 уменьшилась, в то время как интенсивность пика метаболита М2 увеличилась.
Таким образом, метаболит М2 выявлялся по данным хроматографии в интервале от 1 до 10 ч после внутрижелудочного введения AV6. При этом доля М2 через 10 ч после введения препарата превышала AV6. Вероятно, М2 является более стабильным соединением, вместе с тем нельзя исключить, что эффекты AV6 обусловлены действием M2; метаболит М1 в плазме крови не обнаруживается.
Результаты определения AV6 и его метаболитов в образцах мочи
На масс-хроматограммах образцов мочи до введения AV6 (рис. 5) через 8 ч после введения (рис. 6) и 24 ч (рис. 7) после введения вещества видно, что в бланковом образце не обнаруживали пики AV6 и его метаболитов (рис. 5), при этом через 8 ч видны пики как AV6, так и пики обоих метаболитов, причем интенсивность (площадь пика) у AV6 ненамного больше площадей пиков метаболитов, что говорит о наличии в моче исходного AV6. AV6 в образцах мочи через 24 ч обнаруживали в следовых количествах, но метаболиты М1 и М2 присутствовали и четко детектировались (рис. 7б, 7в).
В фоновом образце искомые соединения отсутствуют.
Таблица 2. Условия фрагментирования AV6
Масса [m/z] | Формула [M] | Вид | Полярность | (N)CE | (N)CE тип | Комментарий |
351,22783 | C19H30N2O4 | + H | Positive | 25 | NCE | AV6 |
Таблица составлена авторами по собственным данным
Таблица 3. Результаты оценки массы тела животных (г)
Период наблюдения | Группы животных | ||||
Контроль n = 6 | 5 мг/кг n = 6 | 50 мг/кг n = 6 | 300 мг/кг n = 6 | 2000 мг/кг* | |
1-й день | 18,7 ± 0,7 | 20,0 ± 0,3 | 18,1 ± 0,6 | 19,0 ± 0,7 | 18,3 ± 0,7 |
Неделя 1 | 18,9 ± 0,8 | 20,1 ± 0,1 | 19,3 ± 0,4 | 19,4 ± 0,9 | 18,4 ± 1,6 |
Неделя 2 | 19,2 ± 0,8 | 20,4 ± 0,4 | 19,0 ± 0,5 | 19,6 ± 1,0 | 19,1 ± 1,4 |
Таблица составлена авторами по собственным данным
Примечание: * — данные приведены для выживших животных (n = 3); данные представлены в виде среднего значения и стандартной ошибки среднего значения (M ± m).
Таблица 4. Массовые коэффициенты внутренних органов
Орган | Группы животных | ||||
Контроль n = 6 | 5 мг/кг n = 6 | 50 мг/кг n = 6 | 300 мг/кг n = 6 | 2000 мг/кг n = 3 | |
Сердце | 0,54 ± 0,06 | 0,50 ± 0,03 | 0,57 ± 0,06 | 0,53 ± 0,08 | 0,58 ± 0,04 |
Печень | 5,16 ± 0,33 | 5,05 ± 0,30 | 4,86 ± 0,16 | 4,86 ± 0,36 | 5,57 ± 0,15 |
Почки | 0,71 ± 0,07 | 0,70 ± 0,04 | 0,66 ± 0,05 | 0,68 ± 0,05 | 0,76 ± 0,07 |
Селезенка | 0,53 ± 0,10 | 0,59 ± 0,12 | 0,49 ± 0,03 | 0,47 ± 0,03 | 0,54 ± 0,20 |
Легкие | 1,12 ± 0,32 | 0,88 ± 0,10 | 1,00 ± 0,13 | 0,91 ± 0,15 | 1,10 ± 0,25 |
Тимус | 0,25 ± 0,06 | 0,24 ± 0,09 | 0,25 ± 0,07 | 0,23 ± 0,06 | 0,32 ± 0,06 |
Таблица составлена авторами по собственным данным
Примечание: данные представлены в виде среднего значения и стандартной ошибки среднего значения (M ± m).
Таблица 5. Параметры фармакокинетики у крыс после однократного внутрижелудочного введения AV6 в дозе 25 мг/кг м.т.
Параметр | Значение параметра |
Константа элиминации (ke), ч–1 | 0,138–0,219 |
Период полувыведения (Т½), ч | 3,2–5,0 |
Площадь под фармакокинетической кривой (AUC0→48), мкг×ч/л | 80–98 |
Объем распределения (Vd), л | ~50 |
Общий клиренс в фазе элиминации (CLtot), мл/мин | ~165 |
Таблица составлена авторами по собственным данным
Таблица 6. Молекулярные пики вещества AV6 и его метаболитов (М1 и М2)
Шифр | Брутто- формула | Молекулярная масса | m/z [M + H]+ | Структурная формула | Время удерживания RT, мин |
AV6 | C19H30N2O4 | 350,22056 | 351,22783 | 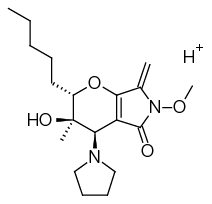 | 7,68 |
М1 | C18H28N2O4 | 336,20491 | 337,21218 | 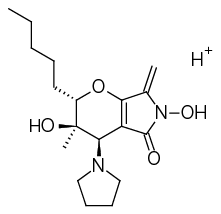 | 7,11 |
М2 | C18H28N2O3 | 320,20999 | 321,21727 | 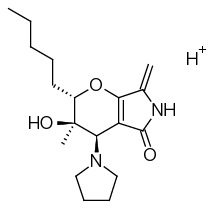 | 6,53 |
Таблица составлена авторами по собственным данным
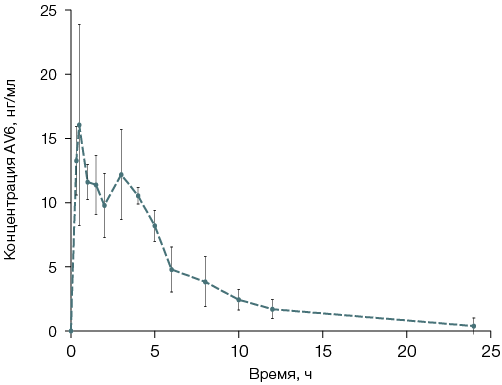
Рисунок подготовлен авторами по собственным данным
Рис. 1. График зависимости концентрации соединения в плазме крови крыс от времени после однократного внутрижелудочного введения AV6
Примечание: график построен с использованием ПО GraphPad Prism 5; данные представлены в виде среднего значения и величины стандартного отклонения (M ± δ).
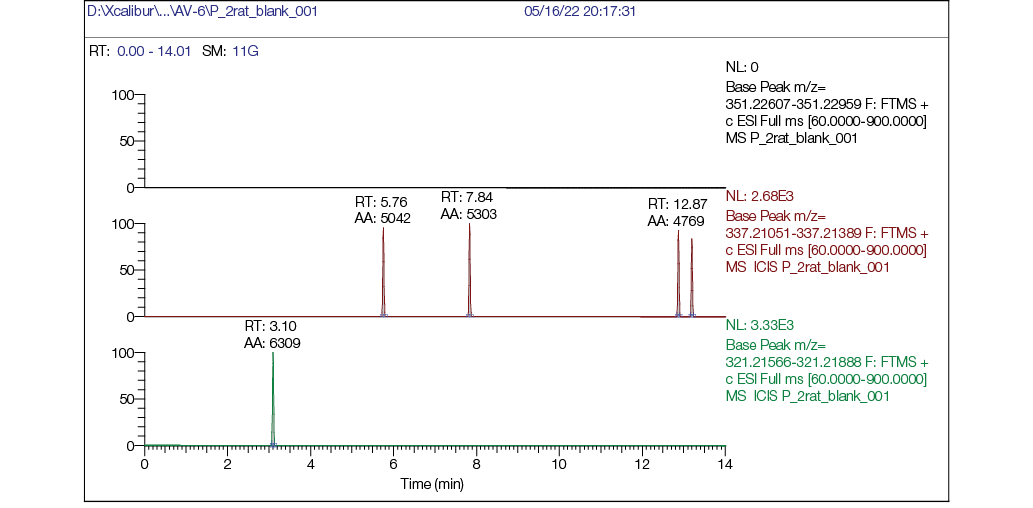
Рисунок подготовлен авторами по собственным данным
Рис. 2. Хроматограмма фонового образца плазмы крысы: а — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 351,22783 (AV6); б — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 337,21218 (M1); в — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 321,21727 (M2)
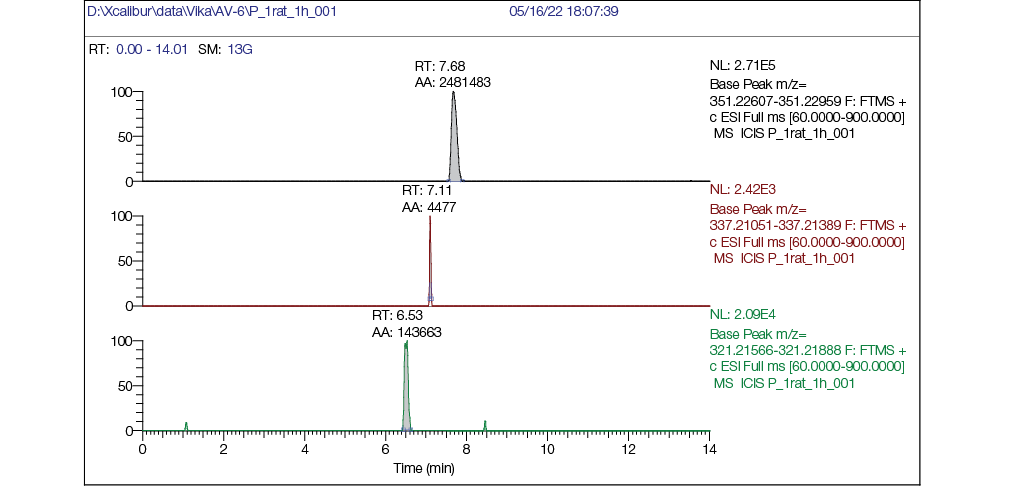
Рисунок подготовлен авторами по собственным данным
Рис. 3. Хроматограмма плазмы крови крысы через 1 час после однократного внутрижелудочного введения AV6 в дозе 25 мг/кг м.т.: а — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 351,22783 (AV6); б — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 337,21218 (M1); в — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 321,21727 (M2)
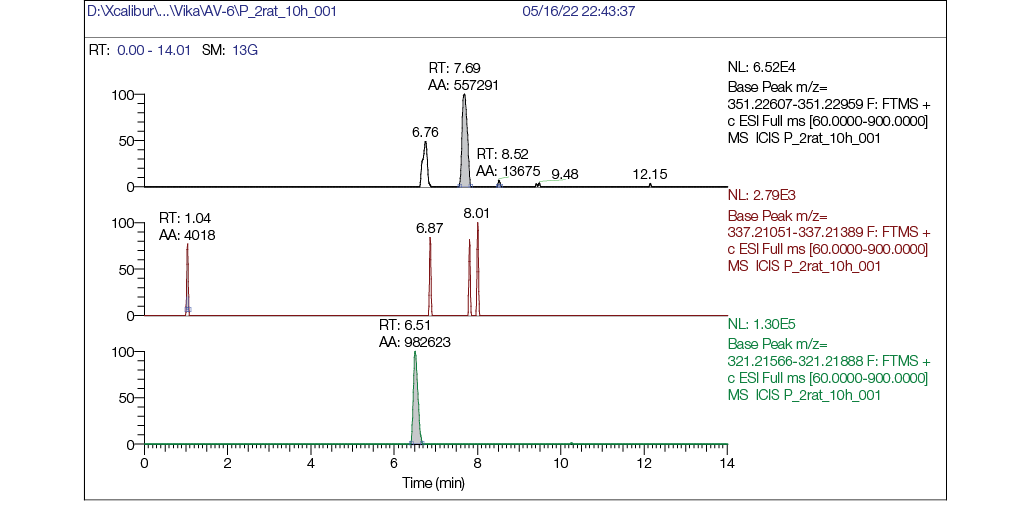
Рисунок подготовлен авторами по собственным данным
Рис. 4. Хроматограмма плазмы крови крысы через 10 часов после однократного внутрижелудочного введения AV6 в дозе 25 мг/кг м.т.: а — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 351,22783 (AV6); б — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 337,21218 (M1); в — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 321,21727 (M2)
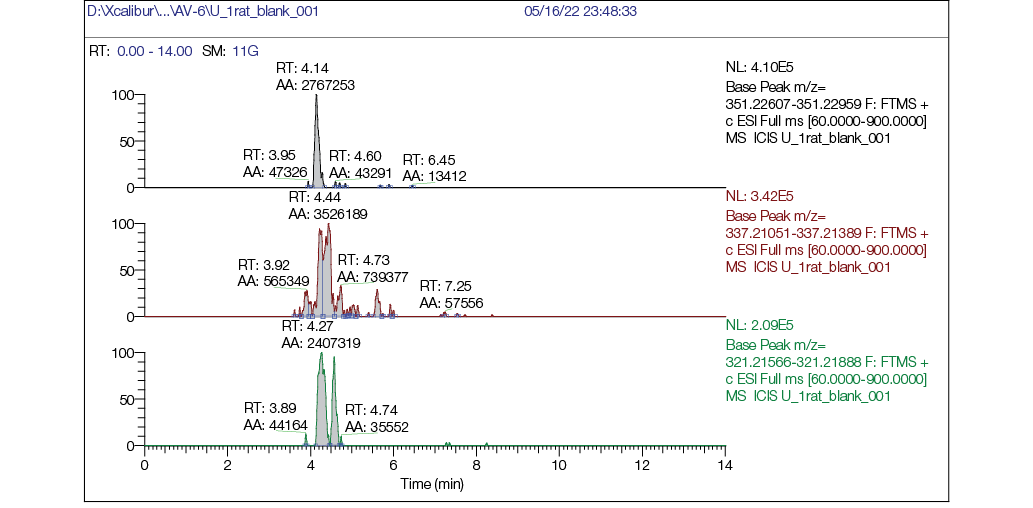
Рисунок подготовлен авторами по собственным данным
Рис. 5. Хроматограмма фонового образца мочи крысы: а — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 351,22783 (AV6); б — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 337,21218 (M1); в — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 321,21727 (M2)
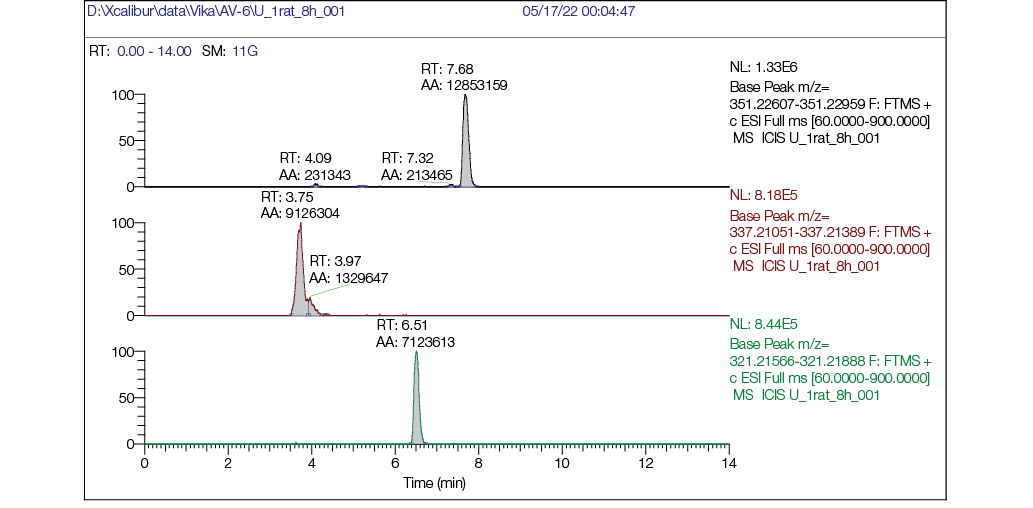
Рисунок подготовлен авторами по собственным данным
Рис. 6. Хроматограмма образца мочи крысы через 8 часов после однократного внутрижелудочного введения AV6 в дозе 25 мг/кг м.т.: а — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 351,22783 (AV6), RT = 7,68 мин; б — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 337,21218 (M1) RT = 3,75 мин; в — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 321,21727 (M2) RT = 6,51 мин
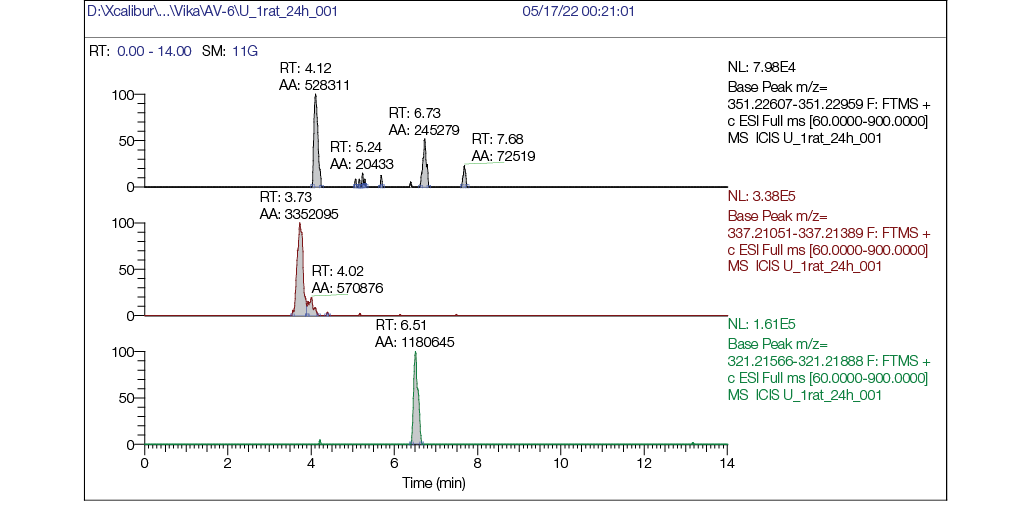
Рисунок подготовлен авторами по собственным данным
Рис. 7. Хроматограмма образца мочи крысы через 24 часа после однократного внутрижелудочного введения AV6 в дозе 25 мг/кг м.т.: а — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 351,22783 (AV6); б — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 337,21218 (M1); в — хроматограмма, реконструированная по точной массе иона [M + H] + с m/z 321,21727 (M2)
ЗАКЛЮЧЕНИЕ
Выполненное доклиническое исследование по оценке острой токсичности AV6, его метаболизма и фармакокинетики является одним из этапов для переноса полученных ранее данных о противоопухолевом потенциале этого производного природного феосферида А и дальнейшей реализации исследований in vivo. Исследованное производное природного феосферида А — AV6 можно отнести к 3-му классу опасности. Не выявлено статистически значимых изменений внутренних органов экспериментальных животных по сравнению с контрольной группой.
В результате выполненного исследования разработана процедура количественного определения AV6 на основе ВЭЖХ-МС/МС анализа. Впервые получены данные о метаболитах, образующихся в организме крыс. Данные о фармакокинетике препарата AV6 при его внутрижелудочном применении в форме масляно-спиртовой эмульсии позволяют говорить о том, что формальное описание его фармакокинетики может быть выполнено с использованием бескомпартментной модели. По всей видимости, требуется дополнительный анализ его распределения в гидрофобные компартменты с учетом его физико-химических свойств. Сведения о метаболитах AV6, полученные в ходе фармакокинетического исследования на крысах, свидетельствуют о том, что скорость метаболизма вещества невысока и обусловлена главным образом химическими превращениями у атома азота лактамного цикла, в результате чего образуются метаболиты, которые могут выделяться в составе мочи. Наиболее вероятными механизмами таких превращений являются окислительное деацилирование и последующий гидролиз.
1 Luellman H, Mohr K, Hein L. Pocket atlas of pharmacology. 4th ed. Thieme; 2011.
2 Важнейшие научные результаты в сфере медицинской химии в 2023 г. Научный совет РАН по медицинской химии, Отделение химии и наук о материалах РАН, 2024. 41 с.
3 Guidance on Nonclinical Safety Studies for the Conduct of Human Clinical Trials and Marketing Authorization for Pharmaceuticals M3(R2) CPMP/ICH/286/95 (2009). The European Agency for the Evaluation of Medicinal Products. Human medicines evaluation unit.
4 Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств».
5 ГОСТ Р 53434-2009. Национальный стандарт Российской Федерации. Принципы надлежащей лабораторной практики. М.: Стандартинформ; 2010.
6 Good laboratory practice: OECD principles and guidance for compliance monitoring. 2005.
7 Миронов АН, редактор. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. М.: Гриф и К; 2012.
8 European Parliament and Council. Directive 2010/63/EU of the European Parliament and of the council of 22 Sept. 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. 2010; 276:33–79.
9 ГОСТ 32644-2014. Межгосударственный стандарт. Методы испытания по воздействию химической продукции на организм человека. Острая пероральная токсичность — метод определения класса острой токсичности. М.: Стандартинформ; 2015.
10 Test Guideline 423. OECD guideline for testing of chemicals. Acute oral toxicity — Acute toxic class method. 2002b. OECD, Sep. 2021.
Список литературы
1. Moten A, Schafer D, Farmer P, Kim J, Ferrari M. Redefining global health priorities: Improving cancer care in developing settings. Journal of Global Health. 2014;4(1):010304. https://doi.org/10.7189/jogh.04.010304
2. Delahaye C, Figarol S, Pradines A, Favre G, Mazieres J, Calvayrac O. Early steps of resistance to target therapies in non-small-cell lung cancer. Cancer.2022;14(11):2613. https://doi.org/10.3390/cancers14112613
3. Whitmire M, Ammerman J, de Lisio P, Killmer J, Kyle D, Mainstone E, et al. LC-MS/MS Bioanalysis Method Development, Validation, and Sample Analysis: Points to Consider When Conducting Nonclinical and Clinical Studies in Accordance with Current Regulatory Guidances. Journal of Analytical and Bioanalytical Techniques. 2011;1(1):S4–001. https://doi.org/10.4172/2155-9872.S4-001
4. Maloney KN, Hao W, Xu J, Gibbons J, Hucul J, Roll D, et al. Phaeosphaeride A, an inhibitor of STAT3-dependent signaling isolated from an endophytic fungus. Organic Letters 2006;8(18):4067–70. https://doi.org/10.1021/ol061556f
5. Abzianidze VV, Efimova KP, Poluektova EK, Trishin YuG, Kuznetsov VA. Synthesis and characterization of natural phaeosphaeride A and semi-natural phaeosphaeride B derivatives. Mendeleev Communications. 2017;27(5):490–2. https://doi.org/10.1016/j.mencom.2017.09.020
6. Abzianidze VV, Zakharenkova S, Kuznetsov VA, Beltyukov P, Moiseeva N, Mejia J, et al. Synthesis and Biological Evaluation of Phaeosphaeride A Derivatives as Antitumor Agents. Molecules. 2018;23(11):3043. https://doi.org/10.3390/molecules23113043
7. Abzianidze VV, Moiseeva NI, Suponina DS, Zakharenkova SA, Rogovskaya NYu, Laletina LA, et al. Natural Phaeosphaeride A Derivatives Overcome Drug Resistance of Tumor Cells and Modulate Signaling Pathways. Pharmaceuticals. 2022;15(4):395. https://doi.org/10.3390/ph15040395
8. Abzianidze VV, Kadochnikov VV, Suponina DS, Skvortsov NV, Beltyukov PP, et al. X-ray structure and in silico molecular docking of a natural phaeosphaeride A derivative for targets associated with kinase cascades. Mendeleev Communications. 2023;33:534–6. https://doi.org/10.1016/j.mencom.2023.06.030
9. Абзианидзе ВВ, Бельтюков ПП, Захаренкова СА, Кузнецов ВА, Лукина ДС, Уколов АИ и др. Новые производные феосферида, обладающие противоопухолевой активностью, способ получения и применение этих соединений. Патент Российской Федерации № 2748533;2021. EDN: HBRZRK
10. Абзианидзе ВВ, Моисеева НИ, Бельтюков ПП, Захаренкова СА, Кузнецов ВА, Супонина ДС и др. Новые производные феосферида, обладающие цитотоксической, противоопухолевой активностью и способностью преодолевать лекарственную устойчивость. Патент Российской Федерации № 2809986;2023. EDN: LVBHXG
11. Bijsterbosch MK, Duursma AM, Bouma JM, Gruber M. The plasma volume of the Wistar rat in relation to the body weight. Experientia. 1981;37(4):381–2. https://doi.org/10.1007/BF01959874
12. Diehl KH, Hull R, Morton D, Pfister R, Rabemampianina Y, Smith D, et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 2001;21(1):15–23. https://doi.org/10.1002/jat.727
Об авторах
В. В. АбзианидзеРоссия
Абзианидзе Виктория Вадимовна - канд. хим. наук.
Ленинградская область
Н. В. Скворцов
Россия
Скворцов Никита Владиславович
Ленинградская область
Г. В. Каракашев
Россия
Каракашев Георгий Васильевич - канд. биол. наук.
Ленинградская область
П. П. Бельтюков
Россия
Бельтюков Петр Петрович - канд. мед. наук.
Ленинградская область
Д. С. Супонина
Россия
Супонина Диана Сергеевна
Ленинградская область
В. О. Мусатова
Россия
Мусатова Валерия Олеговна
Ленинградская область
А. С. Богаченков
Россия
Богаченков Александр Сергеевич - канд. хим. наук.
Ленинградская область
Д. В. Криворотов
Россия
Криворотов Денис Викторович - канд. хим. наук.
Ленинградская область
Дополнительные файлы
Рецензия
Для цитирования:
Абзианидзе В.В., Скворцов Н.В., Каракашев Г.В., Бельтюков П.П., Супонина Д.С., Мусатова В.О., Богаченков А.С., Криворотов Д.В. Оценка острой токсичности и фармакокинетики производного природного феосферида А на лабораторных грызунах. Медицина экстремальных ситуаций. 2025;27(4):441-452. https://doi.org/10.47183/mes.2025-303
For citation:
Abzianidze V.V., Skvortsov N.V., Karakashev G.V., Beltyukov P.P., Suponina D.S., Musatova V.O., Bogachenkov A.S., Krivorotov D.V. Evaluation of acute toxicity and pharmacokinetics of a natural phaeosphaeride A derivative in laboratory rodents. Extreme Medicine. 2025;27(4):441-452. https://doi.org/10.47183/mes.2025-303

















