Перейти к:
Влияние общего перегревания и местного охлаждения на переносимость фентанила крысами
https://doi.org/10.47183/mes.2025-311
Аннотация
Введение. Токсичность многих ксенобиотиков возрастает с температурой воздуха, но неизвестно, относится ли это к наркотическим анальгетикам и как на эту зависимость влияют меры помощи, рекомендуемые при тепловом ударе.
Цель. Оценка влияния повышенной температуры воздуха и местного охлаждения на острую токсичность фентанила.
Материалы и методы. Проведены три серии экспериментов: в первой изучено влияние повышенной температуры воздуха на дозовую зависимость летального и наркотического действия фентанила. Формировали 11 групп по 20 крыс, которым внутривенно (в/в) вводили фентанил в дозах 50, 100, 200, 300 или 400 мкг/кг и группу (n = 14) без введения препарата. После введения фентанила часть крыс (n = 100) содержали в течение суток при температуре воздуха 22 °С; вторую часть (n = 100) — 40 мин в термокамере при 40 °С и далее в течение суток при 22 °С; не получивших фентанил наблюдали в термокамере до первого случая гибели, затем — в течение суток при 22 °С. Во второй серии изучено влияние охлаждения головы на летальность, латентное время пробуждения, ректальную температуру крыс (n = 49) через 40 мин после в/в введения фентанила в дозе 300 мкг/кг (LD5). Формировали 4 группы животных, которых после введения фентанила содержали 40 мин при 22 или 40 °С с местным охлаждением neurocranium или без него и последующим наблюдением в течение суток при 22 °С. В третьей серии по такой же схеме изучено влияние охлаждения средней трети вентральной поверхности туловища на летальность, латентное время пробуждения и ректальную температуру крыс (n = 48) через 40 мин после введения фентанила в той же дозе. Статистический анализ проведен с использованием программного обеспечения OriginPro.
Результаты. Сорокаминутное пребывание интактных крыс при 40 °С было нелетальным. После введения фентанила в дозах 100– 400 мкг/кг летальность составила 0–5% при 22 °С и 60–95% при 40 °С. Гипертермия при 40 °С на фоне введения фентанила в дозе 300 мкг/кг замедлялась при охлаждении головы и предотвращалась при охлаждении вентральной поверхности туловища. Охлаждение вентральной поверхности туловища, но не головы, снижало летальность со 100 до 8%. При 22 °С оба варианта местного охлаждения углубляли вызванную фентанилом гипотермию, существенно не влияя на летальность и продолжительность наркоза.
Выводы. Общее перегревание потенцирует летальное и наркотическое действие фентанила на крыс. Охлаждение в этих условиях вентральной поверхности туловища — эффективная мера предупреждения гипертермии и летальности, а охлаждение головы малоэффективно. При комнатной температуре оба варианта местного охлаждения углубляют вызванную фентанилом гипотермию, существенно не влияя на летальность. Требует оценки эффективность охлаждения вентральной поверхности туловища не только при комбинированном, но и при изолированном перегревании организма.
Ключевые слова
Для цитирования:
Ивницкий Ю.Ю., Вакуненкова О.А., Головко А.И., Лапина Н.В., Рейнюк В.Л. Влияние общего перегревания и местного охлаждения на переносимость фентанила крысами. Медицина экстремальных ситуаций. 2025;27(4):475-482. https://doi.org/10.47183/mes.2025-311
For citation:
Ivnitsky J.J., Vakunenkova O.A., Golovko A.I., Lapina N.V., Rejniuk V.L. The effect of general hyperthermia and local cooling on fentanyl tolerance in rats. Extreme Medicine. 2025;27(4):475-482. https://doi.org/10.47183/mes.2025-311
ВВЕДЕНИЕ
Перегревание организма — повышение температуры тела в условиях, когда сумма тепловой энергии, освободившейся в процессах метаболизма и поступившей извне, превышает тепловую энергию, потерянную излучением, конвекцией и теплопроведением. Климатические условия, способствующие перегреванию организма, нередки на территории нашей страны. Один из аспектов проблемы — увеличение при нем токсичности ряда ксенобиотиков для пойкилотермных [1] и гомойотермных животных [2]. В связи с этим представляет интерес влияние условий, способствующих перегреванию организма, на выраженность побочных эффектов наркотических анальгетиков. Их передозировка не исключена в ходе медицинской эвакуации раненых; актуальна она и в силу стремительного распространения дериватов фентанила на нелегальном рынке наркотических средств и психотропных веществ [3]. Однако данные, позволяющие прогнозировать влияние перегревания организма на токсичность опиоидов, неполны. Для восполнения этого пробела необходимо изучение их токсичности при передозировке в контролируемых климатических условиях. Передозировку опиоидов удобно моделировать введением животным фентанила, сочетающего кратковременность действия с принадлежностью к классу чрезвычайно токсичных веществ [4]. Представляет интерес и применимость на фоне опиоидной анальгезии терапевтических мер, рекомендуемых при изолированном перегревании организма в форме теплового удара. «Стандарт скорой медицинской помощи при тепловом и солнечном ударе»1 в качестве такой меры предписывает «применение пузыря со льдом», однако не указывает место наложения этого пузыря. В учебно-методических источниках таким местом наиболее часто оказывается лоб2. Упоминаются также затылок, шея, виски, ключицы, внутренние сгибы локтевого и коленного суставов, икроножные мышцы, паховая и крестцовая области [5], однако ощущается недостаток объективных данных, характеризующих обоснованность подобных рекомендаций.
Цель исследования — оценка влияния повышенной температуры воздуха и местного охлаждения на острую токсичность фентанила.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено в ноябре 2024 г. на самцах беспородных крыс-альбиносов с массой тела 191–210 г из Филиала НИЦ «Курчатовский институт» — ПИЯФ — ПЛЖ «Рапполово». Выполнены 3 серии экспериментов.
В первой серии экспериментов изучали влияние повышенной температуры воздуха на дозовую зависимость летального и наркотического действия фентанила. Формировали 11 рандомизированных групп. Животным десяти групп (n = 200) в латеральную вену хвоста вводили раствор фентанила 50 мкг/мл (ФГУП «Московский эндокринный завод», серия 30212) в дозах 50, 100, 200, 300, 400 мкг/кг; в одной группе (n = 14) препарат не вводили.
Получивших фентанил особей (n = 100) оставляли на сутки при комнатной температуре воздуха 22 °С (группа контроль); вторую часть животных (n = 100) на 40 мин помещали в открытые вольеры, установленные в термокамере при 40 °С, и далее в течение суток наблюдали при температуре воздуха 22 °С.
Крыс, не получивших фентанил (доза 0 мг/кг, объем 0 мл/кг), помещали в рестрейнеры и удерживали в термокамере до первого случая гибели. После извлечения из термокамеры наблюдение продолжали в течение суток при 22 °С; в это время регистрировали пробуждение (в момент первой побежки при перкуссии хвоста) или гибель. Схема исследования представлена в таблице.
Во второй серии экспериментов на других крысах (n = 49) изучали влияние общего перегревания и (или) местного охлаждения головы на ректальную температуру, летальность и латентное время пробуждения через 40 мин после введения официнального препарата фентанила в дозе 300 мкг/кг; эта доза была предварительно идентифицирована как LD5 для особей, пребывающих при комнатной температуре. Формировали 4 рандомизированные группы:
1-я группа (n = 14) — животные, получившие фентанил в дозе 300 мкг/кг и далее находившиеся 24 ч при температуре 22 °С без местного охлаждения;
2-я группа (n = 12) — животные, получившие фентанил в дозе 300 мкг/кг, после чего оставленные на 40 мин при 22 °С с местным охлаждением и далее 24 ч при 22 °С без местного охлаждения;
3-я группа (n = 12) — животные, получившие фентанил в дозе 300 мкг/кг, пребывавшие 40 мин при 40 °С без местного охлаждения и далее 24 ч при 22 °С;
4-я группа (n = 11) — животные, получившие фентанил в дозе 300 мкг/кг, пребывавшие 40 мин при 40 °С с местным охлаждением и далее 24 ч при 22 °С.
Для охлаждения головы на поверхности neurocranium в течение 40 мин после введения фентанила удерживали пластмассовые емкости, содержавшие 70 г тающего льда, после чего местное охлаждение прекращали и у животных измеряли температуру тела. В течение суток регистрировали исход интоксикации: гибель или пробуждение.
По такой же схеме в третьей серии экспериментов на 4 группах численностью по 12 крыс изучали влияние сорокаминутного пребывания в термокамере при 40 °С и (или) охлаждения средней трети вентральной поверхности туловища на острую интоксикацию фентанилом. Условия местного охлаждения тела иллюстрирует рисунок 1.
Климатические условия, способствующие перегреванию организма, моделировали в термокамере BMT Stericell SC 111 ECO емкостью 111 л (Чехия), в которой поддерживали температуру воздуха 40 ± 1 °С, относительную влажность 48% и кратность воздухообмена 45 объемов камеры в час. Температуру тела измеряли электрическим термометром с датчиком для крыс RET-2 (WPI, КНР), наконечник которого вводили в rectum на глубину 3 см. Инструментальная офтальмоскопия крысам не проводилась; о цвете глазного дна косвенно судили по цвету глаз, которые у крыс-альбиносов лишены иных пигментов, кроме гемоглобина сосудов.
Статистический анализ проведен с использованием программного обеспечения OriginPro. Результаты представлены в виде среднего значения и его ошибки (M ± m). Для проверки нормальности распределения использовали критерий Шапиро – Уилка. Влияние применявшихся воздействий на параметрические показатели оценивали с помощью дисперсионного анализа. В случаях значимости полученных моделей межгрупповое сравнение средних величин выполняли с помощью теста честной значимой разницы Тьюки. Значения LD50 рассчитывали пробит-методом. Межгрупповые различия функций дожития оценивали с использованием критерия Гехана – Вилкоксона, частоты встречаемости альтернативных признаков — точным методом Фишера. Критический уровень значимости α приняли равным 0,05.
Таблица. Схема изучения влияния условий, способствующих перегреванию организма, на дозовую зависимость летального и наркотического действия фентанила
Число крыс | Фармакологическое воздействие | Климатическое воздействие | |
Доза фентанила, мкг/кг | Объем препарата, мл/кг | ||
20 | 50 | 1 | 22 °С в течение суток после введения фентанила |
20 | 100 | 2 | |
20 | 200 | 4 | |
20 | 300 | 6 | |
20 | 400 | 8 | |
14 | 0 | 0 | 40 °С до первого случая гибели и далее в течение суток при 22 °С |
20 | 50 | 1 | 40 °С в течение 40 мин после введения фентанила и далее в течение суток при 22 °С |
20 | 100 | 2 | |
20 | 200 | 4 | |
20 | 300 | 6 | |
20 | 400 | 8 | |
Таблица составлена авторами


Рисунок подготовлен авторами
Рис. 1. Местное охлаждение тела крыс после введения фентанила: А — емкость с тающим льдом контактирует с neurocranium; Б — емкость с тающим льдом контактирует со средней третью вентральной поверхности туловища
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В первой серии экспериментов при изучении дозовой зависимости летального и наркотического действия фентанила через 10–15 с после его введения наблюдали у крыс опистотонус, экстензию хвоста и кратковременное апноэ с последующим редким поверхностным дыханием; глазное дно приобретало фиолетовый цвет. Все случаи гибели отмечены в ближайшие 2 ч, а пробуждения — в ближайшие 3,4 ч. Для особей, остававшихся при комнатной температуре, дозы фентанила 50 и 100 мкг/кг были сублетальными, а при дозах 200, 300 или 400 мкг/кг летальность составляла 5%. Таким образом, при комнатной температуре воздуха значение LD50 фентанила внутривенным введением его официнального раствора в допустимом для крыс объеме ≤ 2 мл не достигалось.
У животных, после введения фентанила помещенных на 40 мин в термокамеру, LD50 составила 113 ± 16 мкг/кг (рис. 2А). Тепловое воздействие на фоне введения фентанила увеличивало латентное время пробуждения в 1,6–4,0 раза (с 10–110 до 40–176 мин, рис. 2Б); у таких животных после пробуждения наблюдали преходящую атаксию, которая отсутствовала в контроле. Для крыс, не получавших фентанил, сорокаминутное тепловое воздействие было нелетальным; первый случай гибели отмечен лишь через 90 мин после помещения в термокамеру.
На рисунке 2 различие с животными, оставленными при комнатной температуре, значимо в интервале доз 100–400 мкг/кг для летальности и в интервале доз 50–400 мкг/кг — для латентного времени пробуждения, p < 0,05.
Во второй и третьей сериях экспериментов, при изучении теплового состояния организма, исходное значение ректальной температуры составило 38,1 ± 0,1 °С (n = 96). Через 40 мин после введения фентанила ректальная температура выживших особей группы 1, оставленных при комнатной температуре без местного охлаждения тела, была снижена до 34,5 ± 0,2 °С (n = 25), а у остававшихся живыми к этому времени крыс группы 3 (n = 5) — повышена до 44,5 ± 0,4 °С. При охлаждении головы температура тела составляла в это время у крыс, оставленных при комнатной температуре, 33,7 ± 0,3 °С группа 2, (n = 10), а у шести, остававшихся живыми в момент извлечения из термокамеры особей группы 4, — 39,8 ± 0,6 °С (рис. 3А). Охлаждение вентральной поверхности туловища снижало, в сравнении с не получавшими местного охлаждения, температуру тела у животных, после введения фентанила находившихся как при комнатной, так и при повышенной температуре воздуха: до 29,7 ± 0,3 °С (n = 9) и 33,0 ± 0,5 °С (n = 11) за 40 мин соответственно. За 40 мин разность среднегрупповых значений температуры тела у переживших пребывание в термокамере крыс, не получавших и получавших местное охлаждение вентральной поверхности туловища, достигала 11,4 °С (рис. 3Б).
У крыс, после введения фентанила оставленных при комнатной температуре, летальность составляла 7–8%, а у помещенных на 40 мин в термокамеру — 100% (p < 0,05). Влияние охлаждения головы на летальность было представлено тенденцией к повышению на 10% для оставленных при комнатной температуре и к понижению на 27% — для помещенных в термокамеру (рис. 4А).
Охлаждение вентральной поверхности туловища полностью предотвращало отягощающее влияние повышенной температуры воздуха на острую интоксикацию: летальность снижалась на 92% и была такой же, как и у крыс, оставленных при комнатной температуре без местного охлаждения (рис. 4Б). У животных, после введения фентанила оставленных при комнатной температуре, при охлаждении вентральной поверхности туловища наблюдалась тенденция к повышению летальности на 17% в сравнении с лишенными местного охлаждения. Крысы, после введения фентанила подвергшиеся тепловому воздействию без местного охлаждения тела, гибли, не пробуждаясь. Существенных межгрупповых различий латентного времени пробуждения остальных животных не выявлено, атаксия у них не возникала.
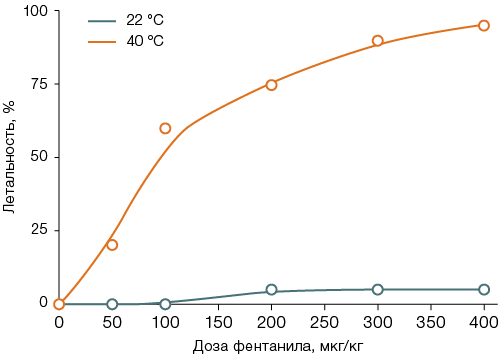
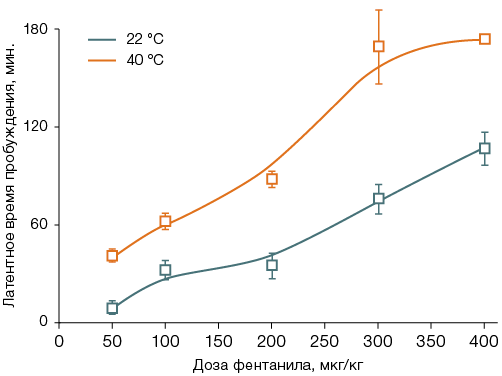
Рисунок подготовлен авторами
Рис. 2. Летальность (А) и латентное время пробуждения (Б) у крыс после введения фентанила с последующим пребыванием 40 мин при температуре воздуха 22 °С или 40 °С
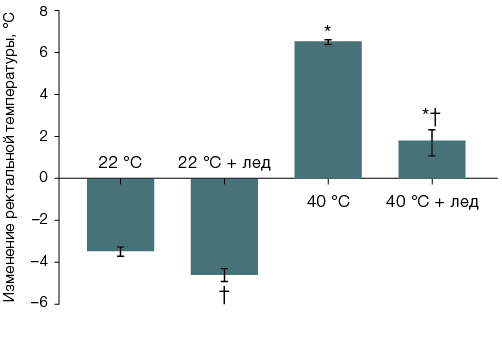
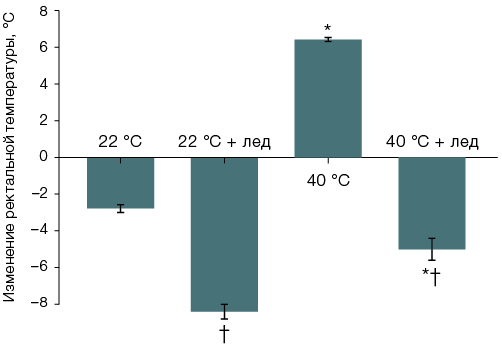
Рисунок подготовлен авторами
Рис. 3. Изменение ректальной температуры крыс после введения фентанила в дозе 300 мкг/кг и сорокаминутного пребывания при температуре воздуха 22 °С или 40 °С с охлаждением льдом головы (А) или вентральной поверхности туловища (Б)
Примечание: статистически значимое различие (p < 0,05): * — с соответствующей группой крыс, после введения фентанила оставленных при комнатной температуре; † — с соответствующей группой крыс без местного охлаждения.
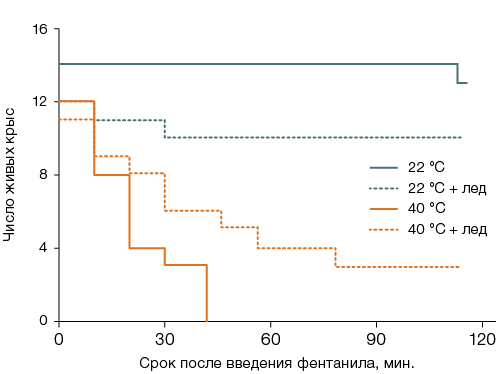
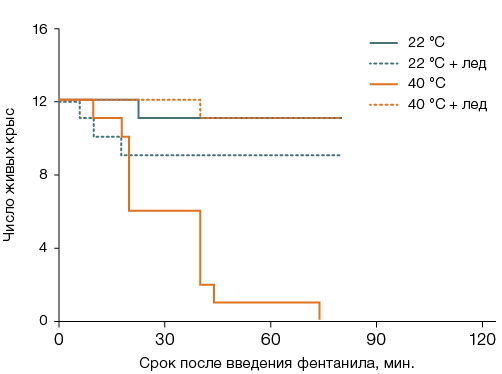
Рисунок подготовлен авторами
Рис. 4. Выживаемость крыс после введения фентанила в дозе 300 мкг/кг и сорокаминутного пребывания при температуре воздуха 22 °С или 40 °С с охлаждением льдом головы (А) или вентральной поверхности туловища (Б)
Примечание: статистически значимое влияние (p < 0,05): общего перегревания без местного охлаждения (А, Б); местного охлаждения при общем перегревании (Б).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Интервал доз фентанила, использованных в настоящей работе, 50–400 мкг/кг, включал в себя ED100 по анальгетической активности для крыс: 75 мкг/кг [6]. При расчете на площадь поверхности тела примененные дозы биоэквивалентны 8–67 мкг/кг для человека. Это в 1–8 раз больше доз, применяемых для нейролептанальгезии, в 2–16 раз больше доз при операциях со спонтанным внешнем дыханием3 и моделирует передозировку наркотического анальгетика опиоидного ряда. Будучи маловероятной в условиях стационара, она возможна при нарушении преемственности оказания помощи раненым на этапах медицинской эвакуации, в том числе и в условиях, способствующих перегреванию организма. У человека, выполняющего легкую физическую работу, перегревание возникает при превышении температуры воздуха 31 °С, измеренной «влажным» термометром [7], что при относительной влажности 48% соответствует 40 °С на «сухом» термометре. Как следует из полученных данных, сорокаминутное пребывание в таких условиях легко переносилось интактными крысами, но резко отягощало токсическое действие на них опиоидов в дозах, нелетальных при тепловом комфорте. Такие данные характеризуют тип взаимодействия нежелательных побочных эффектов опиоида и условий, способствующих перегреванию организма, как потенцирование.
Перегревание животных, помещенных в термокамеру после введения фентанила, возникало вопреки его гипотермическому эффекту, наблюдавшемуся при комнатной температуре [8]. На фоне воздействия фентанила перегреванию организма могло способствовать нарушение теплоотдачи испарением влаги с поверхности тела, которое у крыс гипотетически обеспечивается нанесением на шерстный покров слюны [9]. Наркотизация лишала животных этого терморегуляторного механизма, аналогичного испарению пота у человека. В снижение теплоотдачи могло быть вовлечено и уменьшение испарения влаги с поверхности дыхательных путей вследствие угнетения внешнего дыхания.
Пребывание в термокамере повышало ректальную температуру наркотизированных крыс до уровня 44,5 °С, на 1,5 °С превышавшего порог необратимого тканевого повреждения: 43 °С [10]. Это было достаточным условием их гибели, поскольку без теплового воздействия введение фентанила в равной дозе для большинства животных не было летальным. Обратимые нарушения, такие как повышение проницаемости гематоэнцефалического барьера и влагосодержания головного мозга, возможны и при более низкой температуре тела: 42 °С [10]; с ними могла быть связана атаксия у пробудившихся крыс, после введения фентанила побывавших в термокамере. Таким образом, при отсутствии местного охлаждения тела фактором, исключавшим выживание при температуре воздуха 40 °С на фоне острой интоксикации фентанилом, была гиперпирексия.
При охлаждении вентральной поверхности туловища или головы температура тела 42 °С за время пребывания животных в термокамере не достигалась. Несмотря на то что охлаждение головы предотвращало гиперпирексию во время их пребывания в термокамере, существенного влияния на летальность это не оказало. Вероятные механизмы танатогенеза у таких крыс включали в себя отек и набухание головного мозга, описанные как при тяжелых интоксикациях опиоидами [11], так и при тепловом ударе [12]. Увеличение объема головного мозга в пространстве, ограниченном костями черепа, ведет к повышению внутричерепного давления и уменьшению скорости мозгового кровотока. Этим могла быть обусловлена более низкая охлаждающая эффективность аппликации льда на голову, чем на вентральную поверхность туловища. Такие данные кажутся противоречащими сведениям о высокой скорости кровотока в головном мозгу4, высокой плотности теплового потока с поверхности головы [13] и рекомендациям охлаждать ее при перегревании организма [5][14]. Объяснение этого противоречия возможно в рамках гипотезы о низкой скорости мозгового кровотока, затруднявшей перенос тепла из теплового «ядра» тела к охлаждаемой поверхности neurocranium при острой интоксикации фентанилом на фоне перегревания организма.
Охлаждение средней трети вентральной поверхности туловища оказалось высокоэффективной мерой профилактики перегревания организма вопреки повышенной температуре воздуха и уменьшенной теплоотдаче испарением. Это указывает на объемную скорость кровотока в висцеральной зоне как на достаточную для конвективного переноса к охлаждавшейся поверхности не только избыточного тепла, поступавшего в организм извне, но и высвобождавшегося в ходе метаболических процессов. С учетом этого целесообразно оценить эффективность местного охлаждения живота не только на фоне воздействия опиоидов, но и при изолированном перегревании организма, с внесением при необходимости уточнений в действующий «Стандарт скорой медицинской помощи при тепловом и солнечном ударе». Вместе с тем полученные данные свидетельствуют о нецелесообразности местного охлаждения тела при острой опиоидной интоксикации в комфортных климатических условиях. Вероятно, снижение температуры тела при местном охлаждении на фоне вызываемой фентанилом периферической вазодилатации [15] и его прямого угнетающего действия на потребление кислорода митохондриями [16] угнетало дыхательный центр и углубляло гипоксемию, на которую указывал цианоз глазного дна животных.
Полученные данные позволяют сформулировать гипотезу о механизмах влияния перегревания организма и охлаждения на его фоне висцеральной поверхности туловища на токсическое действие фентанила. Как опиоиды, так и тепловой стресс тормозят пропульсивную функцию желудочно-кишечного тракта, что способствует избыточному росту в нем термофильной микрофлоры и продукции ею токсичных веществ, в том числе аммиака и низших аминов [17]. Образованию этих веществ способствует и сопряженное с активацией фентанилом µ-опиоидных рецепторов накопление жидкости в просвете кишечника, стимулирующее бактериальный рост [18]. Поступление аммиака и низших аминов из желудочно-кишечного химуса в кровь облегчается опосредованным активацией Toll-подобных рецепторов повышением проницаемости кишечного эпителия агонистами µ-опиоидных рецепторов [18]. Дальнейшему переносу аммиака и низших аминов из крови в головной мозг может способствовать метаболический ацидоз, обусловленный перегреванием организма и острой дыхательной недостаточностью. При характерном для него увеличении градиента pH между плазмой крови и цитоплазмой поступление из крови в астроглию аммиака и низших аминов по градиенту концентрации их нейтральных газообразных форм интенсифицируется [19], что должно вести к накоплению в головном мозге свободных аминокислот [20] и его набуханию. Ввиду обратной зависимости между температурой воды и растворимостью в ней газов (в том числе аммиака и низших аминов) такое набухание не может купироваться местным охлаждением головы. Напротив, охлаждение желудочного и кишечного химусов на величину, равную наблюдавшемуся в настоящей работе падению на 11,4 °С температуры тела при аппликации льда на вентральную поверхность туловища, должно снижать метаболическую активность термофильной желудочно-кишечной микрофлоры не менее чем в 2,2 раза, таким образом блокируя механизмы танатогенеза, опосредованные острой кишечной эндотоксемией. Проверка этой гипотезы в ходе дальнейших исследований открывает перспективу новых подходов к патогенетической терапии как острой опиоидной интоксикации, так и теплового удара.
ВЫВОДЫ
- Перегревание организма потенцирует летальное и наркотическое действие фентанила на крыс. Охлаждение в этих условиях вентральной поверхности туловища — эффективная мера предупреждения гипертермии и снижения летальности, а охлаждение головы малоэффективно.
- При комнатной температуре воздуха местное охлаждение как головы, так и вентральной поверхности туловища углубляет вызванную фентанилом гипотермию, существенно не влияя на летальность крыс.
- Полученные данные требуют учета при дальнейшей оценке влияния климатических факторов на переносимость наркотических анальгетиков крупными лабораторными животными и человеком.
1 Приказ МЗ РФ от 20.12.2012 № 1115н «Стандарт скорой медицинской помощи при тепловом и солнечном ударе».
2 Быков ИЮ, Раков АЕ, Сосюкин АЕ, ред. Военно-полевая терапия: национальное руководство. М.: ГЭОТАР-Медиа; 2007.
3 Машковский МД. Лекарственные средства. М.: Новая Волна; 2021.
4 Осипов АП, Ибишов ДФ, Расторгуева СЛ. Физиология кровообращения и лимфообращения. Учебное пособие. Пермь: ИПЦ «Прокростъ»; 2022.
Список литературы
1. Acs A, Schmidt J, Németh Z, Fodor I, Farkas A. Elevated temperature increases the susceptibility of D. magna to environmental mixtures of carbamazepine, tramadol and citalopram. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology. 2025;287:110052. https://doi.org/10.1016/j.cbpc.2024.110052
2. Gordon CJ, Johnstone AFM, Aydin C. Thermal stress and toxicity. Comprehensive Physiology. 2014;4(3):995–1016. https://doi.org/10.1002/cphy.c130046
3. Головко АИ, Ивницкий ЮЮ, Рейнюк ВЛ, Шефер ТВ. Изменения на нелегальном рынке синтетических опиоидов. Наркология. 2024;23(2):54–9. EDN: SEMZIT
4. Березовская ИВ. Прогноз безопасности лекарственных средств в доклинических токсикологических исследованиях. Токсикологический Вестник. 2010;(5):17–22. EDN: TQUNAB
5. Шабалов НП, ред. Педиатрия. СПб.: СпецЛит; 2003. EDN: QLFJWL
6. Getsy PM, May WJ, Young AP, Baby SM, Coffee GA, Bates JN, et al. Tropine exacerbates the ventilator depressant actions of fentanyl in freely-moving rats. Frontiers in Pharmacology. 2024;24:1405461. https://doi.org/10.3389/fphar.2024.1405461
7. Wolf ST, Bernard TE, Kenney WL. Heat exposure limits for young unacclimatized males and females at low and high humidity. Journal of Occupational and Environmental Hygiene. 2022;19(7):415–24. https://doi.org/10.1080/15459624.2022.2076859
8. Canfield JR, Sprague JE. Influence of carbon side chain length on the in vivo pharmacokinetic and pharmacodynamics characteristics of illicitly manufactured fentanyls. Drug Testing and Analyses. 2024;16(10):1113–21. https://doi.org/10.1002/dta.3636
9. Attah AT, Negrón-Moreno PN, Amigo-Duran M, Zhang L, Kenngott M, Brecht M, et al. Sensory cues, behavior and furbased drying in the rat wetness response. Scientific Reports. 2024;14(1):24550. https://doi.org/10.1038/s41598-024-74900-9
10. Yarmolenko PS, Moon EJ, Landon C, Manzoor A, Hochman DW, Viglianti L, et al. Thresholds for thermal damage to normal tissues: an update. International Journal of Hyperthermia. 2011;27(4):320–43. https://doi.org/10.3109/02656736.2010.534527 ORIGINAL ARTICLE | TOXICOLOGY 482 EXTREME MEDICINE | 2025, VOLUME 27, No 4
11. Puszkei A, Malissin I, Cisternino S, Pallet N, Declèves X, Mégarbane B. Massive tramadol ingestion resulting in fatal injury — a pharmacokinetic study with discussion on the involved mechanisms of toxicity. Clinical Toxicology. 2022;60(9):1059–62. https://doi.org/10.1080/15563650.2022.2071286
12. Lee S, Lee SH. Exertional heat stroke with reversible severe cerebral edema. Clinical and Experimental Emergency Medicine. 2021;8(3):242–5. https://doi.org/10.15441/ceem.19.085
13. Alali Z, Eckels SJ. 3D numerical simulations of mixed convective heat transfer and correlation development for a thermal manikin head. Heliyon. 2024;10(9):e30161.
14. Wang J, Jiang C, Kang J, Yu S, Bai G. Head-neck local ventilation mode for long-narrow mine working face. Scientific Reports. 2024;14(1):19663. https://doi.org/10.1038/s41598-024-70739-2
15. Solis E, Cameron-Burr KT, Shaham Y, Kiyatkin EA. Fentanyl-induced brain hypoxia triggers brain hyperglycemia and biphasic changes in brain temperature. Neuropsychopharmacology. 2018;43(4):810–9. https://doi.org/10.1038/npp.2017.181
16. Zamparelli M, Eaton S, Quant PA, McEwan A, Spitz L, Pierro A. Analgesic doses of fentanyl impair oxidative metabolism of neonatal hepatocytes. Journal of Pediatric Surgery. 1999;34(2):260–3. https://doi.org/10.1016/s0022-3468(99)90186-0
17. Ивницкий ЮЮ, Рейнюк ВЛ, Шефер ТВ, Вакуненкова ОА. Острый кишечный эндотоксикоз в медицине экстремальных ситуаций. Кремлевская Медицина. Клинический Вестник. 2024;1:81–6. https://doi.org/10.48612/cgma/1e9k-uttr-7h6a
18. Lacy BE, Cangemi DJ. Opioids and the gastrointestinal tract: the role of peripherally active µ-opioid receptor antagonists in modulating intestinal permeability. American Journal of Gastroenterology. 2024;119(10):1970–8. https://doi.org/10.14309/ajg.0000000000002887
19. Ott P, Vilstrup H. Cerebral effects of ammonia in liver disease: current hypotheses. Metabolic Brain Disease. 2014;29(4):901–11. https://doi.org/10.1007/s11011-014-9494-7
20. Zielinska M, Albrecht J, Popek M. Disregulation of astrocytic glutamine transport in acute hyperammonemic brain edema. Frontiers in Neuroscience. 2022;16:875750. https://doi.org/10.3389/fnins.2022.874750
Об авторах
Ю. Ю. ИвницкийРоссия
Ивницкий Юрий Юрьевич - д-р мед. наук, профессор
Санкт-Петербург
О. А. Вакуненкова
Россия
Вакуненкова Ольга Александровна
Санкт-Петербург
А. И. Головко
Россия
Головко Александр Иванович - д-р мед. наук, профессор
Санкт-Петербург
Н. В. Лапина
Россия
Лапина Наталья Вадимовна - канд. мед. наук
Санкт-Петербург
В. Л. Рейнюк
Россия
Рейнюк Владимир Леонидович - д-р мед. наук
Санкт-Петербург
Дополнительные файлы
Рецензия
Для цитирования:
Ивницкий Ю.Ю., Вакуненкова О.А., Головко А.И., Лапина Н.В., Рейнюк В.Л. Влияние общего перегревания и местного охлаждения на переносимость фентанила крысами. Медицина экстремальных ситуаций. 2025;27(4):475-482. https://doi.org/10.47183/mes.2025-311
For citation:
Ivnitsky J.J., Vakunenkova O.A., Golovko A.I., Lapina N.V., Rejniuk V.L. The effect of general hyperthermia and local cooling on fentanyl tolerance in rats. Extreme Medicine. 2025;27(4):475-482. https://doi.org/10.47183/mes.2025-311

















