Перейти к:
Диагностическая значимость субклинической эпилептиформной активности у пациентов с болезнью Альцгеймера
https://doi.org/10.47183/mes.2025-317
Аннотация
Введение. Высокая распространенность и значительная инвалидизация пациентов с болезнью Альцгеймера (БА) требуют поиска новых маркеров прогрессирования этого заболевания, а также новых подходов к его лечению. В последнее время накапливается все больше сведений о значимости применения электроэнцефалографии у пациентов с БА с целью выявления эпилептиформной активности у данной категории.
Цель. Определение частоты встречаемости эпилептиформной активности у пациентов с БА и оценка ее клинической и диагностической значимости.
Обсуждение. Установлено, что проведение ЭЭГ, особенно продолженной, с включением сна, позволяет выявить субклиническую эпилептиформную активность, которая ассоциирована с более выраженными когнитивными нарушениями и способствует прогрессированию заболевания. В обзоре рассмотрены данные исследований по распространенности и клинической значимости субклинической эпилептиформной активности у пациентов с БА без диагноза «эпилепсия». Также освещены основные патофизиологические механизмы взаимосвязи эпилептиформной активности и прогрессирования когнитивных нарушений в рамках БА. Кроме того, рассматривается вопрос о целесообразности назначения специфической противоэпилептической терапии при выявлении субклинической эпилептиформной активности.
Выводы. Показана высокая клиническая значимость проведения электроэнцефалографии и выявления эпилептиформной активности у пациентов с болезнью Альцгеймера вследствие ее потенциального негативного влияния на прогрессирование когнитивных нарушений и повышения рисков развития эпилептических приступов.
Ключевые слова
Для цитирования:
Бурд С.Г., Боголепова А.Н., Лебедева А.В., Рублёва Ю.В., Коваленко Е.А., Махнович Е.В., Осиновская Н.А., Гилева Е.А., Пантина Н.В., Ковалёва И.И. Диагностическая значимость субклинической эпилептиформной активности у пациентов с болезнью Альцгеймера. Медицина экстремальных ситуаций. 2025;27(4):578-586. https://doi.org/10.47183/mes.2025-317
For citation:
Burd S.G., Bogolepova A.N., Lebedeva A.V., Rubleva Yu.V., Kovalenko E.A., Makhnovich E.V., Osinovskaya N.A., Gileva E.A., Pantina N.V., Kovaleva I.I. Diagnostic significance of subclinical epileptiform activity in patients with alzheimer’s disease. Extreme Medicine. 2025;27(4):578-586. https://doi.org/10.47183/mes.2025-317
ВВЕДЕНИЕ
Болезнь Альцгеймера (БА) — самая частая причина развития деменции и одно из самых распространенных заболеваний пожилого возраста, которым страдают 10–20 млн человек во всем мире [1]. Заболевание сопровождается образованием нейрофибриллярных клубочков и амилоидных бляшек в головном мозге и проявляется прогрессирующими когнитивными нарушениями. Ежегодные прямые и косвенные затраты, связанные с этим заболеванием, достигают 100 млрд долларов, что делает поиск новых диагностических и терапевтических методик крайне актуальным. Прогнозируется, что замедление развития болезни на 5 лет может привести к сокращению расходов на медицинскую помощь в связи с БА в 2 раза [2–5].
Несмотря на значительные возможности лабораторной и генетической диагностики, наличие современных методов нейровизуализации (магнитно-резонансная томография (МРТ) головного мозга с морфометрией, позитронно-эмиссионная томография), диагностика заболеваний, обусловливающих деменцию, вызывает сложности и часто недоступна из-за стоимости обследований. В настоящее время электроэнцефалография (ЭЭГ) не входит в стандарт обследования пациентов с деменцией, в том числе пациентов с БА. Однако во многих литературных источниках представлены данные о том, что у пациентов с БА при записи электроэнцефалограммы может регистрироваться патологическая активность мозга (например, замедление основного ритма или эпилептиформная активность), которая может усугублять прогрессирование когнитивных нарушений и повышать риски развития эпилептических приступов, что еще больше дезадаптирует больных с БА [6][7].
ЭЭГ с применением функциональных проб — простой метод диагностики, позволяющий оценить состояние биоэлектрической активности головного мозга. Неэпилептиформная патологическая активность, такая как тета- или дельта-замедление (региональное/диффузное) биоэлектрической активности головного мозга, — частая находка при данном исследовании у пациентов с БА, которую можно выявить при проведении рутинной ЭЭГ [6]. Имеются данные, свидетельствующие о том, что повышенная относительная мощность тета-колебаний может быть ранним изменением, предшествующим деменции, и может служить важным биомаркером прогрессирования заболевания [8][9].
Более высокую значимость имеет выявление эпилептиформной активности у пациентов с БА. Однако в отношении регистрации эпилептиформной активности проведения рутинной ЭЭГ часто недостаточно, т.к. даже при наличии у пациентов с БА эпилептических приступов около 85% стандартных записей ЭЭГ не выявляют эпилептиформной активности [10]. Это подчеркивает необходимость использования более чувствительных методов, таких как продолженный видео-ЭЭГ-мониторинг с включением сна, магнитоэнцефалография (МЭГ), инвазивная установка электродов через овальное отверстие для выявления данной патологической активности [10]. Некоторыми авторами подчеркивается более широкая распространенность эпилептиформной активности у пациентов с БА, чем у лиц здоровой популяции, а также ее значимость в прогрессировании когнитивных нарушений при нейродегенеративном заболевании. Таким образом, данная патологическая активность может являться перспективной мишенью воздействия при лечении когнитивных нарушений при БА.
Цель исследования — выявление частоты встречаемости эпилептиформной активности у пациентов с БА и верификация ее клинической значимости.
МАТЕРИАЛЫ И МЕТОДЫ
Поиск научной литературы выполнен в электронных библиографических базах данных на русском (eLibrary, CyberLeninka) и английском (PubМed, Google Scholar) языках. Поисковые запросы включали в себя слова или их комбинации: болезнь Альцгеймера, электроэнцефалография, видео-ЭЭГ-мониторинг, субклиническая эпилептиформная активность (Alzheimer disease, electroencephalography, video-EEG monitoring, subclinical epileptiform activity).
Критериями включения публикаций для анализа были литературные систематические обзоры и метаанализы с данными о распространенности субклинической эпилептиформной активности при БА, патофизиологии ее возникновения и взаимосвязи нейродегенеративного процесса, эпилептиформной активности и когнитивных нарушений. Критериями невключения были опубликованные теоретические модели, тезисы, материалы конференций. Проанализировано 52 литературных источника с 1998 по 2024 г.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Субклиническая эпилептиформная активность (СЭА) у пациентов с БА
СЭА принято называть эпилептиформную активность, регистрируемую у пациентов на ЭЭГ, без эпилептических приступов в анамнезе. По данным научных исследований, информация о распространенности и диагностической значимости эпилептиформной активности у пациентов с БА ограничена и противоречива. В опубликованных работах наблюдается значительная вариабельность данных (от 2 до 54%) о распространенности СЭА среди пациентов с диагнозом БА, что, вероятно, связано с существенными различиями в методологии проводимых исследований (табл.) [11].
Таблица. Распространенность субклинической эпилептиформной активности у пациентов с болезнью Альцгеймера
№ | Источник | Степень когнитивного снижения | Количество человек | Частота встречаемости СЭА, % | Индекс эпилептиформной активности | Локализация СЭА | Тип ЭЭГ |
1 | V. Brunetti и соавт.[13] | БА УКН ГК | 50 50 50 | БА – 6,38; УКН – 11,63; ГК – 4,43 | 0,015–0,025/час | Нет данных | НВЭМ + ПСГ + МЭГ |
2 | K.A. Vossel и соавт. [14] | БА + УКН | 113 | 6 | Нет данных | Нет данных | Рутинная ЭЭГ |
3 | M. Liedorp и соавт.[15] | БА УКН Др. деменции | 510 225 193 | 2 БА; 2 УКН; 1 др. деменция | Нет данных | Нет данных | 30-минутная ЭЭГ |
4 | K.A. Vossel и соавт. [16] | БА ГК | 33 19 | 42,4 БА; 10,5 ГК | 0,03–5,18/час | 9,9% бодрствование; 25,7% N1, 64,4% N2–N3; 43% левый висок; 29% левая центральная область; 14% правая лобная область; 14% бифронтотемпорально | Ночная ПСГ + МЭГ |
5 | A.A. Horvath и соавт. [17] | БА | 42 | 28 | Нет данных | Нет данных | 24 часа ЭЭГ |
6 | A.A. Horvath и соавт. [18] | БА ГК | 52 20 | 54 БА; 25 ГК | 0,29–6,68/час | 8% бодрствование; 23% N1, 21% N2, 34% N3; 4% REM; 52% левый висок; 22% правый висок; 26% битемпорально; 3% бипариетально; 3% правая лобная область; 9% бифронтально | 24 часа ЭЭГ |
7 | A.D. Lam и соавт. [19] | БА ГК | 41 43 | 22 БА; 4,7 ГК | 1,5–3/день | 20% N1, 80% N2; 85,7% левая височная область; 28,6% бифронтально | 24 часа ЭЭГ |
8 | C. Babiloni и соавт. [20] | БА с УКН; УКН без БА | 56 32 | Нет данных БА + УКН; 41 УКН без БА | Нет данных | Нет данных | Рутинная ЭЭГ |
9 | A. Nous и соавт. [11] | БА с деменцией; БА с УКН; БА доклиническая стадия | 49 | 31 среди всех пациентов с БА; 50 при деменции; 27 при УКН; 25 на доклинической стадии | Количество спайков за 50 мин: Продолженная ЭЭГ: 0,19 спайка/мин; 50-мин МЭГ: 64,5 спайка/мин; Высокоплотная ЭЭГ: 3 спайка/мин | Лобно-височные отделы (чаще слева). Единичные случаи: центральная область, бифронтотемпорально, битемпорально, правая теменная, правая височная, правая лобная области. Чаще 1-я и 2-я стадии сна | Продолженная ЭЭГ, и/или 50-мин МЭГ, и/или 50-мин высокоплотная ЭЭГ |
Таблица составлена авторами по данным источников [11][13–20]
Примечание: УКН — умеренные когнитивные нарушения; ГК — группа контроля здоровых; СЭА — субклиническая эпилептиформная активность; ЭЭГ — электроэнцефалография; НВЭМ — ночной видео-ЭЭГ-мониторинг, МЭГ — магнитоэнцефалография; ПСГ — полисомнография; N1 — 1-я стадия сна; N2 — 2-я стадия сна; N3 — 3-я стадия сна; REM — сон с быстрым движением глаз.
Наличие эпилептиформной активности может усугублять прогрессирование когнитивных нарушений у пациентов с БА. Более того, ее регистрация может являться маркером потенциального развития эпилептических приступов. Так, J.Q. Kang; M.F. Mendez и соавт. представили данные о том, что эпилепсия развивается в среднем у 10–22% пациентов с БА [7][12].
В исследовании M. Liedorp и соавт. [15], посвященном изучению распространенности и значимости эпилептиформных разрядов у пациентов с различными типами деменций, было установлено, что эпилептиформная активность (преимущественно региональная в височных областях) на рутинной 30-мин ЭЭГ была обнаружена только у 2% пациентов с БА, УКН (умеренными когнитивными нарушениями) и у 1% пациентов с другими типами деменций, что аналогично показателям в общей популяции. И только у 10% пациентов с деменцией с эпилептиформной активностью на ЭЭГ развились приступы в дальнейшем в течение болезни [15].
Низкая выявляемость эпилептиформной активности у пациентов с БА побудила исследователей применять дополнительные ЭЭГ-электроды foramen ovale для ее идентификации. Так, исследование A.D. Lam и соавт. с использованием электродов foramen ovale показало, что субклиническая эпилептиформная активность, преобладающая во время сна (влияет на консолидацию памяти), может быть обнаружена на ранних стадиях течения БА при отсутствии изменений на обычной скальповой ЭЭГ [21]. Это подчеркивает необходимость проведения более масштабных исследований ЭЭГ с использованием дополнительных методик, включая запись через foramen ovale, для определения диагностической ценности ЭЭГ в клинической практике.
По данным ряда исследований, была выявлена значительная распространенность регистрации СЭА у пациентов с БА, что, вероятно, связано с применением продолженного видео-ЭЭГ-мониторинга с включением сна. В последнее время все больше внимания уделяется наличию СЭА у пациентов с БА в связи с тем, что имеются данные о более выраженном снижении когнитивных функций и более быстром прогрессировании заболевания у пациентов с СЭА, чем у пациентов без нее [16][18][22][23].
Так, по данным A.A. Horvath и соавт., субклинические эпилептиформные разряды регистрировались значительно чаще у пациентов с БА (54%) среди 52 человек, чем у здоровых пожилых людей сопоставимого возраста (25%) [18]. СЭА выявляли преимущественно в височных областях, преимущественно слева, реже встречались битемпоральная и правовисочная эпилептиформная активность. Подавляющее большинство эпизодов СЭА возникали во время сна, наиболее часто регистрировались во время 2-й и 3-й стадий сна, тогда как меньшее количество спайков было обнаружено в 1-й стадии сна. При этом наличие СЭА было сопряжено с более выраженными когнитивными нарушениями. В исследовании A.A. Horvath и соавт. показано, что у больных с БА в сочетании с СЭА снижение когнитивных показателей за период наблюдения (3 года) происходило в 1,5 раза быстрее, чем у пациентов без эпилептиформной активности [18]. По данным K.A. Vossel и соавт., эпилептиформная активность была выявлена у 42,4% пациентов с БА и лишь у 10,5% лиц контрольной группы соответствующего возраста без когнитивных нарушений [16]. Отмечено, что у пациентов с СЭА быстрее снижались показатели исполнительных функций глобального познания, определяемые с помощью теста MMSE (краткая шкала оценки психического статуса), в среднем на 3,9 балла/год против 1,6 балла/год у пациентов без СЭА [16].
A. Nous и соавт. исследовали пациентов с различными стадиями БА (доклиническая, УКН, деменция) посредством различных методик: продолженная ЭЭГ, 50-мин МЭГ, ЭЭГ высокой плотности [11]. Так, распространенность СЭА у таких больных составила 31% по сравнению с контрольной группой (8%) без когнитивной дисфункции, с увеличением частоты встречаемости при прогрессировании заболевания: в 50% случаев при развитии деменции, у 27% при УКН и у 25% на доклинической стадии БА. Хотя применение МЭГ не привело к более частому выявлению СЭА при БА по сравнению с продолженной ЭЭГ и ЭЭГ высокой плотности, МЭГ значительно превосходила другие методы по частоте выявления спайков за 50 мин (индекс представленности эпилептиформной активности). Кроме того, обнаружено, что у пациентов с БА наличие СЭА было ассоциировано с более выраженными нарушениями зрительно-пространственных функций и внимания, а также с относительно бóльшим объемом левой лобной, левой височной и энторинальной коры, чем у пациентов без эпилептиформной активности [11].
Патофизиологические механизмы взаимосвязи эпилептиформной активности, нейродегенеративного процесса и когнитивных нарушений при БА
Некоторые авторы рассматривают эпилептиформную активность как часть патофизиологических механизмов, которые приводят к когнитивным нарушениям при БА. Предполагаемые механизмы включают скомпрометированную глутаматергическую систему, вызванную эксайтотоксичностью нейродегенерацию, ускоренное отложение амилоида и отложение тау-протеина под влиянием эпилептиформных разрядов, ремоделирование из-за повышенной возбудимости, приводящей к разъединению функциональных сетей и изменениям структуры сна [23].
Существует гипотеза, описывающая порочный круг, в котором молекулярные изменения при БА способствуют гипервозбудимости нейронов [24], что, в свою очередь, усугубляет нейродегенеративный процесс при БА [25]. Сообщается, что при БА растворимый олигомерный Aβ (амилоид-бета), а не бляшки Aβ, является основной причиной нейрональной гипервозбудимости [24]. Так, было обнаружено, что Aβ1-42 (наиболее токсичная форма растворимых пептидов Aβ) повышает нейрональную возбудимость путем селективного ингибирования токов K+ [26]. Описано, что под действием Aβ у пациентов с болезнью Альцгеймера происходит нарушение обратного захвата нейронального и глиального глутамата, что приводит к эксайтотоксичности. Аналогичным образом эксайтотоксичность глутамата также усугубляется влиянием Aβ на функцию рецептора N-метил-D-аспартата (NMDA-R) [27]. Существует предположение, что активация холинергических рецепторов и Ca2+-каналов под действием Aβ может вызвать раннюю субклиническую эпилептическую активность, предшествующую клинической болезни Альцгеймера [28]. Кроме того, показано, что бета-секретаза 1 (BACE1 — один из основных белков, участвующих в формировании Aβ) расщепляет субъединицы β2 и β4 потенциал-зависимого канала Na+ [24]. Расщепление β2 изменяет транскрипцию и экспрессию рецептора на поверхности клетки [21]; расщепление β4 значительно увеличивает внутриклеточные уровни Na+ [26]; оба процесса приводят к общей нейрональной гипервозбудимости, что может способствовать развитию эпилептических приступов.
Как при эпилепсии, так и при болезни Альцгеймера описана роль нейровоспаления, вызванного Aβ, которое характеризуется индукцией иммунной реакции в ЦНС в ответ на патологический процесс [29]. Воспаление в ЦНС опосредовано в основном микроглией, астроцитами и олигодендроцитами [30]. Глиальная активация Aβ приводит к высвобождению многочисленных провоспалительных цитокинов (например, TNF-α, IL-6 или IL-1β), что вызывает генерализованное нейровоспаление. Этот процесс, в свою очередь, способствует нейротоксическим эффектам, которые в конечном счете приводят к появлению нейрональной гипервозбудимости, усиливая процесс нейродегенерации [24]. Также было описано, что провоспалительные цитокины, такие как IL-1β, увеличивают нейрональную гипервозбудимость за счет усиления высвобождения глутамата астроцитами и снижения его обратного захвата [31] или путем повышения регуляции NMDA-R, увеличивающей внутриклеточный приток Ca2+ [32].
Отдельная роль в эпилептогенезе при БА отводится тау-протеину с учетом того, что данный белок является одним из ведущих медиаторов эпилептогенных механизмов Aβ [33]. Белок тау способствует нейрональной эксайтотоксичности за счет увеличения внеклеточного глутамата и дисфункции NMDA-R [34]. Тау-протеин также связан с аномальной миграцией нейронов в гиппокампе — структуре головного мозга, которая тесно ассоциирована с развитием эпилепсии [35][36]. Кроме того, на животных моделях эпилептогенеза было обнаружено снижение активности фермента фосфатазы 2A, что приводит к увеличению p-тау в эпилептогенных областях мозга [37].
Также известно о связи нейростероида аллопрегнанолона и развития болезни Альцгеймера [38]. Некоторыми авторами получены данные о снижении уровня аллопрегнанолона в плазме и мозге в префронтальной коре у пациентов с болезнью Альцгеймера. Снижение уровня аллопрегнанолона приводит к снижению нейропротекции, активации астроцитов и микроглии, что, в свою очередь, способствует производству нейротоксичных цитокинов, хемокинов и реактивных форм кислорода и азота. Эти механизмы приводят к прогрессированию нейродегенеративного заболевания и гипервозбудимости нейронов [38].
Основные звенья патогенетической взаимосвязи эпилептиформной активности и нейродегенеративного процесса представлены на рисунке. Повышение активности глутаматергической системы при БА вызывает повышенную экспрессию AMPA-рецепторов и мобилизацию внутриклеточного кальция. Повышение уровня внутриклеточного кальция приводит к высвобождению амилоидных олигомеров во внеклеточное пространство и усилению фосфорилирования тау-олигомеров (красные стрелки). Повышенное возбуждение нейронов, представленное эпилептическими разрядами, также является следствием связанной с глутаматом повышенной возбудимости. С другой стороны, накопление амилоидных бляшек и тау-нейрофибрилл изменяет экспрессию глутаматных рецепторов и вызывает избыточное высвобождение глутамата из микроглиальных клеток и астроцитов (зеленые стрелки). Двунаправленная патологическая взаимосвязь может привести к прогрессирующей нейродегенерации (черные стрелки), чем, как правило, сопровождаются когнитивные нарушения [23].
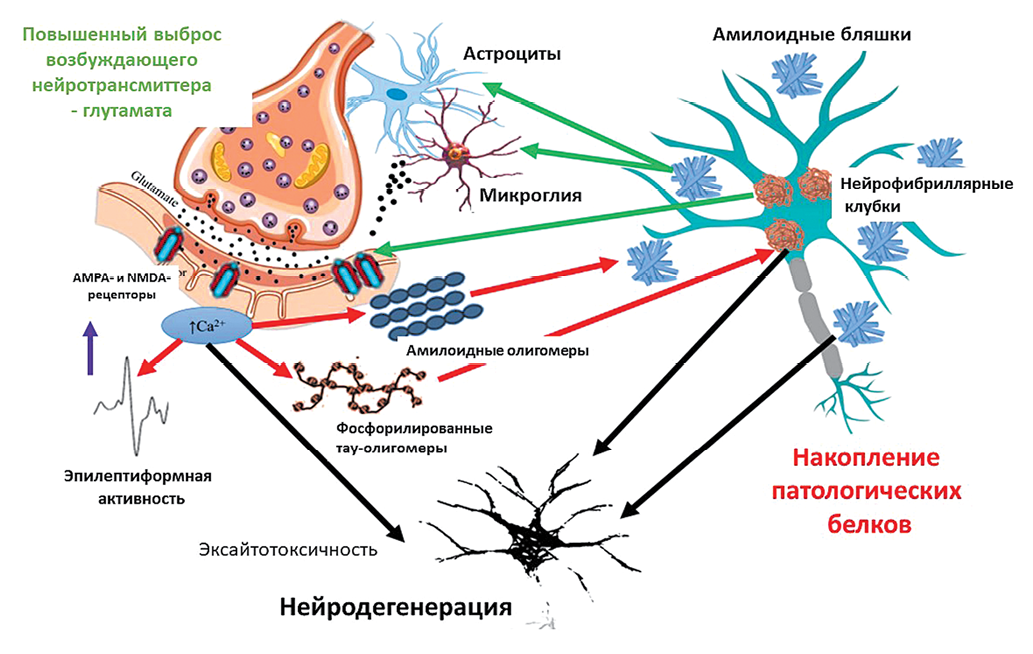
Рисунок подготовлен авторами по данным [23], лицензия CC BY
Рис. Порочный круг глутамат-опосредованной гипервозбудимости и накопления патологических белков при когнитивных нарушениях при болезни Альцгеймера
Большая роль также уделяется патологическому ремоделированию гиппокампо-кортикальных связей при наличии эпилептиформной активности. В результате эпилептиформной активности локальные внутригиппокампальные связи увеличиваются, а сила и количество отдаленных связей уменьшаются. Ремоделирование данных нейронных сетей приводит к относительной изоляции гиппокампа от коры, снижая функционирование гиппокампо-кортикальных связей [23].
Более того, наличие эпилептиформной активности приводит к дезорганизации физиологических паттернов сна и нарушению процесса консолидации памяти. Таламические сонные веретена с частотой 12–16 Гц являются важнейшими элементами формирования памяти, синхронизируя гиппокампальную активность с нейронами коры головного мозга. Медленные волны, связанные с кортикальным сном, обеспечивают наивысшее состояние синхронизации, способствующее активации гиппокампальной активности и таламических сонных веретен. Эпилептиформная активность способствует трансформации гиппокампальной активности, дезорганизации архитектуры сонных веретен, уменьшению кортикальных медленных волн из-за гиперполяризации коры; указанные изменения снижают эффективность процесса консолидации памяти [23].
Терапия субклинической эпилептиформной активности как альтернативный подход к лечению БА
Учитывая существующую концепцию о потенциации СЭА патофизиологических механизмов, которые способствуют прогрессированию когнитивных нарушений при БА, некоторые авторы предлагают терапевтические подходы к лечению пациентов с БА и СЭА, например назначают противоэпилептическую терапию (ПЭП).
Существует широкий спектр ПЭП, однако, учитывая отрицательный эффект большинства из них на когнитивные функции и память, выбор ПЭП у таких пациентов ограничен.
По данным многочисленных исследований, посвященных влиянию ПЭП на когнитивные функции у пациентов с эпилепсией, известно, что ряд препаратов имеет так называемый «прокогнитивный» эффект: например, таким препаратом является леветирацетам. В связи с потенциально благоприятным влиянием леветирацетама на когнитивные функции большинство исследований, направленных на лечение СЭА и эпилепсии у пациентов с БА, изучает именно этот лекарственный препарат [14][39–44]. В эксперименте было показано, что леветирацетам модулирует гипервозбудимость нейронов, снижает количество амилоидных бляшек, регулирует нейротрофические факторы [39][45]. Известно, что у пациентов с БА в сочетании с эпилептиформной активностью быстрее ухудшаются когнитивные функции, чем у пациентов без эпиактивности. Так, K.A. Vossel и соавт. изучали влияние леветирацетама на различные домены когнитивных функций в группе из 34 участников с БА. В результате анализа было показано, что в группе пациентов с наличием эпиприступов или СЭА применение леветирацетама привело к положительной динамике показателей в тестах на исполнительную функцию и зрительно-пространственную память [46].
Ламотриджин, который не обладает негативным эффектом в отношении когнитивных функций, также может рассматриваться к применению у пациентов с БА и наличием СЭА [12][45][47–50]. Ламотриджин препятствует скоплению внеклеточного β-амилоида, подавляет глутаматную эксайтотоксичность, таким образом оказывая нейропротекторные свойства [51][52]. Исследование S. Tekin и соавт. пациентов с БА без эпилепсии показало, что применение ламотриджина в дозе 300 мг/сут на протяжении 8 недель оказывало положительный эффект на когнитивные показатели (в реализации задач на распознавание и называние предмета и соотнесения названия с предметом) и настроение [52]. Однако в настоящее время нет четких клинических рекомендаций по назначению противоэпилептической терапии пациентам с БА с наличием СЭА без приступов, что требует дальнейшего изучения.
ЗАКЛЮЧЕНИЕ
Представленные данные свидетельствуют о высокой клинической значимости проведения электроэнцефалографии и выявления эпилептиформной активности у пациентов с болезнью Альцгеймера вследствие ее потенциального негативного влияния на прогрессирование когнитивных нарушений и повышения рисков развития эпилептических приступов у таких больных. Частота встречаемости СЭА у пациентов с БА может варьировать (2–54%) в зависимости от продолжительности записи ЭЭГ, включения сна, а также использования дополнительных методик (МЭГ, электроды овального окна). Большинство литературных данных подчеркивают более частую встречаемость СЭА у пациентов с БА, чем у пациентов с деменцией другого типа или здоровых людей аналогичного возраста. Патофизиологические механизмы подчеркивают общие этиопатогенетические звенья прогрессирования БА и формирования гипервозбудимости нейронов головного мозга, что сопряжено с появлением на ЭЭГ эпилептиформной активности. Применение ПЭП для терапии СЭА может стать новой стратегией лечения пациентов с БА не только как средство профилактики развития эпилептических приступов, но и в терапии когнитивных нарушений. Однако целесообразность лечения субклинической эпилептиформной активности у пациентов с болезнью Альцгеймера остается вопросом дальнейшего изучения.
Список литературы
1. Левин ОС. Диагностика и лечение когнитивных нарушений и деменции в клинической практике. 3-е изд. М.: МЕДпресс-информ; 2023.
2. Prince M, Wimo A, Guerchet M, Ali GC, Wu YuT, Prina M. World Alzheimer Report, 2015. The Global Impact of Dementia: An analysis of prevalence, incidence, cost and trends. London: ADI; 2015.
3. Белоусов ЮБ, Зырянов СК, Белоусов ДЮ, Бекетов АС. Клинико-экономические аспекты терапии болезни Альцгеймера в России. Качественная Клиническая Практика. 2018;1:3–28.
4. Hurd MD, Martorell P, Delavande A, Mullen KJ, Langa KM. Monetary costs of dementia in the United States. The New England Journal of Medicine. 2013;68(14):1326–34. https://doi.org/doi:10.1056/nejmsa1204629
5. Коберская НН. Болезнь Альцгеймера. Неврология, Нейропсихиатрия, Психосоматика. 2019;11(3S):52–60. https://doi.org/10.14412/2074-2711-2019-3S-52-60
6. Babiloni C, Carducci F, Lizio R, Vecchio F, Baglieri A, Bernardini S, et al. Resting state cortical electroencephalographic rhythms are related to gray matter volume in subjects with mild cognitive impairment and Alzheimer’s disease. Human Brain Mapping. 2013;34(6):1427–46. https://doi.org/doi:10.1002/hbm.22005
7. Kang JQ. Epileptic mechanisms shared by Alzheimer’s disease: Viewed via the unique lens of genetic epilepsy. International Journal of Molecular Sciences. 2021;22(13):7133. https://doi.org/10.3390/ijms22137133
8. Musaeus CS, Engedal K, Høgh P, Jelic V, Mørup M, Nail M, et al. EEG theta power is an early marker of cognitive decline in dementia due to Alzheimer’s disease. Journal of Alzheimer’s Disease. 2018;64(4):1359–71. https://doi.org/10.3233/jad-180300
9. Cretin B, Bousiges O, Hautecloque G, Philippi N, Blanc F, Dibitonto L, et al. CSF in epileptic prodromal Alzheimer’s disease: No diagnostic contribution but a pathophysiological one. Frontiers in Neurology. 2021;12:623777. https://doi.org/10.3389/fneur.2021.623777
10. Csernus EA, Werber T, Kamondi A, Horvath AA. The significance of subclinical epileptiform activity in Alzheimer’s disease: A review. Frontiers in Neurology. 2022;13:856500. https://doi.org/10.3389/fneur.2022.856500
11. Nous A, Seynaeve L, Feys O, Wens V, de Tiege X, van Mierlo P, et al. Subclinical epileptiform activity in the Alzheimer continuum: association with disease, cognition and detection method. Alzheimer’s Research and Therapy. 2024;16(1):19. https://doi.org/10.1186/s13195-023-01373-9
12. Mendez MF, Lim GTH. Seizures in elderly patients with dementia. Drugs and Aging. 2003;20(11):791–803. https://doi.org/10.2165/00002512-200320110-00001
13. Brunetti V, D’Atri A, Della Marca G, Vollono C, Marra C, Vita MG, et al. Subclinical epileptiform activity during sleep in Alzheimer’s disease and mild cognitive impairment. Clinical Neurophysiology. 2020;131(5):1011–8. https://doi.org/10.1016/j.clinph.2020.02.015
14. Vossel KA, Beagle AJ, Rabinovici GD, Shu H, Lee SE, Nassan G, et al. Seizures and epileptiform activity in the early stages of Alzheimer disease. JAMA Neurology. 2013;70(9):1158–66. https://doi.org/10.1001/jamaneurol.2013.136
15. Liedorp M, Stam CJ, van der Flier WM, Pijenburg YAL, Scheltens P. Prevalence and clinical significance of epileptiform EEG discharges in a large memory clinic cohort. Dementia and Geriatric Cognitive Disorders. 2010;29(5):432–7. https://doi.org/10.1159/000278620
16. Vossel KA, Ranasinghe KG, Beagle AJ, Mizuiri D, Honma SM, Dowling AF, et al. Incidence and impact of subclinical epileptiform activity in Alzheimer’s disease. Annals of Neurology. 2016;80(6):858–70. https://doi.org/10.1002/ana.24794
17. Horváth A, Szűcs A, Hidasi Z, Csukly G, Barcs G, Kamondi A. Prevalence, semiology, and risk factors of epilepsy in Alzheimer’s disease: An ambulatory EEG study. Journal of Alzheimer’s Disease. 2018;63(3):1045–54. https://doi.org/10.3233/JAD-170925
18. Horvath AA, Papp A, Zsuffa J, Szucs A, Luckl J, Radai F, et al. Subclinical epileptiform activity accelerates the progression of Alzheimer’s disease: A long-term EEG study. Clinical Neurophysiology. 2021;132(8):1982–9. https://doi.org/10.1016/j.clinph.2021.03.050
19. Lam AD, Sarkis RA, Pellerin KR, Jing J, Dworetzky BA, Hoch DB, et al. Association of epileptiform abnormalities and seizures in Alzheimer disease. Neurology. 2020;95(16):e2259–70. https://doi.org/10.1212/WNL.0000000000010612
20. Babiloni C, Noce G, Di Bonaventura C, Lizio R, Pascarelli MT, Tucci F, et al. Abnormalities of cortical sources of resting state delta electroencephalographic rhythms ere related to epileptiform activity in patients with amnesic mild cognitive impairment not due to Alzheimer’s disease. Frontiers in Neurology. 2020;11:514136. https://doi.org/10.3389/fneur.2020.514136
21. Lam AD, Deck G, Goldman A, Eskandar EN, Noebels J, Cole AJ. Silent hippocampal seizures and spikes identified by foramen ovale electrodes in Alzheimer’s disease. Nature Medicine. 2017;23(6):678–80. https://doi.org/10.1038/nm.4330
22. Ung H, Cazares C, Nanivadekar A, Kini L, Wagenaar J, Becker D, et al. Interictal epileptiform activity outside the seizure onset zone impacts cognition. Brain. 2017;140(8):2157–68. https://doi.org/10.1093/brain/awx143
23. Horvath AA, Csernus EA, Lality S, Kaminski RM, Kamondi A. Inhibiting epileptiform activity in cognitive disorders: possibilities for a novel therapeutic approach. Frontiers in Neuroscience. 2020;14:557416. https://doi.org/10.3389/fnins.2020.557416
24. Giorgi FS, Saccaro LF, Busceti CL, Biagioni F, Fornai F. Epilepsy and Alzheimer’s disease: potential mechanisms for an association. Brain Research Bulletin. 2020;160:107–20. https://doi.org/10.1016/j.brainresbull.2020.04.009
25. Vossel KA, Tartaglia MC, Nygaard HB, Zeman AZ, Miller BL. Epileptic activity in Alzheimer’s disease: causes and clinical relevance. The Lancet Neurology. 2017;16(4):311–22. https://doi.org/10.1016/S1474-4422(17)30044-3
26. Ye CP, Selkoe DJ, Hartley DM. Protofibrils of amyloid β-protein inhibit specific K+ currents in neocortical cultures. Neurobiology of Disease. 2003;13(3):177–90. https://doi.org/10.1016/s0969-9961(03)00068-8
27. Lei M, Xu H, Li Z, Wang Z, O’Malley TT, Zhang D, et al. Soluble Aβ oligomers impair hippocampal LTP by disrupting glutamatergic/GABAergic balance. Neurobiology of Disease. 2016;85:111–21. https://doi.org/10.1016/j.nbd.2015.10.019
28. Kam K, Duffy ÁM, Moretto J, LaFrancois J, Scharfman HE. Interictal spikes during sleep are an early defect in the Tg2576 mouse model of β-amyloid neuropathology. Scientific Reports. 2016;6:20119. https://doi.org/10.1038/srep20119
29. Calsolaro V, Edison P. Neuroinflammation in Alzheimer’s disease: Current evidence and future directions. Alzheimer’s and Dementia. 2016;12(6):719–32. https://doi.org/10.1016/j.jalz.2016.02.010
30. Regen F, Hellmann-Regen J, Costantini E, Reale M. Neuroinflammation and Alzheimer’s disease: implications for microglial activation. Current Alzheimer Research. 2017;14(11):1140–8. https://doi.org/10.2174/1567205014666170203141717
31. Vezzani A, Friedman A, Dingledine RJ. The role of inflammation in epileptogenesis. Neuropharmacology. 2013;69:16–24. https://doi.org/10.1016/j.neuropharm.2012.04.004
32. Postnikova TY, Zubareva OE, Kovalenko AA, Kim KK, Magazinik LG, Zaitsev AV. Status epilepticus impairs synaptic plasticity in rat hippocampus and is followed by changes in expression of NMDA receptors. Biochemistry. 2017;82(3):282–90. https://doi.org/10.1134/S0006297917030063
33. Roberson ED, Scearce-Levie K, Palop JJ, Fengrong Y, Cheng IH, Wu T, et al. Reducing endogenous tau ameliorates amyloid beta-induced deficits in an Alzheimer’s disease mouse model. Science. 2007;316(5825):750–4. https://doi.org/10.1126/science.1141736
34. Decker JM, Krüger L, Sydow A, Dennissen FJA, Siskova Z, Mandelkow E, et al. The Tau/A152T mutation, a risk factor for frontotemporal-spectrum disorders, leads to NR2B receptormediated excitotoxicity. EMBO Reports. 2016;17(4):552–69. https://doi.org/10.15252/embr.201541439
35. Tian FF, Zeng C, Ma YF, Guo TH, Chen JM, Cai XF, et al. Potential roles of Cdk5/p35 and tau protein in hippocampal mossy fiber sprouting in the PTZ kindling model. Clinical Laboratory. 2010;56(3–4):127–36.
36. Thom M, Liu JYW, Thompson P, Pladke R, Narkiewicz M, Martinian L, et al. Neurofibrillary tangle pathology and Braak staging in chronic epilepsy in relation to traumatic brain injury and hippocampal sclerosis: a post-mortem study. Brain. 2011;134(10):2969–81. https://doi.org/10.1093/brain/awr209
37. Liu SJ, Zheng P, Wright DK, Deszi G, Braine E, Nguen T, et al. Sodium selenate retards epileptogenesis in acquired epilepsy models reversing changes in protein phosphatase 2A and hyperphosphorylated tau. Brain. 2016;139(7):1919–38. https://doi.org/10.1093/brain/aww116
38. Luchetti S, Huitinga I, Swaab DF. Neurosteroid and GABA-A receptor alterations in Alzheimer’s disease, Parkinson’s disease and multiple sclerosis. Neuroscience. 2011;191:6–21. https://doi.org/10.1016/j.neuroscience.2011.04.010
39. Sanchez PE, Zhu L, Verret L, Vossel KA, Orr AG, Cirrito JR, et al. Levetiracetam suppresses neuronal network dysfunction and reverses synaptic and cognitive deficits in an Alzheimer’s disease model. PNAS. 2012;109(42):E2895–903. https://doi.org/10.1073/pnas.1121081109
40. Corbett BF, You JC, Zhang X, Pyfer MS, Tosi U, Iaskone DM, et al. ∆FosB regulates gene expression and cognitive dysfunction in a mouse model of Alzheimer’s disease. Cell Reports. 2017;20(2):344355. https://doi.org/10.1016/j.celrep.2017.06.040
41. Shi JQ, Wang BR, Tian YY, Xu J, Gao L, Zhao SL, et al. Antiepileptics topiramate and levetiracetam alleviate behavioral deficits and reduce neuropathology in APPswe/PS1dE9 transgenic mice. CNS Neuroscience and Therapeutics. 2013;19(11):871–81. https://doi.org/10.1111/cns.12144
42. Nygaard HB, Kaufman AC, Sekine-Konno T, Huh LL, Going H, Feldman SJ, et al. Brivaracetam, but not ethosuximide, reverses memory impairments in an Alzheimer’s disease mouse model. Alzheimer’s Research and Therapy. 2015;7(1):25. https://doi.org/10.1186/s13195-015-0110-9
43. Fu CH, Iascone DM, Petrof I, Hazra A, Zhang X, Pyfer MS, et al. Early seizure activity accelerates depletion of hippocampal neural stem cells and impairs spatial discrimination in an Alzheimer’s disease model. Cell Reports. 2019;27(13):3741–51. https://doi.org/10.1016/j.celrep.2019.05.101
44. Cumbo E, Ligori LD. Levetiracetam, lamotrigine, and phenobarbital in patients with epileptic seizures and Alzheimer’s disease. Epilepsy and Behavior. 2010;17(4):461–6. https://doi.org/10.1016/j.yebeh.2010.01.015
45. Horváth A, Szűcs A, Barcs G, Noebels JL, Kamondi A. Epileptic seizures in Alzheimer disease: A review. Alzheimer Disease and Associated Disorders. 2016;30(2):186–92. https://doi.org/10.1097/WAD.0000000000000134
46. Vossel K, Ranasinghe KG, Beagle AJ, La A, Pook KA, Castro M, et al. Effect of levetiracetam on cognition in patients with Alzheimer disease with and without epileptiform activity: A randomized clinical trial. JAMA Neurology. 2021;78(11):1345–54. https://doi.org/10.1001/jamaneurol.2021.3310
47. Nicastro N, Assal F, Seeck M. From here to epilepsy: the risk of seizure in patients with Alzheimer’s disease. Epileptic Disorders. 2016;18(1):1–12. https://doi.org/10.1684/epd.2016.0808
48. Rowan AJ, Ramsay RE, Collins JF, Pryor F, Boardman KD, Uthman BM, et al. New onset geriatric epilepsy: A randomized study of gabapentin, lamotrigine, and carbamazepine. Neurology. 2005;64(11):1868–73. https://doi.org/10.1212/01.wnl.0000167384.68207.3e
49. Vossel KA, Tartaglia MC, Nygaard HB, Zeman AZ, Miller BL. Epileptic activity in Alzheimer’s disease: Causes and clinical relevance. The Lancet Neurology. 2017;16(4):311–22. https://doi.org/10.1016/s1474-4422(17)30044-3
50. Javed A, Cohen B, Detyniecki K, Hirsch LJ, Legge A, Chen B, et al. Rates and predictors of patient-reported cognitive side effects of antiepileptic drugs: An extended followup. Seizure. 2015;29:34–40. https://doi.org/10.1016/j.seizure.2015.03.013
51. Rizzello E, Pimpinella D, Pignataro A, Titta G, Merenda E, Saviana M, et al. Lamotrigine rescues neuronal alterations and prevents seizure-induced memory decline in an Alzheimer’s disease mouse model. Neurobiology of Disease. 2023;181:106106. https://doi.org/10.1016/j.nbd.2023.106106
52. Tekin S, Aykut-Bingöl C, Tanridağ T, Aktan S. Antiglutamatergic therapy in Alzheimer’s disease — effects of lamotrigine. Short communication. Journal of Neural Transmission. 1998;105(2–3):295–303. https://doi.org/10.1007/s007020050059
Об авторах
С. Г. БурдРоссия
Бурд Сергей Георгиевич - д-р мед. наук, профессор
Москва
А. Н. Боголепова
Россия
Боголепова Анна Николаевна - д-р мед. наук, профессор
Москва
А. В. Лебедева
Россия
Лебедева Анна Валерьяновна - д-р мед. наук, профессор
Москва
Ю. В. Рублёва
Россия
Рублева Юлия Владимировна - канд. мед. наук
Москва
Е. А. Коваленко
Россия
Коваленко Екатерина Андреевна - канд. мед. наук
Москва
Е. В. Махнович
Россия
Махнович Екатерина Владимировна - канд. мед. наук
Москва
Н. А. Осиновская
Россия
Осиновская Нина Алексеевна
Москва
Е. А. Гилева
Россия
Гилева Екатерина Андреевна
Москва
Н. В. Пантина
Россия
Пантина Нина Владимировна
Москва
И. И. Ковалёва
Россия
Ковалева Ирина Ивановна
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Бурд С.Г., Боголепова А.Н., Лебедева А.В., Рублёва Ю.В., Коваленко Е.А., Махнович Е.В., Осиновская Н.А., Гилева Е.А., Пантина Н.В., Ковалёва И.И. Диагностическая значимость субклинической эпилептиформной активности у пациентов с болезнью Альцгеймера. Медицина экстремальных ситуаций. 2025;27(4):578-586. https://doi.org/10.47183/mes.2025-317
For citation:
Burd S.G., Bogolepova A.N., Lebedeva A.V., Rubleva Yu.V., Kovalenko E.A., Makhnovich E.V., Osinovskaya N.A., Gileva E.A., Pantina N.V., Kovaleva I.I. Diagnostic significance of subclinical epileptiform activity in patients with alzheimer’s disease. Extreme Medicine. 2025;27(4):578-586. https://doi.org/10.47183/mes.2025-317

















