Перейти к:
Безопасность и эффективность терапии первичной гипероксалурии 1-го типа с использованием малых интерферирующих РНК-агентов (лумасиран): систематический обзор
https://doi.org/10.47183/mes.2025-344
Аннотация
Введение. Первичная гипероксалурия 1-го типа (ПГ1) — наследственное заболевание, вызывающее избыточную выработку оксалатов в печени, что приводит к гипероксалурии, образованию камней в почках, нефрокальцинозу и прогрессирующему повреждению почек. В основе ПГ1 лежат мутации гена AGXT, в то время как 2-й и 3-й типы гипероксалурии вызваны мутациями GRHPR и HOGA1 соответственно. Лумасиран, препарат на основе РНК-интерференции (RNAi), воздействует на ген HAO1 (оксидаза гидроксикислот 1) и снижает уровень гликолатоксидазы, что приводит к снижению выработки оксалатов печенью.
Цель. Оценка эффективности, безопасности и особенностей клинического применения лумасирана у взрослых и детей с генетически подтвержденной первичной гипероксалурией 1-го типа.
Материалы и методы. Систематический обзор проведен согласно критериям PRISMA 2020; выполнен поиск в четырех базах данных (PubMed, Scopus, Web of Science и EMBASE). Отобраны исследования о применении лумасирана у детей или взрослых пациентов с генетически подтвержденной первичной гипероксалурией 1-го типа. Качество и риск системной ошибки оценивали с помощью инструментов критического анализа JBI (Института Джоанны Бриггс). В работу включено 11 исследований (2 рандомизированных контролируемых исследования, 2 проспективных несравнительных исследования с одной группой, 1 серия случаев (с участием 5 пациентов) и 6 индивидуальных отчетов о клинических случаях с участием детей и взрослых).
Обсуждение. Установлено, что применение лумасирана способствовало снижению уровней оксалатов в моче (UOx) (примерно на 60–75%) и оксалатов плазмы крови (POx) (примерно на 30–60%). У пациентов разного возраста, от младенцев до взрослых, значительно стабилизировалась или улучшалась функция почек и снижалось прогрессирование нефрокальциноза. Лумасиран продемонстрировал благоприятный профиль безопасности, при этом наиболее частыми побочными эффектами были слабые реакции в месте инъекции и серьезных проблем, требующих прекращения лечения, не возникало.
Выводы. Подавляя экспрессию гликолатоксидазы, лумасиран неизменно демонстрировал выраженную эффективность в снижении уровня оксалатов, однако есть различия в терапевтических подходах применения препарата у взрослых пациентов и младенцев, а также различные эффекты от воздействия в зависимости от исходной ренальной функции и режимов дозирования. Как у детей, так и у взрослых наблюдали значительное улучшение и нормализацию почечной функции, но младенцам и пациентам с прогрессирующей хронической болезнью почек требовалась корректировка дозы; в исследованиях также продемонстрирована большая вариабельность в значениях ренальных показателей и особенно в отношении прогрессирования нефрокальциноза. Хотя необходимы дополнительные крупномасштабные долгосрочные исследования, наши результаты показывают, что лумасиран может замедлять прогрессирование заболевания почек и потенциально снижать или отсрочить необходимость в трансплантации почек при ПГ1.
Ключевые слова
Для цитирования:
Наджафи С., Абасабади Ф., Сагафи М.С., Косрави Ф., Рахманян М. Безопасность и эффективность терапии первичной гипероксалурии 1-го типа с использованием малых интерферирующих РНК-агентов (лумасиран): систематический обзор. Медицина экстремальных ситуаций. 2025;27(4):525-535. https://doi.org/10.47183/mes.2025-344
For citation:
Najafi S., Abasabadi F., Saghafi M.S., Khosravi F., Rahmanian M. Safety and efficacy of small interfering RNA agents (lumasiran) in therapy for primary hyperoxaluria type 1: A systematic review. Extreme Medicine. 2025;27(4):525-535. https://doi.org/10.47183/mes.2025-344
ВВЕДЕНИЕ
Первичная гипероксалурия (ПГ) представляет собой редкое (орфанное) генетически детерминированное аутосомно-рецессивное заболевание, в основе патогенеза которого лежит нарушение метаболизма глиоксилата печени, вызванного мутациями в генах AGXT, GRHPR и HOGA1, кодирующих ферменты метаболизма глиоксилата [1][2]. В частности, первичная гипероксалурия 1-го типа (ПГ1) вызвана мутациями в гене AGXT, который кодирует фермент аланин-глиоксилатаминотрансферазу (AGT), при дефиците или дисфункции AGT глиоксилат избыточно продуцируется в оксалат. Заболевание приводит к чрезмерной продукции оксалатов печенью, повышенному их содержанию в крови с увеличением экскреции с мочой и образованием почечных оксалатно-кальциевых кристаллов и рентгеноконтрастных конкрементов (главным образом моногидрата оксалата кальция). Клинические проявления заболевания включают образование камней в почках, нефрокальциноз и прогрессирующее хроническое заболевание почек, которое может привести к отложению оксалатов во многих органах и развитию терминальной стадии хронической почечной недостаточности (ХПН) [3–6].
Вследствие критических нарушений ферментативной функции печени и экскреторной функции почек на поздних стадиях заболевания пациентам с ПГ1 может потребоваться одновременная или поэтапная трансплантация печени и почек [7]. Терапевтические возможности при ПГ1 традиционно ограничивались консервативным медикаментозным лечением, включая увеличение потребления жидкости, прием витамина В6 (пиридоксина), а также ингибиторов кристаллизации (цитрата), которые часто не останавливают неуклонное прогрессирование ХПН [8]. Изолированной трансплантации почек, как правило, недостаточно, поскольку выработка оксалатов печенью продолжается, что приводит к рецидивирующей оксалатной нефропатии, в связи с чем предпочтительным методом лечения в настоящее время признана комбинированная трансплантация печени и почек [3]. Однако трансплантация сопряжена с хирургическими рисками, а также рисками развития несостоятельности трансплантата и иммунологическими осложнениями.
Лекарственный препарат на основе малых интерферирующих РНК (миРНК) лумасиран в ноябре 2020 г. получил одобрение Управления по контролю за продуктами и лекарствами США (FDA) как первое средство для лечения первичной гипероксалурии 1-го типа у взрослых и детей в возрасте 6 лет и старше [9]. OxlumoTM (lumasiran) (далее лумасиран) действует по молекулярному механизму РНК-интерференции (RNAi), вызывая деградацию целевых мишеней матричной РНК (мРНК) в цитоплазме клетки, высокоспецифично регулируя экспрессию генов на посттранскрипционном уровне. Данный терапевтический подход предполагает использование небольших молекул РНК для подавления экспрессии определенных генов в организме путем взаимодействия с определенной последовательностью мРНК-мишени и запуска ее деградации [10][11]. Лумасиран воздействует на ген HAO1, кодирующий в гепатоцитах синтез фермента оксидаза гидроксикислот 1, и, соответственно, ингибирует выработку белка под названием гликолатоксидаза (GO) [9, 12]. Подавляя выработку GO, лумасиран снижает уровень AGT и уменьшает выработку оксалата, тем самым предотвращает накопление кристаллов оксалата в почках и других органах [12].
При проведении клинических испытаний установлено, что препарат обладает высокой эффективностью в снижении уровня оксалатов в крови и моче, вызывая улучшение функции почек у пациентов с ПГ1 [13–15]. По данным S.F. Garrelfs и соавт., в ходе проведения рандомизированного двойного слепого плацебо-контролируемого клинического исследования OxlumoTM (lumasiran) у пациентов было отмечено значительное процентное снижение экскреции оксалата с мочой в течение 24 ч на 53,5 процентного пункта больше при применении лумасирана, чем при приеме плацебо в течение 6-месячного периода лечения; у большинства пациентов, получавших OxlumoTM (lumasiran), уровень оксалата в моче был нормальным или почти нормальным к 6-му месяцу наблюдения. Кроме того, ни у одного из пациентов в группе, получавших OxlumoTM (lumasiran), не образовались камни в почках, в то время как у 6 из 12 пациентов в группе плацебо они были обнаружены. Также у 84% пациентов, получавших лумасиран, суточная экскреция оксалата с мочой не превышала верхнюю границу нормального диапазона более чем в 1,5 раза на 6-м месяце наблюдения по сравнению с группой плацебо [14]. Наряду с этим препарат обладает хорошим профилем безопасности при минимальных побочных эффектах [15]. С другой стороны, сообщалось, что для обеспечения эффективности применения препарата у младенцев необходимы более высокие дозы OxlumoTM (lumasiran), и это не может предотвратить развитие нефрокальциноза в будущем [16].
Хотя результаты этих клинических испытаний обнадеживают, необходимы дальнейшие исследования для более полного понимания безопасности и эффективности лумасирана для лечения гипероксалурии. Полученные результаты помогут пересмотреть терапевтические протоколы и снизить потребность в трансплантации печени у пациентов с ПГ1.
Цель исследования — оценка эффективности, безопасности и особенностей клинического применения OxlumoTM (lumasiran) у взрослых и детей с генетически подтвержденной первичной гипероксалурией 1-го типа.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования и стратегия научного поиска
Систематический обзор результатов исследований был проведен согласно критериям PRISMA 2020 [17]. Поиск публикаций проводился по базам данных PubMed, Scopus, EMBASE и Web of Science; выявляли оригинальные исследования применения лумасирана у пациентов с генетическим или клиническим диагнозом первичной гипероксалурии 1-го типа.
В базе данных PubMed/Medline поиск проводился по терминам словаря предметных заголовков/терминов Medical Subject Headings (MeSH) и ключевым словам: «lumasiran», «RNAi», «primary hyperoxaluria type 1 (PH1)», «excessive hepatic oxalate», «glycolate oxidase inhibition», «small interfering RNA (siRNA)». Для повышения эффективности поиска при комбинировании MeSH и ключевых слов использовались операторы OR (любое из ключевых слов) и AND (совокупность всех ключевых слов).
Критерии включения и исключения
В систематический обзор были включены: интервенционные исследования (рандомизированные контролируемые исследования, несравнительные исследования, квазиэкспериментальные проекты), исследования серии случаев и отчеты о клинических случаях, содержащие оригинальные данные о клинических исходах терапии OxlumoTM (lumasiran) у детей и взрослых с ПГ1. Из рассмотрения были исключены обзоры, исследования на животных, дубликаты полнотекстовых версий, тезисы конференций без данных и статьи с недостаточной информацией о пациентах. Затем мы анализировали размеры выборок, демографические данные пациентов, детали диагностики ПГ1, дозы и режимы назначения лумисирана, продолжительность терапии, изменения в уровнях оксалата в моче/плазме, данные по оценке функции почек и любые зарегистрированные нежелательные явления. Исследования охватывали возрастной диапазон пациентов от младенцев (младше 1 года) до пожилых людей (50 и более лет) с различной степенью тяжести основного заболевания.
Выбор исследования и извлечение данных
Из первоначально выявленной 91 статьи из баз данных было исключено 53 публикации по дублированию названия. Два независимых эксперта провели скрининг оставшихся 38 записей по заголовкам и аннотациям, исключив 12 нерелевантных публикаций. Также после поиска в серой литературе Google Scholar и проверки цитирований были добавлены две статьи. Для изучения полнотекстовых версий было отобрано 26 публикаций из баз данных, дополнительно добавлено 2 после проверки «серой» литературы в Google Scholar и цитатах. Исключили из скрининга 15 статей, которые содержали перекрывающиеся данные, одна публикация — несистематический обзор, 1 — нерелевантная теме. Оставшиеся 11 работ соответствовали нашим критериям отбора.
В систематический обзор были включены 11 исследований, из них: 2 рандомизированных контролируемых исследования, 2 несравнительных проспективных исследования с одной группой, 1 серия случаев (с участием 5 пациентов) и 6 индивидуальных отчетов о клинических случаях с участием детей и взрослых. Рассмотрены исследования, которые были проведены в возрастных группах: до 1 года (младенцев) и старше 50 лет (пожилых людей), пациентов с различной степенью выраженности основного заболевания ПГ1.
Оценка качества включенных исследований
Оценка качества включенных исследований проводилась с использованием утвержденных Институтом Джоанны Бриггс (JBI) контрольных списков, соответствующих дизайну каждого исследования (рандомизированные контролируемые испытания, отчеты о клинических случаях и исследования серии случаев). Критерии каждого контрольного списка были независимо оценены двумя экспертами, а разногласия были разрешены путем консенсуса или консультаций с третьим экспертом. Большинство исследований продемонстрировали высокое методологическое качество при минимальной предвзятости.
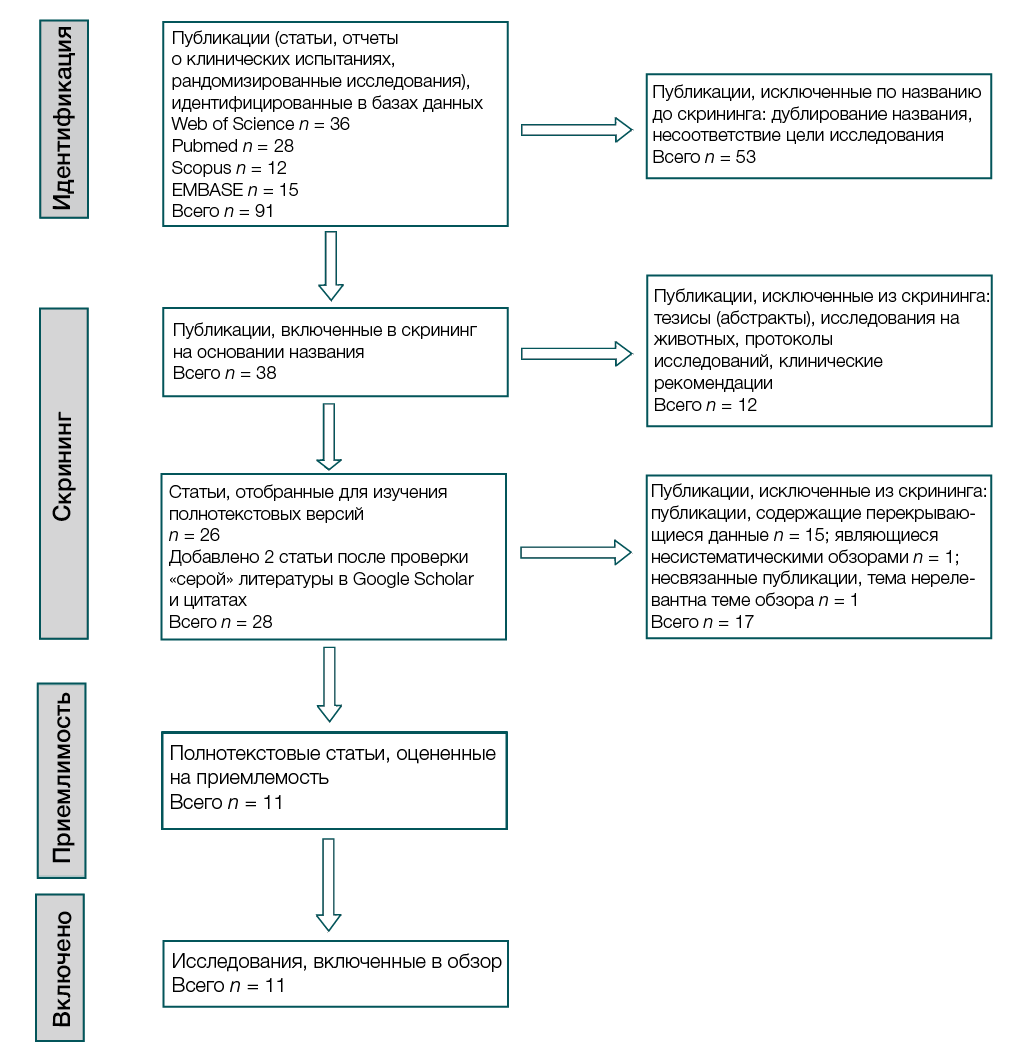
Рисунок подготовлен авторами
Рис. Блок-схема систематического обзора
Таблица. Обобщенные данные исследований, включенных в систематический обзор по изучению влияния OxlumoTM (lumasiran) на течение первичной гипероксалурии 1-го типа (ПГ1)
|
№ исследования |
Авторы, страна |
Год публикации |
Вид исследования |
Размер выборки, возраст |
Способ применения и режим дозирования лумасирана |
Период наблюдения |
Популяция |
Исходы |
|
1 |
Michael, Израиль, Франция, Германия, Великобритания, Нидерланды [13] |
2023 |
НРКИ |
Общее число участников: 21 человек, возраст 0–59 лет |
Детям с массой <10 кг: 6 мг/кг ежемесячно трижды (3 мес.), затем по 3 мг/кг ежемесячно. Детям массой от 10 кг до <20 кг 6 мг/кг ежемесячно трижды (3 мес.), затем по 6 мг/кг ежеквартально. Детям массой >20 кг. 3 мг/кг ежемесячно трижды (3 мес.), затем по 3 мг/кг ежеквартально. Все инъекции выполнялись подкожно |
6–12 мес. |
Общее число участников: 21 человек. Все пациенты получали лечение лумасираном в двух отдельных когортах: Когорта А (n = 6; 50% женщин, 50% мужчин). Когорта В (n = 15; 40% женщин, 60% мужчин) |
Снижение POx на 33,3% и 42,4% при приемлемой безопасности для пациентов |
|
2 |
Garrelfs, Нидерланды [14] |
2021 |
РКИ |
Общее число участников: 39 человек, возраст 6–47 лет |
3 мг/кг ежемесячно в течение 3 мес. С последующим введением поддерживающих доз один раз в 3 меc. начиная через 1 мес. после последней нагрузочной дозы, затем в течение 6 мес. Все инъекции выполнялись подкожно |
6 мес. |
Общее число участников: 39 человек. Группа лумасирана: n = 26 (31% женщин; 69% мужчин). Группа плацебо: n = 13 (38% женщин; 62% мужчин) |
Уменьшение на 64% суточной экскреции UOx (на 84% ниже 1,5-кратной верхней границы). Снижение уровня POx. рСКФ оставалась стабильной. Уменьшение соотношения UOx/Cr |
|
3 |
Méaux, Франция [16] |
2022 |
КС |
Общее число участников: 3 |
6 мг/кг ежемесячно в течение 3 мес. с последующим снижением до 3 мг/кг ежемесячно у детей с массой менее 10 кг. Все инъекции выполнялись подкожно |
10 мес. |
Дети младше 2 лет |
Снижение уровня Pox. Уменьшение отношения UOx/Cr. Почечная функция оставалась в норме |
|
4 |
Frishberg, Израиль, Франция, Германия, Великобритания, Нидерланды [18] |
2021 |
РКИ |
Общее число участников: 52 человека, возраст 6–64 года |
Дозировки и режимы введения: • 1 мг/кг один раз в меc., • 3 мг/кг один раз в мес., • 3 мг/кг каждые 3 мес. Период наблюдения: не менее 12 недель. Все инъекции выполнялись подкожно |
85 дней, 197 дней |
Общее число участников: 52 человека. Здоровые добровольцы: n = 32 Группа лумасирана: n = 24 (46% женщин; 54% мужчин). Группа плацебо: n = 8 (63% женщин; 37% мужчин) Пациенты: n = 20 Группа лумасирана: n = 17 (71% женщин; 29% мужчин). Группа плацебо: n = 3 (33% женщин; 67% мужчин) |
Сокращение на 75% суточной экскреции UOx (не превышая 1,5-кратной верхней границы нормы). Уменьшение плазменной концентрации POx |
|
5 |
Sas, Израиль, Франция, Германия, Великобритания, Нидерланды [19] |
2022 |
НРКИ |
Общее число участников: 18, возраст 0 мес. — 6 лет |
Детям массой <10 кг 6 мг/кг ежемесячно трижды (3 мес.), затем по 3 мг/кг ежемесячно. Детям массой от 10 кг до <20 кг 6 мг/кг ежемесячно трижды (3 мес.), затем по 6 мг/кг ежеквартально. Дети массой >20 кг 3 мг/кг ежемесячно трижды (3 мес.), затем 3 мг/кг ежеквартально. Все инъекции выполнялись подкожно |
6 мес. |
Общее число участников: 18 человек. Все пациенты получали лечение лумасираном. <10 кг, n = 3, 33% женщин); от 10 до <20 кг, n = 12, 75% женщин); ≥20 кг, n = 3, 0 женщин) Все леченные (n = 18, 56% женщин) |
Уменьшение UOx/Cr на 72% и уровня Pox у детей возрастом <6 лет (на 50% ниже 1,5-кратной верхней границы |
|
6 |
Khaled Aldabek, США [20] |
2022 |
КС |
Общее число участников: 2 |
6 мг/кг ежемесячно первые 3 мес. Затем 3 мг/кг ежемесячно. Все инъекции выполнялись подкожно |
8 мес. |
Два близнеца мужского пола 12 мес. |
Заметное уменьшение симптомов |
|
Lombardi, Франция [21] |
2023 |
КС |
Общее число участников: 1 |
3 мг/кг ежемесячно в течение 3 мес. Затем прием поддерживающих доз один раз в 3 мес. начиная через 1 мес. после последней нагрузочной дозы. Все инъекции выполнялись подкожно |
14 мес. |
Мужчина 51 год |
Уменьшение концентрации SOx и UOx, а также кристаллов оксалата в почках |
|
|
Sellier-Leclerc, Франция [22] |
2023 |
Серия случаев |
Общее число участников: 5, возраст 3–45 лет |
Подкожные инъекции лумасирана ежемесячно в течение 3 мес. с последующим поддерживающим дозированием каждые 3 мес. Данные о точной дозировке препарата отсутствуют |
13 мес. |
Общее число участников: 5 человек. Все пациенты получали лечение лумасираном |
Снижение уровня POx |
|
|
7 |
Benedetta Chiodini, Бельгия [23] |
2022 |
КС |
Общее число участников: 1 |
3 мг/кг ежемесячно в течение 3 мес. Затем прием поддерживающих доз один раз в 3 мес. начиная через 1 мес. после последней нагрузочной дозы. Все инъекции выполнялись подкожно |
18 мес. |
Мальчик 13 лет |
Снижение уровней POx и UOx до нормы. Уменьшение на 70% соотношения UOx/Cr. рСКФ оставалась стабильной (60 мл/мин/1,73 м2) |
|
10 |
Joher, Франция [24] |
2022 |
КС |
Общее число участников: 1 |
Терапия лумасираном до почечной трансплантации |
Продолжительность лечения не указана |
Женщина 39 лет |
Нормализация концентрации сывороточных оксалатов, до почечной трансплантации |
|
11 |
Poyah, Канада [25] |
2021 |
КС |
Общее число участников: 1 (взрослый пациент с ТПН и кожными проявлениями) |
Не указано |
Продолжительность лечения не указана |
40-летняя женщина с ПГ, страдающая терминальной почечной недостаточностью (ХПН) с кожными проявлениями |
Уровень оксалатов в плазме крови снизился на 36%, но восстановление функции почек не произошло; прогрессирование внепочечного поражения с деформацией «лебединой шеи» и легочной гипертензией |
Таблица составлена авторами по данным источников [13, 14, 16, 18–25]
Примечание: РКИ — рандомизированное контролированное исследование; НРКИ — нерандомизированное контролированное исследование; КС — клинический случай; ТПН — терминальная почечная недостаточность POx — оксалаты плазмы; UOx/Cr — соотношение оксалатов в моче и уровня креатинина; UOx — оксалаты мочи; SOx — оксалаты сыворотки; KTx — почечная трансплантация; eGFR — скорость клубочковой фильтрации.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В таблице представлены обобщенные данные исследований, демографические данные пациентов, режимы дозирования OxlumoTM (lumasiran) и основные исходы / динамика течения заболевания, а также задокументировано тщательное изучение влияния OxlumoTM (lumasiran) на течение ПГ1.
Y. Frishberg и соавт. [18] отметили значительное снижение средних максимальных уровней экскреции UOx за 24 ч на 75%, или 43–92% от исходного значения 1,69 ммоль/24 ч на 1,73 м2. Следует отметить, что все участники исследования достигли уровней UOx в пределах типичного диапазона или превышали в 1,5 раза верхнюю границу нормы. Таким образом, основной принцип действия лумасирана заключается в его способности расщеплять мРНК гликолатоксидазы. Эти результаты в совокупности дают полное представление об эффективности лумасирана в облегчении течения ПГ1.
S.F. Garrelfs и соавт. [14] оценили влияние терапии лумасираном на процентное изменение 24-часовой экскреции оксалата натрия и уровня оксалата азота в плазме крови (POx) у пациентов с ПГ1. Полученные данные показали, что у 84% пациентов, принимавших лумасиран, уровни UOx в течение 24 ч не превышали в 1,5 раза верхнюю границу стандартного диапазона. Кроме того, лечение лумасираном продемонстрировало значительное снижение уровня POx, что является убедительным доказательством установленного механизма действия, приписываемого лумасирану.
M. Michael и соавт. [13] наблюдали, что применение лумасирана приводило к значительному снижению уровня POx при сохранении удовлетворительного профиля безопасности у лиц с прогрессирующим заболеванием почек и ПГ1.
D.J. Sas и соавт. [19] провели исследование, в котором изучали эффективность лумасирана в качестве терапевтического средства для лечения ПГ1 у пациентов детского возраста. В ходе исследования использовали терапию 4 или 6 курсовыми дозами препарата в зависимости от веса пациента. Полученные результаты показали уменьшение соотношения экскреции оксалатов и креатинина (UOx:Cr) на 72,0%. Более того, у половины пациентов были достигнуты значения UOx:Cr в пределах половины верхней границы нормы. Уровень POx составил 31,7%. Для оценки влияния терапии лумасираном на ПГ1 были включены шесть клинических исследований.
M.N. Méaux и соавт. [16] в своем исследовании наблюдали трех младенцев с диагнозом ПГ1. Пациенты получали терапию лумасираном, дозы и частота которого подбирались в зависимости от массы тела ребенка. В течение первых 3 месяцев назначали дозу 6 мг/кг в месяц; для младенцев весом до 10 кг эта норма была скорректирована до 3 мг/кг в месяц. Как объяснили M.N. Méaux и соавт., этот метод подчеркивает важность учета факторов, основанных на весе, при определении подходящей дозы лумасирана для младенцев с ПГ1. Пациенту 1 был поставлен диагноз ПГ1 в пренатальном периоде в связи с тем, что у его старшей сестры в возрасте 4 месяцев была диагностирована хроническая болезнь почек (ХБП) 5-й стадии. После 10 месяцев наблюдения гиперэхогенность почек у пациента начала снижаться с сохранением функции почек. Пациент 2 с диагнозом ПГ1 был госпитализирован в связи с острой почечной недостаточностью и обезвоживанием в возрасте 2,5 месяца. Уровни креатинина в сыворотке крови составляли 243 мкмоль/л, азота мочевины в крови 19 ммоль/л при расчетной скорости клубочковой фильтрации (рСКФ) 8 мл/мин/1,73 м2 и соотношении UOx:Cr (806 мкмоль/ммоль) и POx (184 мкмоль/л), которые были существенно повышены. После 9 инъекций соотношение UOx:Cr снизилось более чем на 60% — до 310 мкмоль/ммоль, что почти соответствовало норме. В течение 10-месячного периода наблюдения отмечали резкое снижение уровня креатинина в сыворотке крови, который в конечном счете выровнялся примерно до 120 мкмоль/л (рСКФ 20 мл/мин/1,73 м2). Однако нефрокальциноз III степени сохранялся. В связи с наличием нефрокальциноза III степени в возрасте 3,5 месяца пациент 3 был включен в исследование с диагнозом ПГ1. Через неделю соотношение UOx:Cr увеличилось до 2167 мкмоль/ммоль с повышенных 1651 мкмоль/моль по данным биохимического анализа. Уровень POx соответствовал 36 мкмоль/л, что сопровождалось повышенным уровнем гликолята в плазме крови, но нормальной функцией почек (креатинин 30 мкмоль/л, рСКФ 77 мл/мин/1,73 м2). После первоначального введения наблюдалось быстрое снижение соотношения UOx:Cr до 1640 мкмоль/ммоль. Функция почек оставалась стабильной на протяжении всего периода наблюдения. После пятой инъекции нефрокальциноз уменьшился с III до II степени. Результаты показывают, что лумасиран эффективен у младенцев и не имеет каких-либо негативных побочных эффектов. Однако, несмотря на хорошую переносимость лумасирана, нельзя полностью избежать возникновения или прогрессирования нефрокальциноза, особенно в его тяжелых формах, даже при назначении терапии в раннем неонатальном периоде или сочетании с традиционными подходами лечения ПГ1 [22].
В исследовании, проведенном K. Aldabek и соавт. [20], основное внимание было уделено двум младенцам-близнецам мужского пола с диагнозом ПГ1, у которых наблюдали симптомы нефролитиаза и нефрокальциноза. Эти пациенты получали лечение лумасираном начиная с 12-месячного возраста, в течение первых 3 месяцев в начальной дозе 6 мг/кг 1 раз/месяц с последующей коррекцией до 3 мг/кг в месяц. Примечательно, что у мальчиков-близнецов симптомы значительно уменьшились. На основании положительных результатов K. Aldabek и соавт. пришли к выводу, что лумасиран является успешным средством лечения детской ПГ1.
В исследовании B. Chiodini и соавт. [23] один пациент-подросток с ПГ1 получал лечение лумасираном в дозе 3 мг/кг в течение 18 месяцев. У пациента наблюдали быстрое и устойчивое снижение соотношения UOx:Cr в среднем на 70% после приема лумасирана. В течение всего 18-месячного периода наблюдения уровень UOx оставался низким, практически приближаясь к норме. Кроме того, было отмечено быстрое снижение уровня POx, при этом среднее снижение составило примерно 60% после приема лумасирана. Расчетная скорость клубочковой фильтрации не претерпела существенных изменений за весь срок лечения, варьируя в диапазоне от 60 мл/мин/1,73 м2 на исходном уровне до 62 мл/мин/1,73 м2 через 18 мес.
В исследовании Y. Lombardi и соавт. [21] изучалась эффективность терапии лумасираном у 51-летнего пациента с ПГ1, у которого наблюдался рецидив оксалатной нефропатии после изолированной почечной трансплантации. Лекарственная терапия включала подкожное введение лумасирана в дозировке 3 мг/кг. В общей сложности каждый месяц делались 3 инъекции, затем инъекции проводились каждые три месяца. После начала приема лумасирана наблюдалось снижение концентрации оксалата в сыворотке крови (SOx), оксалата в моче и кристаллов оксалата в почках.
Другое исследование, проведенное A.L. Sellier-Leclerc и соавт. [22], включало 5 пациентов с генетически подтвержденной ПГ1, перенесших изолированную почечную трансплантацию. Пациенты со средним возрастом 26 лет (3–45 лет) получали терапию лумасираном в течение 13 мес. (5–17 лет). Результаты показали постоянное и значительное снижение уровня POx у всех пациентов после начала приема лумасирана со 110 (20–150) до 53 (10–72) мкмоль/л на момент почечной трансплантации (KTx) и до 7 (5–26) мкмоль/л через 3 мес. (p < 0,05). Таким образом, если уровень POx составляет 80–90 мкмоль/л, полученные данные указывают на то, что изолированная KTx на фоне терапии лумасираном может быть безопасным вариантом лечения больных ПГ1 с почечной недостаточностью.
N. Joher и соавт. [24] наблюдали 39-летнюю женщину с ПГ1 и КТх, которая ранее уже получала терапию лумасираном. Результаты показали, что концентрация SOx нормализовалась еще до операции КТх. Терапия лумасираном привела к благоприятным результатам в виде снижения концентрации SOx и POx, уровня суточной экскреции UOx и процентного соотношения UOx: Cr. Это было достигнуто за счет снижения содержания матричной РНК, кодирующей фермент гликолатоксидазу, регулирующую AGT.
В работе P. Poyah [25] описан клинический случай первичной гипероксалурии 1-го типа у 40-летней женщины с рецидивирующим нефролитиазом в анамнезе. Терапия лумасираном была назначена спустя 11 мес. на фоне гемодиализа и применения пиридоксина. После 14 мес. высокоинтенсивного гемодиализа и 3 мес. применения лумасирана не было никаких признаков восстановления почек, а внепочечное поражение увеличилось с прогрессирующими деформациями «лебединой шеи», снижением систолической функции сердца и легочной гипертензией. Пациент был внесен в список ожидания на трансплантацию почек и печени.
Основным побочным эффектом, связанным с применением лумасирана, была незначительная преходящая реакция в месте инъекции. Типичные признаки и проявления включали покраснение, изменение цвета кожи и гематому в месте инъекции [18][23][25]. В ходе исследований у некоторых пациентов наблюдались незначительные побочные эффекты, включая лихорадку, рвоту, ринит, боль в животе, диарею, анемию, головную боль или случайную передозировку [13]. Предполагается, что лумасиран не оказывает какого-либо клинического воздействия на результаты лабораторных исследований (включая анализы крови и функции печени), ЭКГ или прочие жизненные показатели [23]. Это подтверждает, что терапия лумасираном является безопасным и эффективным методом лечения младенцев, детей младшего возраста и взрослых.
В нашей работе изучались эффективность, безопасность и клинические результаты применения лумасирана при лечении ПГ1. В результате анализа 11 исследований, включая рандомизированные контролируемые исследования, отчеты о клинических случаях и исследования серии случаев, было установлено, что лумасиран, препарат на основе РНК-интерференции, значительно снижает уровень оксалатов как в плазме, так и в моче, улучшает функцию почек и уменьшает нефрокальциноз у пациентов разного возраста, включая взрослых и детей. Установлено, что у большинства пациентов уровень оксалатов был нормальным или почти нормальным на фоне применения препарата. Препарат в целом хорошо переносился, при этом основным побочным эффектом, о котором сообщалось, были незначительные реакции в месте инъекции. Таким образом, лумасиран представляет собой многообещающий прорыв в лечении ПГ1.
Во всех рассмотренных работах лумасиран неизменно демонстрировал выраженную эффективность в снижении уровня оксалатов, однако наблюдались различия в возрасте пациентов, а также исходной функции почек и режимах дозирования. Как у детей, так и у взрослых было отмечено значительное улучшение и нормализация почечной функции, но младенцам и пациентам с прогрессирующей хронической болезнью почек требовалась корректировка дозы; в исследованиях также продемонстрирована большая вариабельность в значениях ренальных показателей, особенно в отношении прогрессирования нефрокальциноза.
Лумасиран действует путем подавления гена HAO1, который кодирует гликолатоксидазу — фермент, участвующий в производстве оксалатов [9]. Впоследствии за счет ингибирования гликолатоксидазы количество субстрата, необходимого для производства оксалата, уменьшается, а количество гликолата кальция, более безопасного продукта, увеличивается [17]. В результате снижение выработки оксалатов приводит к снижению уровня оксалатов в крови и моче [25]. Многочисленные клинические испытания и отчеты о клинических случаях продемонстрировали эти эффекты и их последствия, такие как улучшение функции почек как у детей, так и у взрослых пациентов с ПГ1 [13, 18, 25]. Согласно фармакокинетическим исследованиям лумасиран быстро всасывается и выводится из организма, что делает его безопасным в применении [9].
В ходе III фазы открытого несравнительного исследования (ILLUMINATE-B), проведенного в 2021 году, 18 детей с ПГ1 в возрасте до 6 лет получали лечение лумасираном в течение 6 месяцев и показали быстрое снижение концентрации оксалатов, в конечном итоге достигнув верхней границы нормы [18].
По данным исследования ILLUMINATE-A, образование камней в почках уменьшилось после 6–12 мес. лечения лумасираном у пациентов с ПГ1 в возрасте старше 6 лет [18, 11]. Экскреция оксалатов с мочой также нормализовалась [14].
Более того, эффективность лумасирана оценивали у пациентов различных возрастных групп и лиц с прогрессирующей ХБП в течение 12 месяцев в ходе исследования ILLUMINATE-C [13][17]. В результате концентрация Pox была значительно снижена. Это может привести к отсрочке необходимости в диализе и трансплантации у пациентов с ХБП, а также улучшить прогноз у тех, кто уже перенес трансплантацию почки [28]. Что касается функции почек, то после нескольких месяцев лечения лумасираном рСКФ оставалась стабильной или даже улучшалась [18, 28].
Подводя итог, можно сказать, что лумасиран может замедлить прогрессирование до терминальной стадии почечной недостаточности за счет улучшения функции почек [20][23]. Однако оптимальные сроки начала приема лумасирана остаются неясными. Хотя раннее начало лечения может помочь предотвратить накопление кристаллов оксалата в почках и других органах и замедлить прогрессирование нефрокальциноза, у некоторых пациентов оно не предотвращает его полностью [23]. Следовательно, необходимы дополнительные исследования, чтобы понять цель комплексной терапии.
Еще одним важным преимуществом лумасирана является его хорошая переносимость. Наиболее частыми нежелательными явлениями, о которых сообщалось, были кратковременные, легкие реакции в месте инъекции [14][18]. У некоторых пациентов наблюдалось по крайней мере одно переносимое незначительное побочное действие, включая лихорадку, рвоту, ринит, боль в животе, инфекцию верхних дыхательных путей, диарею, анемию, ушную инфекцию, головную боль или случайную передозировку, которые быстро прошли в ходе исследования [13]. Многообещающе, что лумасиран не оказывает клинического влияния на результаты лабораторных исследований (включая гематологические и функциональные тесты печени), электрокардиограммы или показатели жизнедеятельности [23]. В ходе исследований не только не сообщалось о серьезных проблемах с безопасностью, таких как прерывание лечения или смерть, связанные с приемом препарата [23], но и не наблюдалось ухудшения каких-либо тяжелых симптомов [15]. Такие симптомы, как усталость, тошнота, снижение аппетита, боль в костях, снижение подвижности, одышка, почечная колика и другие симптомы, либо уменьшались, либо не изменились во время лечения лумасираном [15].
Несмотря на то что исследования по применению лумасирана для лечения ПГ1 являются многообещающими, все еще существуют некоторые ограничения и области, требующие дальнейшего изучения. Одной из заметных проблем является небольшой размер выборки (один или несколько пациентов) в исследованиях, проведенных ранее описанных в нашей работе. Чтобы получить более глубокое представление о безопасности и эффективности этого метода лечения, необходимо провести более масштабные рандомизированные контролируемые исследования. Также следует провести дополнительные исследования в различных возрастных группах, таких как дети младшего возраста и пожилые люди, а также в конкретных подгруппах пациентов, в том числе с прогрессирующими заболеваниями почек.
Кроме того, нет достаточного количества долгосрочных данных о воздействии лумасирана в течение более чем одного года, что имеет решающее значение для понимания всех преимуществ и потенциальных рисков этой терапии. Оптимальная дозировка и график лечения также еще не определены, особенно для пациентов детского возраста. Хотя раннее начало лечения может предотвратить или уменьшить развитие нефрокальциноза у некоторых детей, оно не устраняет это заболевание полностью.
Несмотря на то что терапия, по-видимому, уменьшает отложение оксалатов в почках, необходимы дальнейшие исследования, чтобы определить ее влияние на экстраренальное отложение оксалатов. С другой стороны, большинство исследований проводилось в специализированных центрах с использованием передовых протоколов лечения ПГ1, что потенциально ограничивает их широкую применимость.
Наконец, комбинированная терапия лумасираном и вспомогательными препаратами может иметь дополнительные преимущества, но необходимы дальнейшие исследования, чтобы полностью понять ее потенциал. Для проведения метаанализа требуется больше клинических испытаний. Поэтому мы рекомендуем проводить дополнительные систематические обзоры в дополнение к метаанализу.
В целом, несмотря на то что лумасиран демонстрирует потенциал перспективного средства лечения ПГ1, будущие крупномасштабные исследования или испытания на основе регистров помогут определить его эффективность, безопасность, потенциальные области применения, оптимальную дозировку для новорожденных или пациентов с поздними стадиями ХБП, а также выяснить, может ли комбинированная терапия надежно предотвратить необходимость трансплантации печени и почек.
ЗАКЛЮЧЕНИЕ
Полученные данные подчеркивают высокую эффективность и благоприятный профиль безопасности лумасирана, прорывного препарата на основе RNAi, который снижает уровень оксалатов в плазме крови и моче, что приводит к предотвращению повреждения почек при первичной гипероксалурии 1-го типа как у детей, так и у взрослых пациентов. Применение лумасирана сопровождается в основном легкими, транзиторными реакциями в месте инъекции и может использоваться в качестве терапии первой линии при ПГ1.
Препарат продемонстрировал выраженную эффективность в снижении уровня оксалатов, однако есть различия в терапевтических подходах применения препарата у взрослых пациентов и младенцев, а также различные эффекты от воздействия в зависимости от исходной ренальной функции и режимов дозирования. Как у детей, так и у взрослых наблюдали значительное улучшение и нормализацию почечной функции, но младенцам и пациентам с прогрессирующей хронической болезнью почек требовалась корректировка дозы; в исследованиях также продемонстрирована большая вариабельность в значениях ренальных показателей и особенно в отношении прогрессирования нефрокальциноза.
Полученные результаты свидетельствуют о том, что лумасиран может замедлять прогрессирование заболевания почек и потенциально снижать или отсрочивать необходимость их трансплантации при ПГ1, при этом необходимы дополнительные крупномасштабные долгосрочные исследования. Будущие исследования должны быть сосредоточены на определении оптимальных сроков начала терапии, особенно в младенческом возрасте, оценке потенциальных аддитивных эффектов комбинированных стратегий лечения и подтверждении его устойчивых преимуществ и безопасности при долгосрочном наблюдении. Дальнейшие исследования помогут получить основанные на принципах доказательной медицины данные, которые будут способствовать более широкому применению лумасирана в клинической практике, что, в свою очередь, позволит расширить сведения о терапии, долгосрочных прогнозах и исходах у пациентов с ПГ1.
Список литературы
1. Huang Y, Zhu W, Zhou J, Huang Q, Zeng G. Navigating the Evolving Landscape of Primary Hyperoxaluria: Traditional Management Defied by the Rise of Novel Molecular Drugs. Biomolecules. 2024;14(5):511. https://doi.org/10.3390/biom14050511
2. Cellini B. A molecular journey on the pathogenesis of primary hyperoxaluria. Current Opinion in Nephrology and Hypertension. 2024;33(4):398–404. https://doi.org/10.1097/MNH.0000000000000987
3. Demoulin N, Aydin S, Gillion V, Morelle J, Jadoul M. Pathophysiology and Management of Hyperoxaluria and Oxalate Nephropathy: A Review. American Journal of Kidney Diseases: The Official Journal of the National Kidney Foundation. 2022;79(5):717–27. https://doi.org/10.1053/j.ajkd.2021.07.018
4. Cochat P, Hulton SA, Acquaviva C, Danpure CJ, Daudon M, De Marchi M, et al. Primary hyperoxaluria Type 1: indications for screening and guidance for diagnosis and treatment. Nephrology, dialysis, transplantation: official publication of the European Dialysis and Transplant Association — European Renal Association. 2012;27(5):1729–36. https://doi.org/10.1093/ndt/gfs078
5. Amoroso A, Pirulli D, Florian F, Puzzer D, Boniotto M, Crovella S, et al. AGXT gene mutations and their influence on clinical heterogeneity of type 1 primary hyperoxaluria. JASN. 2001;12(10):2072–9. https://doi.org/10.1681/ASN.V12102072
6. Hoppe B. An update on primary hyperoxaluria. Nature reviews. Nephrology. 2012;8(8):467–75. https://doi.org/10.1038/nrneph.2012.113
7. Devresse A, Cochat P, Godefroid N, Kanaan N. Transplantation for Primary Hyperoxaluria Type 1: Designing New Strategies in the Era of Promising Therapeutic Perspectives. Kidney International Reports. 2020;5(12):2136–45. https://doi.org/10.1016/j.ekir.2020.09.022
8. Gupta A, Somers MJG, Baum MA. Treatment of primary hyperoxaluria type 1. Clinical Kidney Journal. 2022;15(Suppl. 1):i9–13. https://doi.org/10.1093/ckj/sfab232
9. Scott LJ, Keam SJ. Lumasiran: First Approval. Drugs. 2021;81(2):277–82. https://doi.org/10.1007/s40265-020-01463-0
10. Hu B, Zhong L, Weng Y, Peng L, Huang Y, Zhao Y, et al. Therapeutic siRNA: state of the art. Signal Transduction and Targeted Therapy. 2020;5(1):101. https://doi.org/10.1038/s41392-020-0207-x
11. D’Ambrosio V, Ferraro PM. Lumasiran in the Management of Patients with Primary Hyperoxaluria Type 1: From Bench to Bedside. International Journal of Nephrology and Renovascular Disease. 2022;15:197–206. https://doi.org:10.2147/IJNRD.S293682
12. Hulton SA. Lumasiran: expanding the treatment options for patients with primary hyperoxaluria type 1. Expert Opinion on Orphan Drugs. 2021;9(7–10):189–98. https://doi.org/10.1080/21678707.2021.2003779
13. Michael M, Groothoff JW, Shasha-Lavsky H, Lieske JC, Frishberg Y, Simkova E, et al. Lumasiran for Advanced Primary Hyperoxaluria Type 1: Phase 3 ILLUMINATE-C Trial. American Journal of Kidney Disease. 2023;81(2):145–55.e1. https://doi.org:10.1053/j.ajkd.2022.05.012
14. Garrelfs SF, Frishberg Y, Hulton SA, Koren MJ, O’Riordan WD, Cochat P, et al. ILLUMINATE-A Collaborators. Lumasiran, an RNAi Therapeutic for Primary Hyperoxaluria Type 1. The New England Journal of Medicine. 2021;384(13):1216–26. https://doi.org/10.1056/NEJMoa2021712
15. Hulton SA, Groothoff JW, Frishberg Y, Koren MJ, Overcash JS, Sellier-Leclerc AL, et al. Randomized Clinical Trial on the Long-Term Efficacy and Safety of Lumasiran in Patients with Primary Hyperoxaluria Type 1. Kidney International Reports. 2022;7(3):494–506. https://doi.org/10.1016/j.ekir.2021.12.001
16. Méaux MN, Sellier-Leclerc AL, Acquaviva-Bourdain C, Harambat J, Allard L, Bacchetta J. The effect of lumasiran therapy for primary hyperoxaluria type 1 in small infants. Pediatric Nephrology. 2022;37(4):907–11. https://doi.org/10.1007/s00467-021-05393-1
17. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ. 2021;372:n71. https://doi.org/10.1136/bmj.n71
18. Frishberg Y, Deschenes G, Groothoff JW, Hulton SA, Magen D, Harambat J, et al. Phase 1/2 Study of Lumasiran for Treatment of Primary Hyperoxaluria Type 1: A PlaceboControlled Randomized Clinical Trial. Clinical Journal of the American Society of Nephrology. 2021;16(7):1025–36. https://doi.org/10.2215/CJN.14730920
19. Sas DJ, Magen D, Hayes W, Shasha-Lavsky H, Michael M, Schulte I, et al. Phase 3 trial of lumasiran for primary hyperoxaluria type 1: A new RNAi therapeutic in infants and young children. Genetics in Medicine: Official Journal of the American College of Medical Genetics. 2022;24(3):654–62. https://doi.org/10.1016/j.gim.2021.10.024
20. Aldabek K, Grossman OK, Al-Omar O, Fox JA, Moritz ML. Infantile Primary Hyperoxaluria Type 1 Treated With Lumasiran in Twin Males. Cureus. 2022;14(1):e21673. https://doi.org/10.7759/cureus.21673
21. Lombardi Y, Isnard P, Chavarot N, Chauvet S, Martinez F, Thervet É, et al. Stiripentol and Lumasiran as a Rescue Therapy for Oxalate Nephropathy Recurrence After Kidney Transplantation in an Adult Patient With Primary Hyperoxaluria Type 1. American Journal of Kidney Diseases. 2023;82(1):113–6.10. https://doi.org/10.1053/j.ajkd.2022.12.005
22. Sellier-Leclerc AL, Metry E, Clave S, Perrin P, AcquavivaBourdain C, Levi C, et al. Isolated kidney transplantation under lumasiran therapy in primary hyperoxaluria type 1: a report of five cases. Nephrology Dialysis Transplantation. 2023;38(2):517–21. https://doi.org/10.1093/ndt/gfac295
23. Chiodini B, Tram N, Adams B, Hennaut E, Lolin K, Ismaili K. Case Report: Sustained Efficacy of Lumasiran at 18 Months in Primary Hyperoxaluria Type 1. Frontiers in Pediatrics. 2021;9:791616. https://doi.org/10.3389/fped.2021.791616
24. Joher N, Moktefi A, Grimbert P, Pagot E, Jouan N, El Karoui K, et al. Early post-transplant recurrence of oxalate nephropathy in a patient with primary hyperoxaluria type 1, despite pretransplant lumasiran therapy. Kidney International. 2022;101(1):185–6. https://doi.org/10.1016/j.kint.2021.10.022
25. Poyah P, Bergman J, Geldenhuys L, Wright G, Walsh NM, Hull P, et al. Primary Hyperoxaluria Type 1 (PH1) Presenting With End-Stage Kidney Disease and Cutaneous Manifestations in Adulthood: A Case Report. Canadian Journal of Kidney Health Diseases. 2021;8. https://doi.org/10.1177/20543581211058931
26. Garrelfs S, Frishberg Y, Hulton S, Koren M, O’Riordan W, Cochat P, et al. LB002 ILLUMINATE-A, a phase 3 study of lumasiran, an investigational RNAI therapeutic, in children and adults with primary hyperoxaluria type 1 (PH1). Nephrology Dialysis Transplantation. 2020;35(Supplement 3):gfaa146. LB002. https://doi.org/10.1093/ndt/gfaa146.LB002
Об авторах
С. НаджафиИран
Сара Наджафи
Мешхед
Ф. Абасабади
Иран
Фатима Абасабади
Тегеран
М. С. Сагафи
Иран
Мохаммад Садра Сагафи
Кум
Ф. Косрави
Иран
Фарбод Хосрави
Тегеран
М. Рахманян
Иран
Мохаммад Рахманян
Тегеран
Дополнительные файлы
Рецензия
Для цитирования:
Наджафи С., Абасабади Ф., Сагафи М.С., Косрави Ф., Рахманян М. Безопасность и эффективность терапии первичной гипероксалурии 1-го типа с использованием малых интерферирующих РНК-агентов (лумасиран): систематический обзор. Медицина экстремальных ситуаций. 2025;27(4):525-535. https://doi.org/10.47183/mes.2025-344
For citation:
Najafi S., Abasabadi F., Saghafi M.S., Khosravi F., Rahmanian M. Safety and efficacy of small interfering RNA agents (lumasiran) in therapy for primary hyperoxaluria type 1: A systematic review. Extreme Medicine. 2025;27(4):525-535. https://doi.org/10.47183/mes.2025-344

















