Перейти к:
Изучение общетоксического действия у крыс при имплантации гемостатического средства на основе хитозана
https://doi.org/10.47183/mes.2024-26-4-49-57
Аннотация
Введение. Остановка продолжающегося кровотечения при выполнении полостных оперативных вмешательств является актуальной проблемой хирургии как гражданского, так и военного здравоохранения. Разработка и внедрение в клиническую практику нового эффективного и доступного средства для остановки внутреннего кровотечения будет способствовать повышению выживания пострадавших.
Цель. Изучение общетоксического и местного токсического действия местного гемостатического средства (МГС) для внутриполостного применения.
Материалы и методы. Исследование проведено на 20 беспородных крысах (10 самцов и 10 самок) массой 180–220 г. Опытной группе животных местное гемостатическое средство имплантировали в брюшную полость в дозе 512 мг/кг массы тела (м.т.). Животным контрольной группы проводили операцию без имплантации МГС. Анализ данных осуществляли с помощью программ Microsoft Excel 2013 и Statistica 10.0.
Результаты. Результаты оценки состояния опытных животных, их массы тела, кормо- и водопотребления и массовые коэффициенты внутренних органов не отличались от результатов контрольных групп. Оценка гематологических и биохимических показателей крови крыс показала отсутствие выхода значений за пределы референтной нормы. При макро- и микроскопическом изучении внутренних органов животных зафиксировано наличие местнораздражающего действия изучаемого образца.
Заключение. Таким образом, лабораторные животные хорошо перенесли внутрибрюшинную имплантацию МГС в дозе 512 мг/кг м.т.; соответственно дальнейшее изучение его токсических свойств и эффективности является перспективным.
Ключевые слова
Для цитирования:
Носов А.М., Бондаренко А.А., Катрецкая Г.Г., Головко К.П., Шульц А.В., Волкова М.В., Золотоверхая Е.А., Кубарская Л.Г., Бажанова Е.Д., Гайкова О.Н. Изучение общетоксического действия у крыс при имплантации гемостатического средства на основе хитозана. Медицина экстремальных ситуаций. 2024;26(4):49-57. https://doi.org/10.47183/mes.2024-26-4-49-57
For citation:
Nosov A.M., Bondarenko A.A., Katretskaya G.G., Golovko K.P., Shultz A.V., Volkova M.V., Zolotoverkhaja E.A., Kubarskaya L.G., Bazhanova E.D., Gaikova O.N. General toxic effect of a chitosan-based hemostatic agent implanted in rats. Extreme Medicine. 2024;26(4):49-57. https://doi.org/10.47183/mes.2024-26-4-49-57
ВВЕДЕНИЕ
Достижение гемостаза во время выполнения оперативных вмешательств остается актуальной проблемой хирургии XXI века. Наиболее значимой данная проблема является для раненых и пострадавших с политравмой, у которых своевременная остановка кровотечения не только влияет на сроки лечения, но зачастую определяет исход лечения.
Дорожно-транспортные происшествия, неблагоприятная криминогенная обстановка, террористические акты и военные конфликты вносят свой неутешительный вклад в статистику этого вида травм. Так, в исследовании А.П. Трухана и соавт. было установлено, что в результате террористических актов в Санкт-Петербурге и Минске несовместимые с жизнью повреждения как непосредственная причина смерти были зарегистрированы лишь в 33,3% случаев, в то же время необратимая кровопотеря была непосредственной причиной смерти у 66,7% погибших [1]. Наиболее частой (практически в 87,5% случаев) причиной летального исхода пострадавших являлось внутреннее кровотечение. В структуре причин летальных исходов при ранениях, полученных во время вооруженных конфликтов, в 78,1 % случаев именно продолжающаяся геморрагия становилась причиной смерти, при этом более половины из них составляли внутренние кровотечения [2–6].
Несмотря на то что внутреннее кровоизлияние практически невозможно остановить на догоспитальном этапе оказания помощи, даже своевременная доставка пострадавшего в операционную требует немедленного контроля кровотечения. На фоне травматического шока и геморрагии развивается каскад патофизиологических реакций, включающих гипотермию, гипокоагуляцию и ацидоз (летальная триада). Ранняя остановка кровотечения является необходимым условием для успешного лечения раненого не только в остром периоде травматического шока, но и в III периоде травматической болезни (развития инфекционных осложнений) [1].
При этом технические трудности при интраоперационной остановке кровотечений возникают не только в ургентной хирургии (травмы, ранения), но и в плановой хирургии, особенно у пациентов с сопутствующей коагулопатией или на фоне приема дезагрегантов и антикоагулянтов [7–10].
В настоящее время для остановки кровоизлияний, возникающих во время полостных операций, используются различные методы: прошивание раны, тугая тампонада, различные виды электрокоагуляции, в ряде случаев требуется применение местных гемостатических средств (МГС) [11]. Для внутриполостного использования, как правило, применяются МГС на основе фибриногена, целлюлозы, коллагена, фибрина, тромбина, экстрактов растений, мукополисахаридов (крахмалы) и т.д. [12].
Хитозан благодаря его широкой доступности и биосовместимости является одним из перспективных веществ для получения МГС. Было установлено, что материалы на основе хитозана и/или модифицированного хитозана (суспензии, губки, бинты и т.п.) эффективны для остановки кровотечений in vitro и способствуют свертыванию путем активации тромбоцитов и/или агглютинации эритроцитов [13–17].
Ранее в ходе экспериментальных работ нами была продемонстрирована высокая эффективность МГС на основе хитозана в модели интенсивного внутрибрюшного кровотечения у крупных биообъектов [18].
Однако, несмотря на то что хитозан и его производные хорошо изучены, следует учесть, что из-за широкой вариабельности рецептурных составляющих каждый вновь разрабатываемый полимер перед использованием в клинической практике необходимо изучать не только с точки зрения эффективности, но и в отношении его безопасности для потенциального пациента. Под безопасностью мы подразумеваем как биосовместимость с морфологическими структурами, которые находятся в зоне непосредственного контакта, так и общую токсичность для организма. Данные исследования необходимо проводить в том числе в связи с возможным оставлением материала в организме человека.
Цель нашего исследования — изучение общетоксического и местного токсического действия гемостатического средства для внутриполостного применения на следующей основе: хитозан молочнокислый 90%, глицерин 5%, кальция хлорид 5%.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена на базе лабораторий ФГБУ НКЦТ им. С.Н. Голикова ФМБА России.
Исследование проведено на 20 беспородных крысах (10 самцов и 10 самок) массой 180–220 г, полученных из ФГУП ПЛЖ «Рапполово» — НИЦ «Курчатовский институт», распределенных на группы: опытная (самцы и самки) — животным вводили местное гемостатическое средство (МГС) и контрольная (самцы и самки) — ложно оперированные животные. Животные были распределены по группам по полу и с использованием в качестве основного критерия массы тела таким образом, чтобы индивидуальное значение массы тела не отклонялось от среднего значения в пределах одного пола более чем на 10%. До начала исследования всех животных адаптировали к условиям содержания в течение 5 сут. Во время этого периода ежедневно контролировали общее состояние крыс путем визуального осмотра.
Дозу МГС для введения животным рассчитывали исходя из дозы, которая применялась в исследовании эффективности, — 90 мг/кг (по готовой лекарственной форме (ГЛФ)) [18]. С учетом метаболического коэффициента величина дозы МГС для крыс составила: 90×37 (метаболический коэффициент для человека массой 60 кг)/6,5 (метаболический коэффициент для крысы массой 200 г) ≈ 512 мг/кг [19]. Таким образом, исследуемая доза изучаемого образца, вводимого крысам, составила 512 мг/кг массы тела. Масса имплантируемого МГС и соответственно доза препарата для каждого животного рассчитывалась исходя из значения его веса. В ходе исследования использовали стерильные образцы (радиационная стерилизация) МГС. МГС имплантировали в брюшную полость крыс в нативном виде. МГС представляют собой пластины светло-желтого цвета с рельефной поверхностью и пористой структурой, толщиной от 4 до 6 мм. Внешний вид изделия представлен на рисунке 1.

Рисунок подготовлен авторами
Рис. 1. Внешний вид местного гемостатического средства
Животным контрольных групп было проведено оперативное вмешательство без имплантации исследуемого образца (ложно оперированные животные).
Для введения животных в наркоз при проведении имплантации МГС использовали инъекционный анестетик общего действия тилетамин/золазепам (Золетил® 100). Данный препарат обладает хорошим анальгетическим и седативным эффектом. Препарат вводили внутрибрюшинно в дозе 50 мг/кг м.т., полное расслабление и отсутствие болевой чувствительности наступало через 10–15 мин после введения препарата. Средняя продолжительность анестезии составляла 60–90 мин.
Операционное поле подготавливали по общепринятой методике с соблюдением правил асептики и антисептики. В область разреза для обезболивания подкожно вводили Лидокаин раствор для инъекций 20 мг/мл в объеме 0,2 мл. Во время анестезии глаза животных оставались открытыми, и для профилактики развития сухого кератоконъюнктивита наносили глазной гель Видисик®.
Ход операции. Для выполнения срединной лапаротомии животное находилось в дорсальном положении. Разрез кожи выполнялся по средней линии от пупка в каудальном направлении длиной около 1 см, затем тупым способом осуществлялось препарирование тканей до визуализации белой линии живота, брюшину рассекали скальпелем, края брюшной стенки захватывали пинцетом и приподнимали вверх для удобства визуализации органов брюшной полости крысы. Следует отметить, что аппликация МГС производилась в сухом виде, исследуемый материал свободно располагали в брюшной полости (рис. 2).
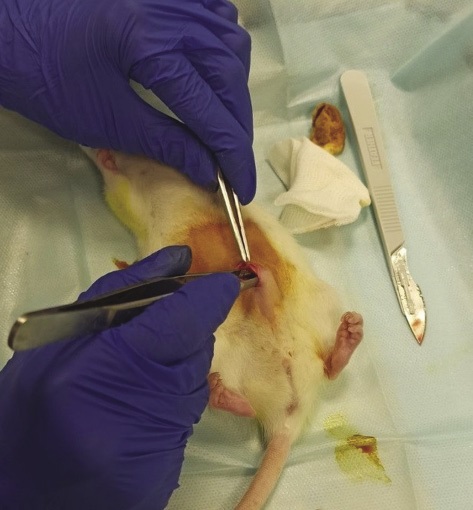
Рисунок подготовлен авторами
Рис. 2. Имплантация местного гемостатического средства в брюшную полость крысы
Затем брюшную полость послойно ушивали (рис. 3). Экспериментальных животных для восстановления после наркоза помещали в обогреваемую клетку с теплым полом. Полное пробуждение животных наступало спустя 2–3 ч после введения в наркоз.
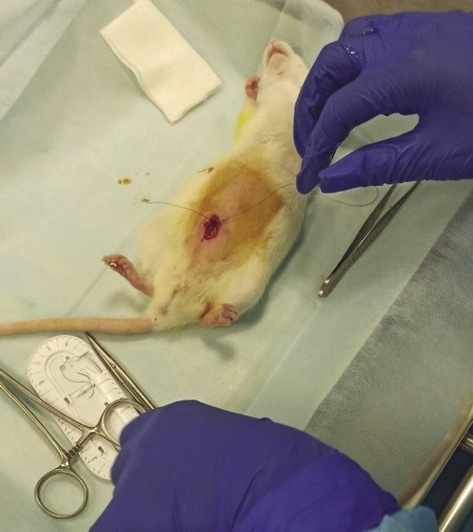
Рисунок подготовлен авторами
Рис. 3. Ушивание брюшины крысы после имплантации местного гемостатического средства
В ходе исследования оценивали выживаемость животных, клиническую картину интоксикации, динамику массы тела, водо- и кормопотребление, проводили оценку гематологических и биохимических показателей, макро- и микроскопическое изучение внутренних органов, рассчитывали массовые коэффициенты органов и оценивали местные реакции после имплантации МГС [20].
Ежедневно оценивали общее состояние крыс, отмечали отклонения в потреблении корма и воды животными в отдельных клетках. Массу тела контролировали за день перед имплантацией МГС, а затем еженедельно после введения в эксперимент. Масса тела голодного животного непосредственно перед некропсией была взята для расчета процентного отношения массы внутренних органов к массе тела животного. Животные лишались корма в ночь перед некропсией. Доступ к воде при этом не ограничивался.
Забор крови для изучения гематологических и биохимических показателей осуществляли на 29-е сут исследования путем обескровливания животных после ингаляции углекислого газа (СО2).
Забор биологического материала у животных осуществлялся после 14–15-часового голодания. Кровь крыс в количестве 0,5 мл отбиралась в пробирки для отбора крови с этилендиаминтетрауксусной кислотой (ЭДТА). Проба крови тщательно перемешивалась и помещалась в холодильник. Анализ пробы производился через 120 мин после забора биологического материала. Для общеклинического анализа крови использовали автоматический гематологический анализатор Advia 2120 фирмы Siemens (Германия). Гематологический анализатор полностью автоматизирован для подсчета клеток крови и эритроцитарных индексов [21].
Для оценки биохимических показателей забор крови производили в сухой вакутейнер. Для получения сыворотки крови пробы цельной крови центрифугировали при 3000 об/мин, при 4°С в течение 10 мин, после чего отбирали надосадочную жидкость — сыворотку. Определение биохимических показателей (общий белок, мочевина, креатинин, глюкоза, холестерин, общий билирубин, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза (ЩФ)) производили на биохимическом анализаторе А-25 фирмы «BioSystems» (Испания) с использованием наборов АО «Вектор-Бест» (Россия). Внутренний контроль качества исследований производился на контрольных материалах АО «Вектор-Бест» (Россия) [22].
В качестве метода эвтаназии использовали ингаляцию СО2 с последующим обескровливанием. Для эвтаназии использовали установку для эвтаназии фирмы Open Science (Россия) [23].
На 29-е сут исследования животные были подвергнуты полной некропсии, которая включала осмотр внешней поверхности тела, всех проходов, черепной, грудной, брюшной полостей и их содержимого. При запланированной некропсии у всех исследуемых животных были взвешены головной мозг, сердце, легкие (пара), печень, надпочечники (пара), почки (пара), селезенка, яичники/семенники (пара), тимус. Парные органы были взвешены вместе. Кроме абсолютного веса органов, рассчитывали отношение веса органа к массе тела животного, представленное в процентилях (‰). У животных был выполнен гистологический анализ выделенных органов и тканей с дополнительной оценкой местного действия МГС после его имплантации (гистология брюшины). Проведен забор образцов ткани, которые были обезвожены, пропитаны парафином; подготовленные срезы окрашивали гематоксилином и эозином. Гистологические препараты были исследованы методом световой микроскопии с помощью микроскопа Leica DM1000 (Германия) под 100-кратным увеличением.
Математико-статистический анализ результатов осуществляли с использованием пакетов программного обеспечения Microsoft Excel 2013 и Statistica 10.0. Для оценки различий между двумя группами был использован U-тест Манна — Уитни (Mann–Whitney test) [24]. Описательную статистику представляли в виде меры центральной тенденции и показателей разброса. Рассчитывали следующие описательные статистики количественных показателей: медиана (Me), верхняя (UQ) и нижняя (LQ) квартили. Статистически значимыми считали различия в показателях у животных опытных групп по отношению к контролю при р ≤ 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
После внутрибрюшинной имплантации исследуемого образца МГС крысам в дозе 512 мг/кг м.т. не зарегистрированы летальные исходы, животные по внешнему виду и поведению не отличались от животных из контрольной группы. Зарегистрирована гибель одного самца в контрольной группе ложно оперированных животных вследствие послеоперационных осложнений. Клиническое состояние экспериментальных животных было удовлетворительным в течение всего периода наблюдения. Признаков интоксикации не отмечено ни у одного животного. Потребление воды и корма у крыс из опытной и контрольной групп не отличалось.
Изучение воздействия исследуемого образца на массу тела половозрелых животных проводили на основании сравнительной оценки массы тела крыс после имплантации исследуемого образца и ложно оперированных животных на нескольких этапах обследования: фон (за день до имплантации МГС), 1-я, 2-я, 3-я и 4-я недели эксперимента.
Данные о массе тела крыс исследуемых групп представлены на рисунках 4 и 5. Важно отметить, что исходные (фоновые) уровни массы тела животных, как самок, так и самцов, значимо не различались в группах с имплантацией образца МГС и контрольной группе.
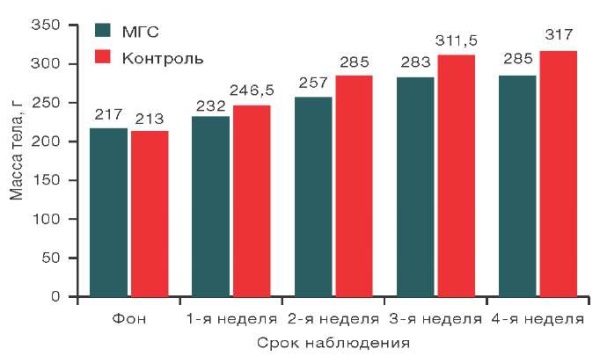
Рисунок подготовлен авторами по собственным данным
Рис. 4. Динамика массы тела крыс самцов на различных сроках наблюдения
Примечание: данные представлены в виде медианных значений.
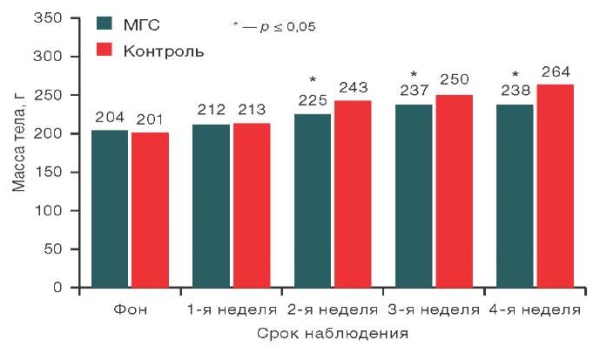
Рисунок подготовлен авторами по собственным данным
Рис. 5. Динамика массы тела крыс самок на различных сроках наблюдения
Примечание: данные представлены в виде медианных значений.
При сравнительной оценке массы тела самцов крыс после имплантации исследуемого образца и массы животных из контрольной группы в срок наблюдения: фон (за день до имплантации), 1-я, 2-я, 3-я и 4-я недели с использованием Mann–Whitney test значимых различий между исследуемыми группами не выявлено. В то же время выявлены статистически значимые различия в массе тела самок крыс из опытной группы на 2-й неделе наблюдения (р = 0,022), 3-й неделе (р = 0,034) и 4-й неделе (р = 0,012) по сравнению с контролем. Анализ данных, представленных на рисунке 5, показал, что значения массы тела самок крыс из опытной группы были статистически значимо ниже контрольных на 2-й неделе на 7,4%, на 3-й неделе на 5,2%, на 4-й неделе на 9,9%, хотя значения и не выходили за пределы референсных показателей для данного вида животных.
В таблице 1 приведены данные гематологических показателей у животных контрольной и экспериментальной групп. Анализ значений гематологических параметров у крыс самцов опытной группы выявил статистически достоверное увеличение доли моноцитов на 18% и абсолютного количества моноцитов на 42% по сравнению с контрольной группой животных. В то время как в результате исследования и последующей оценки значений гематологических параметров у самок из экспериментальной группы по сравнению с контролем выявлено статистически достоверное снижение концентрации гемоглобина и среднего объема эритроцита на 5 и 7% соответственно [25].
Таблица 1. Сравнительная оценка гематологических показателей крыс самцов и самок опытной и контрольной групп через 29 сут после начала эксперимента
Показатель | Контроль (♂) | МГС, 512 мг/кг м.т. (♂) | Контроль (♀) | МГС, 512 мг/кг м.т. (♀) |
Число животных в группе | 4 | 5 | 5 | 5 |
Количество лейкоцитов, 10³/мкл | 9,68 [ 8,17; 11,70] | 10,84 [ 10,19; 12,71] | 7,51 [ 7,43; 8,16] | 7,99 [ 7,09; 8,94] |
Количество эритроцитов, 10⁶/мкл | 7,58 [ 7,52; 8,20] | 7,58 [ 7,55; 7,91] | 7,36 [ 7,31; 7,37] | 7,42 [ 7,31; 7,63] |
Концентрация гемоглобина, г/дл | 14,95 [ 14,20; 15,95] | 14,80 [ 14,80; 15,00] | 14,30 [ 14,10; 14,50] | 13,60* [ 13,00; 13,80] |
Гематокрит, % | 42,25 [ 41,25; 46,00] | 42,50 [ 42,40; 43,20] | 41,90 [ 41,40; 42,20] | 40,30 [ 39,00; 41,20] |
Средний объем эритроцита, фл | 55,20 [ 54,50; 56,65] | 55,90 [ 54,60; 56,40] | 57,20 [ 57,00; 57,30] | 53,40* [ 52,60; 55,60] |
Количество тромбоцитов, 10³/мкл | 787,00 [ 686,00; 928,00] | 826,00 [ 601,00; 978,00] | 983,00 [ 962,00; 1022,00] | 970,00 [ 946,00; 1092,00] |
Средний объем тромбоцита, фл | 6,85 [ 6,55; 7,75] | 6,90 [ 6,70; 7,10] | 7,10 [ 7,00; 7,20] | 7,20 [ 7,10; 7,30] |
Доля нейтрофилов, % | 28,20 [ 20,75; 38,25] | 25,80 [ 23,20; 25,90] | 21,10 [ 20,50; 32,40] | 35,50 [ 28,80; 47,40] |
Доля лимфоцитов, % | 66,95 [ 56,00; 72,85] | 66,60 [ 65,30; 68,20] | 70,70 [ 61,40; 74,90] | 59,40 [ 46,40; 65,10] |
Доля моноцитов, % | 3,45 [ 2,70; 3,65] | 4,20* [ 4,10; 4,50] | 2,80 [ 2,70; 3,00] | 2,70 [ 2,10; 2,70] |
Доля эозинофилов, % | 0,85 [ 0,75; 1,60] | 0,80 [ 0,80; 1,10] | 1,20 [ 1,20; 1,50] | 1,10 [ 0,90; 2,10] |
Доля базофилов, % | 0,90 [ 0,75; 1,20] | 1,00 [ 0,80; 1,20] | 0,70 [ 0,60; 1,80] | 0,40 [ 0,40; 0,50] |
Доля неидентифицированных клеток, % | 0,75 [ 0,60; 1,00] | 1,10 [ 1,00; 2,00] | 0,90 [ 0,90; 1,10] | 0,90 [ 0,60; 0,90] |
Количество нейтрофилов, 10³/мкл | 3,22 [ 2,01; 3,86] | 2,64 [ 2,33; 2,80] | 2,06 [ 1,50; 2,54] | 3,25 [ 2,30; 3,55] |
Количество лимфоцитов, 10³/мкл | 6,82 [ 5,02; 7,80] | 7,08 [ 6,78; 7,28] | 5,48 [ 5,01; 5,74] | 4,15 [ 3,18; 5,35] |
Количество моноцитов, 10³/мкл | 0,30 [ 0,28; 0,33] | 0,52* [ 0,40; 0,55] | 0,21 [ 0,20; 0,24] | 0,19 [ 0,17; 0,25] |
Количество эозинофилов, 10³/мкл | 0,09 [ 0,08; 0,15] | 0,09 [ 0,07; 0,14] | 0,09 [ 0,09; 0,11] | 0,08 [ 0,08; 0,09] |
Количество базофилов, 10³/мкл | 0,10 [ 0,08; 0,11] | 0,11 [ 0,10; 0,11] | 0,05 [ 0,05; 0,18] | 0,03 [ 0,02; 0,05] |
Количество неидентифицированных клеток, 10³/мкл | 0,07 [ 0,07; 0,09] | 0,14 [ 0,10; 0,19] | 0,08 [ 0,07; 0,09] | 0,06 [ 0,05; 0,07] |
Таблица составлена авторами по собственным данным
Примечание: данные представлены в виде Me [ LQ; UQ]. * статистическая значимость различий контрольной и экспериментальной групп, p < 0,05.
Биохимические показатели исследовались через 29 сут после начала эксперимента у контрольных животных (самцов и самок), а также у животных опытной группы с имплантированным МГС (табл. 2).
Таблица 2. Сравнительная оценка биохимических показателей крыс самцов и самок опытной и контрольной групп через 29 сут после начала эксперимента
Показатель | Контроль (♂) | МГС, 512 мг/кг м.т. (♂) | Контроль (♀) | МГС, 512 мг/кг м.т. (♀) |
Число животных в группе | 4 | 5 | 5 | 5 |
Общий белок, г/л | 81,4 [ 75,9; 87,5] | 74,5 [ 71,9; 77,0] | 77,8 [ 77,6; 85,9] | 80,4 [ 79,0; 81,0] |
Мочевина, ммоль/л | 6,0 [ 5,3; 7,3] | 8,7 [ 7,6; 9,0] | 7,5 [ 7,0; 8,9] | 10,0 [ 8,1; 10,8] |
Креатинин, мкмоль/л | 54,0 [ 50,5; 62,5] | 55,0 [ 55,0; 55,0] | 50,0 [ 49,0; 52,0] | 64,0 [ 63,0; 70,0] |
Глюкоза, ммоль/л | 8,8 [ 8,2; 9,9] | 9,2 [ 9,0; 9,4] | 10,5 [ 9,8; 10,7] | 9,8 [ 9,5; 9,9] |
Холестерин, ммоль/л | 2,5 [ 2,2; 3,0] | 2,6 [ 2,1; 2,8] | 2,8 [ 2,4; 3,1] | 2,3 [ 2,2; 2,7] |
Билирубин общий, мкмоль/л | 1,7 [ 1,4; 1,7] | 1,5 [ 1,3; 2,2] | 1,2 [ 0,9; 1,4] | 0,6 [ 0,2; 1,1] |
АСТ, ЕД/л | 166,0 [ 148,6; 171,3] | 196,5* [ 195,9; 200,6] | 73,7 [ 54,4; 74,6] | 102,0 [ 73,3; 114,4] |
АЛТ, ЕД/л | 76,0 [ 66,5; 86,0] | 81,0 [ 79,0; 90,0] | 70,0 [ 69,0; 77,0] | 69,0 [ 65,0; 71,0] |
Щелочная фосфатаза, ЕД/л | 349,0 [ 265,5; 428,5] | 297,0 [ 275,0; 315,0] | 188,0 [ 182,0; 224,0] | 236,0 [ 210,0; 283,0] |
Таблица составлена авторами по собственным данным
Примечание: данные представлены в виде Me [ LQ; UQ]. * статистическая значимость различий контрольной и экспериментальной групп, p < 0,05.
Установлено, что в группе крыс-самцов после имплантации МГС отмечалось достоверное повышение активности аспартатаминотрансферазы на 18% по сравнению с контрольной группой.
При проведении макроскопического осмотра шерсть животных имела опрятный вид, была блестящей, без очагов облысения. При осмотре грудной и брюшной полостей нарушений в расположении внутренних органов не отмечалось. На поверхности брюшины и в брыжейке у животных экспериментальных групп наблюдали фрагменты МГС, которые образовывали плотный конгломерат (рис. 6).
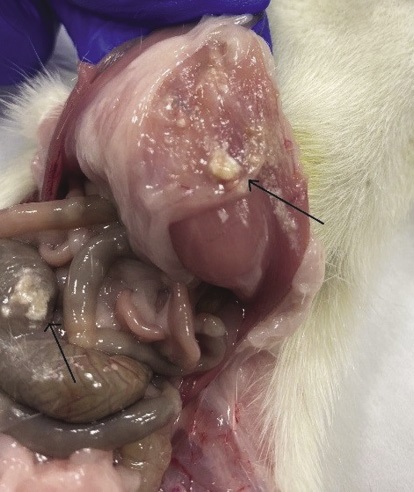
Рисунок подготовлен авторами
Рис. 6. Фрагменты местного гемостатического средства в брюшной полости крысы
Примечание: фрагменты обозначены стрелками.
В контрольной группе животных изменений на поверхности брюшины не было отмечено. В опытной группе в одном случае имело место образование свища передней брюшной стенки, формирование которого обусловлено реакцией отторжения инородного тела.
При осмотре внутренних органов тимус имел треугольную форму, беловатый цвет и умеренно плотную консистенцию. Величина и форма сердца не изменены. Поверхность легких имела бледно-розовую окраску, легкие спадались при вскрытии грудной клетки. Селезенка имела темно-вишневый цвет, гладкую поверхность и плотноватую консистенцию. Желудок имел обычную форму и размеры, просвет был заполнен плотным пищевым содержимым. Слизистая тонкой и толстой кишки была блестящей, гладкой. Поджелудочная железа имела бледно-розовой цвет, дольчатое строение. Величина и форма печени, почек, надпочечников, семенников и яичников не изменены. Вещество головного мозга имело умеренную плотность, расширения желудочков не наблюдалось.
При оценке массовых коэффициентов внутренних органов крыс самцов и самок после имплантации МГС в дозе 512 мг/кг м.т. и контрольных животных с использованием Mann–Whitney test не установлено статистически значимых различий между всеми исследуемыми группами.
При гистологическом исследовании препаратов головного мозга, сердца, легких, почек, тимуса, семенников, яичников, надпочечников и селезенки контрольных животных и животных с имплантацией МГС в брюшную полость через 29 сут после начала исследования существенных различий между группами не выявлено. В печени животных обеих групп регистрировали умеренно или резко выраженную жировую дистрофию гепатоцитов: в 7 случаях в опытной группе с имплантацией МГС и в 6 случаях у контрольных животных. При этом у одного животного из опытной группы и у одного из контрольной регистрировали мелкие некрозы с умеренно выраженной лимфо-макрофагальной инфильтрацией. Данные изменения могли быть вызваны послеоперационным стрессом [26].
При гистологическом исследовании на поверхности брюшины в опытной группе животных были видны фрагменты МГС, окруженные слоем лимфоцитов и лейкоцитов и молодой волокнистой соединительной тканью, была также отмечена лейко-лимфоцитарная инфильтрация (рис. 7), являющиеся признаками местнораздражающего действия. В контрольной группе регистрировали незначительное скопление лимфоцитов и макрофагов.
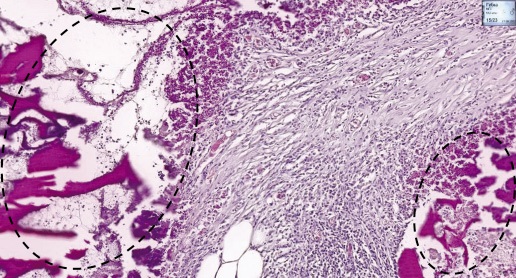
Рисунок подготовлен авторами
Рис. 7. Гистологический срез брюшины крысы после имплантации местного гемостатического средства
Примечание: пунктирной линией выделены фрагменты МГС, окруженные слоем лимфоцитов и лейкоцитов и молодой волокнистой соединительной тканью. Окраска гематоксилином и эозином, 100-кратное увеличение
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В результате проведенного исследования было установлено, что внутрибрюшинная имплантация исследуемого образца в дозе 512 мг/кг м.т. не приводила к гибели животных или к развитию каких-либо признаков интоксикации.
Животные опытной группы по внешнему виду и поведению не отличались от животных контрольной группы. Общее состояние подопытных животных было удовлетворительным на протяжении всего эксперимента, показатели водо- и кормопотребления не отличались от контроля. Показатели массы тела крыс-самцов не отличались от контроля, тогда как показатели массы тела самок были статистически значимо ниже по сравнению с контролем на нескольких этапах обследования, но при этом масса тела животных внутри своей группы не снижалась на протяжении всего исследования. Различия массы тела самок опытной и контрольной групп могли быть связаны с послеоперационным стрессом.
При анализе гематологических показателей у животных в ходе эксперимента установлено статистически достоверное увеличение доли моноцитов и абсолютного количества моноцитов у крыс-самцов опытной группы по сравнению с контрольной группой животных, вероятно, связанное с воспалительной реакцией, протекающей в брюшной полости крыс.
У крыс-самок с имплантированным МГС отмечали статистически значимое снижение концентрации гемоглобина и среднего объема эритроцитов по сравнению с контролем, вызванное, по всей видимости, местнораздражающей реакцией брюшины.
Установленное повышение активности аспартатаминотрансферазы в группе крыс-самцов после имплантации МГС по сравнению с контрольной группой, вероятно, связано с повреждением печени животных из-за послеоперационного стресса [26].
Необходимо отметить, что колебания гематологических и биохимических показателей у животных не выходили за пределы референсных интервалов, установленных для данного вида животных [25].
Оценка массовых коэффициентов внутренних органов крыс после имплантации МГС в дозе 512 мг/кг м.т. показала отсутствие статистически значимых различий между исследуемыми группами. Морфологические макроскопические исследования не выявили у экспериментальных животных изменений структуры внутренних органов, через 29 суток после начала эксперимента в брюшине и в брыжейке наблюдали фрагменты МГС, которые формировали плотный конгломерат. По результатам гистологической оценки местного действия после имплантации МГС выявлены признаки местнораздражающего действия (по сравнению с контрольной группой животных). Формирование свища передней брюшной стенки у одного из самцов группы контроля позволяет предположить, что представленные образцы МГС необходимо удалять по достижении гемостаза.
ЗАКЛЮЧЕНИЕ
Исследование показало, что внутрибрюшинная имплантация образца в дозе 512 мг/кг м.т. не вызвала гибели животных или признаков интоксикации. Масса тела крыс-самок была статистически значимо ниже контрольных на 2, 3, 4-й неделе наблюдения, но значения не выходили за пределы референсных показателей для данного вида животных.
При внутрибрюшинной имплантации образца в дозе 512 мг/кг м.т. у крыс-самцов по сравнению с контролем отмечено увеличение доли абсолютного количества моноцитов, а также повышение активности АсАт, не выходящих за пределы референсных значений, что могло быть связано с местнораздражающим действием образца и/или послеоперационным стрессом.
Патоморфологические исследования не выявили изменений в структуре внутренних органов животных. На брюшине и в брыжейке крыс были обнаружены фрагменты МГС, которые сформировали плотный конгломерат. Гистологическая оценка тканей показала признаки местнораздражающего действия.
Полученные в результате проведенного исследования данные свидетельствуют о нормальной переносимости животными (крысами) имплантации местного гемостатического средства в брюшную полость в дозе 512 мг/кг м.т. и позволяют рекомендовать его для дальнейших исследований токсичности, а также специфических видов активности.
Для оценки биосовместимости и возможного срока биодеградации местного гемостатического средства необходимо проведение дополнительных исследований. Исследование биосовместимости и биодеградации МГС на основе хитозана целесообразно провести на крупных лабораторных животных (свиньях) с целью последующей экстраполяции полученных результатов на человека.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.А. Бондаренко — разработка протокола исследования, выполнение экспериментальной части работы, статистическая обработка полученных экспериментальных данных; А.В. Шульц — выполнение экспериментальной части работы; Г.Г. Катрецкая — научное руководство, написание раздела введение; Е.А. Золотоверхая, Л.Г. Кубарская — проведение биохимических и гематологических исследований крови; Е.Д. Бажанова, О.Н. Гайкова — проведение гистологического исследования органов; А.М. Носов, К.П. Головко, М.В. Волкова — разработка образцов местного гемостатического средства, разработка протокола исследования.
Список литературы
1. Трухан АП, Самохвалов ИМ, Толмачев ИА, Исаков ВД, Головко КП, Скакунова ТЮ и др. Роль кровопотери в структуре факторов танатогенеза при взрывной травме мирного времени. Вестник Российской Военно-медицинской академии. 2020;2(70):66-9.
2. Самохвалов ИМ, Гончаров АВ, Чирский ВС, Носов АМ, Головко КП, Бадмаев ВБ и др. Потенциально спасаемые раненые — резерв снижения догоспитальной летальности при ранениях и травмах. Скорая медицинская помощь. 2019;20(3):10–7.
3. Янбарисова ЭВ, БадретдиноваЮА, Хасанов АГ. Диагностика и хирургическая тактика при повреждениях паренхиматозных органов брюшной полости. Успехи современного естествознания. 2014;6:73–6.
4. Чумаков АА, Малашенко ВН, Хореев АН, Козлов СВ. Показания к лечебнодинамическим видеолапароскопиям при проникающих ранениях брюшной полости. Мат-лы второй науч.-практич. конф. хирургов Северо-Запада и 23 Республики Карелия совместно с Санкт-Петербургским НИИ скорой помощи. Петрозаводск; Республика Карелия; 2000.
5. Schoenfeld AJ. The combat experience of military surgical assets in Iraq and Afghanistan: a historical review. American journal of surgery. 2012;204(3):377–83. https://doi.org/10.1016/j.amjsurg.2011.09.028
6. Hoencamp R, Vermetten E, Tan E. Systematic review of the prevalence and characteristics of battle casualties from NATO coalition forces in Iraq and Afghanistan. Injury. 2014;45(7):1028–34. https://doi.org/10.1016/j.injury.2014.02.012
7. Атаджанов ШК. Анализ осложнений лапароскопических холецистэктомий и пути их профилактики. Журн. теорет. и клин. мед. 2005;2:89–93.
8. Хаджибаев АМ, Маликов ЮР, Атаджанов ШК, Эрметов АТ, Саметдинов НЮ. Лапароскопические вмешательства в диагностике и лечении послеоперационных внутрибрюшных осложнений в ургентной абдоминальной хирургии. Анналы хир. гепатол. 2005;10(2):230.
9. Шинкевич ДС, Магилевец МВ. Сравнительная оценка различных методов хирургического гемостаза, применяемых при удалении зубов у гематологических пациентов. Матлы национ. конгресса с междунар. участием «Паринские чтения 2020»: Актуальные вопросы диагностики, лечения и диспансеризации пациентов с хирургической патологией челюстно-лицевой области и шеи; 7-8 мая 2020; Минск, Республика Беларусь. Минск: Белорусский государственный университет; 2020. С. 272–7.
10. Kim JC, Choi SS, Wang SJ, Kim SG. Minor complications after mandibular third molar surgery: type, incidence, and possible prevention. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 2006;102(2):4–11. https://doi.org/10.1016/j.tripleo.2005.10.050
11. Rago AP, Marini J, Duggan MJ, et al. Diagnosis and deployment of a self-expanding foam for abdominal exsanguination: Translational questions for human use. Journal of Trauma and Acute Care Surgery. 2015;78(3):607–13. https://doi.org/10.1097/TA.0000000000000558
12. Белозерская ГГ, Макаров ВА, Жидков ЕА, Малыхина ЛС, Сергеева ОА, Тер-Арутюнянц АА и др. Гемостатические средства местного действия (обзор). Химико-фармацевтический журнал. 2006;40(7):9–15.
13. Muxika A, Etxabide A, Uranga J, Guerrero P, de la Caba K. Chitosan as a bioactive polymer: Processing, properties and applications. International Journal of Biological Macromolecules. 2017;105:1358–68. https://doi.org/10.1016/j.ijbiomac.2017.07.087
14. Dowling MB, Kumar R, Keibler MA, Hess JR, Bochicchio GV, Raghavan SR. A self-assembling hydrophobically modified chitosan capable of reversible hemostatic action. Biomaterials. 2011;32(13):3351–7. https://doi.org/10.1016/j.biomaterials.2010.12.033
15. Okamoto Y, Yano R, Miyatake K, Tomohiro I, Shigemasa Y, Minami S. Effects of chitin and chitosan on blood coagulation. Carbohydr. Polym. 2003;(53):337-42. https://doi.org/10.1016/s0142-9612(01)00324-6
16. Paneva D, Manolova N, Rashkov I, Danchev D, Gel beads composed of chitosan and polyacids and their blood compatibility. J. Bioact. Compat. Polym. 2005;(20):133–51. https://doi.org/10.1177/0883911505051855
17. Wang X, Yan Y, Zhang R A comparison of chitosan and collagen sponges as hemostatic dressings. J. Bioact. Compat. Polym. 2006;(21):39–54. https://doi.org/10.1177/0883911506060201
18. Самохвалов ИМ, Головко КП, Гришин МС, Носов АМ, Лябах ДД, Ковалевский АЯ. Экспериментальное исследование эффективности местного гемостатического средства на основе хитозана и внешней компрессии живота для временной остановки внутрибрюшного кровотечения. Журнал Неотложная хирургия им. И.И. Джанелидзе. 2023;1:66–72.
19. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К; 2012.
20. ГОСТ ISO 10993-11-2021 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия. ГОСТ ISO 10993-11-2021 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия.
21. Меньшиков ВВ, Делекторская ЛН, Золотницкая РП. Лабораторные методы исследования в клинике. М.: Медицина; 1987
22. Лифшиц В.М., Сидельникова В.И. Биохимические анализы в клинике: справочник. М.: МИА; 1998.
23. Рыбакова АВ, Макарова МН. Методы эвтаназии лабораторных животных в соответствии с Европейской директивой 2010/63. Международный вестник ветеринарии. 2015;2:96-107.
24. Юнкеров ВИ. Математико-статистическая обработка данных медицинских исследований. СПб.: ВМедА; 2002.
25. Формирование пополняемого реестра ассоциированных со здоровьем референсных интервалов биометрических признаков лабораторных животных. Отчет о НИР (промежуточный). ФГБУ НКЦТ им. С.Н. Голикова ФМБА России, рук. Верведа АБ, исполн.: Бажанова ЕД, Генералова КР, Кубарская ЛГ, Бельская АВ и др. СПб.; 2021. 180 с. № ГР НИР AAAA-A20-120041690023-2. Деп. в ЦИТИС 09.12.2021, № ИКРБС 221121300357-3.
26. Иванова ЕА, Дзюман АН, Дворниченко МВ. Местная биосовместимость и биохимические маркеры цитолиза гепатоцитов при подкожной имплантации полилактидных матриц. Бюллетень сибирской медицины. 2022;21(4):63–71
Об авторах
А. М. НосовРоссия
Носов Артем Михайлович, канд. мед. наук
Санкт-Петербург
А. А. Бондаренко
Россия
Бондаренко Анастасия Александровна
Санкт-Петербург
Г. Г. Катрецкая
Россия
Катрецкая Галина Геннадьевна, канд. мед. наук
Санкт-Петербург
К. П. Головко
Россия
Головко Константин Петрович, д-р мед. наук, доцент
Санкт-Петербург
А. В. Шульц
Россия
Шульц Алена Викторовна
Санкт-Петербург
М. В. Волкова
Россия
Волкова Марина Викторовна, канд. биол. наук
Санкт-Петербург
Е. А. Золотоверхая
Россия
Золотоверхая Екатерина Андреевна, канд. биол. наук
Санкт-Петербург
Л. Г. Кубарская
Россия
Кубарская Лариса Георгиевна, канд. мед. наук
Санкт-Петербург
Е. Д. Бажанова
Россия
Бажанова Елена Давыдовна, д-р биол. наук
Санкт-Петербург
О. Н. Гайкова
Россия
Гайкова Ольга Николаевна, д-р мед. наук, проф.
Санкт-Петербург
Рецензия
Для цитирования:
Носов А.М., Бондаренко А.А., Катрецкая Г.Г., Головко К.П., Шульц А.В., Волкова М.В., Золотоверхая Е.А., Кубарская Л.Г., Бажанова Е.Д., Гайкова О.Н. Изучение общетоксического действия у крыс при имплантации гемостатического средства на основе хитозана. Медицина экстремальных ситуаций. 2024;26(4):49-57. https://doi.org/10.47183/mes.2024-26-4-49-57
For citation:
Nosov A.M., Bondarenko A.A., Katretskaya G.G., Golovko K.P., Shultz A.V., Volkova M.V., Zolotoverkhaja E.A., Kubarskaya L.G., Bazhanova E.D., Gaikova O.N. General toxic effect of a chitosan-based hemostatic agent implanted in rats. Extreme Medicine. 2024;26(4):49-57. https://doi.org/10.47183/mes.2024-26-4-49-57

















