Перейти к:
Корреляция параметров протеома крови с количеством некоторых бактерий кишечной микрофлоры у здоровых женщин
https://doi.org/10.47183/mes.2024-26-4-123-131
Аннотация
Введение. Микрофлора кишечника человека обладает целым спектром важных для организма функций: осуществляет неспецифическую противовоспалительную защиту посредством продукции бактериоцинов, органических кислот и веществ с бактериостатическими свойствами, стимулирует эукариотические клетки к синтезу муцина и веществ с антимикробной активностью, подавляет развитие воспалительных реакций в клетках эпителия кишечника. Очевидно, эти бактерии действуют синергично с иммунокомпетентными клетками кишечника, претерпевающими изменения в условиях невесомости, моделируемых с помощью «сухой» иммерсии. Регуляторные и метаболические изменения, происходящие во время модельных экспериментов, отражаются в том числе на белковом составе крови.
Цель. Выявление взаимосвязи между уровнем белков в крови человека и количеством E. coli, Lactobacillus spp., Enterococcus spp. и Bifidobacterium spp. в кишечнике с применением экспериментальной модели 3-суточной «сухой» иммерсии для потенциального использования в качестве клинических рекомендаций по коррекции микрофлоры кишечника, основываясь на данных протеомного профиля крови.
Материалы и методы. Исследование проведено с участием 6 женщин возрастом 25–40 лет. Во время 3-суточной «сухой» иммерсии испытуемые находились в иммерсионной ванне полностью погруженными в воду комнатной температуры, исключая прямой контакт кожи испытуемых и воды. В ходе исследования отбирались фекальные пробы и образцы капиллярной крови у каждой из участниц. Для оценки количества белков проводили хромато-масс-спектрометрический анализ образцов высушенных пятен крови с использованием нано-ВЭЖХ Dionex Ultimate3000, совмещенным с масс-спектрометром TimsTOF Pro. Исследование количества кишечных бактерий проводили с помощью культурального посева предварительно разведенных образцов фекалий на селективные среды по стандартной методике с последующим учетом колоний.
Результаты. Регрессионная модель показала связь между уровнями отдельных белков и представителями кишечной микрофлоры. Была выявлена статистически значимая корреляционная взаимосвязь белков крови ENO1 (r = 0,71), MYH9 и SPTA1 (r = -0,99) с количеством E. coli; белков крови EPB41, VCP, C8B и CCT2 (r = 0,74) и белков FAH, YWHAE (r = -0,46) с количеством Bifidobacterium spp., а также достоверная сильная положительная корреляционная взаимосвязь между Lactobacillus spp. и белками ENO1, CA2 (r = 0,74), S100A6 и HSPA4 (r = -0,87). С количеством Enterococcus spp. коррелировал белок CALM2 (r = -0,76).
Выводы. Выявлены комплексы белков, количество которых коррелировало с количеством некоторых видов микрофлоры кишечника: белки, связанные с иммунной системой; белки, прямо или косвенно влияющие на процессы пищеварения и минеральный обмен; белки, влияющие на толерантность клеток к гипоксии.
Для цитирования:
Комиссарова Д.В., Пастушкова Л.Х., Каширина Д.Н., Ильин В.К., Ларина И.М. Корреляция параметров протеома крови с количеством некоторых бактерий кишечной микрофлоры у здоровых женщин. Медицина экстремальных ситуаций. 2024;26(4):123-131. https://doi.org/10.47183/mes.2024-26-4-123-131
For citation:
Komissarova D.V., Pastushkova L.Kh., Kashirina D.N., Ilyin V.K., Larina I.M. Correlation of blood proteome parameters to the number of certain intestinal microflora bacteria in healthy women. Extreme Medicine. 2024;26(4):123-131. https://doi.org/10.47183/mes.2024-26-4-123-131
ВВЕДЕНИЕ
Нормальная микрофлора кишечника человека представлена широким спектром микроорганизмов, большинство из которых являются облигатными или факультативными анаэробами. Оппортунистические инфекции могут возникать непосредственно из-за облигатных возбудителей или косвенно из-за чрезмерного роста условно-патогенных микроорганизмов (УПМ); важную роль в этом играет и истощение популяции кишечных комменсалов (КК) [1]. Известно, что факторы космического полета, например измененный режим питания, гигиенических процедур, психоэмоциональное напряжение, постоянный микробный обмен, неизбежно возникающий в гермозамкнутом помещении космического корабля, негативно влияют на состав кишечной микробиоты, при этом отмечается активное размножение условно-патогенного компонента микрофлоры и снижение количества протективных видов микроорганизмов [2]. Это определяет необходимость разработки средств профилактики и снижения рисков развития дисбиотических состояний, а также проведения исследований для углубленного понимания взаимосвязей кишечной микробиоты и иных физиологических и биохимических показателей здоровья человека, что впоследствии позволит влиять на состав кишечной микробиоты через точечные воздействия на отдельные процессы в организме, например на метаболизм отдельных белков.
Подавляющее большинство бактерий обитает в толстом кишечнике. В проксимальных отделах тонкого кишечника в норме содержится до 10⁴ КОЕ/мл микроорганизмов, что связано с pH среды (7,2–7,6) и бактерицидным действием желчи. Комменсальная микрофлора кроме участия в процессах пищеварения обладает целым спектром важных для организма хозяина функций. Она осуществляет неспецифическую противовоспалительную защиту через продукцию бактериоцинов, органических кислот и веществ с бактериостатическими свойствами, стимулирует эукариотические клетки к синтезу муцина и веществ с антимикробной активностью. Кроме того, сообщество комменсальной микрофлоры направленно подавляет развитие воспалительных реакций в клетках эпителия кишечника. Очевидно, эти представители микрофлоры кишечника действуют синергично с местной иммунной системой [3][4].
Следовательно, кишечник человека является не только важной частью пищеварительной системы для переваривания пищи, всасывания воды и питательных веществ, он также играет существенную роль в организации иммунной защиты [5]. Эпителиальные клетки слизистой оболочки кишечника задействованы в иммунной регуляции. В собственной пластинке слизистой оболочки кишечника присутствуют Т- и В-клетки, защищающие организм от проникновения патогенов. Помимо этого, клетки слизистой оболочки кишечника продуцирует различные цитокины, такие как гамма-интерферон (IFN-γ), фактор некроза опухоли α (TNF-α), интерлейкин 2 (IL-2) и интерлейкин 6 (IL-6), которые являются важными регуляторами как физиологических адаптивных реакций, так и врожденных иммунных реакций [6]. В частности, они могут участвовать в воспалительных реакциях и опосредовать дифференцировку, пролиферацию и активацию различных иммунных клеток [7]. Более того, кишечная микрофлора необходима для организации и осуществления различных иммунных реакций [8]. Так, микрофлора кишечных комменсалов активирует как врожденный, так и адаптивный иммунитет в клетках слизистой оболочки кишечника [9].
В настоящем исследовании нами предпринята попытка проанализировать возможную взаимосвязь комплекса белков в крови с количеством ряда бактерий кишечника женщин, участвующих в эксперименте с 3-суточной «сухой» иммерсией [10].
В проведенных ранее исследованиях микрофлоры кишечника у людей в эксперименте «сухой» иммерсии было выявлено существенное ухудшение состояния микрофлоры: увеличение доли УПМ, снижение количества КК [11].
По мнению некоторых исследователей, регуляторные и метаболические изменения, происходящие во время экспериментов с «сухой» иммерсией, отражаются и на белковом составе крови. Исследования, выполненные методами протеомики на основе масс-спектрометрии, выявили изменения уровней плазминогена, фибронектина, других факторов свертывания и фибринолиза, повышение содержания продуктов фибринолиза, активацию системы комплемента [12]. Очевидно, что протеомные методы позволяют определить белки, реагирующие на сложный комплекс факторов «сухой» иммерсии, и уточнить молекулярные механизмы изменений в различных физиологических системах.
Цель исследования — выявление взаимосвязи между уровнем белков в крови человека и количеством E. coli, Lactobacillus spp., Enterococcus spp. и Bifidobacterium spp. в кишечнике с применением экспериментальной модели 3-суточной «сухой» иммерсии для потенциального использования в качестве клинических рекомендаций по коррекции микрофлоры кишечника, основываясь на данных протеомного профиля крови.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн эксперимента
В эксперименте «сухой» иммерсии продолжительностью 3 сут приняли участие 6 женщин в возрасте от 25 до 40 лет. Во время эксперимента все испытуемые не принимали антибактериальные препараты и иные средства, способные оказать влияние на колебания уровней микрофлоры. В начале эксперимента все участницы были распределены по фазе менструального цикла (фолликулярная фаза), чтобы избежать различий в уровнях эстрадиола и его эффектов на микрофлору и белки плазмы. Во время периода «сухой» иммерсии испытуемые не подвергались никаким дополнительным воздействиям, направленным на предотвращение адаптивных изменений в физиологических системах [10].
Эксперимент «сухая» иммерсия является одним из методов имитации таких факторов, воздействующих на организм в космическом полете, как гипогравитация, опорная разгрузка, перераспределение жидких сред организма в краниальном направлении. Во время «сухой» иммерсии испытуемые женщины находились в иммерсионной ванне полностью погруженными в воду комнатной температуры, но благодаря водонепроницаемой пленке соприкосновения кожи испытуемых с водой не происходило, что позволяло увеличивать время пребывания в ванне (рис. 1).
Исследование было проведено на стендовой базе «Сухая иммерсия» ИМБП РАН. В течение всего эксперимента участницы находились в горизонтальном положении без физических нагрузок с ограничением произвольных движений.
Фото публикуется с письменного согласия участников исследования
Рис. 1. Испытуемая в иммерсионной ванне
Сбор образцов кала, культивирование и идентификация представителей кишечной микрофлоры
Пробы кала отбирали за 1–2 сут до начала эксперимента и на 1–3 сут после окончания «сухой» иммерсии для оценки количества E. coli, Bifidobacterium spp., Lactobacillus spp., Enterococcus faecium. Из образцов фекалий готовили ряд десятикратных разведений в стерильном физиологическом растворе от 10-1 до 10-9 и затем 100 мкл инокулята высевали в чашки Петри с селективными питательными средами: среда Мана, Рогозы и Шарпа (МРС) (для культивирования бактерий рода Lactobacillus spp.), среда Эндо (для выращивания E. coli), агар для энтерококков, бифидоагар (производитель всех сред — Himedia, Индия). Культуры выращивали в термостате при 37 °С в течение 48–72 ч в зависимости от исследуемой культуры, бифидобактерии и лактобациллы выращивали в анаэробных условиях. Выросшие колонии подсчитывали с помощью счетчика колоний Stegler СКМ-2 и визуально идентифицировали [13].
Сбор образцов сухих пятен крови
Забор образцов капиллярной крови объемом 20 мкл для проведения хромато-масс-спектрометрического анализа проводили с помощью автоматического скарификатора путем прокола концевой фаланги безымянного пальца с последующим нанесением на специальные фильтры (Perkin Elmer) для высушивания (метод «сухого пятна»). Образцы крови собирали у добровольцев за 2 сут до начала эксперимента и в динамике на 1-е, 2-е, 3-и сут во время «сухой иммерсии», а также через 2 сут после ее окончания. Пробы капиллярной крови после сбора были высушены при комнатной температуре в течение 2 часов, а затем хранили высушенные образцы пятен крови при -20 °C.
Сухие пятна крови готовили к хромато-масс-спектрометрическому анализу для определения белков в крови человека следующим образом: белки экстрагировали в буфере, содержащем 25 мМ бикарбоната аммония, 1% дезоксихолата натрия и 5 мМ TCEP (трис-(2-карбоксиэтил) фосфин гидрохлорид) (Thermo Scientific), при температуре 60 °С со скоростью встряхивания 1000 оборотов в минуту (термомиксер, Eppendorf) в течение 1 часа, затем восстанавливали, алкилировали, осаждали и расщепляли трипсином, как описано в методике [14].
Хромато-масс-спектрометрический анализ экстрактов сухих пятен крови
Смеси триптических пептидов разделяли с помощью жидкостной хроматографии на основе нано-ВЭЖХ Dionex Ultimate3000 (Thermo Fisher Scientific, США), затем анализировали на масс-спектрометре TimsTOF Pro (Bruker Daltonics, США) с использованием метода параллельного накопления при последовательной фрагментации (PASEF) [15].
Статистический анализ
Статистический анализ полученных данных проведен с использованием ряда непараметрических методик. Изменения в кишечной микрофлоре оценивали с помощью непараметрического критерия Краскела — Уоллиса для связанных выборок. Вычисляли эубиотический индекс, который выражается в суммировании положительных и отрицательных количественных изменений протективных и условно-патогенных групп микроорганизмов и отражает позитивные сдвиги в составе микрофлоры. Статистическая обработка эубиотического индекса проводилась с помощью парного двухвыборочного t-теста для средних.
Изменение количества белков в крови оценивали с помощью дискриминантного анализа для малых выборок. Связь между уровнем белков в крови человека и численностью ряда бактерий кишечника была адекватно описана с помощью регрессионной модели, в которой в качестве зависимой переменной выступало количество ряда бактерий, в качестве независимой — количество белков [16]. Обработку результатов осуществляли с помощью пакета программного обеспечения Statistica 12.0. За критический уровень значимости принимали p ≤ 0,05. Для визуализации взаимосвязей белков использовалась база данных STRING.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В образцах сухих пятен крови женщин-добровольцев идентифицировали порядка 1256 белков с определением их относительных уровней с использованием безметкового метода количественной оценки (label free quatification). Регрессионная модель показала связь между количеством ряда белков в крови, описанных ниже, и численностью бактерий E. coli, Bifidobacterium spp., Lactobacillus spp., Enterococcus faecium.
В результате проведенного регрессионного анализа была выявлена взаимосвязь ряда белков с количеством кишечной палочки (E. coli) (рис. 2). Количество белка ENO1 (альфа-енолаза) в крови положительно коррелировало с количеством кишечной палочки (r = 0,71), в то время как для белков MYH9 (немышечный миозин с тяжелой цепью IIa), ACLY (АТФ-цитратлиаза), DPP3 (дипептидилпептидаза 3), SPTA1 (альфа-цепь спектрина) была выявлена сильная отрицательная корреляционная связь r = -0,99 (p ≤ 0,05).
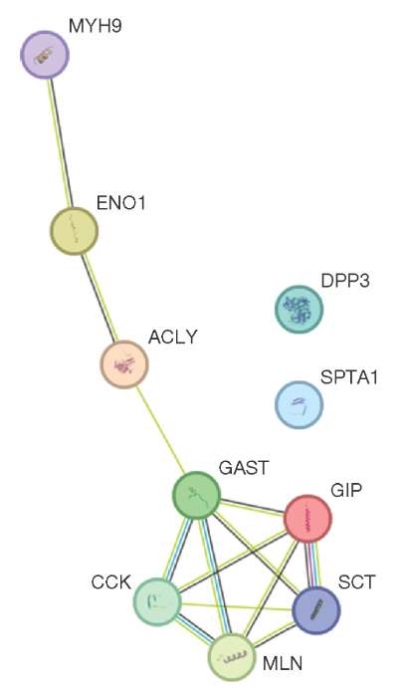
Рисунок подготовлен авторами по собственным данным
Рис. 2. Взаимосвязь белков крови с количеством E. coli в кишечной микрофлоре испытуемых
С количеством бифидобактерий (Bifidobacterium spp.) в кишечнике статистически значимо коррелировали белки EPB41 (мембранный белок эритроцитов band 4.1), A1BG (альфа-1-B гликопротеин), VCP (валозин-содержащий белок), C8B (бета-цепь С8 комплемента) и CCT2 (бета субъединица Т-комплекса), r = 0,74 (p ≤ 0,05), также слабая отрицательная корреляция r = -0,46 (p ≤ 0,05) наблюдалась для белков FAH (фермент фумарилацетоацетат гидролаза) и YWHAE (белок активации тирозин-3-монооксигеназы/триптофан-5-монооксигеназы эпсилон). Соответствующие данные представлены на рисунке 3.
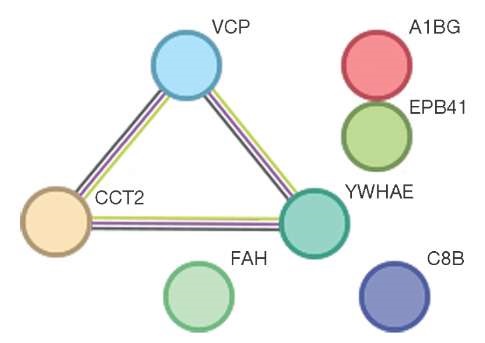
Рисунок подготовлен авторами по собственным данным
Рис. 3. Взаимосвязь белков крови с количеством Bifidobacterium spp. в кишечной микрофлоре испытуемых
В ходе проведенного исследования при анализе данных была выявлена достоверная сильная положительная корреляционная взаимосвязь между количеством лактобацилл и белков в крови испытуемых ENO1, CA2 (r = 0,74) и отрицательная корреляционная связь между количеством Lactobacillus spp. и белками S100A6 и HSPA4 (r = -0,87). Также была выявлена отрицательная корреляционная зависимость между белком CALM2 (кальмодулин) в крови с количеством энтерококков в кишечной флоре (r = -0,76) (p ≤ 0,05). Обобщенные данные о выявленной корреляционной зависимости белков с некоторыми представителями кишечной микрофлоры приведены в таблице 1.
Таблица 1. Выявленные в исследовании корреляции белков с некоторыми представителями кишечной микрофлоры, (p ≤ 0,05)
Микроорганизм кишечного микробиома | Отрицательно коррелирующие с данным микроорганизмом белки | r | Положительно коррелирующие с данным микроорганизмом белки, коэффициент корреляции | r |
E. coli | MYH9, ACLY, DPP3, SPTA1 | 0,99 | ENO1 | 0,71 |
Lactobacillus spp. | S100A6, HSPA4 | 0,87 | ENO1, CA2 | 0,97 |
Enterococcus spp. | CALM2 | 0,76 | - | |
Bifidobacterium spp. | YWHAE, FAH | 0,46 | VCP, C8B, CCT2, EPB41, A1BG | 0,74 |
Таблица подготовлена авторами по собственным данным
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В результате проведенного регрессионного анализа была выявлена взаимосвязь ряда белков с количеством кишечной палочки. В крови количество белка ENO1 (альфа-енолаза — гликолитический фермент, катализирующий превращение 2-фосфоглицерата в фосфоенолпируват) положительно коррелирует с количеством кишечной палочки. Основными функциями данного белка являются участие в гликолизе, процессах клеточного роста и аллергических реакциях. Кроме того, данный белок служит рецептором на поверхности лейкоцитов и стимулирует выработку иммуноглобулинов [17].
Необходимо сказать, что кишечная палочка играет важную роль в организме человека. Она способна вырабатывать ряд витаминов (B1, B2, B6, K и др.), жирные кислоты, участвует в обмене холестерина, билирубина, холина, желчных кислот и включена в процессы всасывания железа и кальция [3][5].
Показано, что E. coli продуцирует имеющее иммунологическое сходство с соматостатином вещество [16]. Также соматостатин продуцируется D-клетками тонкого кишечника, в то же время соматостатин-28 участвует в ингибировании инсулина, секретина, глюкагона, гастрина и других гормонов в желудочно-кишечном тракте. Основными функциями синтезированного в кишечнике соматостатина являются предотвращение секреции соляной кислоты, замедление перистальтики кишечника и изменение уровня желчных кислот [18].
В секрете толстого кишечника имеется значительное количество отторгнутых клеток эпителия, лимфоцитов и слизи, а также содержится небольшое количество ферментов. Либеркюнова железа (крипта), наряду с кишечными ворсинками, является одной из двух важнейших структурных единиц слизистой оболочки кишечника. На каждую ворсинку у человека приходится от 4 до 7 либеркюновых желез, максимальное их количество находится в 12-перстной кишке. Либеркюновы железы толстого кишечника выстланы однослойным цилиндрическим полярным эпителием, высота которого выше у устья, чем у основания. Эпителий либеркюновых желез содержит различные эндокринные клетки: I-клетки, продуцирующие холецистокинин (CCK), S-клетки — секретин (SCT), K-клетки — глюкозозависимый инсулинотропный полипептид (GIP), M-клетки — мотилин (MLN), G-клетки — гастрин (GAST) [19]. Вышеперечисленные белки биохимически связаны между собой и с белком ACLY (АТФ-цитратлиаза), с уровнем которого коррелирует E. coli. Кроме того, ACLY и ряд дифференциально экспрессируемых генов участвуют в ErbB (эритобластический онкоген В) сигналинге и холецистокинин/гастрин сигналинге. ACLY является важным ферментом, связывающим углеводы с метаболизмом липидов путем выработки ацетил-КоА из цитрата для биосинтеза жирных кислот и холестерина [20]. Изменения уровней ACLY, вероятно, связаны с сигналингом гастрина.
Еще одним белком, оказывающим влияние на количество кишечной палочки, является MYH9 (немышечный миозин с тяжелой цепью IIa, член семейства моторных белков). MYH9 участвует в процессах секреции, цитокинезе и обеспечивает подвижность клеток. Количество E. coli отрицательно коррелирует с количеством данного белка в крови, что также может быть связано с сигналингом гастрина.
Анализ полученных данных позволяет сделать вывод о том, что повышение уровня ENO1 и снижение MYH9 и ACLY способствуют увеличению численности кишечной палочки. Гены ENO1, MYH9 и ACLY коэкспрессируются и участвуют в сигналинге гастрина. Гастрин, в свою очередь, связан с холецистокинином, секретином, глюкозозависимым инсулинотропным полипептидом и мотилином, которые вырабатываются либеркюновыми железами толстой кишки. При этом глюкозозависимый инсулинотропный полипептин (инкретин) тормозит абсорбцию жиров, что, вероятно, вызывает увеличение их количества в непереваренной пище и, как следствие, приводит к увеличению количества E. coli, для которой жирные кислоты являются одним из источников энергии [21]. Инкретин также ингибирует липопротеинлипазу. По данным R.A. Scholl et al., со снижением данного фермента коррелирует высокое количество E. coli [22].
Положительно коррелирующий с количеством кишечной палочки белок ENO1 стимулирует выработку иммуноглобулинов, что может свидетельствовать об усилении иммунной активности локально в толстом кишечнике. Одним из объяснений выявленной взаимосвязи может служить предположение, что аутологичная комменсальная микрофлора кишечника, вероятно, обладает толерантностью к местно выделяемым иммуноглобулинам. Аналогичная взаимосвязь отмечена и для другого облигатного представителя кишечной флоры — Lactobacillus spp. Суммируя вышесказанное: ENO1, MYH9 и ACLY тесно связаны с процессами экскреции биологически активных веществ клетками либеркюновых желез толстой кишки, в частности инкретина (GIP), который, в свою очередь, учитывая его функции, способствует увеличению численности кишечной палочки.
Белок DPP3 (дипептидилпептидаза 3) является цинк-зависимой пептидазой, внутриклеточной сериновой пептидазой и обладает участком уникальной каталитической последовательности, обеспечивающей деградацию олигопептидов с остатками от 4 до 10 аминокислот. Данный участок в нашем исследовании имел достаточно сильную отрицательную корреляционную связь с количеством кишечной палочки. Известно, что белок DPP3 имеет широкий спектр биологических функций. Так, он участвует во внутриклеточном расщеплении белков, кроме того, в некоторых исследованиях [23] была показана активность DPP3 в клетках врожденной иммунной системы, например в полиморфно-ядерных гранулоцитах и нейтрофилах, что отчасти подтверждает его активное участие в регуляции иммунной функции организма. Интересно отметить, что в нашем исследовании была выявлена сильная отрицательная корреляционная связь количества данного белка как с количеством кишечной палочки, так и с количеством гемолитических стафилококков.
В проведенном исследовании также было установлено, что уровень белка SPTA1 имел достаточно сильную отрицательную корреляцию с количеством кишечной палочки, однако, учитывая функции данного белка, возможные причины взаимодействия уровней данного белка и числа представителей E. coli остаются неясными.
Бифидобактерии являются одними из важнейших компонентов кишечной микрофлоры. Они участвуют в синтезе лактата и ацетата, регулирующих pH содержимого кишечника, а также обеспечивают усиление колонизационной резистентности кишечной микрофлоры.
В нашем исследовании наиболее сильные связи с количеством бифидобактерий в кишечнике были выявлены для белков EPB41, A1BG, VCP, C8B и CCT2, также слабая корреляционная связь установлена с количеством белков FAH и YWHAE.
Белок, кодируемый геном EPB41 (мембранный белок эритроцитов band 4.1), представляет собой многофункциональный протеин, который опосредует взаимодействия между цитоскелетом эритроцитов и плазматической мембраной. Кодируемый геном EPB41 белок связывает и стабилизирует дофаминовые рецепторы D2 и D3 на плазматической мембране нейронов, участвует в регуляции транспорта ионов кальция и регуляции кишечной абсорбции [24]. В проведенных исследованиях была установлена положительная корреляция между количеством белка EPB41 и количеством бифидобактерий. Отмечено, что при снижении количества белка EPB41 наблюдается нарушение всасывания кальция в клетках тонкого кишечника [23]. Таким образом, при увеличении количества белка EPB41 происходит усиление абсорбции кальция в эпителии тонкого кишечника. Аналогичный процесс контролируется и бифидобактериями, которые также вызывают усиление всасывания ионов кальция. Наибольшее количество Bifidobacterium spp. содержится в толстом отделе кишечника, в то же время бифидобактерии и лактобациллы составляют около 20–30% микрофлоры тонкого кишечника, локализуясь в основном в тощей кишке [25].
Одной из предполагаемых функций белка A1BG (альфа-1-B гликопротеин), экспрессирующегося в печени, является участие в распознавании клеток и регуляции клеточного поведения [26]. Для данного белка отмечена положительная корреляционная связь с количеством бифидобактерий, что может быть объяснено толерантностью иммунной системы в отношении КК и усилении иммунного ответа на фоне стрессового фактора, которым является «сухая» иммерсия. Важно отметить, что белок C8B (бета-цепь С8 комплемента, лектиновый путь активации), который также играет ключевую роль в реализации механизмов врожденного и адаптивного иммунного ответа, отрицательно коррелирует с количеством бифидобактерий в кишечнике.
Белок CCT2 (бета-субъединица белка 1-го Т-комплекса, молекулярный шаперон) способствует сворачиванию протеинов при гидролизе АТФ и в составе комплекса TRiC (шаперонин) играет роль в сворачивании актина и тубулина. Согласно данным литературы, спектриновый цитоскелет является мишенью для кишечных бактериальных патогенов (например, патогенных штаммов E. coli, S. Typhimurium, L. Monocytogene) за счет усиления адгезии клеток и играет решающую роль в прогрессировании дисбиотических состояний [27]. Вероятно, аналогичный механизм также позволяет усилить адгезию Bifidobacterium spp. на эпителии кишечника и таким образом способствовать их росту, поскольку в нашем исследовании была отмечена положительная корреляционная связь количества данного белка с количеством бифидобактерий.
В то же время YWHAE (белок активации тирозин-3-монооксигеназы/триптофан-5-монооксигеназы эпсилон), участвующий в регуляции широкого спектра как общих, так и специализированных сигнальных путей, также задействован в реализации различных биохимических процессов, связанных с передачей сигналов, таких как деление клеток и регуляция чувствительности к инсулину. Его уровень тесно связан с количеством белка HSF1 (фактор теплового шока 1), продукция которого клеткой, в свою очередь, индуцируется воздействием не только температурного стресса, но и множеством других провоцирующих факторов, а именно: гипоксических условий, воздействия ксенобиотиков, протеотоксического стресса [28]. Взаимосвязь уровней белка YWHAE в крови и количества Bifidobacterium spp. в кишечной флоре отрицательная. То есть при усилении воздействия стрессовых факторов и увеличении соответственно белка YWHAE в крови происходит угнетение роста бифидобактерий, что подтверждает взаимосвязь между уровнями стресса различной этиологии и кишечной флоры.
Белок FAH (фермент фумарилацетоацетат гидролаза, который расщепляет 4-фумарилацетоацетат до ацетоацетата и фумарата, обеспечивая финальную стадию катаболизма аминокислоты тирозина), как это следует из его основной функции, вовлечен в метаболизм тирозина и является последним из пяти ферментов, расщепляющих данную аминокислоту. Следствием действия этой гидролазы и превращения 4-фумарилацетоацетата в фумарат и ацетоацетат является повышение уровня кетоновых тел в крови. Было показано, что избыток кетоновых тел, например при кетодиете, снижает количество бифидобактерий, то есть между ними, по данным Q.Y. Ang, существует отрицательная корреляционная взаимосвязь [29]. В нашем эксперименте установлена прямая положительная корреляционная связь между количеством белка FAH и количеством Bifidobacterium spp., хотя степень выраженности ее была относительно слабой.
Вместе с тем белок VCP (валозин-содержащий белок) — АТФаза переходного эндоплазматического ретикулума является компонентом процесса деградации белков, связанного с эндоплазматической сетью и отвечающего за поддержание протеостаза клеток, в том числе эндотелия кишечника. Также в отдельных исследованиях было выдвинуто предположение о возможном вкладе белка VCP в течение инфекции, вызываемой токсоплазмой [30]. Данный белок положительно коррелирует с количеством бифидобактерий. Кроме того, он коэкспрессируется с белками CCT2 и YWHAE.
Лактобациллы играют важную роль в поддержании колонизационной резистентности желудочно-кишечного тракта. Несмотря на то что большинство бактерий в ЖКТ обитают в толстом кишечнике, лактобациллы и энтерококки являются доминирующей флорой в двенадцатиперстной и тощей кишке. Их количество по сравнению с толстой кишкой невелико (около 10³–10⁴ КОЕ/мл), однако они играют важную роль в иммуномодуляции и проявляют антагонистическую активность в отношении патогенных микроорганизмов [31].
Большинство штаммов Lactobacillus spp., заселяющих кишечник человека, являются гомоферментативными и образуют в качестве результата брожения преимущественно молочную кислоту, используя гликолиз для образования лактата из глюкозы. По отношению к кислороду большинство лактобацилл являются аэротолерантными анаэробами, то есть активнее всего растут при дефиците кислорода.
В нашем исследовании при анализе данных была выявлена взаимосвязь количества белков ENO1, CA2, S100A6 и HSPA4 с количеством лактобацилл. При этом ENO1 и CA2 имели положительную, а S100A6 и HSPA4 — отрицательную корреляционную связь с количеством Lactobacillus spp.
В некоторых исследованиях установлено, что ENO1 является белком, обеспечивающим толерантность клеток к гипоксии, а также катализирует превращение 2-фосфоглицерата в фосфоенолпируват в процессе гликолиза, причем присутствует как в клетках и тканях человека, так и у некоторых видов Lactobacillus spp. Вероятнее всего, взаимосвязь количества данного белка с количеством лактобацилл обусловлена в первую очередь увеличением толерантности клеток кишечника к гипоксии, которая, в свою очередь, способствует росту количества лактобацилл.
Белок CA2, принадлежащий к семейству карбоангидраз, играет решающую роль в функционировании гемоглобина благодаря катализу процесса гидратации углекислого газа с образованием угольной кислоты и последующей диссоциацией ее в воде. Это приводит к снижению pH крови, что, в свою очередь, снижает сродство гемоглобина к кислороду. Таким образом, увеличение количества данного белка также связано с гипоксией и, как следствие, с созданием наиболее благоприятных условий для размножения Lactobacillus spp.
Кальций-связывающий белок A6 S100A6 (S100) играет важную роль в связывании кальция. Уровень данного белка в крови отрицательно коррелирует с количеством лактобацилл (Lactobacillus spp.), которые в процессе метаболизма цитрата используют ионы кальция [32]. Следовательно, при увеличении количества белка S100A6 количество кальция, необходимого для метаболизма лактобацилл, снижается и уровень Lactobacillus spp. падает.
Установлено, что белок HSPA4 (член семейства белков теплового шока Hsp110) имеет важные функции молекулярного шаперона внутри клетки: ответ на развернутый белок, импорт белка во внешнюю мембрану митохондрий, сборка белковых комплексов. В условиях воздействия многих стрессовых факторов, вызывающих нарушение процессов протеостаза, также происходит и снижение комменсалов кишечника [33, 34]. В проведенных нами исследованиях корреляция количества данного белка с количеством Lactobacillus spp. была отрицательной: чем больше данного белка в крови, тем выше уровень стресса и тем меньше количество лактобацилл.
Энтерококки являются одним из важных компонентов микрофлоры кишечника. Ряд препаратов, применяемых в качестве пробиотиков в настоящее время, содержат Enterococcus faecium. Численность энтерококков в кишечнике в норме должна составлять 10⁶ КОЕ/мл. Энтерококки (вместе с лактобациллами), помимо толстого кишечника, колонизируют и тонкую кишку, однако их количество заметно меньше. Enterococcus spp. относят к молочнокислым микроорганизмам, так как они осуществляют метаболизм бродильного типа и ферментируют углеводы с образованием молочной кислоты, которая, в свою очередь, снижает pH среды. Кроме того, энтерококки являются хорошо известными продуцентами антимикробных пептидов (энтероцинов).
При анализе полученных данных была выявлена отрицательная корреляционная взаимосвязь белка CALM2 (кальмодулин) в крови с количеством энтерококков в кишечной флоре. Кальмодулин экспрессируется клетками эпителия практически во всех отделах тонкого кишечника и, вероятно, регулирует концентрацию свободного кальция в клетках микроворсинок. Имеются данные, что повышенное содержание ионов кальция и магния в среде ингибирует выработку энтероцинов и метаболизм энтерококков [35]. Это, вероятно, является одной из возможных причин отрицательной корреляции белка CALM2 в крови и количества Enterococcus spp. в кишечной флоре.
ВЫВОДЫ
- В результате проведенных исследований были выявлены комплексы белков, уровень которых в крови хозяина коррелировал с количеством протективных микроорганизмов (ПМ).
- Все белки, коррелирующие с разными ПМ, можно условно разделить на 4 группы в зависимости от функций и характера взаимодействия этих белков с различными микроорганизмами: белки, связанные с иммунной системой; белки, прямо или косвенно влияющие на процессы пищеварения и минеральный обмен; белки, влияющие на толерантность клеток к гипоксии; белки, имеющие высокий коэффициент регрессии при корреляции с некоторыми микроорганизмами, но не имеющие очевидной функциональной взаимосвязи.
- Полученные данные способствуют не только фундаментальному пониманию взаимосвязи различных процессов в организме человека, но и могут послужить важной отправной точкой для формирования клинических рекомендаций по коррекции микрофлоры кишечника, основываясь на данных протеомного профиля крови или, напротив, коррекции белковых показателей крови с помощью пробиотических и аутопробиотических средств.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Д.В. Комиссарова — статистическая обработка результатов, написание разделов результаты, материалы и методы, обсуждение результатов, выводы; Л.Х. Пастушкова — дизайн экспериментальной части по протеомике, написание разделов введение, результаты и обсуждение результатов; Д.Н. Каширина — проведение экспериментальной части по протеомике, написание разделов введение, материалы и методы, обсуждение результатов; В.К. Ильин — дизайн и проведение экспериментальной части по микробиологии; И.М. Ларина — дизайн экспериментальной части по протеомике, написание разделов результаты, обсуждение результатов и выводы.
Список литературы
1. Ильин ВК, Воложин АИ, Виха ГВ. Колонизационная резистентность организма в измененных условиях обитания. М.: Наука; 2005.
2. Turroni S, Magnani M, Kc P, Lesnik P, Vidal H, Heer M. Gut microbiome and space travelers’ health: state of the art and possible pro/prebiotic strategies for long-term space missions. Front Physiol. 2020;11:553929. https://doi.org/10.3389/fphys.2020.553929
3. Reinoso Webb C, Koboziev I, Furr KL, Grisham MB. Protective and pro-inflammatory roles of intestinal bacteria. Pathophysiology. 2016;23(2):67–80. https://doi.org/10.1016/j.pathophys.2016.02.002
4. Iacob S, Iacob DG, Luminos LM. Intestinal microbiota as a host defense mechanism to infectious threats. Front. Microbiol. 2019;9:3328. https://doi.org/10.3389/fmicb.2018.03328
5. Leser TD, Mølbak L. Better living through microbial action: the benefits of the mammalian gastrointestinal microbiota on the host. Environ. Microbiol. 2009;11(9):2194–206. https://doi.org/10.1111/j.1462-2920.2009.01941.x
6. Onyiah JC, Colgan SP. Cytokine responses and epithelial function in the intestinal mucosa. Cell. Mol. Life Sci. 2016;73(22):4203- 4212. https://doi.org/10.1007/s00018-016-2289-8
7. Metryka E, Chibowska K, Gutowska I, Falkowska A, Kupnicka P, Barczak K, et al. Lead (Pb) exposure enhances expression of factors associated with inflammation. Int. J. Mol. Sci. 2018;19(6):1813. https://doi.org/10.3390/ijms19061813
8. Belkaid Y, Hand TW. Role of the microbiota in immunity and inflammation. Cell. 2014;157(1):121–41. https://doi.org/10.1016/j.cell.2014.03.011
9. Hooper LV, Littman DR, Macpherson AJ. Interactions between the microbiota and the immune system. Science. 2012;336(6086):1268–73. https://doi.org/10.1126/science.1223490
10. Tomilovskaya E, Amirova L, Nosikova I, Rukavishnikov I, Chernogorov R, Lebedeva S, et al. The first female dry immersion (NAIAD-2020): design and specifics of a 3-day study. Front. Physiol. 2021;12:661959. https://doi.org/10.3389/fphys.2021.661959
11. Ильин ВК, Комиссарова ДВ, Морозова ЮА, Жиганшина АА. Изменение микрофлоры кишечника, верхних дыхательных путей и вагинальных слизистых оболочек у добровольцев в эксперименте с 3-суточной «сухой» иммерсией. Материалы 56-х научных чтений, посвященных разработке научного наследия и развитию идей К.Э. Циолковского. Калуга; 2021
12. Pastushkova LCh, Goncharova AG, Kashirina DN, Goncharov IN, Rukavishnikov IV, Brzhozovskiy AG, et al. Characteristics of blood proteome changes in hemorrhagic syndrome after headup tilt test during 21-day dry immersion. Acta Astronautica. 2021;189:158–65. https://doi.org/10.1016/j.actaastro.2021.08.044
13. Меньшиков ВВ, ред. Клиническая лабораторная аналитика. М.; 2013.
14. Kashirinа D, Brzhozovskiy A, Sun W, Pastushkova L, Popova O, Rusanov V, et al. Proteomic characterization of dry blood spots of healthy women during simulation the microgravity effects using dry immersion. Front. Physiol. 2022;12:75329. https://doi.org/10.3389/fphys.2021.753291
15. Meier F, Brunner AD, Koch S, Koch H, Lubeck M, Krause M, et al. Online Parallel Accumulation–Serial Fragmentation (PASEF) with a novel trapped ion mobility mass spectrometer. Mol. Cell. Proteomics. 2018;17(12):2534–45. https://doi.org/10.1074/mcp.TIR118.000900
16. Кулаичев АП. Методы и средства комплексного статистического анализа данных: учебное пособие. 5-е изд. М.: ИНФРА-М; 2017.
17. Jensen EA, Young JA, Mathes SC, List EO, Carroll RK, Kuhn J, et al. Crosstalk between the growth hormone/insulin-like growth factor-1 axis and the gut microbiome: A new frontier for microbial endocrinology. Growth Horm. IGF Res. 2020;53–4:101333. https://doi.org/10.1016/j.ghir.2020.101333
18. Schubert ML. Gastric acid secretion. Curr. Opin. Gastroenterol. 2016;32(6):452–60. https://doi.org/10.1097/MOG.0000000000000308
19. Функциональная гастроэнтерология. Available from: https://www.gastroscan.ru/handbook/117/309
20. Feng X, Zhang L, Xu S, Shen AZ. ATP-citrate lyase (ACLY) in lipid metabolism and atherosclerosis: An updated review. Prog. Lipid Res. 2020;77:101006. https://doi.org/10.1016/j.plipres.2019.101006
21. Tazi A, Araujo JR, Mulet C, Arena ET, Nigro G, Pédron T, Sansonetti PJ. Disentangling host-microbiota regulation of lipid secretion by enterocytes: insights from commensals Lactobacillus paracasei and Escherichia coli. mBio. 2018;9(5):e01493–18. https://doi.org/10.1128/mBio.01493-18
22. Scholl RA, Lang C.H., Bagby G.J. Hypertriglyceridemia and its relation to tissue lipoprotein lipase activity in endotoxemic, Escherichia coli bacteremic, and polymicrobial septic rats. J. Surg. Res. 1984; 37(5): 394–401. https://doi.org/10.1016/0022-4804(84)90205-1
23. Grdisa M, Vitale L. Types and localization of aminopeptidases in different human blood cells. Int. J. Biochem. 1991;23(3):339–45. https://doi.org/10.1016/0020-711x(91)90116-5
24. Liu C, Weng H, Chen L, Yang S, Wang H, Debnath G, et al. Impaired intestinal calcium absorption in protein 4.1R-deficient mice due to altered expression of plasma membrane calcium ATPase 1b (PMCA1b). J. Biol. Chem. 2013;288(16):11407–15. https://doi.org/10.1074/jbc.M112.436659
25. Инновационные пищевые технологии. Available from: https://propionix.ru/kolichestvo-mikroorganizmov-v-tonkom-itolstom-kishechnike
26. Sun D, Zhao YY, Dai SP, Fang K, Dong LY, Ding Q. Cloning and analysis of human alpha-1B glycoprotein precursor gene: a novel member of human immunoglobulin superfamily. Acta Genetica Sinica. 2002;29(4):299–302. PMID: 11985261.
27. Ruetz T, Cornick S, Guttman JA. The spectrin cytoskeleton is crucial for adherent and invasive bacterial pathogenesis. PLOS ONE. 2011;6(5):e19940. https://doi.org/10.1371/journal.pone.0019940
28. Dayalan Naidu S, Dinkova-Kostova AT. Regulation of the mammalian heat shock factor 1. FEBS J. 2017;284(11):1606–27. https://doi.org/10.1111/febs.13999
29. Ang QY, Alexander M, Newman JC, Tian Y, Cai J, Upadhyay V, et al. Ketogenic diets alter the gut microbiome resulting in decreased intestinal Th17 cells. Cell. 2020;181(6):1263–75.e16. https://doi.org/10.1016/j.cell.2020.04.027
30. Clough B, Fisch D, Mize TH, Encheva V, Snijders A, Frickel E-M. p97/VCP targets Toxoplasma gondii vacuoles for parasite restriction in interferon-stimulated human cells. bioRxiv. 2023.06.20.545566. https://doi.org/10.1101/2023.06.20.545566
31. Яруллина ДР, Фахруллин РФ. Бактерии рода Lactobacillus: общая характеристика и методы работы с ними. Учебнометодическое пособие Казанского (Приволжского) федерального университета. Казань; 2014.
32. Mortera P, Pudlik A, Magni C, Alarcón S, Lolkema JS. Ca2+- citrate uptake and metabolism in Lactobacillus casei ATCC 334. Appl. Environ. Microbiol. 2013;79(15):4603–12. https://doi.org/10.1128/AEM.00925-13
33. Lutgendorff F, Akkermans LM, Söderholm JD. The role of microbiota and probiotics in stress-induced gastro-intestinal damage. Curr. Mol. Med. 2008;8(4):282–98. https://doi.org/10.2174/156652408784533779
34. Марданов АВ, Бабыкин ММ, Белецкий АВ, Григорьев АИ, Зинченко ВВ, Кадников ВВ и др. Метагеномный анализ динамики изменений состава микробиома кишечника участников эксперимента «Марс-500», имитирующего длительный космический полет. Acta Naturae. 2013;3(48):120–8.
35. Kumar M, Srivastava S. Effect of calcium and magnesium on the antimicrobial action of enterocin LR/6 produced by Enterococcus faecium LR/6. Int. J. Antimicrob. Agents. 2011;37(6):572–5. https://doi.org/10.1016/j.ijantimicag.2011.01.014
Об авторах
Д. В. КомиссароваРоссия
Комиссарова Дарья Валерьевна, канд. биол. наук
Москва
Л. Х. Пастушкова
Россия
Пастушкова Людмила Ханифовна, д-р биол. наук
Москва
Д. Н. Каширина
Россия
Каширина Дарья Николаевна, канд. биол. наук
Москва
В. К. Ильин
Россия
Ильин Вячеслав Константинович, д-р мед. наук, профессор
Москва
И. М. Ларина
Россия
Ларина Ирина Михайловна, д-р мед. наук, профессор
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Комиссарова Д.В., Пастушкова Л.Х., Каширина Д.Н., Ильин В.К., Ларина И.М. Корреляция параметров протеома крови с количеством некоторых бактерий кишечной микрофлоры у здоровых женщин. Медицина экстремальных ситуаций. 2024;26(4):123-131. https://doi.org/10.47183/mes.2024-26-4-123-131
For citation:
Komissarova D.V., Pastushkova L.Kh., Kashirina D.N., Ilyin V.K., Larina I.M. Correlation of blood proteome parameters to the number of certain intestinal microflora bacteria in healthy women. Extreme Medicine. 2024;26(4):123-131. https://doi.org/10.47183/mes.2024-26-4-123-131

















