Перейти к:
Клональное кроветворение и ионизирующее излучение: риски развития онкогематологической и соматической патологии
https://doi.org/10.47183/mes.2024-26-4-5-12
Аннотация
Введение. Влияние радиационно-индуцированной генетической нестабильности на формирование клональной экспансии актуально для мониторинга здоровья и превентивной диагностики онкогематологической и соматической патологии у лиц, подвергающихся длительному воздействию техногенного облучения в малых дозах (работники атомной промышленности и врачи лучевой диагностики).
Цель. Выявление возможных точек приложения превентивной диагностики маркеров нестабильности генома и клонального кроветворения у групп лиц, подвергающихся длительному воздействию техногенного облучения в малых дозах.
Обсуждение. Генетическая нестабильность в генах эпигенетической регуляции (DNMT3A, TET2, ASXL1), сигнальных путей и клеточной пролиферации (JAK2, FLT3), регуляторов репарации ДНК (TP53, PPM1D), факторов сплайсинга РНК (SF3B1, SRSF2) наиболее часто инициирует клональное кроветворение, реализующееся чаще миелоидными и реже лимфоидными неоплазиями. Влияние клонального кроветворения на развитие соматических заболеваний опосредовано сочетанным действием носительства указанных мутаций и процессами хронического воспаления. Ионизирующее излучение в малых дозах способно инициировать клональную экспансию преимущественно за счет мутаций в генах DNMT3A и TET2. Исследований по оценке повышения заболеваемости на фоне развития клонального кроветворения в группах профессионального риска воздействия малых доз ионизирующего излучения (работники атомной промышленности и врачи лучевой диагностики) в настоящее время мало, что требует дальнейшего изучения.
Выводы. Исследования по выявлению маркеров риска роста заболеваемости на фоне развития клонального кроветворения в группах работников, подвергающихся длительному техногенному действию ионизирующего излучения в малых дозах, позволят сформировать когортно-ориентированную программу профилактики заболеваний у данных лиц.
Ключевые слова
Для цитирования:
Жернякова А.А., Крысюк О.Б., Куневич Е.О. Клональное кроветворение и ионизирующее излучение: риски развития онкогематологической и соматической патологии. Медицина экстремальных ситуаций. 2024;26(4):5-12. https://doi.org/10.47183/mes.2024-26-4-5-12
For citation:
Zherniakova A.A., Krysiuk O.B., Kunevich Ye.O. Clonal haematopoiesis and ionizing radiation: risks for hematological malignancies and somatic diseases. Extreme Medicine. 2024;26(4):5-12. https://doi.org/10.47183/mes.2024-26-4-5-12
ВВЕДЕНИЕ
Изучение возникновения радиационно-индуцированной генетической нестабильности и ее взаимосвязи с формированием клональной экспансии является актуальным научным направлением в аспекте мониторинга состояния здоровья работников атомной промышленности и врачей лучевой диагностики. Выявление факторов риска развития неблагоприятных событий у данных категорий лиц, диспансерное наблюдение, а также своевременная профилактика позволят предотвратить развитие патологии [1].
Человек ежедневно подвергается воздействию малых доз ионизирующего излучения (ИИ), испускаемого как естественными источниками (радионуклиды в окружающей среде, находящиеся в атмосфере, в почве и воде), так и получаемого от искусственных или техногенных источников. Совокупность воздействия всех видов естественного излучения определяют как естественный или природный радиоактивный фон. Среднемировые показатели такого излучения в различных регионах мира находятся в диапазоне от 2,4 до 4,0 мЗв/год, для Российской Федерации средний уровень — 3,36 (от 2,10 до 8,60) мЗв/год [1–3].
Воздействие ИИ на человека осуществляется за счет влияния природного радиоактивного фона, профессионального облучения на рабочем месте, а также при получении медицинской помощи (медицинское облучение). Широкое использование ИИ в медицине и различных отраслях промышленности, прежде всего в атомной энергетике, способствует увеличению радиационной нагрузки на работников этих отраслей. Так, для определенного перечня производств, на которых возможно дополнительное техногенное воздействие ИИ, предел допустимой эффективной дозы ИИ составляет 5 мЗв/год для персонала группы Б и 20 мЗв/год для персонала группы А [3].
В настоящее время хорошо изучены и описаны ближайшие и отсроченные последствия воздействия на организм человека ИИ в больших дозах при техногенных катастрофах, характеризующиеся критическими изменениями, приводящими к дефектам функционирования органов и систем. Вместе с тем установлено, что малые дозы ИИ, при воздействии которых отсутствуют клинические проявления радиационного повреждения организма, также индуцируют повреждения на генетическом и эпигенетическом уровнях, а зависимость эффекта от дозы облучения носит немонотонный полимодальный характер. В последнее время появились данные относительно того, что действие малых доз ИИ может приводить к нестабильности генома, модифицируя клеточные и тканевые процессы, что в итоге может способствовать изменению чувствительности организма к действию дополнительных нерадиационных факторов [4–6].
В последнее десятилетие ученые активно изучают клональное кроветворение (КК), рассматривая его в качестве биологического состояния, предрасполагающего к развитию злокачественных заболеваний системы крови (ЗЗСК), солидных опухолей, сердечно-сосудистой патологии, аутоиммунных заболеваний и другой патологии [7–9].
Цель работы — выявление возможных точек приложения превентивной диагностики маркеров нестабильности генома и КК у групп лиц, подвергающихся длительному воздействию техногенного облучения в малых дозах.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Общие представления о клональном кроветворении
Гемопоэтические клетки костного мозга (КМ) обладают наиболее высоким пролиферативным потенциалом. Процессы пролиферации и дифференцировки клеток крови в КМ осуществляются непрерывно. Ежедневно образуется около 1 триллиона клеток крови. Основой кроветворения являются гемопоэтические стволовые клетки (ГСК), обладающие способностью к дифференцировке во все зрелые клетки периферической крови, что было впервые постулировано профессором А.А. Максимовым в 1909 году. Наилучшим подтверждением модели кроветворения, предложенной А.А. Максимовым, стали экспериментальные данные, полученные в эпоху активного изучения последствий воздействия радиации на организм человека [10].
За последние десятилетия наши представления о системе гемопоэза существенно расширились и усложнились [10–13]. Так, в многочисленных исследованиях была предложена идея непрерывных ландшафтов дифференциации с небольшими или отсутствующими дискретными стадиями дифференциации и плавными переходами между состояниями клеток. В этом контексте клетки в гетерогенном пуле предшественников дифференцируются по множеству потенциальных траекторий, которые содержат некие точки ветвления, определяющие судьбу конкретной клетки. Однако неизменным остается представление о том, что потомство одной ГСК представляет собой клон конкретной ГСК. В норме система кроветворения поликлональна, что предполагает продукцию различными ГСК «своих» клонов клеток и поддержание их числа, а также соотношения клеток различных степеней и направлений дифференцировки в КМ в устойчивых пределах. Для кроветворных клеток с высокой пролиферативной активностью характерно накопление генетических «поломок» с нарастанием количества делений [14].
С возрастом у человека в физиологических условиях происходят количественные и качественные изменения кроветворения: снижение общей пролиферативной активности ГСК при относительном увеличении их общего количества, увеличение числа эритроидных предшественников, снижение числа лимфоидных предшественников с возрастными изменениями функции иммунной системы. В целом кроветворение приобретает тенденцию к развитию олигоклональности [15]. В основе возрастных изменений КМ, вероятнее всего, лежат генетические и эпигенетические процессы. Отмечаются возрастное снижение регенеративного потенциала ГСК [16], характерные изменения экспрессии генов — регуляторов транскрипции, накопление соматических мутаций [17], выраженное укорочение теломерных участков хромосом [18]. Кроме того, у пожилых людей выявлена повышенная экспрессия генов, принимающих участие в регуляции апоптоза и воспаления в системе гемопоэза, тогда как у молодых людей высока активность генов, регулирующих процессы пролиферации и метаболической активности кроветворных клеток-предшественниц. Все описанные тенденции являются проявлением закономерных процессов, характеризующих изменения кроветворения в процессе старения организма [19].
Вместе с тем накопление мутаций может привести к такому развитию КК, при котором активируется пролиферация одной ГСК или более дифференцированной клетки — предшественницы гемопоэза с формированием клона ее потомков, несущих мутации генов. Несмотря на то что КК не является самостоятельной нозологией, оно может выступать в качестве «промежуточного этапа» между нормальным кроветворением и ЗЗСК [20]. Показано, что КК может возникнуть в результате нейтрального дрейфа или направленного отбора. В случае нейтрального дрейфа изначально все клоны клеток имеют равные шансы своего вклада в формирование пула самообновляющихся ГСК, решающее влияние оказывают случайные процессы, такие как истощение пула стволовых клеток. При направленном отборе соматические изменения оказывают влияние на появление преимущества избирательного роста у определенных клонов ГСК относительно других, с последующим развитием клональной экспансии [21].
В 2014 году двумя независимыми группами были опубликованы результаты крупных исследований с использованием метода секвенирования нового поколения (new generation sequencing, NGS). Согласно полученным данным было определено, что развитие КК ассоциировано с соматическими мутациями, наиболее часто возникающими в трех генах эпигенетической регуляции транскрипции (DNMT3A — ген, кодирующий белок, осуществляющий de novo метилирование; TET2 кодирует белок, который катализирует превращение модифицированного основания ДНК метилцитозина в 5-гидроксиметилцитозин и участвует в регуляции процесса транскрипции, ASXL1 кодирует ядерный белок, участвующий в эпигенетической регуляции экспрессии генов и в процессе ремоделирования хроматина). Полученные результаты нашли подтверждение при исследовании групп пациентов с разными типами ЗЗСК и солидными новообразованиями [22, 23]. В работе M. Xie и соавт. было убедительно продемонстрировано, что наиболее часто и практически во всех нозологических подгруппах, которые были проанализированы, возникали мутации в генах DNMT3A, TET2, ASXL1 и TP53 [24].
На основании накопленных данных в 2015 году был введен термин «клональное кроветворение неопределенного потенциала» (ККНП) (clonal haematopoiesis of indeterminate potential). Так, ККНП определяется при наличии клона кроветворной клетки с мутацией гена, ассоциированного с риском развития ЗЗСК, при отсутствии цитопении и критериев иных гематологических заболеваний, согласно классификации Всемирной организации здравоохранения. Уровень аллельной нагрузки указанного гена должен быть не менее 2% (значение принято в качестве минимального клинически значимого порогового уровня для метода секвенирования нового поколения (next generation sequencing — NGS)), а для генов, сцепленных с Х-хромосомой у мужчин, — не менее 4% [25][26]. Частота детекции мутаций увеличивается с возрастом, а их наличие ассоциировано с повышением риска развития ЗЗСК. Было определено, что у порядка 15–20% людей старше 70 лет без наличия онкогематологического заболевания присутствует носительство соматических мутаций, ассоциированных с повышенным риском развития онкопатологии [27]. Позже для таких изменений был предложен термин «ассоциированное с возрастом клональное кроветворение» (age-related clonal haematopoiesis), которое определяется у пожилых пациентов при наличии соматической мутации в генах вне зависимости от ее клинического значения и уровня аллельной нагрузки, а также при отсутствии изменений в гемограмме и критериев ЗЗСК [23][27].
Для обозначения состояния носительства мутаций, которые могут выступать в качестве непосредственного драйвера развития ЗЗСК, был введен термин «клональное кроветворение онкогенного потенциала» (ККОП) (clonal haematopoiesis of oncogenic potential) [28][29]. Выделение такой категории и подход к разделению генов по их непосредственной роли в развитии ЗЗСК (то есть их онкогенному потенциалу) в настоящее время носит весьма условный характер, является дискуссионным и требует накопления данных и анализа.
В научной литературе можно встретить также термин «клональная цитопения неустановленного значения» (clonal cytopenia of undetermined significance), для которой характерно наличие соматических мутаций в гене/генах, связанных с ЗЗСК, при уровне аллельной нагрузки не менее 2% (или 4% у мужчин в случае наличия мутации в генах, сцепленных с Х-хромосомой); отсутствие критериев ЗЗСК, других причин цитопении и молекулярных аберраций; стойкая цитопения более чем в одном ростке кроветворения (гемоглобин ниже 100 г/л, нейтрофилы менее 1,8×10⁹/л, тромбоциты менее 100×10⁹/л) в течение не менее 4 месяцев. Также при наличии стойкой цитопении более чем в одном ростке кроветворения и отсутствии критериев миелоидного новообразования и других заболеваний системы крови предложено использовать термин «идиопатическая цитопения неустановленного значения» (idiopathic cytopenia of undetermined significance) [30].
Клональное кроветворение и онкогематологические заболевания
В настоящее время показано, что у лиц с КК чаще выявляются признаки генетической нестабильности, обусловленные соматическими мутациями в генах эпигенетической регуляции (DNMT3A, TET2, ASXL1), генах сплайсинга РНК (SF3B1, SRSF2, ZRSR2), сигнальных путей и клеточной пролиферации (JAK2, FLT3), генах, связанных с метаболизмом и клеточной дифференцировкой (IDH1, IDH2), а также в генах регуляции репарации ДНК (TP53, PPM1D), в сравнении с популяцией они же часто обнаруживаются при диагностике цитопений неясной этиологии. Около 80% случаев ККНП приходится на мутации в генах DNMT3A, TET2 и ASXL1 [22][23].
Мутации, характерные для миелодиспластического синдрома (МДС), миелопролиферативных новообразований и острого миелоидного лейкоза, наблюдаются в генах JAK2, PPM1D, TP53, SRSF2, SF3B1 и встречаются реже [26]. Частота обнаружения данных мутаций намного выше, чем заболеваемость ЗЗСК, тем не менее КК можно рассматривать как событие, предшествующее развитию гемобластозов. Признаки КК определяют у 50% больных апластической анемией, у 15% находят характерные для КК мутации генов DNMT3A и ASXL1 [31][32]. Другим примером развития КК с его трансформацией в патологический процесс является пароксизмальная ночная гемоглобинурия. При данном заболевании клон, возникший из ГСК с дефицитом гликозил-фосфатидилинозитола, менее восприимчив к опосредованному Т-клетками уничтожению по сравнению с нормальными ГСК [30][33].
Кроме того, КК с точечными мутациями или структурными вариациями, такими как изменение числа копий гена, приводит к 10-кратному увеличению риска развития ЗЗСК. Роль нарушений противоопухолевого звена иммунной системы в трансформации КК в ЗЗСК требует дальнейшего изучения [22]. При этом наличие ККНП сопряжено с 13-кратным повышением риска развития гемобластозов, с частотой их возникновения у 0,5–1% пациентов в год [8].
В большинстве случаев ККНП является доброкачественным, особенно при небольших размерах клона, отсутствии множественных и драйверных мутаций [20]. Основные факторы риска развития не только гематологических, но и соматических заболеваний при ККНП включают: значительный размер клона (от 10% и выше) и ускорение его роста, клональные изменения более чем в одной клеточной линии, множественные драйверные мутации, мутации гена TР53, хромосомные аберрации [34].
Накопленная информация и расширение спектра детектируемых генетических мутаций до недавнего времени не позволяли отделить мутации, инициирующие возникновение КК, от тех, которые являются ранним событием в развитии ЗЗСК, а также выделить мутации второго порядка, которые вносят наиболее существенный вклад уже при прогрессировании заболевания. Так, было предложено выделение драйверных мутаций, пассажирских мутаций, а также фоновых и кооперирующих мутаций [20][22]. В публикациях 2024 года указано, что уже разработаны методы для определения драйверных мутаций, например «метод обогащения несинонимичных мутаций по сравнению с нейтральными синонимичными мутациями» или алгоритмы на основе машинного обучения [35][36].
Таким образом, в соответствии с современными представлениями мутации генов, ассоциированных с ККНП, являются одним из предрасполагающих факторов к развитию ЗЗСК. Появление таких мутаций приводит к трансформации нормальной ГСК в «предлейкозную» неопластическую ГСК. Измененная ГСК дает начало небольшим субклонам и сама практически не отличается от нормальной ГСК. Частота выявления мутаций увеличивается с возрастом, и это закономерный биологический процесс, сопровождающий старение. Однако «предлейкозная» ГСК обладает повышенным риском для трансформации в лейкозную ГСК при приобретении дополнительных молекулярно-генетических повреждений. Факторы такой трансформации требуют дальнейшего изучения. Классификация генетических поломок по их онкогенному потенциалу также является областью интереса для современных научных исследований. Модель КК, представленная на рисунке 1, обобщает наши представления о драйверных, кооперирующих, пассажирских и фоновых мутациях, а также о причинах генетической нестабильности, обусловливающих клональную эволюцию с развитием ЗЗСК.
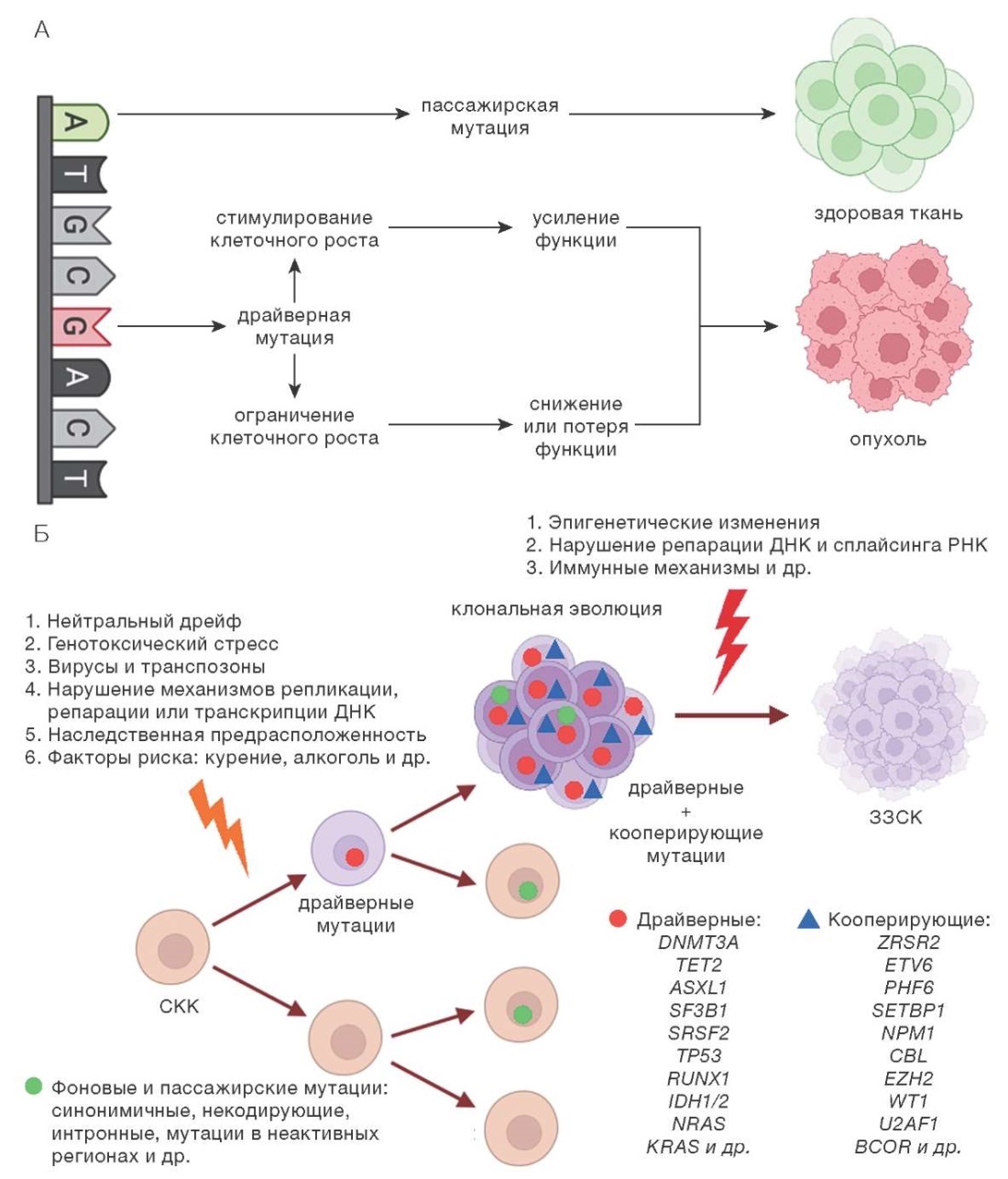
Рисунок подготовлен авторами по данным источника [24]
Рис. 1. Модель клонального кроветворения: реализация действия пассажирских (А) и драйверных (Б) мутаций
Клональное кроветворение и соматическая патология
Развитие ККНП является независимым фактором риска не только различных гемобластозов, но и сердечно-сосудистых заболеваний, болезни Альцгеймера, сахарного диабета 2 типа, тромбозов, аутоиммунных процессов и иной патологии [7]. При развитии клональной экспансии ГСК нет анатомических ограничений, и клетки клона циркулируют в кровяном русле в большом количестве [21]. Таким образом, при КК возрастает риск развития не только ЗЗСК (чаще миелоидных и реже лимфоидных), но и развития различной соматической патологии [21][37].
В ряде публикаций было убедительно продемонстрировано, что ККНП ассоциировано не только с риском развития острых лейкозов, МДС и других гемобластозов, но и с такими формами неблагоприятного течения сердечно-сосудистой патологии, как острое нарушение мозгового кровообращения и острый инфаркт миокарда [38–40]. В двух независимых метаанализах также было показано, что наличие ККНП связано с высоким риском развития атеросклероза и сердечно-сосудистой патологии [40][41].
Наличие ККНП способствует ускорению процессов атеросклеротического поражения сосудов. Данный факт был подтвержден на животных моделях, схожие выводы были получены в дальнейшем и для человека [41–43]. Мутации, характерные для ККНП, ускоряют атеросклеротический процесс, что отмечали даже при незначительном увеличении их аллельной нагрузки [41]. Путем моделирования ККНП в эксперименте на мышах было показано, что атеросклеротическое поражение аорты было на 60% более выражено по сравнению с контрольной группой животных [43]. Подобное моделирование ККНП показало свою исключительную воспроизводимость и в других экспериментах на животных [43][44]. Схожие результаты были получены и при моделировании ККНП, сопряженного с мутацией JAK2V617F. Наличие данной мутации у животных обусловливало увеличение эритрофагоцитоза в атеросклеротических бляшках, что ускоряло их дестабилизацию [45]. Кроме того, данная мутация была ассоциирована с более высокой частотой тромбообразования в атеросклеротических бляшках [45][46].
Клональное кроветворение неясного потенциала повышает не только риск острых сердечно-сосудистых событий, но и усугубляет течение сердечной недостаточности (СН) [40][45]. В исследовании S. Sano, K. Oshima et al. мышам проводили трансплантацию 10% Tet2–/– клеток КМ, и при этом была выявлена связь инактивированного драйверного гена с высокой частотой развития СН [43]. Детальный транскриптомный анализ тканей сердца продемонстрировал у животных повышенную экспрессию генов, связанных с NLRP3-инфламмасомой, а также гена IL1B. Использование ингибитора NLRP3 снижало частоту ремоделирования сердца и риск развития СН у мышей [44][47][48]. Таким образом, было продемонстрировано, что драйверные мутации ККНП также интенсифицируют провоспалительную реакцию, приводящую к развитию сердечно-сосудистой патологии [7][45][48].
Вместе с тем уже установлены новые факты, и на данный момент продолжаются исследования относительно роли ККНП в развитии различных вариантов течения сахарного диабета 2-го типа [7], болезни Альцгеймера [7][49], аутоиммунных заболеваний [7][50], тромбозов [7v46] и другой патологии. Решающую роль при соматической патологии отводят сочетанию эффектов соматических мутаций, характерных для ККНП, с хроническим воспалительным процессом, длительной гиперактивацией иммунной системы, сопутствующей патологией и ее терапией, образом жизни, а также воздействием внешних факторов [46].
Ионизирующее излучение как индуктор генетической нестабильности и клонального кроветворения
Действие ИИ приводит к нарушению процессов репарации, интерфазной или митотической репродуктивной гибели клеток и нарастающему дефициту дифференцированных клеток с формированием детерминированных эффектов облучения. Они заключаются в прямом повреждающем действии ИИ на клетки и ткани и проявляются только после облучения в дозе, превышающей пороговую, то есть такую, при которой определяются клинически значимые последствия, как детерминированные (тканевые реакции), так и стохастические. Степень выраженности повреждения быстро нарастает по мере накопления дозы облучения [51][52].
При воздействии малых доз ИИ развиваются стохастические эффекты. Под малыми дозами в таком случае принято понимать следующие: разовая эквивалентная доза до 0,1 Зв или 10 бэр; поглощенная доза до 0,1 Гр или 10 рад; эффективная эквивалентная доза до 0,1 Зв/год, что примерно соответствует экспозиционной дозе 750 мкР/час [1][6]. В случае такого воздействия, когда незначительное повреждение клеток под действием ИИ произошло, но было полностью устранено за счет восстановительных процессов, клетки сохраняют жизнеспособность, но приобретают генетические мутации. Вероятность нанесения такого повреждения при единичном воздействии малых доз ИИ минимальна, но резко возрастает при увеличении эффективной эквивалентной дозы и длительности воздействия. Следовательно, для стохастических эффектов характерно отсутствие дозового порога облучения и принимается, что вероятность их возникновения линейно пропорциональна величине воздействующей дозы ИИ. К стохастическим эффектам относят развитие ЗЗСК и солидных опухолей, а также наследственной патологии [4][6][51].
Таким образом, основной реакцией организма на хроническое действие малых доз ИИ является нарушение стабильности генома и регуляторных процессов. На фоне генетической нестабильности возможны различные реакции организма на воздействие внешних факторов, вплоть до гибели. Увеличение количества хромосомных аберраций может предшествовать развитию вторичного иммунодефицита, преждевременного старения, неоплазий, в том числе ЗЗСК, а также соматической патологии. Малые дозы ИИ являются для организма фактором стресса, а отдаленные последствия его длительного хронического воздействия заключаются в истощении компенсаторных возможностей организма [7][52].
В настоящее время возросло число публикаций по исследованию эффектов профессионального воздействия, в том числе малых доз ИИ, у определенного профессионального контингента (работники атомной промышленности, врачи лучевой диагностики и др.). Заслуживают внимания данные, опубликованные в 2022 году в исследовании S. Jasra et al., в котором приведен анализ воздействия химических веществ и твердых частиц пыли на 481 спасателя, принимавшего участие в ликвидации последствий катастрофы во Всемирном торговом центре 11 сентября 2001 г. Авторами было обнаружено значительное увеличение рисков развития КК у данных лиц, при этом наиболее часто определяли мутации в генах DNMT3A и TET2, а частота их выявления увеличивалась с возрастом в сопоставлении с 255 сотрудниками из группы сравнения [53].
По данным другого крупного исследования, проведенного в 2019 году и основанного на результатах наблюдения за лицами, пережившими атомную бомбардировку, не имеющими диагноза ЗССК, установлено, что под воздействием радиоактивного излучения наблюдалось ускорение процессов клональной экспансии клеток крови, что приводило к долгосрочному повышению циркулирующих моноцитов в группе лиц старше 60 лет [54]. Также в 2022 году были опубликованы результаты исследования, посвященного анализу наличия мутаций генов-драйверов КК у астронавтов NASA. В ходе исследования были выявлены 34 несинонимичные мутации в 17 драйверных генах, с наибольшей частотой встречаемости в генах TP53 и DNMT3A [55].
В последнее время появляются единичные работы, посвященные изучению производственного влияния ИИ на развитие онкологической и сердечно-сосудистой патологии у сотрудников атомной промышленности и врачей лучевой диагностики. Так, по результатам крупного метаанализа было установлено, что значение поглощенной дозы ИИ, при превышении которого увеличивается смертность от болезней системы кровообращения у данных категорий работников, составляет 0,5 Гр [56].
По результатам метаанализа (данные 15 стран) показателей общей смертности и смертности от всех злокачественных новообразований для работников ядерной индустрии, а также для работников, имеющих контакт с наиболее токсичными тяжелыми металлами и химическими соединениями, по показателям смертности от всех злокачественных новообразований не было выявлено их явного повышения сравнительно с популяцией [57]. При проведении метаанализа данных по рискам развития сердечно-сосудистой патологии авторами также не были отмечены существенные различия с показателями в популяции [58]. Однако в контексте действия малых доз ИИ на развитие КК у данных категорий лиц в настоящее время в крупных работах по определению мутаций, ассоциированных с КК, сведений не представлено. Большинство отечественных исследований ориентированы на характеристики ИИ и ретроспективный анализ заболеваемости, а также выживаемости сотрудников, подвергающихся длительному воздействию малых доз ИИ. Следовательно, возможность определения мутаций, ассоциированных с КК, представляет наибольший интерес для современных исследований.
ЗАКЛЮЧЕНИЕ
В настоящее время установлена связь КК с естественными процессами старения. Описано влияние ККПН на повышение рисков развития гемобластозов, соматической патологии и увеличение общей летальности. Генетическая нестабильность в генах DNMT3A, TET2, ASXL1. JAK2, TP53, PPM1D, SF3B1, SRSF2, которые наиболее часто инициируют КК, в сочетании с хроническим воспалением и повышенной активацией иммунной системы приводят к развитию указанных заболеваний.
Вместе с тем на данный момент нет исчерпывающих данных о рисках перехода клинически не выраженного ККНП в заболевание. Своевременный скрининг, направленный на выявление факторов, коррелирующих с неблагоприятными исходами, позволит выявлять лиц с повышенным риском развития патологии.
Изучение влияния радиационно-индуцированной генетической нестабильности на формирование клональной экспансии является актуальным для мониторинга здоровья и превентивной диагностики онкогематологической и соматической патологии у лиц с длительным техногенным облучением в малых дозах (работники атомной промышленности и врачи лучевой диагностики).
Дальнейшие исследования позволят не только улучшить понимание роли КК и ККНП при различной патологии, но и определить возможности терапевтического воздействия, направленного на профилактику неблагоприятного течения заболевания и увеличения продолжительности жизни.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.А. Жернякова — разработка концепции статьи, обзор литературы, сбор и анализ литературных источников, написание текста; Е.О. Куневич — обзор литературы, сбор и анализ литературных источников, написание текста, рисунок; О.Б. Крысюк — разработка концепции статьи, сбор и анализ литературных источников, редактирование статьи, окончательное одобрение рукописи.
Список литературы
1. Маренный АМ, Киселев СМ, Семенов СЮ. О проблеме обеспечения защиты населения России от природных источников ионизирующего излучения. Медицина экстремальных ситуаций. 2019;21(3):371–82.
2. Пучков ВА, ред. Гражданская защита. М.: ФГБУ ВНИИ ГОЧС; 2015
3. Барковский АН, Ахматдинов РР, Ахматдинов РР, Барышков НК, Библин АМ, Братилова АА и др. Дозы облучения населения Российской Федерации в 2020 г. Радиационная гигиена. 2021;14(4):103–13.
4. Кострюкова НК, Карпин ВА. Биологические эффекты малых доз ионизирующего излучения. БМЖ. 2005;50(1):17–22.
5. Кузнецова ЕА, Заичкина СИ, Сирота НП, Абдуллаев СА, Розанова ОМ, Аптикаева ГФ и др. Индукция редко- и плотноионизирующими излучениями повреждений ДНК в лейкоцитах крови и цитогенетических повреждений в полихроматофильных эритроцитах костного мозга мышей и их потомков. Радиационная биология. Радиоэкология. 2014;54(4):341–9.
6. Жижина ГП. Влияние малых доз низкоинтенсивной ионизирующей радиации на структуру и функции ДНК. Радиационная биология. Радиоэкология. 2011;51(2):218–28.
7. Cacic AM, Schulz FI, Germing U, Dietrich S, Gattermann N. Molecular and clinical aspects relevant for counseling individuals with clonal hematopoiesis of indeterminate potential. Front. Oncol. 2023;13:1303785. https://doi.org/10.3389/fonc.2023.1303785
8. Jaiswal S. Clonal hematopoiesis and nonhematologic disorders. Blood. 2020;136(14):1606–14. https://doi.org/10.1182/blood.20190009899
9. Reed SC, Croessmann S, Park BH. CHIP Happens: Clonal Hematopoiesis of Indeterminate Potential and Its Relationship to Solid Tumors. Clin Cancer Res. 2023;29(8):1403–11. https://doi.org/10.1158/1078-0432.CCR-22-2598
10. Doulatov S, Notta F, Laurenti E, Dick JE. Hematopoiesis: A human perspective. Cell Stem Cell. 2012:10(2):120–36. https://doi.org/10.1016/j.stem.2012.01.006
11. Watcham S, Kucinski I, Gottgens B. New insights into hematopoietic differentiation landscapes from single-cell RNA sequencing. Blood. 2019;133(13):1415–26. https://doi.org/10.1182/blood-2018-08-835355
12. Eaves CJ. Hematopoietic stem cells: concepts, definitions, and the new reality. Blood. 2015; 125(17): 2605–13. https://doi.org/10.1182/blood-2014-12-570200
13. Nimmo RA, May GE, Enver T. Primed and ready: understanding lineage commitment through single cell analysis. Trends. Cell. Biol. 2015;25(8):459–67. https://doi.org/10.1016/j.tcb.2015.04.004
14. Lee-Six H, Øbro NF, Shepherd MS, Grossmann S, Dawson K, Belmonte M, et al. Population dynamics of normal human blood inferred from somatic mutations. Nature. 2018;561(7724):473–8. https://doi.org/10.1038/s41586-018-0497-0
15. Mitchell E, Spencer Chapman M, Williams N, Dawson KJ, Mende N, Calderbank EF, et al. Clonal dynamics of haematopoiesis across the human lifespan. Nature. 2022;606(7913):343–50. https://doi.org/10.1038/s41586-022-04786-y
16. Vijg J. From DNA damage to mutations: All roads lead to aging. Ageing Res Rev. 2021;68(101316). https://doi.org/10.1016/j.arr.2021.101316
17. Vijg J. Pathogenic Mechanisms of Somatic Mutation and Genome Mosaicism in Aging. Cell. 2020;182(1):12–23. https://doi.org/10.1016/j.cell.2020.06.024
18. Holstege H, Pfeiffer W, Sie D, Hulsman M, Nicholas TJ, Lee CC, et al. Somatic mutations found in the healthy blood compartment of a 115-yr-old woman demonstrate oligoclonal hematopoiesis. Genome Res. 2014;24(5):733–42. https://doi.org/10.1101/gr.162131.113
19. Ainciburu M, Ezponda T, Berastegui N, Alfonso-Pierola A, VilasZornoza A, San Martin-Uriz P., et al. Uncovering perturbations in human hematopoiesis associated with healthy aging and myeloid malignancies at single-cell resolution. Elife. 2023;12:e79363. https://doi.org/10.7554/eLife.79363
20. Кашлакова АИ, Бидерман БВ, Паровичникова ЕН. Клональное кроветворение и острые миелоидные лейкозы. Онкогематология. 2023;18(3):92–101.
21. Петинати НА, Дризе НИ. Клональное кроветворение и его роль в развитии гематологических заболеваний. Гематология и трансфузиология. 2021;66(4):580–92.
22. Genovese G, Kähler AK, Handsaker RE, Lindberg J, Rose SA, Bakhoum SF, et al. Clonal hematopoiesis and blood-cancer risk inferred from blood DNA sequence. N. Engl. J. Med. 2014;371(26):2477–87. https://doi.org/10.1056/NEJMoa1409405
23. Jaiswal S, Fontanillas P, Flannick J, Manning A, Grauman PV, Mar BG, et al. Age-related clonal hematopoiesis associated with adverse outcomes. N. Engl. J. Med. 2014; 371(26):2488–98. https://doi.org/10.1056/NEJMoa1408617
24. Xie M, Lu C, Wang J, McLellan MD, Johnson KJ, Wendl MC, et al. Age-related mutations associated with clonal hematopoietic expansion and malignancies. Nat. Med. 2014;20(12):1472–8. https://doi.org/10.1038/nm.3733
25. Steensma DP. Clinical consequences of clonal hematopoiesis of indeterminate potential. Hematology Am. Soc. Hematol. Educ. Program. 2018;2018(1):264–9. https://doi.org/10.1182/asheducation-2018.1.264
26. Steensma DP, Bejar R, Jaiswal S, Lindsley RC, Sekeres MA, Hasserjian RP, Ebert BL. Clonal hematopoiesis of indeterminate potential and its distinction from myelodysplastic syndromes. Blood. 2015;126(1):9–16. https://doi.org/10.1182/blood-2015-03-631747
27. Cooper JN, Young NS. Clonality in context: hematopoietic clones in their marrow environment. Blood. 2017:130(22):2363–72. https://doi.org/10.1182/blood-2017-07-794362
28. Valent P, Kern W, Hoermann G, Milosevic Feenstra JD, Sotlar K, Pfeilstöcker M, et al. Clonal hematopoiesis with oncogenic potential (CHOP): separation from CHIP and roads to AML. Int. J. Mol. Sci. 2019;20(3):789. https://doi.org/10.3390/ijms20030789
29. Cappelli LV, Meggendorfer M, Baer C, Nadarajah N, Hutter S, Jeromin S, et al. Indeterminate and oncogenic potential: CHIP vs CHOP mutations in AML with NPM1 alteration. Leukemia. 2022;36(2):394–402. https://doi.org/10.1038/s41375-021-01368-1
30. Gondek LP. CHIP: is clonal hematopoiesis a surrogate for aging and other disease? Hematology Am Soc Hematol Educ Program. 2021;2021(1):384–9. https://doi.org/10.1182/hematology.2021000270
31. Yoshizato T, Dumitriu B, Hosokawa K, Makishima H, Yoshida K, Townsley D, et al. Somatic mutations and clonal hematopoiesis in aplastic anemia Somatic Mutations and Clonal Hematopoiesis in Aplastic Anemia. N Engl J Med. 2015;373(1):35–47. https://doi.org/10.1056/NEJMoa1414799
32. Babushok DV. A brief, but comprehensive, guide to clonal evolution in aplastic anemia. Hematology. Am Soc Hematol Educ Program. 2018;2018(1):457–66. https://doi.org/10.1182/asheducation-2018.1.457
33. Colden MA, Kumar S, Munkhbileg B, Babushok DV. Insights Into the Emergence of Paroxysmal Nocturnal Hemoglobinuria. Front Immunol. 2022;12:830172. https://doi.org/10.3389/fimmu.2021.830172
34. Robertson NA, Latorre-Crespo E, Terradas-Terradas M, Lemos-Portela J, Purcell AC, Livesey BJ, et al. Longitudinal dynamics of clonal hematopoiesis identifies gene-specific fitness effects. Nat Med. 2022;28(7):1439–46. https://doi.org/10.1038/s41591-022-01883-3
35. Bernstein N, Spencer Chapman M, Nyamondo K, Chen Z, Williams N, Mitchell E, et al. Analysis of somatic mutations in whole blood from 200,618 individuals identifies pervasive positive selection and novel drivers of clonal hematopoiesis. Nat Genet. 2024;56(6):1147–55. https://doi.org/10.1038/s41588-024-01755-1
36. Demajo S, Ramis-Zaldivar JE, Muinos F, Grau ML, Andrianova M, Lopez-Bigas N. Identification of Clonal Hematopoiesis Driver Mutations through In Silico Saturation Mutagenesis. Cancer Discov. 2024;14(9): 1717–31. https://doi.org/10.1158/2159-8290.CD-23-1416
37. Luis TC, Wilkinson AC, Beerman I, Jaiswal S, Shlush LI. Biological implications of clonal hematopoiesis. Exp Hematol. 2019;77:1–5. https://doi.org/10.1016/j.exphem.2019.08.004
38. Mooney L, Goodyear CS, Chandra T, Kirschner K, Copland M, Petrie MC, Lang NN. Clonal haematopoiesis of indeterminate potential: intersections between inflammation, vascular disease and heart failure. Clin Sci (Lond). 2021;135(7):991–1007. https://doi.org/10.1042/CS20200306
39. Marnell CS, Bick A, Natarajan P. Clonal hematopoiesis of indeterminate potential (CHIP): Linking somatic mutations, hematopoiesis, chronic inflammation and cardiovascular disease. J Mol Cell Cardiol. 2021;161:98–105. https://doi.org/10.1016/j.yjmcc.2021.07.004
40. Dorsheimer L, Assmus B, Rasper T, Ortmann CA, Ecke A, Abou-El-Ardat K, et al. Association of Mutations Contributing to Clonal Hematopoiesis With Prognosis in Chronic Ischemic Heart Failure. JAMA Cardiol. 2019; 4(1):25–33. https://doi.org/10.1001/jamacardio.2018.3965
41. Jaiswal S, Natarajan P, Silver AJ, Gibson CJ, Bick AG, Shvartz E, et al. Clonal Hematopoiesis and Risk of Atherosclerotic Cardiovascular Disease. N Engl J Med. 2017;377(2):111–21. https://doi.org/10.1056/NEJMoa1701719
42. Heyde A, Rohde D, McAlpine CS, Zhang S, Hoyer FF, Gerold JM, et al. Increased stem cell proliferation in atherosclerosis accelerates clonal hematopoiesis. Cell. 2021;184(5):1348–61.e22. https://doi.org/10.1016/j.cell.2021.01.049
43. Fuster JJ, Walsh K. Somatic Mutations and Clonal Hematopoiesis: Unexpected Potential New Drivers of Age-Related Cardiovascular Disease. Circ Res. 2018;122(3):523–32. https://doi.org/10.1161/CIRCRESAHA.117.312115
44. Sano S, Oshima K, Wang Y, MacLauchlan S, Katanasaka Y, Sano M, et al. Tet2-Mediated Clonal Hematopoiesis Accelerates Heart Failure Through a Mechanism Involving the IL-1β/NLRP3 Inflammasome. J Am Coll Cardiol. 2018;71(8):875–86. https://doi.org/10.1016/j.jacc.2017.12.037
45. Wang W, Liu W, Fidler T, Wang Y, Tang Y, Woods B, et al. Macrophage Inflammation, Erythrophagocytosis, and Accelerated Atherosclerosis in Jak2 V617F Mice. Circ Res. 2018;123(11):e35–e47. https://doi.org/10.1161/CIRCRESAHA.118.313283
46. Wolach O, Sellar RS, Martinod K, Cherpokova D, McConkey M, Chappell RJ, et al. Increased neutrophil extracellular trap formation promotes thrombosis in myeloproliferative neoplasms. Sci Transl Med. 2018;10(436):eaan8292. https://doi.org/10.1126/scitranslmed.aan8292
47. Fidler TP, Xue C, Yalcinkaya M, Hardaway B, Abramowicz S, Xiao T, et al. The AIM2 inflammasome exacerbates atherosclerosis in clonal haematopoiesis. Nature. 2021;592(7853):296–301. https://doi.org/10.1038/s41586-021-03341-5
48. Tyrrell DJ, Goldstein DR. Ageing and atherosclerosis: vascular intrinsic and extrinsic factors and potential role of IL-6. Nat Rev Cardiol. 2021;18(1):58–68. https://doi.org/10.1038/s41569-020-0431-7
49. Bouzid H, Belk JA, Jan M, Qi Y, Sarnowski C, Wirth S, et al. NHLBI Trans-Omics for Precision Medicine (TOPMed) Consortium. Clonal hematopoiesis is associated with protection from Alzheimer’s disease. Nat Med. 2023;29(7):1662–70. https://doi.org/10.1038/s41591-023-02397-2
50. Arends CM, Weiss M, Christen F, Eulenberg-Gustavus C, Rousselle A, Kettritz R, et al. Clonal hematopoiesis in patients with anti-neutrophil cytoplasmic antibody-associated vasculitis. Haematologica. 2020;105(6):e264–e267. https://doi.org/10.3324/haematol.2019.223305
51. Hamada N, Fujimichi Y. Classification of radiation effects for dose limitation purposes: history, current situation and future prospects. J Radiat Res. 2014;55(4):629–40. https://doi.org/10.1093/jrr/rru019
52. Zhang Y, Chen X, Wang X, Chen J, Du C, Wang J, Liao W. Insights into ionizing radiation-induced bone marrow hematopoietic stem cell injury. Stem Cell Res Ther. 2024;15(1):222. https://doi.org/10.1186/s13287-024-03853-7
53. Jasra S, Giricz O, Zeig-Owens R, Pradhan K, Goldfarb DG, Barreto-Galvez A, et al. High burden of clonal hematopoiesis in first responders exposed to the World Trade Center disaster. Nat Med. 2022;28(3):468–71. https://doi.org/10.1038/s41591-022-01708-3
54. Yoshida K, French B, Yoshida N, Hida A, Ohishi W, Kusunoki Y. Radiation exposure and longitudinal changes in peripheral monocytes over 50 years: the Adult Health Study of atomicbomb survivors. Br J Haematol. 2019;185(1):107–15. https://doi.org/10.1111/bjh.15750
55. Brojakowska A, Kour A, Thel MC, Park E, Bisserier M, Garikipati VNS, et al. Retrospective analysis of somatic mutations and clonal hematopoiesis in astronauts. Commun Biol. 2022;5(1):828. https://doi.org/10.1038/s42003-022-03777-z
56. Котеров АН. От очень малых до очень больших доз радиации: новые данные по установлению диапазонов и их экспериментально-эпидемиологические обоснования. Медицинская радиология и радиационная безопасность. 2013; 58(2):5–21.
57. Котеров АН, Ушенкова ЛН, Калинина МВ, Бирюков АП. «Эффект здорового работника» по показателям общей смертности и смертности от злокачественных новообразований у персонала предприятий ядерной и химической индустрии: мета-анализы. Медицинская радиология и радиационная безопасность. 2023; 68(4):43–50.
58. Котеров АН, Избыточный относительный риск смертности от болезней системы кровообращения после облучения. Обзор и мета-анализ, декларирующих эффекты малых доз 2023 г. Радиационная биология. Радиоэкология. 2023;63(1):3–33.
Об авторах
А. А. ЖерняковаРоссия
Жернякова Анастасия Андреевна, канд. мед. наук
Санкт-Петербург
О. Б. Крысюк
Россия
Крысюк Олег Богданович, д-р мед. наук, профессор
Санкт-Петербург
Е. О. Куневич
Россия
Куневич Евгений Олегович, канд. мед. наук
Санкт-Петербург
Рецензия
Для цитирования:
Жернякова А.А., Крысюк О.Б., Куневич Е.О. Клональное кроветворение и ионизирующее излучение: риски развития онкогематологической и соматической патологии. Медицина экстремальных ситуаций. 2024;26(4):5-12. https://doi.org/10.47183/mes.2024-26-4-5-12
For citation:
Zherniakova A.A., Krysiuk O.B., Kunevich Ye.O. Clonal haematopoiesis and ionizing radiation: risks for hematological malignancies and somatic diseases. Extreme Medicine. 2024;26(4):5-12. https://doi.org/10.47183/mes.2024-26-4-5-12

















