Перейти к:
Микрочастицы как критерии качества концентрата тромбоцитов
https://doi.org/10.47183/mes.2024-26-4-132-140
Аннотация
Введение. В связи с возросшей потребностью применения концентрата тромбоцитов для лечения и профилактики тромбоцитопатии актуальной задачей является разработка, совершенствование и внедрение новых подходов мониторинга параметров его качества и оценки безопасности.
Цель. Проведение систематического обзора и анализа литературных данных для выявления перспективных подходов к оценке адекватного анализа качества тромбоцитного концентрата для повышения эффективности и безопасности трансфузий.
Обсуждение. Выявлены возможности и преимущества рационального подхода к переливанию концентрата тромбоцитов с учетом степени активации тромбоцитов для оптимизации заготовки компонента. Особое внимание уделено методам оценки активации тромбоцитов. Обнаружение микрочастиц на основе динамического рассеяния света позволит отличать активированные (с высоким содержанием микрочастиц) от неактивированных (с низким содержанием микрочастиц) тромбоцитов при проведении как лечебных, так и профилактических трансфузий и оптимизировать использование этого дефицитного компонента крови.
Выводы. Возможность дифференцировки концентратов тромбоцитов на основе скрининга содержания микрочастиц, образующихся в результате активации, будет способствовать повышению эффективности и безопасности трансфузионной терапии.
Для цитирования:
Гришина Г.В., Касьянов А.Д., Ласточкина Д.В., Кробинец И.И., Голованова И.С., Матвиенко О.Ю. Микрочастицы как критерии качества концентрата тромбоцитов. Медицина экстремальных ситуаций. 2024;26(4):132-140. https://doi.org/10.47183/mes.2024-26-4-132-140
For citation:
Grishina G.V., Kasyanov A.D., Lastochkina D.V., Krobinets I.I., Golovanova I.S., Matvienko O.Yu. Microparticles as quality criteria for platelet concentrate. Extreme Medicine. 2024;26(4):132-140. https://doi.org/10.47183/mes.2024-26-4-132-140
ВВЕДЕНИЕ
В последние два десятилетия в Российской Федерации наблюдается устойчивый рост потребности в использовании тромбоцитных концентратов (ТК) в связи с совершенствованием и интенсификацией лечебных программ с применением ТК во многих областях медицины.
Тромбоциты — это специализированные безъядерные клетки крови, играющие ключевую роль в остановке кровотечений и опасном перекрывании здоровых сосудов при тромбозе. Неактивированные тромбоциты представляют собой сплюснутые сфероиды (диски) с соотношением полуосей от 2 до 8 и характерным размером от 2 до 4 мкм в диаметре. В активированном состоянии форма тромбоцитов изменяется: часть активированных тромбоцитов приобретает форму близкую к сферической. При переходе в активированное состояние от тромбоцитов отделяются микрочастицы с размерами в интервале от 50 до 100 нм, которые попадают в межклеточное пространство крови [1]. Показателем доли активных тромбоцитов является содержание микрочастиц в данном концентрате.
Концентраты тромбоцитов — это один из дефицитных компонентов крови, используемых при гемотрансфузиях. Для оценки качества этих концентратов и правильного их использования важно иметь информацию о доле активных тромбоцитов, содержащихся в них [1–4]. Этот показатель зависит от индивидуальных особенностей донора, способа получения концентрата тромбоцитов из донорской крови, длительности и условий хранения концентрата. Слишком большая доля микрочастиц в концентрате делает его непригодным для использования при трансфузии. Возможность использования концентратов с умеренной долей активных тромбоцитов и, соответственно, микрочастиц зависит от особенностей пациента, для которого этот концентрат предназначен.
Цель исследования: проведение систематического обзора и анализа литературных данных для выявления перспективных подходов к оценке адекватного анализа качества тромбоцитного концентрата для повышения эффективности и безопасности трансфузий.
ОБСУЖДЕНИЕ
Свойства и функции тромбоцитарных микрочастиц
Образование микрочастиц (МЧ) (микровезикул) является неотъемлемым проявлением жизнедеятельности клеток и происходит как in vivo, так и in vitro. Образование микрочастиц стимулируется действием патогенов, стрессом, различными повреждениями и иными неблагоприятными факторами [1]. Наиболее активная продукция микрочастиц свойственна форменным элементам крови, а также эндотелиальным и гладкомышечным клеткам сосудов [2]. Среди всех микрочастиц, находящихся в крови, микрочастицы тромбоцитов (МТ) являются наиболее многочисленными [3] и составляют около 70–90% от общего числа клеток. Растет научный и клинический интерес к физиологической роли, которую играют тромбоцитарные микрочастицы [4]. По сравнению с тромбоцитами, которые имеют среднюю продолжительность жизни около 10 суток, длительность существования тромбоцитарных микрочастиц измеряется минутами [5], при этом остается невыясненным аспект удаления микрочастиц из циркуляции в кровеносном русле.
Микрочастицы тромбоцитов представляют собой фрагменты размером 0,1–1 мкм, выделяемые из плазматических мембран тромбоцитов, которые подвергаются активации, стрессу или апоптозу, с широким спектром биологической активности. Они имеют структуру на основе фосфолипидов (ФЛП) и экспрессируют функциональные рецепторы из мембран тромбоцитов. Являясь наиболее распространенными микрочастицами в крови, МТ экспрессируют прокоагулянт фосфатидилсерин (ФС) и, вероятно, дополняют, если не усиливают, функции тромбоцитов в гемостазе, тромбозе, онкологическом процессе и воспалении, но также действуют как стимуляторы регенерации тканей. Их размер и структура делают МТ незаменимыми в системе межклеточных взаимодействий с клетками тканей в качестве инструмента доставки переносимых тромбоцитами биологически активных молекул, включая факторы роста, другие сигнальные молекулы и микроРНК.
Учитывая реакционноспособность МТ, они могут оказывать различное патофизиологическое влияние на клеточную среду при взаимодействии с компонентами кровеносной системы. Также появляется все больше доказательств того, что выработка МТ запускается во время донации, разделения на компоненты и хранения крови, что может привести к тромботическим и воспалительным побочным эффектам у реципиентов. Оценка МТ требует строгих преаналитических и аналитических процедур во избежание генерации артефактов и обеспечения точной оценки количества, перераспределения размера и функциональных свойств этих микрочастиц [6][7].
В условиях in vivo МТ могут высвобождаться из тромбоцитов в нормальных физиологических условиях или в результате активации, стресса или апоптоза. Исследование поверхностных маркеров показало, что МТ, вероятно, являются наиболее распространенными МЧ у здоровых людей, составляя 70–90% циркулирующих клеток в крови [6], с диапазоном их количества примерно 100–1000/мкл [7]. Мегакариоциты также могут высвобождать МЧ [8], но определение их доли требует дальнейших исследований. Остальные МЧ высвобождаются эндотелиальными клетками, лейкоцитами и эритроцитами. Оценка МТ по-прежнему требует разработки строгих преаналитических и аналитических процедур для обеспечения наиболее точной оценки численности, размера и функциональных свойств. Количество МТ увеличивается в результате активации коагуляционного каскада или системы комплемента, а также под действием апоптотических сигналов или сдвиговых сил. Число МТ увеличивается при некоторых протромботических и воспалительных заболеваниях, а также при некоторых видах рака [9].
Вероятно, количественное содержание микрочастиц в крови связано с состоянием баланса между их образованием и утилизацией [10]. При различных патологических состояниях этот баланс нарушается и в крови регистрируется увеличение содержания тромбоцитарных микрочастиц, вызванное «хронической активацией» тромбоцитов [11]. Микрочастицы тромбоцитов гетерогенны и характеризуются присутствием или отсутствием митохондрий [12], а также варьированием размеров. Поскольку МТ могут экспрессировать функциональные рецепторы от мембран тромбоцитов и являются наночастицами на основе ФЛП, они все чаще рассматриваются как инструментальные средства во взаимодействии между тромбоцитами и клетками тканей [13]. Микрочастицы тромбоцитов содержат биологически активные молекулы, включая факторы роста и другие сигнальные молекулы, способные передавать сообщения соседним клеткам или клеткам-мишеням [14]. Таким образом, МТ потенциально могут оказывать влияние на клеточную среду, которая взаимодействует с кровеносной сетью, поскольку они обнажают поверхность прокоагулянта ФЛП и действуют как транспортер ранее указанных биологически активных молекул, а также генетических материалов, включая микроРНК [15]. Генерация МТ также запускается in vitro во время обработки и хранения клеток крови [16], что потенциально может вызвать побочные эффекты при проведении трансфузионной терапии.
Точная характеристика МТ требует тщательной подготовки образцов для исследования, чтобы избежать экспериментальных артефактов. Кроме того, при оценке МТ должен быть сделан разумный выбор аналитических методов, сочетающих методики, характеризующие клеточное происхождение, численность, размер и функциональную активность микрочастиц [17].
Микрочастицы как универсальный показатель качества концентратов тромбоцитов
В клинической практике ТК имеют широкое применение. У онкологических пациентов тромбоциты используются для профилактики геморрагического синдрома. Лицам, перенесшим травму или операционные вмешательства, трансфузии ТК проводят с целью остановки кровотечения. Кроме того, внедрение инъекций богатой тромбоцитами плазмы основано на иммунологических функциях тромбоцитов.
Требования к качеству тромбоцитов, предназначенных для предотвращения и остановки кровотечений или ускорения заживления ран, потенциально сильно различаются. Может ли одна измеримая характеристика описать качество тромбоцитов для всех видов применения? Положительный ответ на этот вопрос содержится в работе Е. Maurer-Spurej, в которой представлены данные относительно использования измерения содержания микрочастиц в образцах тромбоцитов в качестве универсальной характеристики качества для производства, хранения, оценки жизнеспособности, функции и совместимости ТК [18].
Предполагается, что при получении тромбоконцентрата содержащиеся в нем жизнеспособные тромбоциты теряют свою жизнеспособность вследствие изменений во время хранения (storage lesion); при этом вариабельность доноров не считается основным способствующим этому фактором [19]. Из этого следует, что пациентам с показаниями к трансфузиям ТК, содержащим жизнеспособные тромбоциты, длительно циркулирующие в кровотоке, необходимо переливать компоненты в ближайшее время после их заготовки. Традиционно оценка качества тромбоцитов in vitro основывалась на этих предположениях [20]. Измерение экспрессии поверхностного рецептора CD62, уровня агрегации, стимулированной АДФ проводится в связи с изменением данных параметров как при активации тромбоцитов, так и в процессе их хранения. Показано, что высвобождение микрочастиц тромбоцитами следует за активацией и увеличивается по мере хранения тромбоцитарных компонентов [21]. Таким образом, качество тромбоцитов оценивается с точки зрения производителя и регулируется для обеспечения последовательности и стабильности производственного процесса [22].
Поскольку основное внимание при проведении оценки качества ТК уделяется обнаружению деградации от начала до конца регламентированного 5-дневного срока хранения [23], нормативные показатели имеют высокую разрешающую способность для небольших изменений у «покоящихся/жизнеспособных» тромбоцитов и низкую — у «активированных/функциональных». Анализируемые характеристики качества донорских тромбоцитов имеют значение в оценке немедленного ответа на трансфузию, но сохранение длительности ответа зависит преимущественно от характеристик пациента [24][25].
В исследованиях E. Maurer-Spurej, R. Larsen, A. Labrie et al. отмечено, что в 17% случаев (независимо от возраста) переливание концентратов донорских тромбоцитов не приводило к ожидаемому увеличению количества тромбоцитов после трансфузии у онкогематологических пациентов [26]. Одной из возможных причин такого неожиданно высокого уровня неблагоприятных клинических исходов является то, что жизнеспособность тромбоцитов в значительной степени зависит от характеристик донора. Действительно, установлено, что у примерно 33% доноров обнаруживали предварительно активированные тромбоциты, о чем свидетельствовал высокий уровень микрочастиц в заготовленном тромбоконцентрате [27]. Пациенты с онкопатологией обычно нуждаются в переливании тромбоцитов не по причине активного кровотечения, а в связи с предрасположенностью к развитию кровотечений из-за низкого количества тромбоцитов, вторичного по отношению к основному заболеванию и/или терапии. У этих пациентов донорские тромбоциты для возможной активации должны оставаться в циркуляторном русле. Из-за сниженной жизнеспособности предварительно активированные тромбоциты не рекомендуются для хранения или применения у онкологических больных [28]. Напротив, считается, что предварительно активированные тромбоциты, обладающие повышенной гемостатической активностью, эффективны для остановки острого кровотечения, что особенно важно для пациентов с хирургическими вмешательствами или травмами [29].
Тромбоциты используются в клинической практике для самых различных целей, и качество тромбоцитарного концентрата должно соответствовать конкретной задаче переливания. Следовательно, идеальный параметр качества для прогнозирования функционирования тромбоцитов после трансфузии ТК должен позволять различать покоящиеся/жизнеспособные и предварительно активированные/высокофункциональные тромбоциты с одинаковым разрешением по всему спектру жизнеспособности/функциональности [28][29].
Показатель содержания микрочастиц как фрагментации и гетерогенности тромбоцитов можно рассматривать как критерий качества для производства, хранения, жизнеспособности, функции и совместимости тромбоцитов [30][31]. Гетерогенность концентратов тромбоцитов, с учетом степени активации по микрочастицам, позволяет корректировать процесс заготовки, а также дифференцировать ТК для профилактических и лечебных трансфузий.
Если тромбоциты более жизнеспособны, то есть способны пережить определенные условия хранения, транспортировку, облучение и другие воздействия, то они по определению менее функциональны. Данный факт известен еще с 1970-х годов, когда исследователи пытались определить оптимальную температуру хранения концентратов тромбоцитов. Оказалось, что тромбоциты, хранившиеся при комнатной температуре, были более жизнеспособны, но охлажденные тромбоциты демонстрировали лучшую функциональную активность, оцениваемую по критерию изменений гемостатических показателей у добровольцев, получавших аспирин, или у пациентов с тромбоцитопенией [32]. Поддержание жизнеспособности тромбоцитов является важной ролью антикоагулянтов. Концентраты, богатые жизнеспособными тромбоцитами, однородны по своему составу, содержат преимущественно дисковидные тромбоциты и небольшое количество (или отсутствие) микрочастиц или микроагрегатов [27]. Напротив, ожидается, что длительно хранящиеся, охлажденные или иным образом активированные тромбоциты будут гетерогенными, содержащими тромбоциты с высокой полидисперсностью из-за полиморфизма, высокой поверхностной экспрессии маркеров активации, большого количества микрочастиц и присутствия микроагрегатов [33].
Гетерогенность концентратов тромбоцитов увеличивается при хранении [34], а также при патогенредукции [23] и сильно варьирует у здоровых доноров [35]. Наибольший вклад в гетерогенность тромбоцитов вносит содержание микрочастиц.
В настоящее время актуальными являются два важных вопроса: во-первых, оказывают ли микрочастицы в компонентах крови потенциально патогенный эффект и, во-вторых, как процесс заготовки, дополнительная обработка и хранение компонентов крови влияют на высвобождение микрочастиц. В последнее время нарастает значение микрочастиц как индикаторов качества ТК из-за их потенциальной физиологической и патофизиологической роли. Признается важность микрочастиц в трансфузионной медицине, поскольку микрочастицы присутствуют как в плазме, так и в клеточных продуктах крови [7]. Патофизиологическое воздействие МТ, связанное с регуляцией иммунных реакций, вызывает очевидные опасения по поводу потенциального пагубного воздействия, связанного с переливанием крови у иммунокомпрометированных пациентов [36][37]. Имеются убедительные данные о том, что как микрочастицы, полученные из клеток крови, так и микрочастицы тромбоцитов образуются при производстве и хранении всех компонентов крови, плазмы для переливания, а также концентратов эритроцитов и тромбоцитов, приготовленных из цельной крови методом афереза [38][39]. Высвобождение МТ вызывается такими раздражителями, как напряжение сдвига, возникающего в результате активации или апоптоза клеток во время хранения и их контакта со стенками контейнера для хранения [38]. При хранении тромбоцитных концентратов при +20–24 °С или эритроцитных единиц при +1–6 °С образуются побочные продукты экспрессии клеток [40].
Микрочастицы тромбоцитов, по всей видимости, присутствуют в более высоких количествах в ТК, заготовленном методом афереза, чем в концентрате тромбоцитов, полученном из лейкотромбослоя. Показано, что особенности протокола процедуры афереза или тип используемого клеточного сепаратора могут влиять на степень высвобождения МТ во время обработки [41]. Микрочастицы тромбоцитов, по-видимому, не удаляются путем лейкоредукции [42], однако было обнаружено, что лейкофильтрация цельной крови снижает риск последующего образования МТ [43]. Свежезамороженная плазма, приготовленная после ночной экспозиции цельной крови при температуре +4 °C, содержала больше МТ, чем та, которая была получена по истечении 8 ч после забора крови [44]. В то же время, по данным L.N. George et al., криопреципитат, содержащий высококонцентрированные МТ, имел потенциально более выраженный гемостатический эффект по сравнению с исходной плазмой [45].
Более четкое понимание механизма высвобождения МТ во время обработки и хранения компонентов крови с помощью тщательной подготовки образцов и комбинации аналитических методов [46] очень важно для безопасности трансфузионной терапии. Предполагаемые осложнения при трансфузии включают повышенный риск развития инфекционных осложнений, почечной, дыхательной и полиорганной недостаточности [37]. Некоторыми авторами (A.A. Khorana, C.W. Francis et al.) установлено наличие взаимосвязи повышения частоты венозных тромбозов и эмболий после введения концентратов тромбоцитов с присутствием МТ [47], которые, как известно, проявляют более высокую прокоагулянтную активность (50–100 раз) по сравнению с эквивалентными активированными тромбоцитами [48]. Хотя считается, что период полувыведения МТ очень короткий из-за фагоцитоза макрофагами, недавние эксперименты показывают, что он может составлять примерно 5,8 ч при введении концентратов тромбоцитов пациентам с тяжелой тромбоцитопенией [49]. Фосфатидилсерин-экспрессирующие МТ могут активировать клетки врожденного иммунитета, приводя к воспалительной реакции, опосредующей острое повреждение легких, связанное с переливанием крови (TRALI) [50]. Микрочастицы тромбоцитов также могут способствовать иммуносупрессивным эффектам, возникающим при трансфузии, что косвенно объясняет возникновение посттрансфузионных инфекций или рецидивов рака [40]. Еще одним возможным побочным эффектом МЧ является потенциальный высокий риск аллоиммунизации против антигенов клеток крови, поскольку они могут обладать высоким иммунологическим потенциалом [51].
Рефрактерность тромбоцитов — ситуация, при которой у пациента не наблюдается ожидаемого клинически значимого ответа на переливание ТК [52], что является осложнением, наблюдаемым у 27% реципиентов тромбоцитов [53]. Рефрактерность к трансфузиям тромбоцитов определяется как две последовательные трансфузии тромбоцитов, приводящие к недостаточному увеличению скорректированного прироста тромбоцитов (СПТ). Порог, ниже которого СПТ считается недостаточным, зависит от момента измерения: СПТ менее 5000–7500 тромбоцитов/мкл, измеренный в образце крови реципиента, взятом через 1 ч после переливания, характеризует низкое восстановление; СПТ менее 5000 тромбоцитов/мкл в образце, взятом через 24 ч после переливания, характеризует низкую выживаемость. У пациентов с иммунной рефрактерностью наблюдается низкий посттрансфузионный СПТ как через 1 ч, так и через 24 ч после переливания, который может быть устранен (или нет) с помощью подбора соответствующих HLA/HPA-концентратов тромбоцитов [54]. Однако увеличение количества тромбоцитов через 1 ч с последующим значительным снижением количества тромбоцитов через 24 ч после трансфузии выявляют даже при отсутствии документально подтвержденной аллоиммунизации. Было высказано предположение, что неадекватное качество тромбоцитов является одной из причин, по которой у онкологических пациентов после переливания крови может наблюдаться особенно низкая выживаемость тромбоцитов через 24 ч [12]. Помимо усложнения самого лечебного процесса, при лечении пациентов с резистентностью к тромбоцитам по сравнению с пациентами без рефрактерности более чем вдвое увеличивается себестоимость койко-дней, при этом пребывание в стационаре происходит на 21 день дольше [55].
Микрочастицы являются маркерами протромботического воспаления. У пациентов, которые становятся невосприимчивыми к переливанию тромбоцитов, часто наблюдается сопутствующая лихорадка или системное воспаление, которые могут быть обнаружены в виде повышенного содержания микрочастиц [56]. Следовательно, гомогенные тромбоциты могут быть лучшим выбором для онкологических пациентов с риском развития рефрактерности, в то время как гетерогенные тромбоциты могут приводить к развитию осложнений. Отсюда следует, что переливание тромбоцитов от доноров с высоким содержанием микрочастиц может быть наиболее оптимальной опцией. По всей вероятности, переливание гетерогенных тромбоцитов пациентам, чья иммунная система гиперактивирована, может подтолкнуть их к переломному моменту, когда они станут невосприимчивыми к трансфузии тромбоцитов. В независимых друг от друга исследованиях I. Cortés-Puch et al. и W.A. Flegel et al. установлено, что отказ от переливания гетерогенных тромбоцитов в профилактических целях может предотвратить рефрактерность. Похожая концепция анализировалась в экспериментальном исследовании на животных, у которых сочетание бактериальной инфекции и трансфузии «более старых» эритроцитов, содержащих высокие концентрации микрочастиц, приводило к увеличению риска смертности [57][58].
Гетерогенные концентраты тромбоцитов содержат предварительно активированные тромбоциты, которые способны быстро реагировать при попадании в кровоток. Таким образом, гетерогенные тромбоциты обладают более выраженной функциональной активностью и, как было показано, останавливают кровотечение быстрее, чем гомогенные жизнеспособные тромбоциты [33].
Внедрение измерений микрочастиц для контроля качества и безопасности концентратов тромбоцитов могло бы устранить влияние на ТК инактивации патогенов, внесенных добавочных растворов и условий 7-дневного хранения. Управление запасами, основанное на этом показателе, может привести к оптимизации лечебного процесса и существенно снизить затраты.
Оценка содержания тромбоцитарных микрочастиц
Для обнаружения и анализа микрочастиц тромбоцитарного происхождения используется ряд экспериментальных методов: проточная цитометрия, анализ траекторий наночастиц, электронная микроскопия, атомно-силовая микроскопия, динамическое рассеяние света [59–61].
Наиболее информативным из названных методов является проточная цитометрия. Этот метод реализует измерение интенсивности упругого рассеяния света от единичной клетки или частицы, последовательно проходящих через зону фокусировки лазерного луча, с последующей обработкой этих данных с помощью специальных математических алгоритмов. При этом характеристики фронтального и бокового светорассеяния позволяют получить представление о размерах и структуре клетки, кроме того, учитывается уровень флуоресценции химических соединений, входящих в состав клетки. Метод требует использования достаточно сложной и дорогостоящей аппаратуры и больших затрат времени на подготовку и проведение анализов, поэтому он малопригоден для оперативного скрининга концентратов тромбоцитов.
В качестве экспресс-метода, позволяющего оперативно контролировать содержание микрочастиц в концентратах тромбоцитов, было предложено использовать динамическое рассеяние света (ДРС). Достаточно эффективный метод измерения размеров и распределения по размерам частиц в жидкости. В анализаторах ДРС непосредственно измеряется зависимость от времени интенсивности лазерного излучения, рассеянного взвешенными в жидкости частицами. По этой зависимости восстанавливается распределение частиц в координатах «диаметр частиц — относительная интенсивность излучения», рассеянного частицами данного диаметра (распределение по интенсивности). На таких распределениях выделяют две области: в интервале от 0,05 до 0,5 мкм, соответствующую микрочастицам, и в области от 1 до нескольких мкм, соответствующую тромбоцитам. На этом принципе основана оценка концентратов тромбоцитов с помощью специализированного ДРС анализатора ThromboLUX, выпускавшегося канадской фирмой LightIntegra Technology [59].
При использовании методики ThromboLUX c тестируемым концентратом тромбоцитов проводят три измерения: при температуре 37 °С, при охлаждении до 20 °С, при повторном нагревании до 37 °С. В исследовании Е. Maurer-Spurej et al. продемонстрирован результат измерений распределений частиц методом ДРС [27]. Установлено, что при охлаждении с 37 до 20 °С доля тромбоцитов уменьшается с 72 до 65%, а микрочастиц — возрастает с 26 до 31%. При повторном нагревании до 37 °С восстанавливается прежнее соотношение микрочастиц и тромбоцитов.
Показана хорошая корреляция оценок состояния тромбоцитов и микрочастиц, полученных по методике ThromboLux, c данными проточной цитометрии и электронной микроскопии [59]. Содержание микрочастиц может быть достаточно универсальным индикатором, позволяющим оценить качество тромбоцитов в концентрате. В экспериментальном исследовании [18] на основании анализа большого количества данных была показана схема выбора оптимального концентрата тромбоцитов для разных категорий больных. Методика ThromboLux применялась в США и Канаде, в частности, для сравнительного анализа качества КТ, полученных от разных доноров или различными способами из крови одного донора [60].
Микрочастицы в концентратах тромбоцитов совсем недавно исследовались с помощью универсального ДРС анализатора — прибора Malvern Zetasizer [61]. В этом приборе обеспечивается сбор рассеянного излучения под углом 173° (технология обратного рассеяния), что дает возможность проводить измерения для малопрозрачных образцов. Наиболее информативными оказываются распределения частиц, измеренные для неразбавленных концентратов тромбоцитов. На рисунке 1 приведены распределения по интенсивности рассеянного излучения микрочастиц и тромбоцитов, измеренные при указанных выше условиях. Для каждого из исследованных образцов проведено по 3 измерения. Первое измерение произведено при температуре 37 °С — это характеристика исходного состояния концентрата, второе характеризует устойчивость тромбоцитов к температурному стрессу, т.е. активации при понижении температуры до 20 °С. Третье измерение выполнено после повышения температуры с 20 до 37 °С, его результаты позволили оценить способность тромбоцитов восстанавливаться после стресса.
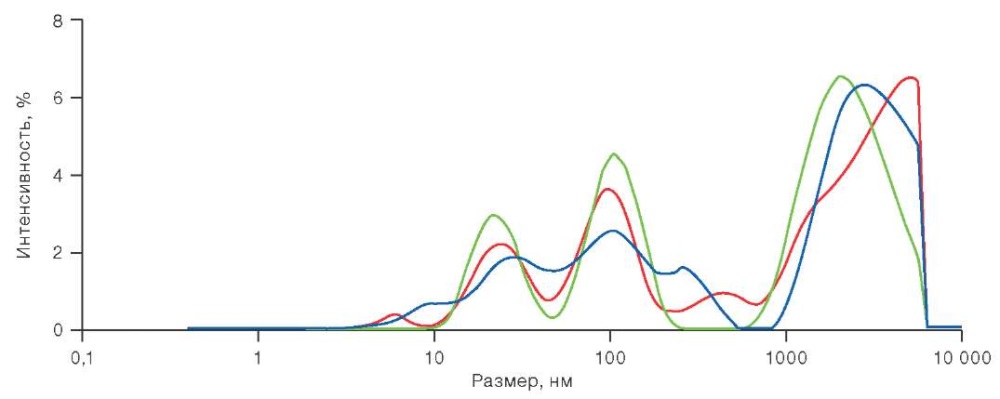
Рисунок подготовлен и адаптирован авторами по данным источника [59]
Рис. 1. Распределение по интенсивности рассеянного излучения микрочастиц и тромбоцитов в концентрате тромбоцитов
Примечание: красный цвет — при температуре 37 °С (исходное состояние); зеленый цвет — при температуре 20 °С; синий цвет — после повышения температуры от 20 до 37 °С.
Из данных, представленных на рисунке 1, видна большая доля микрочастиц в КТ при температуре 20 °С (зеленый цвет линии) и ее снижение при нагреве до 37 °С (синий цвет линии). В работе А. Labrie et al. произведен анализ тромбоцитных концентратов, полученных разными способами: путем афереза, из обогащенной тромбоцитами плазмы и из лейкоцитарно-фосфористой пленки. В измеренных распределениях микрочастиц по размерам отчетливо видны пики, соответствующие экзосомам (более мелким частицам, диаметр которых не превышает 100 мкм) и микрочастицам тромбоцитарного происхождения [59]. Однако в зависимости от способа получения ТК положения этих пиков по шкале диаметров частиц заметно различаются [60].
В последние годы интенсивно разрабатываются технологии заготовки, переработки, хранения и применения ТК, для которых необходимы новые способы оценки качества и безопасности компонентов крови, отвечающие современным стандартам [59–63]. Способ определения микрочастиц в ТК как одна из возможностей сохранения их качественных характеристик и безопасности при последующих трансфузиях показан на рисунке 2.
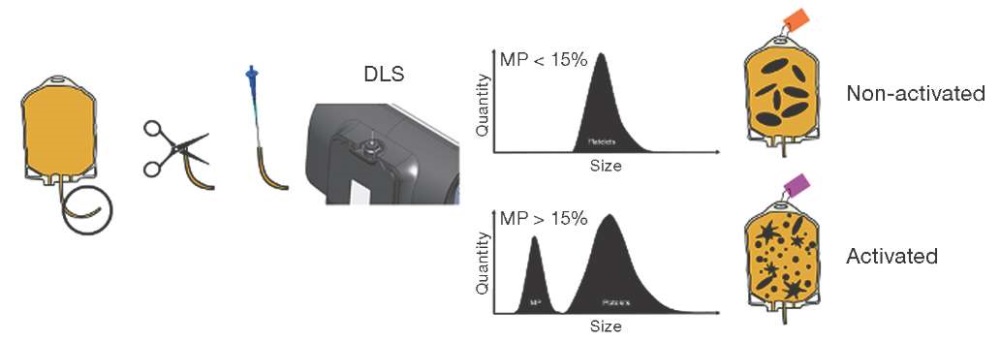
Рисунок подготовлен авторами по данным источника [60]
Рис. 2. Метод выявления содержания микрочастиц, позволяющий различать концентраты активированных и неактивированных тромбоцитов
На рисунке 2 показаны действия, которые необходимо выполнить для рутинного управления запасами тромбоцитов в банке крови: получение образца из концентрата тромбоцитов, загрузка образца в капилляр для измерения ДРС, выполнение теста ДРС для идентификации микрочастиц и использование сообщенного содержания микрочастиц для идентификации активированных тромбоцитов. Среднестатистическому пользователю требуется 3 мин 23 с, чтобы подготовить систему ДРС к тесту, получить и протестировать образец в соответствии с протоколом и пометить пакет с тромбоцитами. Основное внимание в этом протоколе уделяется определению состава частиц, присутствующих в переливаниях тромбоцитов, и использованию микрочастиц в качестве биомаркеров активации тромбоцитов. Переливания тромбоцитов помечаются как неактивированные или активированные на основе порогового значения процента микрочастиц 15%. К концу срока хранения в КТ отмечается увеличение количества циркулирующих МЧ тромбоцитарного происхождения, что свидетельствует об избыточной активации и/или апоптозе тромбоцитов и потере их функциональной активности и приводит в конечном итоге к снижению ожидаемого терапевтического эффекта от применения ТК. Определение количества тромбоцитарных МЧ методом ДРС может быть перспективным методом оценки качества КТ.
Перспективной является разработка отечественной методики с использованием динамического светорассеяния для анализа содержания микрочастиц в концентратах тромбоцитов как одного из критериев контроля качества компонентов крови. Современный анализ будет проводить рутинный скрининг микрочастиц обогащенной тромбоцитами плазмы или концентратов тромбоцитов с валидацией результатов и формированием заключения о возможности использования ТК для последующей трансфузии.
ЗАКЛЮЧЕНИЕ
С развитием современных технологий все большее значение приобретает поиск новых методов определения качества и безопасности компонентов крови, в том числе концентратов тромбоцитов. Для проведения рутинного скрининга ТК возможно проведение быстрого и неинвазивного теста, который оценивает характеристики тромбоцитов, имеющие значение для реципиента. В качестве исследуемого параметра может быть определение содержания микрочастиц. Измеряя состав концентрата тромбоцитов, можно определить характеристики компонента при хранении, устойчивость к дополнительным нагрузкам и обосновать его оптимальное использование.
Представленный метод оценки качества и безопасности тромбоконцентратов основан на динамическом рассеянии света, имеющем ряд преимуществ над предшествующими тестами. Внедрение метода в клиническую практику позволит оценить эффективность использования ТК до проведения трансфузии, что имеет важное значение, так как многократные трансфузии ТК у пациентов могут вызвать нежелательные явления. Пациентам, имеющим кровопотерю в результате травмы или хирургического вмешательства, целесообразно переливать более активные тромбоциты, содержащие высокий уровень микрочастиц. При трансфузиях ТК больным с онкологическими заболеваниями активированные тромбоциты нежелательны, вследствие чего необходимо применение тромбоконцентрата с минимальным содержанием микрочастиц. Однако использование данного метода в клинической практике требует дальнейшего изучения.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Г.В. Гришина — написание текста рукописи, анализ данных, оформление статьи, утверждение окончательного варианта рукописи для публикации; А.Д. Касьянов — планирование и разработка дизайна исследований, оформление статьи; И.С. Голованова, Д.В. Ласточкина — анализ тестов; О.Ю. Матвиенко — анализ данных; И.И. Кробинец — разработка дизайна исследований, утверждение окончательного варианта рукописи для публикации.
Список литературы
1. Tetta C, Bruno S, Fonsato V, Deregibus MC, Camussi G. The role of microvesicles in tissue repair. Organogenesis. 2011;7(2):105–15. https://doi.org/10.4161/org.7.2.15782
2. Nomura S, Ozaki Y, Ikeda Y. Function and role of microparticles in various clinical settings. Thromb Res. 2008;123(1):8–23. https://doi.org/10.1016/j.thromres.2008.06.006
3. Diamant M, Tushuizen ME, Sturk A, Nieuwland R. Cellular microparticles: new players in the field of vascular disease? Eur J Clin Invest. 2004;34(6):392–401. https://doi.org/10.1111/j.1365-2362.2004.01355.x
4. Burnouf T, Goubran HA, Chou ML, Devos D, Radosevic M. Platelet microparticles: detection and assessment of their paradoxical functional roles in disease and regenerative medicine. Blood Rev. 2014;28(4):155–66. https://doi.org/10.1016/j.blre.2014.04.002
5. Flaumenhaft R. Formation and fate of platelet microparticles. Blood Cells Mol Dis. 2006;36(2):182–7. https://doi.org/10.1016/j.bcmd.2005.12.019
6. Lynch SF, Ludlam CA. Plasma microparticles and vascular disorders. Br J Haematol. 2007;137(1):36–48. https://doi.org/10.1111/j.1365-2141.2007.06514.x
7. Simak J, Gelderman MP. Cell membrane microparticles in blood and blood products: potentially pathogenic agents and diagnostic markers. Transfus Med Rev. 2006;20(1):1–26. https://doi.org/10.1016/j.tmrv.2005.08.001
8. Siljander PR. Platelet-derived microparticles — an updated perspective. Thromb Res. 2011;127 Suppl 2:S30-3. https://doi.org/10.1016/S0049-3848(10)70152-3
9. Piccin A, Murphy WG, Smith OP. Circulating microparticles: pathophysiology and clinical implications. Blood Rev. 2007;21(3):157–71. https://doi.org/10.1016/j.blre.2006.09.001
10. Ayers L, Nieuwland R, Kohler M, Kraenkel N, Ferry B, Leeson P. Dynamic microvesicle release and clearance within the cardiovascular system: triggers and mechanisms. Clin Sci (Lond). 2015;129(11):915–31. https://doi.org/10.1042/CS20140623
11. Tan KT, Lip GY. The potential role of platelet microparticles in atherosclerosis. Thromb Haemost. 2005;94(3):488–92. https://doi.org/10.1160/TH05-03-0201
12. Marcoux G, Duchez AC, Rousseau M, Lévesque T, Boudreau LH, Thibault L et al. Microparticle and mitochondrial release during extended storage of different types of platelet concentrates. Platelets. 2017;28(3):272–80. https://doi.org/10.1080/09537104.2016.1218455
13. Baj-Krzyworzeka M, Majka M, Pratico D, Ratajczak J, Vilaire G, Kijowski J et al. Platelet-derived microparticles stimulate proliferation, survival, adhesion, and chemotaxis of hematopoietic cells. Exp Hematol. 2002;30(5):450–9. https://doi.org/10.1016/s0301-472x(02)00791-9
14. Delabranche X, Berger A, Boisramé-Helms J, Meziani F. Microparticles and infectious diseases. Med Mal Infect. 2012;42(8):335–43. https://doi.org/10.1016/j.medmal.2012.05.011
15. Laffont B, Corduan A, Plé H, Duchez AC, Cloutier N, Boilard E et al. Activated platelets can deliver mRNA regulatory Ago2•microRNA complexes to endothelial cells via microparticles. Blood. 2013;122(2):253–61. https://doi.org/10.1182/blood-2013-03-492801
16. Saas P, Angelot F, Bardiaux L, Seilles E, Garnache-Ottou F, Perruche S. Phosphatidylserine-expressing cell by-products in transfusion: A pro-inflammatory or an anti-inflammatory effect? Transfus Clin Biol. 2012;19(3):90–7. https://doi.org/10.1016/j.tracli.2012.02.002
17. Momen-Heravi F, Balaj L, Alian S, Tigges J, Toxavidis V, Ericsson M et al. Alternative methods for characterization of extracellular vesicles. Front Physiol. 2012;3:354. https://doi.org/10.3389/fphys.2012.00354
18. Maurer-Spurej E, Chipperfield K. Could Microparticles Be the Universal Quality Indicator for Platelet Viability and Function? J Blood Transfus. 2016;2016:6140239. https://doi.org/10.1155/2016/6140239
19. Mittal K, Kaur R. Platelet storage lesion: An update. Asian J Transfus Sci. 2015;9(1):1–3. https://doi.org/10.4103/0973-6247.150933
20. Holme S. Storage and quality assessment of platelets. Vox Sang. 1998;74(2):207–16. https://doi.org/10.1111/j.1423-0410.1998.tb05422.x
21. Pienimaeki-Roemer A, Kuhlmann K, Böttcher A, Konovalova T, Black A, Orsó E et al. Lipidomic and proteomic characterization of platelet extracellular vesicle subfractions from senescent platelets. Transfusion. 2015;55(3):507–21. https://doi.org/10.1111/trf.12874
22. Farrugia A, Vamvakas E. Toward a patient-based paradigm for blood transfusion. J Blood Med. 2014;5:5–13. https://doi.org/10.2147/JBM.S55769
23. Johnson L, Schubert P, Tan S, Devine DV, Marks DC. Extended storage and glucose exhaustion are associated with apoptotic changes in platelets stored in additive solution. Transfusion. 2016;56(2):360–8. https://doi.org/10.1111/trf.13345
24. Murphy S. Utility of in vitro tests in predicting the in vivo viability of stored PLTs. Transfusion. 2004;44(4):618–9. https://doi.org/10.1111/j.1537-2995.2004.00355.x
25. Apelseth TO, Bruserud O, Wentzel-Larsen T, Hervig T. Therapeutic efficacy of platelet transfusion in patients with acute leukemia: an evaluation of methods. Transfusion. 2010;50(4):766–75. https://doi.org/10.1111/j.1537-2995.2009.02540.x
26. Maurer-Spurej E, Labrie A, Pittendreigh C, Chipperfield K, Smith C, Heddle N et al. Platelet quality measured with dynamic light scattering correlates with transfusion outcome in hematologic malignancies. Transfusion. 2009;49(11):2276–84. https://doi.org/10.1111/j.1537-2995.2009.02302.x
27. Maurer-Spurej E, Larsen R, Labrie A, Heaton A, Chipperfield K. Microparticle content of platelet concentrates is predicted by donor microparticles and is altered by production methods and stress. Transfus Apher Sci. 2016;55(1):35–43. https://doi.org/10.1016/j.transci.2016.07.010
28. Schiffer CA, Anderson KC, Bennett CL, Bernstein S, Elting LS, Goldsmith M et al. American Society of Clinical Oncology. Platelet transfusion for patients with cancer: clinical practice guidelines of the American Society of Clinical Oncology. J Clin Oncol. 2001;19(5):1519–38. https://doi.org/10.1200/JCO.2001.19.5.1519
29. Getz TM, Montgomery RK, Bynum JA, Aden JK, Pidcoke HF, Cap AP. Storage of platelets at 4°C in platelet additive solutions prevents aggregate formation and preserves platelet functional responses. Transfusion. 2016;56(6):1320–8. https://doi.org/10.1111/trf.13511
30. Johnson L, Reade MC, Hyland RA, Tan S, Marks DC. In vitro comparison of cryopreserved and liquid platelets: potential clinical implications. Transfusion. 2015;55(4):83–47. https://doi.org/10.1111/trf.12915
31. Johnson L, Tan S, Wood B, Davis A, Marks DC. Refrigeration and cryopreservation of platelets differentially affect platelet metabolism and function: a comparison with conventional platelet storage conditions. Transfusion. 2016;56(7):1807–18. https://doi.org/10.1111/trf.13630
32. Valeri CR. Circulation and hemostatic effectiveness of platelets stored at 4 C or 22 C: studies in aspirin-treated normal volunteers. Transfusion. 1976;16(1):20–3. https://doi.org/10.1046/j.1537-2995.1976.16176130832.x
33. Reddoch KM, Pidcoke HF, Montgomery RK, Fedyk CG, Aden JK, Ramasubramanian AK et al. Hemostatic function of apheresis platelets stored at 4°C and 22°C. Shock. 2014;41 Suppl 1(01):54–61. https://doi.org/10.1097/SHK.0000000000000082
34. Johnson L, Schubert P, Tan S, Devine DV, Marks DC. Extended storage and glucose exhaustion are associated with apoptotic changes in platelets stored in additive solution. Transfusion. 2016;56(2):360–8. https://doi.org/10.1111/trf.13345
35. Phang M, Lincz L, Seldon M, Garg ML. Acute supplementation with eicosapentaenoic acid reduces platelet microparticle activity in healthy subjects. J Nutr Biochem. 2012;23(9):1128–33. https://doi.org/10.1016/j.jnutbio.2011.06.006
36. Kim HK, Song KS, Park YS, Kang YH, Lee YJ, Lee KR, Kim HK, Ryu KW, Bae JM, Kim S. Elevated levels of circulating platelet microparticles, VEGF, IL-6 and RANTES in patients with gastric cancer: possible role of a metastasis predictor. Eur J Cancer. 2003;39(2):184–91. https://doi.org/10.1016/s0959-8049(02)00596-8
37. Kriebardis A, Antonelou M, Stamoulis K, Papassideri I. Cellderived microparticles in stored blood products: innocent-bystanders or effective mediators of post-transfusion reactions? Blood Transfus. 2012;10 Suppl 2:s25–38. https://doi.org/10.2450/2012.006S
38. Bode AP, Orton SM, Frye MJ, Udis BJ. Vesiculation of platelets during in vitro aging. Blood. 1991;77(4):887–95.
39. Krailadsiri P, Seghatchian J. Are all leucodepleted platelet concentrates equivalent? Comparison of Cobe LRS Turbo, Haemonetics MCS+ LD, and filtered pooled buffy-coat-derived platelets. Vox Sang. 2000;78(3):171–5. https://doi.org/10.1159/000031176
40. Vamvakas EC, Blajchman MA. Transfusion-related immunomodulation (TRIM): an update. Blood Rev. 2007;21(6):327–48. https://doi.org/10.1016/j.blre.2007.07.003
41. Rank A, Nieuwland R, Liebhardt S, Iberer M, Grützner S, Toth B, et al. Apheresis platelet concentrates contain plateletderived and endothelial cell-derived microparticles. Vox Sang. 2011;100(2):179–86. https://doi.org/10.1111/j.1423-0410.2010.01385.x
42. Devine DV, Bradley AJ, Maurer E, Levin E, Chahal S, Serrano K, et al. Effects of prestorage white cell reduction on platelet aggregate formation and the activation state of platelets and plasma enzyme systems. Transfusion. 1999;39(7):724–34. https://doi.org/10.1046/j.1537-2995.1999.39070724.x
43. Sugawara A, Nollet KE, Yajima K, Saito S, Ohto H. Preventing platelet-derived microparticle formation--and possible side effects-with prestorage leukofiltration of whole blood. Arch Pathol Lab Med. 2010;134(5):771–5. https://doi.org/10.5858/134.5.771
44. Lawrie AS, Cardigan RA, Williamson LM, Machin SJ, Mackie IJ. The dynamics of clot formation in fresh-frozen plasma. Vox Sang. 2008;94(4):306–44. https://doi.org/10.1111/j.1423-0410.2008.01037.x
45. George JN, Pickett EB, Heinz R. Platelet membrane microparticles in blood bank fresh frozen plasma and cryoprecipitate. Blood. 1986;68(1):307–9.
46. Strasser EF, Happ S, Weiss DR, Pfeiffer A, Zimmermann R, Eckstein R. Microparticle detection in platelet products by three different methods. Transfusion. 2013;53(1):156–66. https://doi.org/10.1111/j.1537-2995.2012.03720.x
47. Khorana AA, Francis CW, Blumberg N, Culakova E, Refaai MA, Lyman GH. Blood transfusions, thrombosis, and mortality in hospitalized patients with cancer. Arch Intern Med. 2008;168(21):2377–81. https://doi.org/10.1001/archinte.168.21.2377
48. Sinauridze EI, Kireev DA, Popenko NY, Pichugin AV, Panteleev MA, Krymskaya OV, et al. Platelet microparticle membranes have 50- to 100-fold higher specific procoagulant activity than activated platelets. Thromb Haemost. 2007;97(3):425–34.
49. Rank A, Nieuwland R, Crispin A, Grützner S, Iberer M, Toth B et al. Clearance of platelet microparticles in vivo. Platelets. 2011;22(2):111–6. https://doi.org/10.3109/09537104.2010.520373
50. Saas P, Angelot F, Bardiaux L, Seilles E, Garnache-Ottou F, Perruche S. Phosphatidylserine-expressing cell by-products in transfusion: A pro-inflammatory or an anti-inflammatory effect? Transfus Clin Biol. 2012;19(3):90–7. https://doi.org/10.1016/j.tracli.2012.02.002
51. Kitazawa J, Nollet K, Morioka H, Tanaka K, Inomata M, Kubuki Y et al. Non-D Rh antibodies appearing after apheresis platelet transfusion: stimulation by red cells or microparticles? Vox Sang. 2011;100(4):395–400. https://doi.org/10.1111/j.1423-0410.2010.01435.x
52. Rebulla P. A mini-review on platelet refractoriness. Haematologica. 2005;90(2):24753.
53. Slichter SJ, Davis K, Enright H, Braine H, Gernsheimer T, Kao KJ et al. Factors affecting posttransfusion platelet increments, platelet refractoriness, and platelet transfusion intervals in thrombocytopenic patients. Blood. 2005;105(10):4106–14. https://doi.org/10.1182/blood-2003-08-2724
54. Hess JR, Trachtenberg FL, Assmann SF, Triulzi DJ, Kaufman RM, Strauss RG, et al. Clinical and laboratory correlates of platelet alloimmunization and refractoriness in the PLADO trial. Vox Sang. 2016;111(3):281–91. https://doi.org/10.1111/vox.12411
55. Meehan KR, Matias CO, Rathore SS, Sandler SG, Kallich J, LaBrecque J, et al. Platelet transfusions: utilization and associated costs in a tertiary care hospital. Am J Hematol. 2000;64(4):251–6. https://doi.org/10.1002/1096-8652(200008)64:43.0.co;2-n.C.O
56. Boilard E, Nigrovic PA, Larabee K, Watts GF, Coblyn JS, Weinblatt ME et al. Platelets amplify inflammation in arthritis via collagen-dependent microparticle production. Science. 2010;327(5965):580–3. https://doi.org/10.1126/science.1181928
57. Cortés-Puch I, Remy KE, Solomon SB, Sun J, Wang D, Al-Hamad M, et al. In a canine pneumonia model of exchange transfusion, altering the age but not the volume of older red blood cells markedly alters outcome. Transfusion. 2015;55(11):2564–75. https://doi.org/.1111/trf.13275
58. Flegel WA, Natanson C, Klein HG. Does prolonged storage of red blood cells cause harm? Br J Haematol. 2014;165(1):3–16. https://doi.org/10.1111/bjh.12747
59. Labrie A, Marshall A, Bedi H, Maurer-Spurej E. Characterization of platelet concentrates using dynamic light scattering. Transfus Med Hemother. 2013;40(2):93–100. https://doi.org/10.1159/000350362
60. Millar D, Hayes C, Jones J, Klapper E, Kniep JN, Luu HS, et al. Comparison of the platelet activation status of single-donor platelets obtained with two different cell separator technologies. Transfusion. 2020;60(9):2067–78. https://doi.org/10.1111/trf.15934
61. Li M, Zhao Y, Chen X, Du X, Luo Y, Li Y, et al. Comparative analysis of the quality of platelet concentrates produced by apheresis procedures, platelet rich plasma, and buffy coat. Transfusion. 2024;64(2):367–79. https://doi.org/10.1111/trf.17704
62. Кищенко ВВ, Сироткина ОВ, Сидоркевич СВ, Вавилова ТВ. Тромбоцитарные везикулы–потенциальный маркер качества концентрата тромбоцитов. Профилактическая и клиническая медицина. 2020;77(4):93–101.
63. Пономаренко ЕА, Игнатова АА, Федорова ДВ, Жарков ПА, Пантелеев МА. Функциональная активность тромбоцитов: физиология и методы лабораторной диагностики. Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2019;18(3):112–19.
Об авторах
Г. В. ГришинаРоссия
Гришина Галина Викторовна, канд. биол. наук, старший научный сотрудник НИЛ гемотрансфузионных технологий
Санкт-Петербург
А. Д. Касьянов
Россия
Касьянов Андрей Дмитриевич, канд. мед. наук, ведущий научный сотрудник НИЛ гемотрансфузионных технологий
Санкт-Петербург
Д. В. Ласточкина
Россия
Ласточкина Дарья Вячеславовна
Санкт-Петербург
И. И. Кробинец
Россия
Кробинец Ирина Ивановна, д-р биол. наук, руководитель НИЛ иммуногенетики и диагностики иммунологических конфликтов
Санкт-Петербург
И. С. Голованова
Россия
Голованова Ирина Станиславовна, научный сотрудник НИЛ гемотрансфузионных технологий
Санкт-Петербург
О. Ю. Матвиенко
Россия
Матвиенко Олеся Юрьевна, канд. мед. наук, ведущий научный сотрудник научно-исследовательский отдел патологии гемостаза
Санкт-Петербург
Рецензия
Для цитирования:
Гришина Г.В., Касьянов А.Д., Ласточкина Д.В., Кробинец И.И., Голованова И.С., Матвиенко О.Ю. Микрочастицы как критерии качества концентрата тромбоцитов. Медицина экстремальных ситуаций. 2024;26(4):132-140. https://doi.org/10.47183/mes.2024-26-4-132-140
For citation:
Grishina G.V., Kasyanov A.D., Lastochkina D.V., Krobinets I.I., Golovanova I.S., Matvienko O.Yu. Microparticles as quality criteria for platelet concentrate. Extreme Medicine. 2024;26(4):132-140. https://doi.org/10.47183/mes.2024-26-4-132-140

















