Медицина экстремальных ситуаций – научно-практический рецензируемый журнал Федерального медико-биологического агентства России (Москва).
Зарегистрирован Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 27 июля 2006 года (Свидетельство о регистрации ПИ № ФС 77-25124).
Издается с 1999 года, выходит 4 раза в год и бесплатно публикует результаты фундаментальных и прикладных научных исследований, связанных с оценкой влияния факторов окружающей среды на здоровье населения; изучением механизмов адаптации организма к воздействию экстремальных условий среды обитания; исследованием влияния трудовой деятельности и факторов производственной среды на организм работающих, в том числе специального контингента авиационной, космической и морской отрасли; совершенствованием системы оценки и управления рисками развития экологически обусловленных, социально значимых и профессиональных заболеваний; усовершенствованием медицинских технологий для обеспечения спорта высших достижений; разработкой новых методов получения, хранения, контроля качества компонентов донорской крови и вопросам совершенствования службы крови и другие.
Распространяется в Российской Федерации, в зарубежных странах.
Журнал представлен в международных и российских базах данных: РИНЦ (Российский индекс научного цитирования), Scopus, Google Scholar, CyberLeninka, включен в Перечень ведущих рецензируемых научных журналов и изданий Высшей аттестационной комиссии Минобрнауки России (ВАК РФ), в которых должны быть опубликованы основные научные результаты диссертаций на соискание учёной степени доктора и кандидата наук.
Подписной индекс:
- в каталоге Урал-Пресс – 015598 (Медицина экстремальных ситуаций), 015599 (Extreme Medicine);
- в каталоге Книга-сервис – 45101 (Медицина экстремальных ситуаций), 28044 (Extreme Medicine)
Текущий выпуск
Введение. В условиях ограниченных возможностей применения свежезамороженной плазмы в экстремальных условиях важны логистические преимущества, которые дает использование лиофилизированной плазмы. Эффективность ее применения зависит от сохранности коагуляционного потенциала в процессе производства.
Цель. Анализ перспективных направлений совершенствования технологий получения лиофилизированной плазмы с использованием международного и отечественного опыта производства, оценки контроля качества и применения гемокомпонента.
Обсуждение. Применяющиеся и доказавшие свою эффективность и безопасность коммерческие препараты FLyP, LyoPlas N-w и Bioplasma FDP, OctaplasLG Lyo, а также лиофилизированная плазма Республики Беларусь и КНР выпускаются в стеклянных флаконах. Перспективным направлением считается получение лиофилизированной плазмы в полимерных контейнерах с применением мембранной технологии, что обеспечивает преимущества использования гемокомпонента в экстремальных условиях. Известны разработки компаний Terumo BCT Biotechnologies и Teleflex Inc., полученные ими продукты лиофилизированной плазмы находятся на стадии клинических исследований и ограниченно применяются в военных операциях. В Российской Федерации зарегистрирован полимерный контейнер «Лиокон». В процессе лиофилизации наблюдается увеличение рН до щелочных значений порядка 8, что связано с удалением углекислого газа. При оценке коагуляционного потенциала наиболее значимо снижение активности фактора VIII до 50%, фактора V — до 37%, протеина S — до 34%, фактора Виллебранда — до 25%. Отмечена пролонгация протромбинового времени (ПВ) и активированного частичного тромбопластинового времени (АЧТВ). В Российской Федерации лиофилизированная плазма относится к гемокомпонентам, поэтому внедрение зарубежного опыта производства (внесение крио- и лиопротекторов, корректировка рН и др.) ограничено законодательно, что подчеркивает важность разработки отечественных технологий.
Выводы. Производство лиофилизированной плазмы в полимерных контейнерах является одним из путей бесперебойного трансфузионного обеспечения при оказании медицинской помощи, что будет способствовать повышению выживаемости раненых с острой кровопотерей в чрезвычайных ситуациях. В связи с этим актуально создание отечественных технологий лиофилизации плазмы и разработка подходов к повышению ее эффективности.
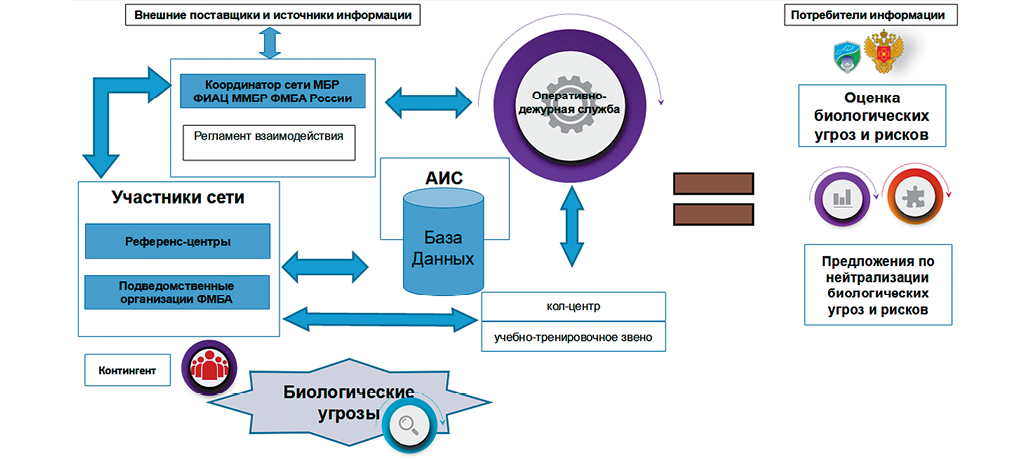
Введение. Мониторинг биологических рисков (МБР) обеспечивает своевременное реагирование на возникающие биологические угрозы и предотвращение их негативного воздействия на здоровье человека. Для совершенствования и развития сети МБР ФМБА России необходимо знание и понимание принципов его функционирования.
Цель. Научное обоснование принципов функционирования сети МБР на территориях и в организациях, обслуживаемых ФМБА России.
Материалы и методы. Информационной платформой для исследования послужила автоматизированная информационная система Федерального информационно-аналитического центра мониторинга биологических рисков ФМБА России (ФИАЦ ММБР ФМБА России), агрегирующая данные МБР на территориях и в организациях, обслуживаемых ФМБА России. Исследование построено на применении научных методов системного анализа, обратного инжиниринга, классической логики, анализа, синтеза, сравнения, обобщения, категоризации и классификации.
Результаты и их обсуждение. Проведено всестороннее исследование действующей сети МБР ФМБА России. Рассмотрены и детально проанализированы цель, основные задачи, функции и направления деятельности созданной сети МБР, ее свойства, характеристики и особенности. На основании применения метода обратного инжиниринга обоснованы 19 ключевых принципов работы сети МБР. Разработана и представлена классификация перечисленных принципов, основанием для которой послужил признак разделения на классы по видам деятельности, обеспечивающей функционирование сети МБР как сложной организационной системы. В результате выделено 3 класса принципов: информационно-технологической, организационно-управленческой и научно-практической направленности.
Заключение. По результатам проведенного исследования были определены, сформулированы, обоснованы и классифицированы принципы функционирования сети МБР на территориях и в организациях, обслуживаемых ФМБА России. Среди них: системный подход, принцип непрерывности мониторинга и представления его результатов, принцип комплексности информационно-аналитического обеспечения и некоторые другие. Научное обоснование ключевых принципов, базирующееся на результатах исследования процессов функционирования сети мониторинга, будет способствовать выработке предложений по оптимизации и совершенствованию технологии мониторинга биологических рисков ФМБА России.
Введение. Использование дикорастущих растений в производстве пищевых продуктов, добавок, ингредиентов и биологически активных веществ требует оценки сырья на содержание тяжелых металлов (ТМ). Это важно учесть и в связи с использованием дикоросов в пищу при выживании после аварий, катастроф или боевых действий на море.
Цель. Оценить потенциальную опасность употребления в пищу прибрежной флоры, способной аккумулировать ТМ, в местах возможной высадки экипажей судов, терпящих бедствие в акватории морей Российской Федерации.
Материалы и методы. Объектами исследования служили прибрежные водоросли и высшие растения, произрастающие на побережье Финского залива. Образцы растений собраны на участках побережий Финского залива: о-ва Большой Березовый, о-ва Гогланд, а также Кургальского п-ова. До проведения элементного анализа образцы всех растений досушивали при 80 °С до постоянного веса и оценивали их сухую массу с точностью до 1 мг. Оценку сырой массы осуществляли, опираясь на данные по сухой массе и условно принимая, что содержание воды в нативных листьях деревьев составляет 75%, в листьях трав — 85%, а в слоевищах F. vesiculosus — 70%. Минерализацию высушенного материала осуществляли в СВЧ-минерализаторе МС-6 («Вольта», Россия). Элементный анализ выполняли на атомно-абсорбционном спектрометре МГА-915М. Результаты измерений обрабатывали с помощью пакета прикладных программ Statistica for Windows 7.
Результаты. Содержание меди и свинца у изученных растений были в границах ПДУ. Допустимый уровень кадмия был превышен в 2–4 раза у A. ptarmica, C. angustifolium и U. dioica на п-ове Кургальский, что определяет риск использования их в пищу. Минимальные величины содержания марганца (менее 20 мг/кг сухой массы) характерны для двух видов растений (L. japonicus и Salix sp.) с о-ва Березовый и для A. podagraria с п-ова Кургальский. Токсическое действие марганца (Mn) начинается при превышении нормы суточного потребления 2 мг/сут, в то время как максимальное содержание Mn у изученных объектов составляло 11,9 мг/кг. Высокое содержание Zn характерно для всех растений о-ва Гогланд, а также T. repens и A. podagraria с п-ова Кургальский и Salix sp. и L. japonicas с о-ва Большой Березовый. Было рассчитано предельное количество растительного материала, которое можно безопасно употребить в пищу; оно составило приблизительно 0,17 кг/сут сырой массы листьев.
Выводы. Отсутствие в нормативных документах ВДУ суточного потребления эссенциальных элементов затрудняет оценку тяжести последствий использования растительного сырья для пищевых и лекарственных целей и применение риск-ориентированного подхода в оценке безопасности питания. Высокая степень опасности использования в пищу растений п-ова Кургальский (A. ptarmica, C. angustifolium и U. dioica) обусловлена существенным превышением ПДУ по Cd. Содержание Cu, Pb во всех изученных растениях ниже ПДУ, т.е. опасность по этим элементам отсутствует. Содержание Zn является безопасным, поскольку для обеспечения суточной потребности в нем необходимо употреблять более 1 кг сырой массы листьев ежедневно, что в реальных условиях практически невозможно.
Введение. Огнестрельные ранения живота встречаются в 4,7–16,2% от общего числа ранений. Такие ранения сопровождаются высокими показателями летальных исходов (их количество зависит от характера ранений: изолированные или сочетанные), а также достаточно большим количеством осложнений. Исходя из этого, немаловажной задачей для снижения количества осложнений и летальных исходов является правильная и своевременная организация помощи на догоспитальном этапе.
Цель. Определить объем и правильность оказанной медицинской помощи на догоспитальном этапе пострадавшим с огнестрельными ранениями живота из числа гражданского населения.
Материалы и методы. Проведена оценка качества оказания неотложной медицинской помощи на основании ретроспективного анализа первичной документации: сопроводительных листов станций скорой помощи, талонов к ним (ф. 114/у) и историй болезни 60 пациентов (47 (78,3%) мужчин и 13 (21,7%) женщин; средний возраст 35 ± 5 лет) из числа гражданского населения в районах военных действий специальной военной операции (СВО). Все пострадавшие были разделены на две группы: в первую вошли раненые, которым помощь была оказана врачебными бригадами скорой медицинской помощи (СМП), — 46 (76,7%) человек, во вторую — 14 (23,3%) пациентов с оказанием помощи фельдшерскими бригадами СМП. Оценивали время доезда до пациента бригад скорой медицинской помощи, объем оказанной медицинской помощи. Оценка тяжести состояния проведена с использованием военно-полевой хирургической шкалы скорой помощи.
Результаты. Установлено, что время доезда бригад СМП варьировало от 5 до 30 мин и в среднем составило для врачебных бригад 24 ± 4 мин, для фельдшерских — 21 ± 6 мин, что в целом можно охарактеризовать как нормативное. У 57 (85%) раненых были отмечены осколочные ранения, огнестрельные ранения регистрировали в 3 (5%) случаях. У пострадавших преобладали множественные ранения в 52 (86,7%) случаях, тогда как одиночные ранения были отмечены в 8 (13,3%) наблюдениях. Нетяжелое состояние регистрировали у 38 (63,3) раненых, тяжелое — у 9 (15%), крайне тяжелое — у 12 (15%), критическое — у 1 (1,7%) пострадавшего. В подавляющем большинстве (54 (90%) наблюдения) оказанная помощь была своевременной, правильной и в полном объеме. Одновременно с этим в 6 (10%) наблюдениях объем выполненной скорой медицинской помощи можно считать недостаточным: в 2 (3,3%) наблюдениях при оказании помощи врачебными бригадами и в 4 (6,7%) — при оказании помощи фельдшерскими бригадами. Ошибки были связаны с недооценкой тяжести состояния пострадавших, как следствие — отсутствием выполнения адекватного обезболивания и проведения инфузионной терапии, т.е. непроведением противошоковых мероприятий.
Заключение. При огнестрельных ранениях живота пострадавшим из числа гражданского населения на догоспитальном этапе медицинская помощь оказывается врачебными и фельдшерскими бригадами скорой медицинской помощи. Объем помощи заключается в обработке раны и наложении асептической повязки, адекватном обезболивании и проведении противошоковых мероприятий. Отмечен более низкий процент ошибок при оказании скорой медицинской помощи врачебными бригадами СМП по сравнению с помощью, оказанной фельдшерскими бригадами СМП. Необходимо централизованное внедрение мероприятий по улучшению как теоретических знаний оказания скорой медицинской помощи при огнестрельных ранениях живота на догоспитальном этапе, так и отработки практических навыков бригадами СМП. С этой целью для обучения персонала СМП необходимо привлекать врачей-хирургов и специалистов по медицине катастроф.
КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
Введение. Ингибиторы растительного и грибного происхождения (ИРГП) представляют собой перспективное направление в противоопухолевой терапии, предлагая разнообразные механизмы действия, в большинстве случаев отличающиеся от традиционных химиотерапевтических препаратов. Как правило, ИРГП одновременно влияют на несколько метаболических путей, что снижает вероятность развития резистентности, оказывая комбинированный эффект на разные мишени в раковой клетке.
Цель. Изучить перспективные направления в создании новых противоопухолевых препаратов для последующего лечения, обобщить современные данные о механизмах действия ИРГП в контексте комплексного подхода к лечению злокачественных опухолей.
Обсуждение. В настоящее время усиленно проводится поиск новых соединений с противоопухолевым потенциалом. ИРГП представляют собой перспективное направление в противоопухолевой терапии, предлагая разнообразные механизмы действия. Многие традиционные химиотерапевтические препараты также имеют растительное происхождение и обладают хорошей эффективностью, что подтверждает актуальность изучения данной тематики. Солидные опухоли обладают повышенной способностью к активной пролиферации и ангиогенезу, что объясняет неизменный интерес к активному поиску новых соединений растительного происхождения с антиангиогенными свойствами, наряду с исследованиями других ИРГП. Как правило, ИРГП одновременно влияют на несколько метаболических путей, что снижает вероятность развития резистентности, оказывая комбинированный эффект на разные мишени в раковой клетке.
Выводы. В обзоре рассмотрены молекулярные механизмы действия ИРГП, включающие в себя подавление ангиогенеза и пролиферации раковых клеток, индукцию апоптоза, модуляцию клеточного цикла, а также прямой цитотоксический эффект путем стимуляции активности CD8+ Т-лимфоцитов, NK-клеток и макрофагов.
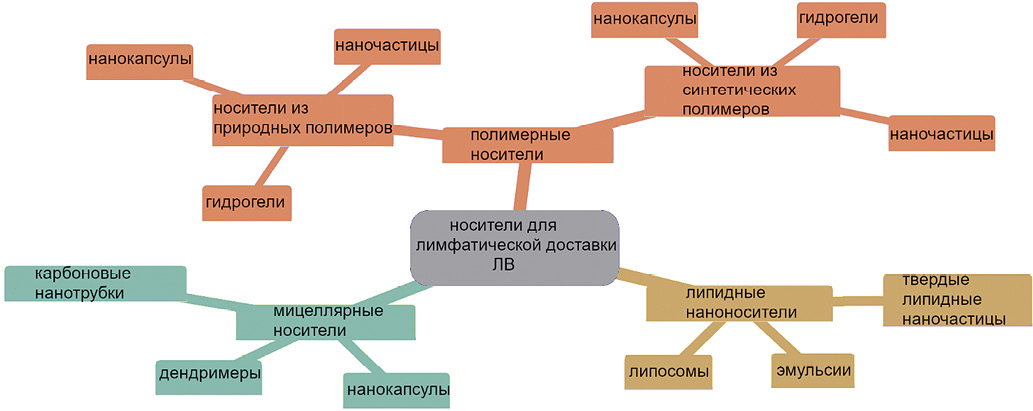
Введение. Лимфатический путь доставки может быть перспективен для липофильных химиотерапевтических и иммуномодулирующих средств, применяемых при лечении онкологических заболеваний. Носители на основе липидов (например, липосомы) могут не только повысить растворимость и стабильность лекарственных средств, но и защитить их от разложения в желудочно-кишечном тракте. Исследование возможности лимфатической доставки липосомами биологически активных веществ позволит в дальнейшем повысить эффективность многих липофильных препаратов.
Цель. Изучение перспектив применения липосом первого поколения (без холестерина) из соевого лецитина в качестве возможного лимфатического носителя для биологически активных веществ.
Материалы и методы. Получены липосомы из соевого лецитина, содержащие зеленый флуоресцентный белок GFP (с максимумом флуоресценции при длине волны 506 нм), методом гидратации/регидратации тонкой пленки. Для модификации некоторых липосом использовали раствор хитозана в концентрациях 1, 0,5 и 0,1%. Визуализация включения GFP в липосомы проведена методом конфокальной микроскопии. Исследования in vivo проводили в 3 группах самок мышей линии Balb/c возрастом 11–13 недель (по 3 животных в группе): контрольная группа; группа, получающая нативный флуоресцентный белок, и группа с исследуемой конструкцией (липосома, содержащая флуоресцентный белок). После введения проведен забор тонкой кишки, ее подготовка и окрашивание криосрезов. Анализ клеточной суспензии проведен на проточном цитофлуориметре CytoFLEX в конфигурации V5-B5-R3.
Результаты. При оценке полученных методом гидратации тонкой пленки липосом с использованием конфокальной микроскопии установлено, что большинство частиц имело размеры в диапазоне 1–5 мкм. Включение модельного белка в липосомы, как показали результаты измерения его содержания до и после формирования липосом, составило не менее 60%. В эксперименте на мышах in vivo выявлено, что внутрижелудочное введение липосом с флуоресцентным белком позволяет обеспечить доставку белка в стенку кишечника.
Выводы. Применение метода гидратации тонкой пленки позволило получить липосомы из соевого лецитина. Методом конфокальной микроскопии проведена оценка размера полученных липосом и качественно оценено включение в них зеленого флуоресцентного белка. Включение хитозана в оболочку липосом приводило к значительной агрегации конечного продукта, что может приводить к снижению эффективности доставки липосом в клетки. Конфокальная микроскопия криосрезов и цитофлуориметрический анализ клеточных суспензий, полученных из фрагментов тонкой кишки, показали, что примененная система позволяет доставить флуоресцентный белок и, вероятно, неразрушенные липосомы в стенку кишечника.
ГЕНЕТИКА
Введение. Благодаря активному развитию мультиомиксных технологий исследователи получают все больше сведений о генетических и иммунологических данных человека. Для систематизации и хранения такого рода информации используются репозитории, что ускоряет поиск и использование сведений для научных исследований и решения прикладных задач в области медицины.
Цель. Провести анализ мирового опыта эксплуатации репозиториев генетических и иммунологических данных человека для определения их функциональных особенностей и роли в развитии популяционной иммунологии и генетики.
Обсуждение. Проанализированы функциональные особенности репозиториев генетических и иммунологических данных. Данные о репозиториях, включенных в исследование, были получены из открытых источников. Процесс отбора репозиториев включал три этапа: подбор научных публикаций, дедупликация, фильтрация по критериям отбора. Основные критерии последующей оценки репозиториев генетических и иммунологических данных человека: объем данных; доступность данных; форматы данных. Поиск сведений о репозиториях и биобанках на территории Российской Федерации проводился по поисковым запросам в сети Интернет. В исследовании было проанализировано 15 крупнейших репозиториев генетических и иммунологических данных, из которых 37,5% аффилированы с Великобританией, 43,75% — с США. Для создания и поддержания крупных репозиториев, как правило, формируются международные и межинституциональные консорциумы. Доступность репозиториев генетической информации обеспечивается комбинацией технологических, организационных и правовых механизмов. Наиболее частыми источниками финансирования репозиториев являются государственный бюджет, средства частных фондов и благотворительных организаций, инвестиции фармацевтических компаний. Основные риски, возникающие при эксплуатации репозитория, можно разделить на четыре группы: этические, правовые, биологические и технологические, связанные с обеспечением конфиденциальности данных. В Российской Федерации генетические исследования являются одним из наиболее активно развивающихся направлений науки. В этой связи становятся актуальными задачи безопасного хранения, этичного использования и правовой защиты получаемых данных. Рассмотрены возможные направления для дальнейшего развития национальных репозиториев генетических и иммунологических данных, а также возможности дополнительного регулирования обращения с генетическими данными на законодательном уровне.
Выводы. На основании анализа данных определены возможные риски, связанные с функционированием репозиториев, предложены различные подходы к их минимизации и оптимизации развития репозиториев. В качестве одного из наиболее перспективных направлений рассматривается разработка интеграционных модулей на основе искусственного интеллекта для обработки и аннотирования данных, представленных в стандартизированных протоколах.
Введение. Развитие симптомов посттравматического стрессового расстройства (ПТСР) определяется комплексом факторов, которые не ограничиваются принадлежностью к классическим нейротрансмиттерным системам мозга или стрессовым гормонам. В частности, в механизмы ПТСР возможно вовлечение ренин-ангиотензин-альдостероновой системы мозга.
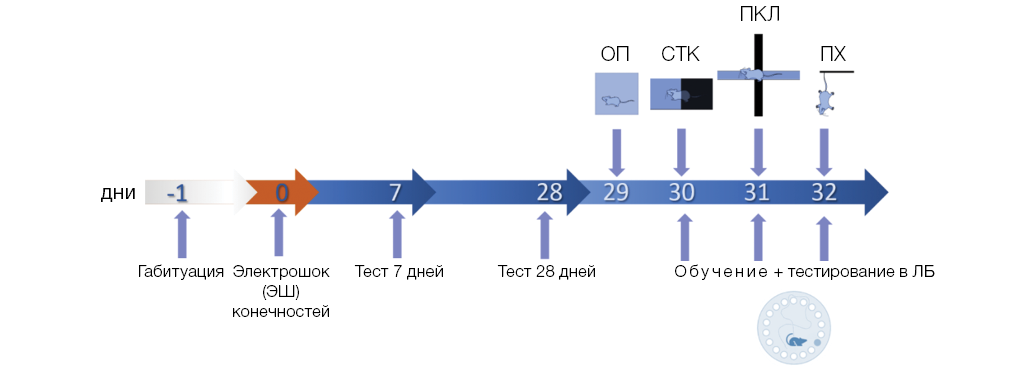
Цель. Изучение влияния экспрессии гена hACE2 ангиотензинпревращающего фермента 2-го типа (ACE2) на тревожность и восприимчивость к психофизиологическому стрессу при моделировании ПТСР-подобного состояния у мышей, осуществленному с применением электрошока (ЭШ) конечностей.
Материалы и методы. Эксперименты были проведены на самцах мышей линий C57Bl/6N и k18-hACE2 возрастом 4–5 месяцев. Было сформировано три группы мышей линии C57Bl/6N: группа «контроль» (n = 7); группа «электрошок (ЭШ)» (n = 7); группа «ЭШ + лизиноприл» (n = 7); две группы мышей линии k18-hACE2: группа «контроль» (n = 7); группа «ЭШ» (n = 8). Проведено обусловливание реакции страха по Павлову с использованием ЭШ конечностей в качестве безусловного стимула. Мыши группы «ЭШ + лизиноприл» в течение 28 дней после психофизиологической травмы получали лизиноприл в дозе 10 мг/кг в сутки с питьевой водой. Оценку экспрессии реакции страха, отражающей память о психофизиологической травме, проводили на 7-е и 28-е сутки после воздействия ЭШ. Величину экспрессии реакции страха оценивали по относительному времени замирания. Для оценки общей локомоторной активности использовали тест «открытое поле». Оценку стратегии стресс-зависимого поведения изучали в тесте подвешивания за хвост; оценку тревожности — в тестах «светло-темная камера» и «приподнятый крестообразный лабиринт». Оценку пространственной навигации и динамики пространственного обучения проводили в тесте «лабиринт Барнса». Поведенческие параметры оценивали при помощи программного обеспечения ANY-maze Video-Tracking Software. Статистический анализ проведен с помощью пакета ПО Prism GraphPad 10.0.
Результаты. При моделировании ПТСР-подобного состояния с помощью ЭШ конечностей у мышей линии k18-hACE2 с экспрессией гена гуманизированного ACE2 под контролем промотора гена цитокератина выявлена более выраженная способность, по сравнению с мышами линии C57Bl/6N, к запоминанию и удержанию памяти об условном стимуле/контексте травмирующего события. После воздействия ЭШ у мышей линии k18-hACE2 тревожность в тесте «светло-темная камера» была ниже по сравнению с мышами линии C57Bl/6N. При этом наблюдали снижение двигательной активности в тесте «открытое поле» и не обнаруживали изменений в пространственной памяти в тесте «лабиринт Барнса». Применение лизиноприла, ингибитора ACЕ, у мышей линии C57Bl/6N в течение 28 дней после ЭШ не приводило к снижению травматической памяти, что свидетельствует о том, что промнестический эффект экспрессии гена hACE2 не является следствием системной гипотензии, и указывает на участие центральных механизмов в реализации эффекта гена hACE2 при формировании патологического фенотипа.
Выводы. Полученные данные свидетельствуют о влиянии гена hACE2 на формирование реакции на стресс у мышей, а именно, экспрессия hACE2 у мышей сопровождается усилением памяти о психофизиологической травме и снижением экстинкции памяти о травме по сравнению с мышами дикого типа, что может определяться модуляцией активности ACE2-зависимого каскада ренин-ангиотензин-альдестероновой системы в мозге. Уменьшение регулирования активности РААС при применении ингибитора ACE лизиноприла с гипотензивным действием не оказывало влияния на память у мышей дикого типа.
МИКРОБИОЛОГИЯ
Введение. Применение метода на основе низкотемпературной аргоновой плазмы (НТАП) широко изучается в качестве альтернативного подхода к профилактике развития гнойных инфекций в случаях, когда эффективность антимикробных препаратов и антисептиков снижена из-за сформированной к ним устойчивости патогенов.
Цель. Оценка выживаемости условно-патогенных микроорганизмов, обладающих патогенным потенциалом, после воздействия факторов НТАП на модели in vitro.
Материалы и методы. Исследование выполнено с использованием клинических штаммов из группы ESKAPE-патогенов (группа супер-микроорганизмов с высоким эпидемическим потенциалом формирования госпитальных штаммов) и эталонных музейных культур, а также смеси штаммов. В качестве источника НТАП использовали плазменно-дуговую установку «ПЛАЗМОРАН» (Россия). В работе использовали один режим плазмогенерации, три варианта расстояния от среза сопла плазмотрона до плоскости расположения культуры в чашке Петри (10, 15 и 20 см), четыре варианта экспозиции действия факторов НТАП на культуры (15, 30, 45 с для бактерий и 30, 45 и 60 с для грибов). Оценку выживаемости патогенных микроорганизмов in vitro после воздействия НТАП определяли по задержке бактериального роста.
Результаты. Выявлено выраженное противомикробное действие в отношении клинических штаммов грамотрицательных бактерий из группы ESKAPE-патогенов K. pneumoniae, Р. aeruginosa, A. baumanii, E. coli, грамположительных бактерий MRSA и дрожжеподобных грибов С. albicans при времени воздействия 30–45 с для бактерий (необходимая при этом доза излучения УФ-А 37,8 Дж/м2, УФ-В 15,9 Дж/м2, УФ-С 34,2 Дж/м2) и расстоянии от сопла прибора 10–15 см. Противомикробное действие НТАП заключается в отсутствии роста микроорганизмов на питательных средах в месте воздействия НТАП при определенных дозе воздействия, времени экспозиции и расстоянии, обеспечивающих снижение титра жизнеспособных микроорганизмов не только монокультур, но и в ассоциации бактерий, как в отношении музейных эталонных культур, так и в отношении клинических штаммов из группы ESKAPE-патогенов.
Выводы. Факторы НТАП, формируемые плазменно-дуговой установкой «ПЛАЗМОРАН», обладают выраженным антибактериальным и противогрибковым действием как в отношении музейных эталонных культур, так и в отношении клинических штаммов рабочей коллекции группы ESKAPE-патогенов. Эффективность воздействия факторов НТАП обеспечивает снижение титра жизнеспособных микроорганизмов с 10 8 –10 9 до единичных КОЕ. Факторы воздействия НТАП (доза излучения УФ-А 37,8 Дж/м2; УФ-В 15,9 Дж/м2; УФ-С 34,2 Дж/м2) имеют наибольший эффект при обработке бактериальных культур на расстоянии 10–15 см с экспозицией 30–45 с; для грибов (доза излучения УФ-А 168,6 Дж/м2; УФ-В 68,4 Дж/м2; УФ-С 159 Дж/м2) при расстоянии 10 см и времени воздействия 60 с. A. baumannii и E. faecium более устойчивы к факторам воздействия НТАП, чем другие исследованные бактерии при стандартных дозе, времени воздействия и расстоянии. C. albicans более устойчива к факторам воздействия НТАП по сравнению с бактериями, и их уничтожение требует большей экспозиции воздействия и меньшего расстояния от сопла плазмотрона до обрабатываемой поверхности. Полученные результаты требуют дальнейшего изучения.
АВИАКОСМИЧЕЧЕСКАЯ И МОРСКАЯ МЕДИЦИНА
Введение. В условиях стратосферы при разгерметизации кабины самолета летчик переходит в режим дыхания кислородом под избыточным давлением. Однако дыхание в таких условиях приводит к развитию неблагоприятных процессов, влияющих на функциональное состояние организма и снижающих качество пилотирования самолета. В качестве психофизиологической подготовки летчиков к работе в таких условиях предусмотрена тренировка дыхания и речи под избыточным давлением кислорода.
Цель исследования. Оценка эффективности 5-дневного курса тренировки дыхания и речи под избыточным давлением кислорода у вьетнамских испытателей.
Материалы и методы. В исследовании приняли участи 35 вьетнамских испытателей в возрасте 19–32 лет. Оценка сформированности навыка дыхания под избыточным давлением кислорода (ИДК) осуществлялась по динамике психологических показателей, психофизиологических резервов четкости произношения контрольных слов. В исследовании использовали кислородную маску КМ-35 в комплекте с защитным шлемом ЗШ-7А; для создания контрдавления на грудную клетку использовался высотно-компенсирующий костюм ВКК-15. Создание ИДК осуществлялось на аппаратно-программном комплексе БАРС-ГД. Разработанный курс тренировки дыхания и речи под ИДК представляет собой пять сеансов дыхания ИДК, которые проводятся один раз в день в течение пяти дней подряд. Каждый сеанс представлял собой дыхание под ИДК последовательно и непрерывно на пяти ступенях с созданием избыточного давления 150–1000 мм вод. ст., время дыхания на каждой ступени составляло 2 мин. Оценка уровня функционирования центральной нервной системы (ЦНС) проведена по среднему времени простой и сложной зрительно-моторной реакции (ПЗМР, СЗМР) и реакции на движущийся объект (РДО). Уровень ситуативной тревожности, самочувствия, активности и настроения оценивали по методике САН. Статистический анализ проведен с использованием пакета прикладных программ SPSS 26.
Результаты. В результате 5-дневного курса тренировки отмечено статистически значимое снижение донагрузочного уровня ситуативной тревожности на 3,9%. До курса тренировки после моделирования быстрой разгерметизации кабины самолета отмечали снижение показателей самочувствия и настроения на 3,7 и 5,7% соответственно. Также зарегистрировано повышение психофизиологических резервов, что подтверждено статистически значимым изменением времени простой и сложной зрительно-моторной реакции, а также результатов теста — реакцией на движущийся объект до и после курса тренировки.
Выводы. Полученные данные показали эффективность разработанного 5-дневного курса тренировки, в результате которого у испытателей сформировалась психологическая и психофизиологического готовность к выполнению задач в условиях резкого снижения давления в гермокабине летательного аппарата и работы высотного снаряжения. 5-дневный режим тренировки вьетнамских военнослужащих целесообразно интегрировать в систему подготовки летчиков к высотным и стратосферным полетам.
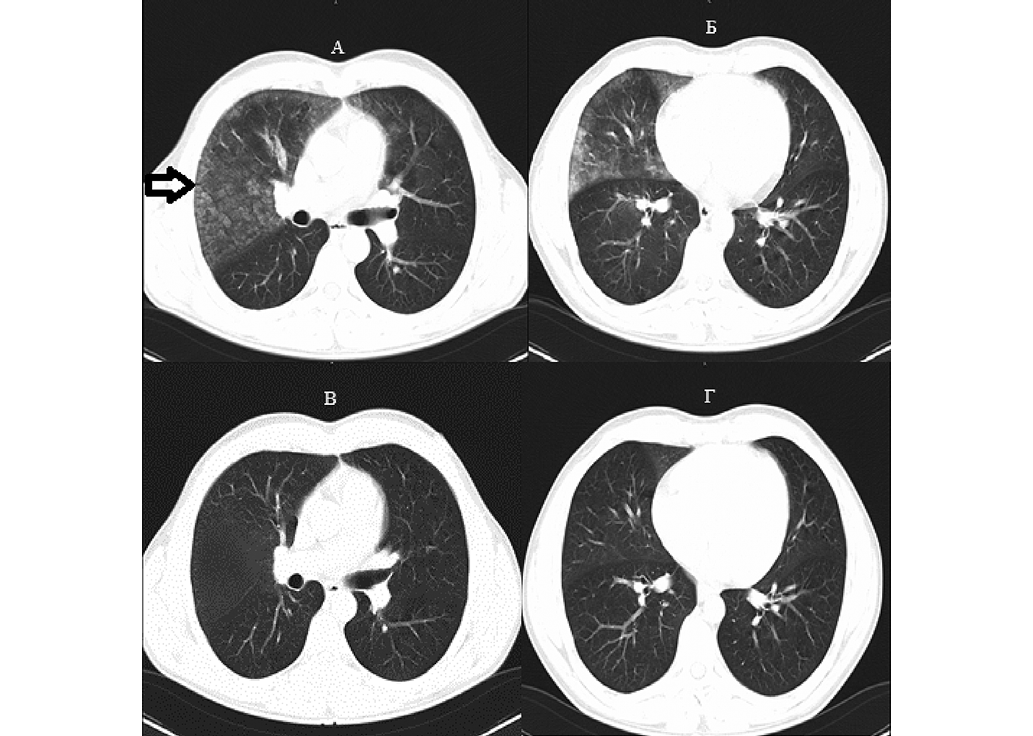
Введение. Иммерсионный отек легких (ИОЛ) — патологическое состояние, которое возникает в водной среде при различных видах деятельности: подводно-технических работах, любительском дайвинге, спортивных соревнованиях по триатлону и т.д. Несмотря на значительное количество англоязычных публикаций, в России проблема ИОЛ остается недостаточно изученной.
Цель. Исследование особенностей диагностики, клинических проявлений, лечения и профилактики иммерсионного отека легких для оптимизации медицинской помощи при данном патологическом состоянии.
Обсуждение. К основным факторам, приводящим к ИОЛ, относятся: нахождение в холодной воде, тяжелая физическая нагрузка при плавании, повышенное артериальное давление в период нахождения в воде, избыточное потребление жидкости перед плаванием, возраст свыше 50 лет; дыхание под водой 100% кислородом, вызывающим гипероксию, оксидативный стресс, нарушение целостности альвеоло-капиллярной мембраны и дефицит сурфактанта, что приводит к транссудации жидкости в интерстициальную ткань легких и отеку. Воздействие гипероксии приводит к вазоконстрикции легочных сосудов, повышению гидростатического давления и усилению фильтрации жидкости в интерстиции, что усугубляет развитие ИОЛ и обусловливает развитие альвеолярного отека легких. Клинически ИОЛ проявляется затрудненным дыханием, острой одышкой, кашлем с кровохарканьем, кровянистыми выделениями пенистой консистенции и другими симптомами. Отличительной чертой паталогического состояния является исчезновение основных симптомов в течение 48 часов. Вместе с тем при проведении перкуссии над пораженным участком легкого отмечается притупление звука, при аускультации в легких выслушиваются влажные хрипы; при аускультации сердца — шумы, характерные для острой митральной недостаточности с левожелудочковой недостаточностью. При компьютерной томографии выявляются снижение прозрачности легочных полей по типу «матового стекла», перибронхиальная инфильтрация и плевральный выпот, преимущественно на пораженной стороне. Основным ограничением метода является невозможность проведения исследования непосредственно в условиях аварийного спуска. Ультразвуковыми признаками диагностики ИОЛ можно считать наличие гиперэхогенных реверберационных артефактов (В-линий), образующихся при взаимодействии ультразвуковых волн с воздух-жидкостным содержимым альвеол, характерным для отека легких. Клинико-лабораторным маркером ИОЛ является повышение копептина, мозгового натрийуретического пептида, модифицированного ишемией альбумина, сверхчувствительного тропонина Т.
Выводы. ИОЛ остается недостаточно изученным, но крайне опасным патологическим состоянием в дайвинге и плавании на воде, поэтому водолазам, боевым пловцам, дайверам и спортсменам (триатлонистам, пловцам) целесообразно доводить информацию о мерах предосторожности при появлении его симптомов во время плавания на воде и под водой. Применение комплексного подхода в профилактике ИОЛ снизит частоту случаев появления патологического состояния и повысит безопасность водолазных спусков.
СПОРТИВНАЯ МЕДИЦИНА
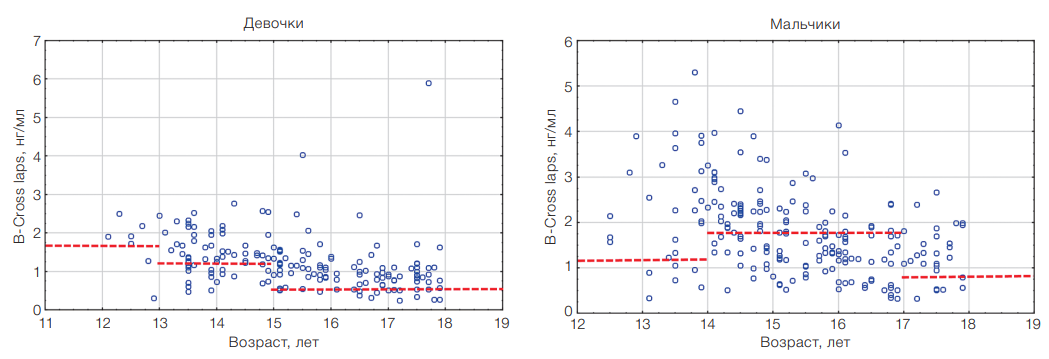
Введение. При оценке маркеров костного метаболизма у спортсменов, не достигших 18-летнего возраста, следует учитывать, что для педиатрической популяции характерны более высокие значения данных метаболитов по сравнению со взрослой, а их максимальное повышение в период пубертата совпадает с пиковым набором костной массы.
Цель. Оценить состояние метаболизма костной ткани по уровням С-концевого телопептида (β-CrossLaps), остеокальцина и N-терминального пропептида человеческого проколлагена 1-го типа (P1NP) в сыворотке крови у здоровых высококвалифицированных спортсменов, не достигших 18-летнего возраста.
Материалы и методы. Проведено одномоментное одноцентровое исследование, в котором участвовали 383 юных спортсмена в возрасте 13–18 лет (из них 248 девочек и 135 мальчиков; средний возраст 15,2 [14,0; 16,1] года) сборных команд Российской Федерации в период с марта 2021 по июль 2023 г. Все спортсмены были разделены на половозрастные группы: мальчики: 13,1–14,0 (n = 3); 14,1–15,0 (n = 11); 15,1–16,0 (n = 43); 16,1–17,0 (n = 42); 17,1–18,0 года (n = 36); девочки: 13,1–14,0 (n = 17); 14,1–15,0 (n = 51); 15,1–16,0 (n = 65); 16,1–17,0 (n = 59); 17,1–18,0 года (n = 56). У спортсменов определяли уровень остеокальцина, С-концевого телопептида, проколлагена 1-го типа в сыворотке крови. Оценка полового развития проведена по классификации Tanner. Статистическая обработка данных произведена с использованием пакета прикладных программ Statistica version 10.0 (StatSoft Inc., США).
Результаты. Установлено, что максимальные значения β-CrossLaps у мальчиков (2,27 [1,14; 3,45] нг/мл) и девочек (1,55 [1,10; 2,02] нг/мл) отмечены в возрасте 13–14 лет. Уровни остеокальцина и P1NP у юных высококвалифицированных спортсменов соответствовали нормам для детей с обычным уровнем физической активности. Максимальные значения P1NP определялись в возрасте 13–14 лет как у мальчиков (767,8 [148,1; 1142,4] нг/мл), так и у девочек (450,5 [268,6; 569,3] нг/мл). Максимальные значения остеокальцина у мальчиков (125 [89; 144] нг/мл) достигаются в возрасте 14–15 лет; у девочек (86 [62; 131] нг/мл) — в возрасте 13–14 лет.
Выводы. Уровень β-Cross laps — основного маркера костной резорбции — у юных высококвалифицированных спортсменов значительно повышен по сравнению с популяционными нормами для детей и подростков с обычным уровнем физической активности. При оценке уровня β-CrossLaps, остеокальцина и P1NP целесообразно применение референтных значений с учетом пола и стадии полового развития спортсменов. Полученные данные могут быть использованы при интерпретации результатов углубленного медицинского обследования у спортсменов спортивных сборных команд РФ для выявления нарушений ремоделирования костной ткани.
Введение. Прогностическое моделирование в здравоохранении — новая развивающаяся отрасль научного знания, находящаяся на стыке информационных технологий и медицины. Для спортивной медицины наличие точного прогноза параметров физической работоспособности в ответ на изменяющиеся условия внешней среды сложно переоценить, а для спортсмена подобная информация даст необходимое конкурентное преимущество при проведении ответственных соревнований.
Цель. Разработка методов и подходов к анализу клинических данных углубленного медицинского обследования (УМО) спортсменов.
Материалы и методы. Проведен анализ обезличенных медицинских данных результатов УМО для 6222 спортсменов высокого класса (3792 мужчины и 2430 женщин) (средний возраст 23,3 ± 5,1 года). Данные были распределены по полу и в соответствии с группами видов спорта: циклические виды спорта (1376 спортсменов, из них 861 мужчина и 515 женщин); сложнокоординационные виды спорта (1342 спортсмена, из них 761 мужчина и 581 женщина); игровые виды спорта (1618 спортсменов, из них 980 мужчин и 638 женщин) и спортивные единоборства (1886 спортсменов, из них 1190 мужчин и 696 женщин). Анализу подверглись как клинические данные по наличию (отсутствию) нозологических единиц, выявленных в ходе осмотров врачами-специалистами, так и физиологические показатели нагрузочного тестирования на велоэргометре. Статистический анализ проведен с использованием программы StatTech v. 4.6.0 (разработчик — ООО «Статтех», Россия).
Результаты. В результате на основе метода регрессионного анализа были построены достоверные (p < 0,001) прогностические модели группы параметров физической работоспособности, которые выявили наличие более 40 связей с клиническими диагнозами врачей-специалистов. Больше всего взаимосвязей было зафиксировано между группой показателей физической работоспособности и проставленными диагнозами стоматолога. Дальнейшая работа будет направлена на разработку математической модели прогнозирования снижения результативности у спортсменов спорта высших достижений, основанной на анализе рисков развития заболеваний.
Выводы. Разработанные и примененные подходы к анализу клинических данных углубленного медицинского обследования спортсменов высокого класса позволили, применяя метод линейной регрессии, создать эффективные прогностические математические модели параметров физической работоспособности с учетом наличия/отсутствия выявленного диагноза. Предложенные модели обеспечивают комплексную оценку функционального состояния спортсменов, что способствует более точному прогнозированию уровня физической работоспособности и позволяет оптимизировать профессиональную деятельность, минимизируя риски перетренированности и травматизма.
КЛИНИЧЕСКАЯ ЛАБОРАТОРНАЯ ДИАГНОСТИКА
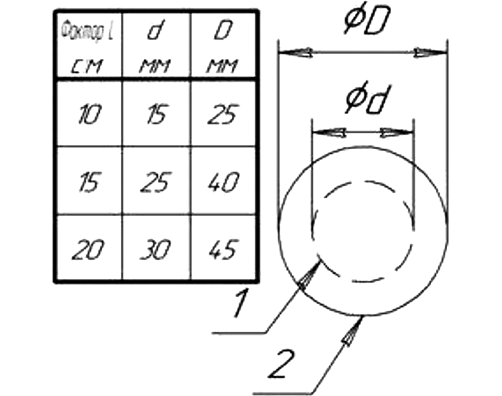
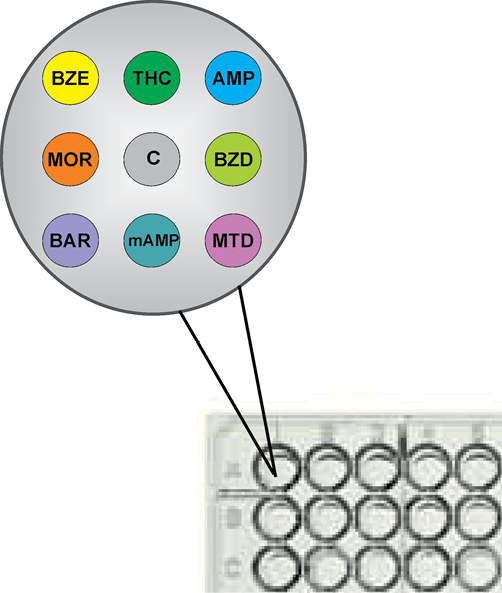
Введение. С учетом сложной наркоситуации в России, роста числа скрытых потребителей наркотических средств (НС) представляется целесообразным расширение рамок скрининговых обследований для выявления НС с использованием новых методических подходов, позволяющих сократить стоимость тестирования за счет снижения затрат на этапах сбора, транспортировки, хранения и аналитического исследования биологических образцов.
Цель. Разработка на основе технологии ФОСФАН метода мультиплексного иммуноанализа для обнаружения основных групп наркотических, психотропных средств в пулах образцов мочи, высушенных на бумаге, с последующей оценкой перспектив его применения для выявления наркозависимых лиц в рамках расширенного диспансерного наркоконтроля.
Материалы и методы. Сухие образцы мочи (n = 31) приготовлены на бумажных тест-полосках из жидких образцов, содержащих (n = 30) или не содержащих (n = 1) кокаин, каннабиноиды, амфетамин, опиаты, бензодиазепины, барбитураты, метамфетамин или метадон по данным химико-токсикологического исследования (ХТИ). Образцы исследованы в виде пулов, содержащих 1–40 фрагментов (0,45×0,45 см) тест-полосок. Люминесцентный сигнал регистрировали на микропланшетном иммуночипе с помощью индикатора фотолюминесценции импульсного ИФИ-05. Наличие НС в образцах оценивали по степени ингибирования связывания антител в соответствующей тестовой зоне иммуночипа (отношение В/В0). Статистическую обработку результатов проводили с помощью стандартных программ Microsoft Office.
Результаты. Включение в состав пулов до 10 сухих образцов мочи, только один из которых содержит искомое НС, не оказало значимого влияния на способность разрабатываемого метода выявлять НС с показателями чувствительности, соответствующими требованиям ХТИ. В исследованных пулах обнаружены: кокаин — в 2 образцах, каннабиноиды — в 11 пробах, амфетамин — в 6, опиаты — в 9, бензодиазепины — в 7, барбитураты — в 10, метамфетамин — в 7, метадон — в 6 пробах, в том числе на фоне высоких концентраций опиатов и амфетаминов.
Выводы. Разработан метод мультиплексного фосфоресцентного микропланшетного иммуноанализа для выявления восьми основных групп наркотических, психотропных средств в пулах из высушенных на бумаге образцов мочи. Пределы детекции исследуемых НС в экстрактах из высушенных на тест-полосках образцов мочи составили 2–8 нг/мл, что существенно ниже рекомендованных для скринингового обследования пределов детекции. Предложенный подход может составить основу новой методологии скрининга, включающей отбор проб мочи, нанесение их на бумажные тест-бланки и транспортировку в лабораторию для проведения обследования групп лиц на критически важных объектах. Использование мультиплексного фосфоресцентного иммуноанализа и пулированных образцов мочи позволит кардинально (более чем в 10 раз) снизить стоимость тестирования по сравнению с традиционными технологиями иммунохроматографического анализа.
КЛИНИЧЕСКАЯ МЕДИЦИНА
Введение. Первичные иммунодефицитные состояния (ПИДС) — это группа врожденных заболеваний, вызванных генетическими дефектами и обусловливающих разнообразные фенотипические проявления. Классические воспалительные заболевания кишечника (ВЗК) в большинстве случаев являются многофакторными патологиями, когда сочетаются генетическая предрасположенность, изменения кишечной микрофлоры и неблагоприятное влияние окружающей среды. Очень раннее начало ВЗК, с дебютом болезни в возрасте до 6 лет, составляет 3–15% всех детских воспалительных заболеваний кишечника. Именно для этой группы характерна моногенная этиология, протекающая в рамках ПИДС с гастроинтестинальным фенотипом и связанная с мутацией в конкретном гене.
Описание клинического случая. Представлен клинический случай моногенной болезни Крона у ребенка с Х-сцепленным лимфопролиферативным синдромом 2-го типа с демонстрацией многоэтапного командного подхода. Для достижения стойкой ремиссии, помимо подбора консервативной терапии, потребовалось проведение повторных хирургических вмешательств и повторных трансплантаций гемопоэтических стволовых клеток. Индивидуальный подход и планирование лечебной стратегии позволили достичь положительного результата лечения.
Выводы. Очень важно у детей раннего возраста с атипичным течением воспалительного заболевания кишечника и рефрактерностью к стандартной терапии дифференцировать моногенные формы ВЗК. Такие пациенты требуют пристального внимания, динамического наблюдения, мультидисциплинарного подхода с альянсом гастроэнтеролога, иммунолога и хирурга.
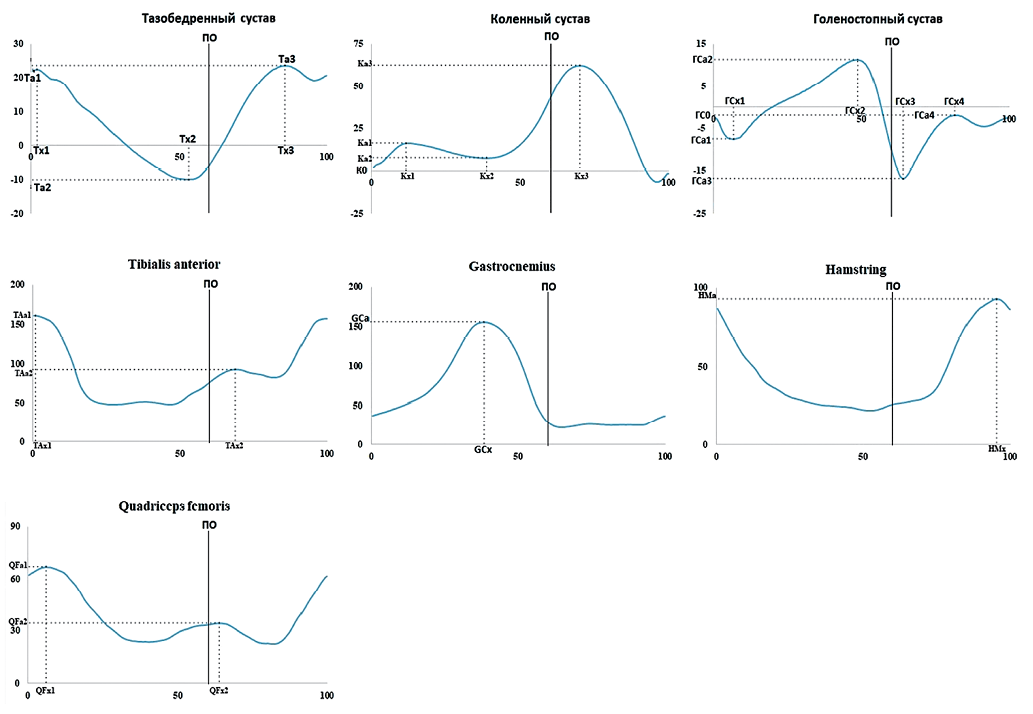
Введение. Одним из осложнений острых нарушений мозгового кровообращения является нарушение функции ходьбы, которое биомеханически характеризуется снижением скорости и асимметрией пространственно-временных и кинематических параметров. Для коррекции данных изменений возможно применение функциональной электростимуляции мышц (ФЭС), однако в имеющейся литературе данный метод применяется преимущественно в позднем восстановительном периоде инсульта.
Цель. Оценка возможности применения многоканальной ФЭС у пациентов в раннем восстановительном периоде инсульта для восстановления функции ходьбы.
Материалы и методы. В исследовании приняли участие 11 пациентов (2 женщины и 9 мужчин) в возрасте от 46 до 66 лет в раннем восстановительном периоде ишемического инсульта (количество дней после инсульта составило 69,1 ± 52,0 дня) и 34 здоровых испытуемых (18 женщин и 16 мужчин) — контрольная группа. Изучали: мышечную силу нижних конечностей по Medical Research Council Weakness Scale, мышечный тонус нижних конечностей по модифицированной шкале Ашфорт; функцию ходьбы оценивали по индексу динамической походки, индексу Хаузера, тестам «Встань и иди» и десятиметровой ходьбы; а также исследовали функцию стереотипа походки (d770), преодоление препятствий (d4551) и ходьбу на короткие расстояния (d4500). Всем пациентам проведен курс ФЭС (среднее количество — 10,8 процедуры). Клиническое и биомеханическое исследования выполнены до и по окончании курса ФЭС. Биомеханическое исследование ходьбы проведено с помощью комплекса программного обеспечения «Стэдис» («Нейрософт»). Статистическая обработка данных выполнена в программе Statistica 12.0.
Результаты. Клиническая оценка показала незначительное, но достоверное функциональное улучшение по результатам тестирования после проведенного лечения. Отмечено увеличение значений индекса динамической походки и теста 10-метровой ходьбы, уменьшение индекса Хаузера и времени выполнения теста «Встань и иди», а также по доменам (d770) и (d4500). Функция ходьбы улучшилась. Возросли значения скорости ходьбы (p < 0,05), увеличился период двойной опоры на паретичной стороне (p < 0,05), возросла активность m. gastrocnemius на паретичной и здоровой сторонах (p < 0,05).
Выводы. Обнаруженные изменения функции ходьбы были типичны для гемипареза. В ходе проведения курса ФЭС у пациентов не было выявлено негативных реакций на проводимую стимуляцию. Клинические и биомеханические функции ходьбы пациентов за время курса ФЭС изменилась незначительно, но динамика их положительная. Из биомеханических параметров достоверно возросла амплитуда икроножной мышцы на стороне пареза, что является одним из целевых параметров ФЭС. Проведение коротких курсов многоканальной ФЭС данной категории больных возможно, но недостаточно эффективно. Повышение эффективности ФЭС требует дальнейшего изучения.
ОРГАНИЗАЦИЯ ЗДРАВООХРАНЕНИЯ
Введение. Совершенствование информационного контента необходимо для решения проблем целевой аудитории и привлечения потенциальных пользователей в связи со снижением интереса врачей к институту присвоения квалификационных категорий.
Цель. Оценка качества информационного контента сайтов территориальных аттестационных комиссий и органов управления здравоохранением субъектов Российской Федерации относительно присвоения квалификационных категорий.
Материалы и методы. Выполнен поиск информации о процедуре аттестации медицинских работников на 47 сайтах органов исполнительной власти 83 субъектов Российской Федерации в сфере здравоохранения и сайтах территориальных аттестационных комиссий. Проведен заочный опрос 47 врачей: (25 (53,2%) мужчин и 22 (46,8%) женщин; средний возраст респондентов 32,30 ± 4,94 года) со стажем работы по специальности от 2 лет. Каждый респондент рассматривал информацию о прохождении аттестации, размещенную на сайтах трех различных субъектов Российской Федерации. Распределение сайтов по респондентам произведено случайным образом с помощью онлайн-ресурса генератора случайных чисел. Опрос проведен с использованием анкеты, которая была разработана сотрудниками кафедры экономики и маркетинга Академии постдипломного образования ФГБУ ФНКЦ ФМБА России. Статистическая обработка выполнена в программе SPSS (IBM Company).
Результаты. Информацию по всем пунктам приказа Минздрава России от 31 августа 2023 г. № 458н, касающимся правил и порядка подачи документов, содержали 47 (56,6%) сайтов территориальных аттестационных комиссий. При опросе достаточность информации сайтов о правилах и порядке аттестации врачами оценена выше (3,13 ± 1,04 балла) по сравнению с понятностью контента (2,98 ± 1,02 балла) (р = 0,009). Оценки респондентов достаточности и понятности контента разных сайтов значимо отличаются: 102,155 ≤ χ2 ≤ 110,978 (р ≤ 0,001), а для одних и тех же сайтов — одинаковы (р = 0,881 и р = 0,976). Оценки достаточности и понятности информации не зависели от возраста респондентов (р = 0,416 и р = 0,706), их пола (р = 0,163 и р = 0,148), специальности (р = 0,901 и р = 0,947), работы в организациях, оказывающих помощь в разных условиях (р = 0,956 и р = 0,983).
Выводы. Информация о процедуре аттестации медицинских работников, размещенная на сайтах органов исполнительной власти субъектов Российской Федерации в сфере здравоохранения и сайтах территориальных аттестационных комиссий, нуждается в коррекции и актуализации.
ISSN 2713-2765 (Online)