Перейти к:
Определение предикторов неблагоприятного исхода заболевания у пациентов с COVID-19 на основании исследования системы гемостаза
https://doi.org/10.47183/mes.2025-306
Аннотация
Введение. Среди тяжелых осложнений новой коронавирусной инфекции (COVID-19) выделяют артериальные или венозные тромбозы, которые приводят не только к более тяжелому течению заболевания, но и к увеличению летальности. Развитие гиперкоагуляции, предшествующее реализации тромбоза, обусловлено выраженной активацией системы гемостаза, а также появлением в циркуляции микрочастиц (МЧ), которые генерируются активированными клетками крови и увеличивают прокоагулянтную направленность гемостаза. В связи с этим оценка прогностического значения изменений показателей системы гемостаза, связанных с течением и исходом COVID-19, представляет большой интерес.
Цель. Выявить предикторы неблагоприятного исхода новой коронавирусной инфекции на основе оценки параметров, характеризующих состояние системы гемостаза.
Материалы и методы. Обследовано 163 пациента (78 мужчин и 85 женщин, возраст которых колебался от 35 до 90 лет, медиана возраста — 69 лет) в остром периоде с тяжелым и среднетяжелым течением заболевания. В зависимости от исхода заболевания пациенты были разделены на две группы: группа «выжившие пациенты» (n = 120); группа «умершие пациенты» (n = 43). Проведено исследование показателей плазменного гемостаза (протромбинового теста по Квику, концентрации фибриногена, активированного парциального тромбопластинового времени, активности фактора VIII, ристоцетин-кофакторной активности и содержания фактора Виллебранда, активности протеина С, антитромбина, уровня свободного протеина S), а также оценка характеристик МЧ. Статистическую обработку полученных результатов выполняли с помощью пакета программного обеспечения Statistica 12.0.
Результаты. У пациентов с неблагоприятным исходом заболевания получено значимое снижение протромбинового теста (ПТ) по Квику и активности антитромбина, повышение активности фактора Виллебранда, концентрации D-димера и количества тромбоцитарных МЧ. Проведенный анализ чувствительности и специфичности данных параметров позволил рассматривать ПТ по Квику менее 70% (чувствительность и специфичность составили 70 и 74,3% соответственно), уровень D-димера более 800 нг/мл (чувствительность и специфичность — 72 и 75,2% соответственно) и количество тромбоцитарных МЧ более 3,22% (чувствительность и специфичность — 77,8 и 72,7% соответственно) в качестве пороговых значений, ассоциированных с летальным исходом от СOVID-19.
Выводы. На основании проведенного ROC-анализа получены прогностические модели риска возникновения неблагоприятного исхода COVID-19, сопряженные с изменениями параметров системы гемостаза: концентрации D-димера, ПТ по Квику и количества тромбоцитарных МЧ, которые могут быть использованы в качестве лабораторных предикторов неблагоприятного течения заболевания.
Ключевые слова
Для цитирования:
Матвиенко О.Ю., Смирнова О.А., Головина О.Г. Определение предикторов неблагоприятного исхода заболевания у пациентов с COVID-19 на основании исследования системы гемостаза. Медицина экстремальных ситуаций. 2025;27(4):587-593. https://doi.org/10.47183/mes.2025-306
For citation:
Matvienko O.U., Smirnova O.A., Golovina O.G. Determination of predictors of adverse disease outcome in patients with COVID-19 based on hemostasis system analysis. Extreme Medicine. 2025;27(4):587-593. https://doi.org/10.47183/mes.2025-306
ВВЕДЕНИЕ
К настоящему времени установлено, что новая коронавирусная инфекция (COVID-19) характеризуется развитием эндотелиальной дисфункции, активацией клеток крови с образованием микрочастиц (МЧ) плазмы крови, несостоятельностью фибринолиза, развитием «цитокинового шторма» [1][2]. Подобные патологические изменения приводят к появлению прокоагулянтной направленности системы гемостаза, что может быть ассоциировано с развитием состояния гиперкоагуляции с последующим тромбообразованием в микроциркуляторном русле, дистресс-синдромом и полиорганной недостаточностью. Одной из ведущих причин увеличения смертности у пациентов с COVID-19 являются тромбоэмболические осложнения.
Показано, что у больных, которые проходят лечение в отделениях реанимации и/или интенсивной терапии, частота тромботических осложнений достигает 18% [3][4]. На фоне новой коронавирусной инфекции происходит активация системы гемостаза, охватывающая как ее плазменное, так и клеточное звено, что и приводит к развитию протромботического состояния [5–8]. Большую роль в развитии данных прокоагулянтных изменений могут играть МЧ, происходящие из различных клеток крови и способные участвовать в целом ряде биологических реакций организма. МЧ плазмы крови — фосфолипидные микровезикулы, размер которых колеблется в диапазоне 0,1–1 мкм. МЧ окружены клеточной мембраной, лишены ядра и значительно различаются по составу антигенных детерминант, которые находятся на их поверхности, что определяется как механизмом образования МЧ, так и характером стимулирующего влияния. За счет локализованных на их поверхности отрицательно заряженных фосфолипидов и тканевого фактора МЧ активно участвуют в гемостатических реакциях, что может иметь значение в процессе развития тромботических осложнений при различной патологии, в том числе и на фоне COVID-19 [9–11].
Использование различных лабораторных и инструментальных исследований для поиска предикторов неблагоприятного течения и исхода новой коронавирусной инфекции представляет большой интерес. Так, определение вирусной нагрузки SARS-CoV-2, оценка результатов компьютерной томографии легких при поступлении в стационар с помощью искусственного интеллекта обнаружили хорошее прогностическое значение, однако эти методы недоступны для широкого клинического применения [12, 13] Определенной информативностью обладают уровень лимфопении и изменений субпопуляции лимфоцитов, а также изменение таких показателей, как С-реактивный белок, прокальцитонин и ферритин, которые являются неспецифическими маркерами воспаления [14–17]. Учитывая характерные изменения системы свертывания крови, сопровождающие COVID-19, поиск подобных маркеров проводится и среди гемостатических показателей. Многие исследователи отмечают связь высокого уровня D-димера с летальным исходом, при этом его пороговые прогностические значения сильно варьируют [18–20].
Выбор показателей, характеризующих состояние плазменного гемостаза, а также степень активации клеток крови, которые могут служить для прогностической оценки тяжести течения заболевания и его исхода, будет способствовать более рациональному ведению пациентов с COVID-19.
Цель исследования — выявить предикторы неблагоприятного исхода новой коронавирусной инфекции на основе оценки параметров, характеризующих состояние системы гемостаза.
МАТЕРИАЛЫ И МЕТОДЫ
Обследованная группа включала 163 пациента (78 мужчин и 85 женщин, возраст которых 35–90 лет, медиана возраста — 69 лет), которые находились на лечении в отделении интенсивной терапии с тяжелой или среднетяжелой формой COVID-19. Критериями включения в настоящее исследование служили: возраст старше 18 лет, новая коронавирусная инфекция, подтвержденная положительным результатом лабораторного исследования на наличие РНК вируса SARS-CoV-2. Критерии исключения из группы пациентов составили: возраст менее 18 лет, наличие в анамнезе или на момент обследования онкологического заболевания, ВИЧ-инфекции, гепатитов В и С, патологии печени с нарушением ее функции, заболеваний почек с изменением скорости клубочковой фильтрации, прием каких-либо препаратов антикоагулянтного действия на постоянной основе до начала заболевания.
Тяжесть течения заболевания была обусловлена степенью поражения легких, которая составляла более 25%, а также коморбидностью пациентов. Среди обследованных больных у 120 (74%) пациентов заболевание закончилось выздоровлением, у 43 (26%) пациентов наблюдался неблагоприятный (летальный) исход заболевания. В зависимости от исхода заболевания пациенты были разделены на две группы, в которых проводилась оценка показателей гемостаза и характеристик МЧ: группа «выжившие пациенты» (n = 120); группа «умершие пациенты» (n = 43).
Взятие образцов крови для исследования проводили (при поступлении пациентов в стационар до назначения специфической терапии и антикоагулянтной профилактики) с помощью вакуумной системы в вакуумные пробирки Vacutest с антикоагулянтом 3,2% цитрат натрия.
Оценивали следующие параметры, характеризующие состояние плазменного гемостаза: протромбиновый тест по Квику (ПТ), концентрацию фибриногена (ФГ), активированное парциальное тромбопластиновое время (индекс АПТВ), активность фактора VIII (ф.VIII), ристоцетин-кофакторную активность и содержание фактора Виллебранда (ф.В. и аг.ф.В. соответственно), активность протеина С (PC) и антитромбина (АТ), а также содержание свободного протеина S (PS). Использовали реагенты HemosIL (Instrumentation Laboratory, США), все исследования проводили согласно инструкциям производителя к реагентам и оборудованию. Определение перечисленных параметров осуществляли на автоматических коагулометрах серии ACL: ACL Top 300 CTS и ACL Elite Pro (Automated Coagulation Laboratory, Instrumentation Laboratory, США).
Для изучения характеристик МЧ на проточном цитофлуориметре бедную тромбоцитами плазму центрифугировали на центрифуге ThermoFisherScientific (Германия) при температуре 22 °С в течение 30 мин при ускорении 14 000 g. Из образцов, полученных после высокоскоростного центрифугирования, аспирировали супернатант и забирали осадок, который ресуспендировали путем добавления 100 мкл фосфатно-солевого буфера (ФСБ). Полученную взвесь МЧ использовали для дальнейшего исследования. Для определения количества и происхождения МЧ применяли лазерный проточный цитофлуориметр Cytoflex (Beckman Coulter, США) с использованием флуоресцентно меченых антител к поверхностным маркерам клеток: тромбоцитарных — CD41, лейкоцитарных — CD45, эндотелиальных — CD144.
Статистическую обработку полученных результатов выполняли с помощью пакета программного обеспечения Statistica 12.0 (StatSoft Inc., США). Несимметричное распределение полученных данных выявляли с помощью критерия Шапиро – Уилка, в связи с чем полученные результаты представлены в виде медианы (Ме) и межквартильного [ 25–75 процентили] интервала [Q1–Q3]. Сравнение двух групп проводили с помощью непараметрического критерия Манна – Уитни. Для поиска разделяющего порога переменных, ассоциированных с неблагоприятным исходом COVID-19, был использован ROС-анализ с построением ROC-кривых. Количественную интерпретацию ROC-кривых оценивали по показателю AUC, площади, ограниченной ROC-кривыми и осью доли ложноположительных результатов теста. Значение общей чувствительности модели по AUC менее 0,5 демонстрировало непригодность выбранного метода классификации, тогда как показатель AUC более 0,7 характеризовал высокую прогностическую силу построенной модели. В качестве критерия нахождения оптимальной пороговой точки или разделяющего значения по кривой ROC использовали индекс Юдена, который позволил оценить разницу между долей истинно положительных результатов теста (чувствительность) и долей ложноположительных результатов теста (специфичность) и выбрать оптимальное пороговое значение. Критический уровень статистической значимости принимали равным 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты, полученные при сравнении показателей плазменного гемостаза обследованных пациентов в зависимости от исхода заболевания, представлены в таблице 1.
Результаты, представленные в таблице 1, указывают на наличие значимых различий между двумя группами обследованных пациентов: неблагоприятный исход заболевания ассоциировался с увеличением активности ф.В. в 1,4 раза (340,0 [ 260,1–420,0]; p = 0,01), снижением показателей ПТ по Квику в 1,2 раза (65,3 [ 51,0–73,9]; p = 0,00) и активности АТ до уровня 85,3 [ 71,0–97,5]; (p = 0,034) при сравнении с группой выживших пациентов. Наиболее значимые различия затрагивали концентрацию D-димера, которая у умерших пациентов была превышена практически в 4 раза (1670,0 [ 715,0–4334,5]; p ≤ 0,0001) относительно уровней у больных с благоприятным исходом заболевания. Полученный результат согласуется с данными других исследователей, которые также рассматривали значительное повышение уровня D-димера в качестве неблагоприятного маркера течения и исхода новой коронавирусной инфекции [21][22].
Параллельно с исследованием параметров плазменного гемостаза нами был проведен анализ характеристик МЧ плазмы крови у части обследованных пациентов в зависимости от исхода заболевания. Полученные результаты представлены в таблице 2.
Данные, представленные в таблице 2, свидетельствуют о значимом повышении числа тромбоцитарных МЧ у больных с неблагоприятным исходом заболевания по сравнению с выжившими пациентами. Значимых различий между двумя группами по количеству эндотелиальных МЧ выявлено не было. Лейкоцитарные МЧ были обнаружены в незначительном количестве, что не позволило провести корректную статистическую обработку результатов.
Для дальнейшего анализа были отобраны результаты тех тестов, параметры которых значимо различались в группах пациентов в зависимости от исхода заболевания, а именно концентрация D-димера, активность ф. Виллебранда и АТ, ПТ по Квику, число тромбоцитарных МЧ.
Оценка с помощью ROС-анализа показателей активности ф.В., антитромбина с вероятностью развития неблагоприятного исхода COVID-19 не дала возможности получить модель хорошего качества. В то же время при проведении ROС-анализа для таких параметров, как D-димер, ПТ по Квику и количество тромбоцитарных МЧ, изменения которых также непосредственно связаны с неблагоприятным исходом COVID-19, была получена модель с высокой прогностической силой: AUC составила 0,787, 0,747 и 0,798 соответственно. Полученные результаты позволили определить пороговые значения данных показателей, указывающие на высокую вероятность летального исхода.
При анализе уровня D-димера наибольший индекс Юдена — 47,2, соответствующий чувствительности 72% и специфичности 75,2%, был получен для пороговой точки 800 нг/мл (рис. 1).
Для показателя ПТ по Квику наибольший индекс Юдена — 44,3, соответствующий чувствительности модели 70% и специфичности 74,3%, был получен для пороговой точки 70% (рис. 2).
Для числа тромбоцитарных МЧ наибольший индекс Юдена — 50,5, соответствующий чувствительности 77,8% и специфичности 72,7%, был получен для пороговой точки 3,22% событий (рис. 3).
Таким образом, проведенный анализ чувствительности и специфичности выбранных параметров позволяет рассматривать снижение ПТ по Квику менее 70%, повышение уровня D-димера более 800 нг/мл и количества тромбоцитарных МЧ более 3,22% событий в качестве маркеров неблагоприятного исхода СOVID-19.
Таблица 1. Показатели, характеризующие состояние плазменного гемостаза больных COVID-19
Показатели | Выжившие пациенты (n = 120) | Умершие пациенты (n = 43) | Уровень статистической значимости*, p |
индекс АПТВ | 0,88 [ 0,82–0,97] | 0,88 [ 0,82–1,08] | 0,407 |
ПТ, % | 79,0 [ 70,2–85,1] | 65,3 [ 51,0–73,9] | 0,000 |
ФГ, г/л | 5,4 [ 4,1–6,9] | 5,5 [ 3,6–8,0] | 0,931 |
ф.VIII, % | 112,4 [ 85,8–165,5] | 150,0 [ 80,3–217,2] | 0,08 |
ф.В., % | 250,5 [ 180,0–350,1] | 340,0 [ 260,1–420,0] | 0,01 |
аг.ф.В., % | 219,6 [ 198,3–321,2] | 340,0 [ 260,1–420,0] | 0,08 |
D-димер, нг/мл | 387,0 [ 220,0–724,5] | 1670,0 [ 715,0–4334,5] | <0,0001 |
АТ, % | 97,7 [ 84,3–105,0] | 85,3 [ 71,0–97,5] | 0,034 |
PC, % | 97,0 [ 79,7–117,3] | 88,0 [ 67,2–102,0] | 0,185 |
PS, % | 75,2 [ 56,5–90,0] | 62,7 [ 48,2–86,3] | 0,138 |
Таблица составлена авторами по собственным данным
Примечание: * — сравнение выполнено между группами пациентов с COVID-19; индекс АПТВ — активированное парциальное тромбопластиновое время, ПТ — протромбиновый тест по Квику, ФГ — концентрация фибриногена, ф.VIII — активность фактора VIII, ф.В. — ристоцетин-кофакторная активность, аг.ф.В. — содержание фактора Виллебрандта, АТ — активность антитромбина, PC — активность протеина С, PS — содержание свободного протеина S.
Таблица 2. Характеристика микрочастиц (МЧ) у больных COVID-19
Клеточный маркер | Выжившие пациенты (n = 15) | Умершие пациенты (n = 9) | Уровень статистической значимости*, p |
CD41+ (% событий) | 2,22 [ 1,385–3,25] | 4,27 [ 3,48–4,61] | 0,025 |
CD144+ (% событий) | 0,03 [ 0,02–0,03] | 0,05 [ 0,03–0,06] | 0,8 |
Таблица составлена авторами по собственным данным
Примечание: * — сравнение выполнено между группами пациентов с COVID-19.
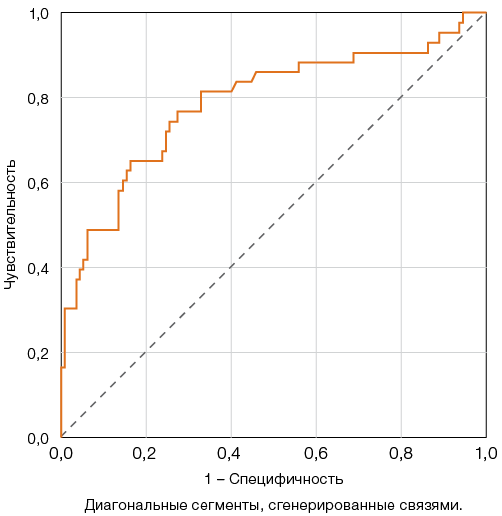
Рисунок подготовлен авторами по собственным данным
Рис. 1. ROC-кривые для оценки прогностической модели повышения уровня D-димера и неблагоприятного исхода COVID-19
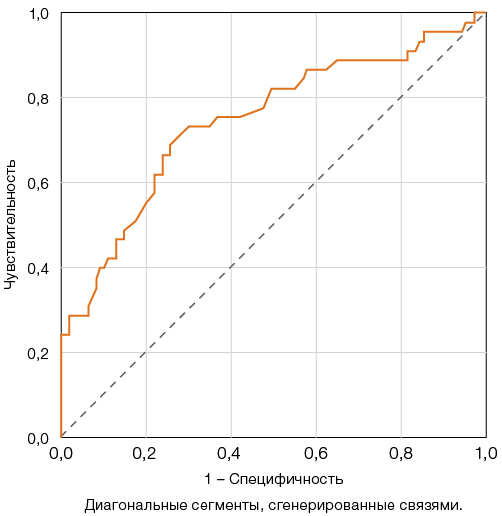
Рисунок подготовлен авторами по собственным данным
Рис. 2. ROC-кривые для оценки прогностической модели снижения протромбинового теста по Квику (ПТ) и неблагоприятного исхода COVID-19
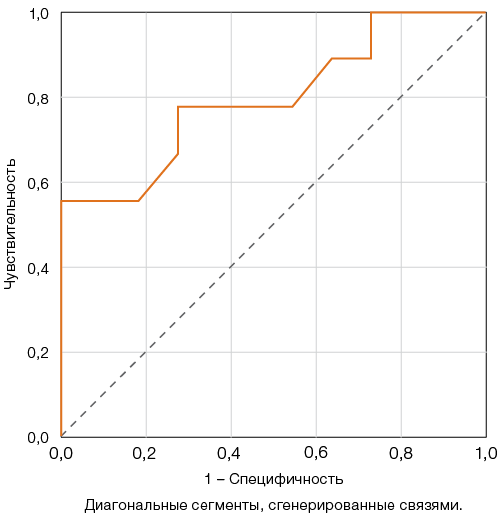
Рисунок подготовлен авторами по собственным данным
Рис. 3. ROC-кривые для оценки прогностической модели роста числа тромбоцитарных микрочастиц (МЧ) и неблагоприятного исхода COVID-19
ЗАКЛЮЧЕНИЕ
Нарушения системы гемостаза играют одну из ведущих ролей в патогенезе осложнений COVID-19. Протромботические изменения приводят к развитию процессов тромбообразования в сосудах различного типа и калибра, что ухудшает прогноз заболевания. Проведенное нами исследование обнаружило, что ряд показателей, характеризующих состояние системы гемостаза, а именно концентрация D-димера и ПТ по Квику, могут быть использованы в качестве лабораторных предикторов летального исхода заболевания. Учитывая немногочисленность группы, в которой определялись характеристики МЧ, требуются дополнительные исследования для определения их значения для развития неблагоприятного течения и исхода COVID-19.
Список литературы
1. Галстян ГМ. Коагулопатия при COVID-19. Пульмонология. 2020;30(5):645–57. https://doi.org/10.18093/0869-0189-2020-30-5-645-657
2. Буланов АЮ, Ройтман ЕВ. Новая коронавирусная инфекция, система гемостаза и проблемы дозирования гепаринов: это важно сказать сейчас. Тромбоз, Гемостаз и Реология. 2020;2:11–8. https://doi.org/10.25555/THR.2020.2.0913
3. Лобастов КВ, Порембская ОЯ, Счастливцев ИВ. Эффективность и безопасность применения антитромботической терапии при COVID-19. Амбулаторная Хирургия. 2021;18(2):17–30. https://doi.org/10.21518/1995-1477-2021-18-2
4. Di Minno AD, Ambrosino P, Calcaterra I, Di Minno MND. COVID-19 and venous thromboembolism: a meta-analysis of literature studies. Seminars in Thrombosis and Hemostasis. 2020;46(7):763–71. https://doi.org/10.1055/s-0040-1715456
5. Матвиенко ОЮ, Корсакова НЕ, Лернер АА, Шведова ТН, Папаян ЛП. Состояние плазменного звена гемостаза у пациентов с коронавирусной инфекцией, вызванной вирусом SARS-CoV-2. Тромбоз, Гемостаз и Реология. 2020;4:52–6. https://doi.org/10.25555/THR.2020.4.0945
6. Schulman S, Hu Y, Konstantinides S. Venous thromboembolism in COVID-19. Thrombosis and Haemostasis. 2020;120(12):1642–53. https://doi.org/10.1055/s-0040-1718532
7. Кузнецов СИ, Шестаков ЕА, Жибурт ЕБ. Коагулопатия при инфекции COVID-19. Тромбоз, Гемостаз и Реология. 2020;4:31–4. https://doi.org/10.25555/THR.2020.4.0942
8. Ranucci M, Ballotta A, Di Dedda U, Baryshnikova E, Dei Poli M, Resta M, et al. The procoagulant pattern of patients with COVID-19 acute respiratory distress syndrome. Journal of Thrombosis and Haemostasis. 2020;18(7):1747–51. https://doi.org/10.1111/jth.14854
9. Момот АП, Царигородцева НО, Федоров ДВ, Бишевский КМ, Вострикова НВ, Климова ЕЕ. Тромбоцитарные микровезикулы и их роль в обеспечении гемостатического потенциала (обзор литературы). Сибирский Научный Медицинский Журнал. 2020;40(2):4–14. https://doi.org/10.15372/SSMJ20200201
10. Зубаиров ДМ, Зубаирова ЛД. Микровезикулы в крови. Функции и их роль в тромбообразовании. М.: ГЭОТАРМедиа; 2009.
11. Сироткина ОВ, Ермаков АИ, Гайковая ЛБ, Кудлай ДА, Вавилова ТВ. Микрочастицы клеток крови у больных COVID-19 как маркер активации системы гемостаза. Тромбоз, Гемостаз и Реология.2020;4:35–40. https://doi.org/10.25555/THR.2020.4.0943
12. Tang K, Wu L, Luo Y, Gong B. Quantitative assessment of SARS-CoV-2 RNAemia and outcome in patients with coronavirus disease. Journal of Medical Virology. 2021;93(5):3165–75. https://doi.org/10.1002/jmv.26876
13. Li Y, Shang K, Bian W, He L, Fan Y, Ren T, et al. Prediction of disease progression in patients with COVID-19 by artificial intelligence assisted lesion quantification. Scientific Reports. 2020;10(1):22083. https://doi.org/10.1038/s41598-020-79097-1
14. Ozel AS, Altunal LN, Aydin M, Unal M, Cam G, Ozer MC, et al. Clinical characteristics and risk factors associated with severe disease and outcome of patients with COVID-19. Journal of Infection in Developing Countries. 2022;16(3):435–44. https://doi.org/10.3855/jidc.15411
15. Henry BM, de Oliveira MHS, Benoit S, Plebani M, Lippi G. Hematologic, biochemical and immune biomarker abnormalities associated with severe illness and mortality in coronavirus disease 2019 (COVID-19): a meta-analysis. Clinical Chemistry and Laboratory Medicine. 2020;58(7):1021–8. https://doi.org/10.1515/cclm-2020-0369
16. Мищенко ТА, Ермакова ПА, Ермакова АА, Целлер ЛП, Рогожкина ЮА, Вертелецкая МИ и др. Предикторы тяжелого течения новой коронавирусной инфекции (COVID-19): дизайн исследования. Терапевтический Архив. 2022;94(11):1246–51. https://doi.org/10.26442/00403660.2022.11.201402
17. Bobcakova A, Petriskova J, Vysehradsky R, Kocan I, Kapustova L, Barnova M, et al. Immune profile in patients with COVID-19: lymphocytes exhaustion markers in relationship to clinical outcome. Frontiers in Cellular and Infection Microbiology. 2021;11:646688. https://doi.org/10.3389/fcimb.2021.646688
18. Rajpoot A, Mishra M, Banerjee S, Kumar A, Panda PK, Sindhwani G, et al. Predictors of poor outcome in patients with COVID-19 associated respiratory failure: a retrospective observational study. Journal of the Association of Physicians of India. 2023;71(4):11–2.
19. Oudkerk M, Büller HR, Kuijpers D, Oudkerk SF, van Beek JR. D-Dimer and COVID-19. Radiology. 2020;297(3):343–4. https://doi.org/10.1148/radiol.2020203481
20. Zhang L, Yan X, Fan Q, Liu X, Liu Z, Zhang Z, et al. D-dimer levels on admission to predict in-hospital mortality in patients with Covid-19. Journal of Thrombosis and Haemostasis. 2020;18(6):1324–9. https://doi.org/10.1111/jth.14859
21. Момот ДА, Мамаев АН, Николаева МГ, Момот АП, Кудинов АВ, Неймарк МИ. Анализ возможностей применения нового метода определения уровня D-димера в плазме крови у больных с COVID-19 на госпитальном этапе. Бюллетень Медицинской Науки. 2023;2(30):79–86. https://doi.org/10.31684/25418475-2023-2-79
22. Воробьева НА, Воробьева АИ. Прогностическая значимость Д-димера при COVID-19. Проблемы Стандартизации в Здравоохранении. 2021;5–6:36–42. https://doi.org/10.26347/1607-2502202105-06036-042
Об авторах
О. Ю. МатвиенкоРоссия
Матвиенко Олеся Юрьевна - канд. мед. наук
Санкт-Петербург
О. А. Смирнова
Россия
Смирнова Ольга Анатольевна - канд. мед. наук
Санкт-Петербург
О. Г. Головина
Россия
Головина Ольга Георгиевна - канд. биол. наук
Санкт-Петербург
Дополнительные файлы
Рецензия
Для цитирования:
Матвиенко О.Ю., Смирнова О.А., Головина О.Г. Определение предикторов неблагоприятного исхода заболевания у пациентов с COVID-19 на основании исследования системы гемостаза. Медицина экстремальных ситуаций. 2025;27(4):587-593. https://doi.org/10.47183/mes.2025-306
For citation:
Matvienko O.U., Smirnova O.A., Golovina O.G. Determination of predictors of adverse disease outcome in patients with COVID-19 based on hemostasis system analysis. Extreme Medicine. 2025;27(4):587-593. https://doi.org/10.47183/mes.2025-306

















